2. 3. Химический состав белков.
Белки являются
сложными органическими соединениями,
состоящими из аминокислот. Химический
анализ показал, что белки состоят из
следующих элементов:
-
Углерод
50-55 % -
Водород
6-7 % -
Кислород
21-23 % -
Азот
15-17 % -
Сера
0,3-2,5 %.
В
составе отдельных белков обнаружены
также фосфор, йод, железо, медь и др.
макро- и микровещества.
Содержание
основных химических элементов может
различаться в отдельных белках, исключение
составляет азот, среднее количество
которого характеризуется наибольшим
постоянством и составляет 16 %. В связи
с этим существует способ определения
количества белка по входящему в его
состав азоту. Зная, что 6,25 грамм белка
содержит 1 грамм азота, можно найти
количество белка, умножив найденное
количество азота на коэффициент 6,25.
2. 4. Аминокислоты.
Аминокислоты
– карбоновые
кислоты альфа-углеродный атом водорода
которых замещен на аминогруппу. Белки
состоят из аминокислот. В настоящее
время известно более 200 различных
аминокислот. В организме человека их
около 60, а в состав белков входят только
20 аминокислот, которые называют природными
или протеиногенными. 19
из них являются альфа-аминокислотами,
это означает, что аминогруппа присоединена
к альфа-углеродному атому карбоновой
кислоты. Общая формула этих аминокислот
выглядит следующим образом.
R


 h3N
h3N
CH
COOH
Только
аминокислота пролин не соответствует
этой формуле, её относят к иминокислотам.
Химические
названия аминокислот, для краткости
сокращают, например, глутаминовая
кислота ГЛУ, серин СЕР и т.д. для записи
первичной структуры белков в последнее
время стали пользоваться только
однобуквенными символами.
Во
всех аминокислотах есть общие группировки:
-СН2, -NН2,
-СООН, они придают общие химические
свойства белкам, и радикалы, химическая
природа которых разнообразна. Именно
они определяют структурные и функциональные
особенности аминокислот.
Классификации
аминокислот основана на их физико-химических
свойствах.
По строению
радикалов:
-
Циклические
— гомоциклические ФЕН, ТИР, гетероциклические
ТРИ, ГИС. -
Ациклические
– моноаминомонокарбоновые ГЛИ, АЛА,
СЕР, ЦИС, ТРЕ, МЕТ, ВАЛ, ЛЕЙ, ИЛЕЙ,НЛЕЙ,
моноаминодикарбоновые АСП, ГЛУ,
диаминомонокарбоновые ЛИЗ, АРГ.
По образованию в
организме:
-
Заменимые
– могут синтезироваться в организме
из веществ белковой и небелковой
природы. -
Незаменимые
– не могут синтезироваться в организме,
поэтому должны поступать только с пищей
– все циклические аминокислоты, ТРЕ,
ВАЛ, ЛЕЙ, ИЛЕЙ.
Биологическое
значение аминокислот:
-
Входят в состав
белков организма человека. -
Входят
в состав пептидов организма человека. -
Из
аминокислот образованы в организме
многие низкомолекулярные биологически
активные вещества: ГАМК, биогенные
амины и т.д. -
Часть
гормонов в организме – производные
аминокислот (гормоны щитовидной железы,
адреналин). -
Предшественники
азотистых оснований, входящих в состав
нуклеиновых кислот. -
Предшественники
порфиринов, идущих на биосинтез гема
для гемоглобина и миоглобина. -
Предшественники
азотистых оснований, входящих в состав
сложных липидов (холина, этаноламина). -
Участвуют
в биосинтезе медиаторов в нервной
системе (ацетилхолин, дофамин, серотонин,
норадреналин и др.).
Свойства
аминокислот:
-
Хорошо растворимы
в воде. -
В
водном растворе существуют в виде
равновесной смеси биполярного иона,
катионной и анионной форм молекулы.
Равновесие зависит от рН среды.
N

 h4—CH—COOH
h4—CH—COOH
Nh4—CH—COO
Nh3—CH—COO
R
+ ОН R
R
+ Н
Катионная
форма Биполярный ион Анионная
форма

 Щелочная
Щелочная
среда рН
Кислая среда
-
Способны
двигаться в электрическом поле, что
используется для разделения аминокислот
с помощью электрофореза. -
Проявляют
амфотерные свойства. -
Могут
играть роль буферной системы, т.к. могут
реагировать как слабое основание и
слабая кислота.
studfile.net
химия белки
белки
БЕЛКИ
— это азотсодержащие высокомолекулярные
органические вещества со сложным
составом
и строением молекул.
Белок
можно рассматривать как сложный полимер
аминокислот.
Белки
входят в состав всех живых организмов,
но особо важную роль они играют
в
животных организмах, которые состоят
из тех или иных форм белков (мышцы,
покровные
ткани, внутренние органы, хрящи, кровь).
Растения
синтезируют белки (и их составные части
a-аминокислоты) из углекислого
газа
СО2
и воды Н2О
за счет фотосинтеза, усваивая
остальные
элементы белков (азот N, фосфор Р, серу
S, железо Fe, магний Mg) из
растворимых
солей, находящихся в почве.
Животные
организмы в основном получают готовые
аминокислоты с пищей и на их
базе
строят белки своей организма. Ряд
аминокислот (заменимые аминокислоты)
могут
синтезироваться непосредственно
животными организмами.
Характерной
особенностью белков является их
многообразие, связанное с
количеством,
свойствами и способах соединения
входящих в их молекулу
аминокислот.
Белки выполняют функцию биокатализаторов
— ферментов,
регулирующих
скорость и направление химических
реакций в организме. В
комплексе
с нуклеиновыми кислотами обеспечивают
функции роста и передачи
наследственных
признаков, являются структурной основой
мышц и осуществляют
мышечное
сокращение.
В
молекулах белков содержатся повторяющиеся
амидные связи С(0)—NH, названные
пептидными
(теория русского биохимика
А.Я.Данилевского).
Таким
образом, белок представляет собой
полипептид, содержащий сотни или
тысячи
аминокислотных звеньев.
Структура
белков:
|
Особый
характер белка каждого вида связан не
только с длиной, составом и
строением
входящих в его молекулу полипептидных
цепей, но и с тем, как эти
цепи
ориентируются.
В
структуре любого белка существует
несколько степеней организации:
1.
Первичная структура белка — специфическая
последовательность аминокислот
в
полипептидной цепи.
2.
|
Вторичная
структура белка — способ скручивания
полипептидной цепи в
пространстве
(за счет водородной связи между водородом
амидной группы —NH— и
карбонильной
группы — СО—, которые разделены четырьмя
аминокислотными
фрагментами).
3.
|
Третичная
структура белка — реальная трехмерная
конфигурация закрученной
спирали
полипептидной цепи в пространстве
(спираль, скрученная в спираль).
Третичная
структура белка обуславливает
специфическую биологическую
активность
белковой молекулы. Третичная структура
белка поддерживается за
счет
взаимодействия различных функциональных
групп полипептидной цепи:
·
дисульфидный мостик (-S-S-) между атомами
серы,
·
сложноэфирный мостик – между
карбоксильной группой (-СО-) и
гидроксильной
(-ОН),
·
солевой мостик — между карбоксильной
(-СО-) и аминогруппами (NH2).
4.
Четвертичная
структура
белка — тип взаимодействия между
несколькими
полипептидными
цепями.
|
Например,
гемоглобин представляет из себя комплекс
из четырех макромолекул
белка.
Физические
свойства
Белки
имеют большую молекулярную массу (
104—107),
многие
белки
растворимы в воде, но образуют, как
правило, коллоидные растворы, из
которых
выпадают при увеличении концентрации
неорганических солей, добавлении
солей
тяжелых металлов, органических
растворителей или при нагревании
(денатурация).
Химические
свойства
1.
Денатурация — разрушение вторичной и
третичной структуры белка.
2.
Качественные реакции на белок:
n
биуретовая реакция: фиолетовое
окрашивание при обработке солями меди
в
щелочной
среде (дают все белки),
n
ксантопротеиновая реакция: желтое
окрашивание при действии
концентрированной
азотной кислоты, переходящее в оранжевое
под действием
аммиака
(дают не все белки),
n
выпадение черного осадка (содержащего
серу) при добавлении ацетата свинца
(II),
гидроксида натрия и нагревании.
3.
Гидролиз белков — при нагревании в
щелочном или кислом растворе с
образованием
аминокислот.
Синтез
белков
Белок
— сложная молекула, и синтез его
представляется трудной задачей. В
настоящее
время разработано много методов
прекращения [ГМВ1]
a-аминокислот
в пептиды и синтезированы простейшие
природные белки — инсулин,
рибонуклеаза
и др.
Большая
заслуга в создании микробиологической
промышленности по производству
искусственных
пищевых продуктов принадлежит советскому
ученому
А.Н.Несмеянову.
Литература:
“ХИМИЯ”
М.,”СЛОВО” 1995.
Г.Е.Рудзитис,
Ф.Г.Фельдман
“Химия
11. Органическая химия”
М.,
“Просвещение”,1993.
А.И.Артеменко,
И.В. Тикунова
“Химия
10-11. Органическая химия”
М.,
“Просвещение” 1993.
studfile.net
Химические свойства белков | Химия онлайн
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
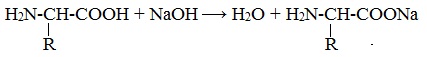
При действии же кислот он выступает в форме катиона:

Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
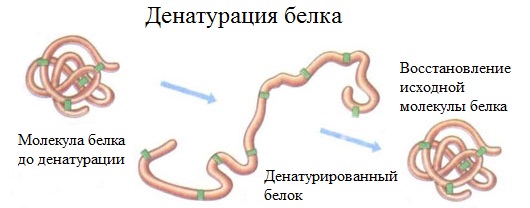
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
5. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.

Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина: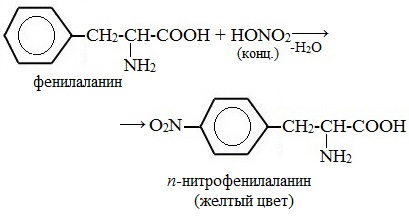
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.

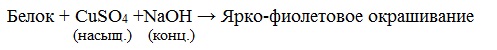

Причина появления окраски – образование комплексных соединений с координационным узлом: 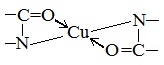
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)

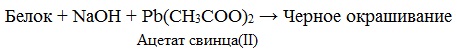
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Белки
himija-online.ru
Формула яичного белка Мне на химии сказали найти формулу яичного белка, не могу найти.
Её нет. Это, как белок, состоит из аминокислот, вот их формулы в принципе есть, хотя эти формулы не маленькие.
там же не один белок, а их смесь.. причем они будут отличатся от курицы к курице.. потому что состав этого белка заключен в днк конкретной курицы..
это проблематично
помню, сам искал
яичный белок — это не белок
это полимеризованный сахар
полимер типа полиэтилен, нейлон, дидерон, клей «Момент», только натуральный
по-научному называется «Мукополисахарид» <a rel=»nofollow» href=»https://ru.wikipedia.org/wiki/Гликозаминогликаны» target=»_blank»>https://ru.wikipedia.org/wiki/Гликозаминогликаны</a>
яичный белок — сильнейший абсорбент, и потому в сыром виде он опасен для жизни
в вареном виде этот белок для организма балласт, неусваимый, полностью выводимый наружу
touch.otvet.mail.ru
