Основы правильного питания — Школа здоровья — ГБУЗ Городская поликлиника 25 г. Краснодара МЗ КК
25 сентября 2019 г.
Значение белков, жиров и углеводов (БЖУ) в питании человека
Значение белка в питании здорового человека
Белки – сложные азотсодержащие биополимеры, мономерами которых служат α-аминокислоты. Белки – высокомолекулярные соединения. Их молекулярная масса колеблется от 6000 до 100000 и более. Аминокислотный состав различных белков неодинаков и является важнейшей характеристикой каждого белка, а также критерием его ценности в питании. Аминокислоты – органические соединения, в которых имеются две функциональные группы – карбоксильная, определяющая кислотные свойства молекул и аминогруппа, придающая этим соединениям основные свойства.
Среди большого число природных аминокислот в составе белков с наибольшим постоянством обнаруживают следующие 20 аминокислот: глицин (гликокол), аланин, серин, треонин, метионин, цистин, валин, лейцин, изолейцин, глутаминовая кислота, глутамин, аспарагиновая кислота, аспарагин, аргинин, лизин, фенилаланин, тирозин, гистидин, триптофан, пролин.
Все белки принято делить на простые (протеины) и сложные (протеиды). Под простыми понимают соединения, включающие в свой состав лишь полипептидные цепи, под сложными белками – соединения, в которых наряду с белковой молекулой имеется также небелковая часть – так называемая простетическая группа. В зависимости от пространственной структуры белки можно разделить на глобулярные и фибриллярные. К числу простых глобулярных белков относятся, в частности, альбумины, глобулины, проламины и глютелины. Альбумины и глобулины широко распространены в природе и составляют основную часть белков сыворотки крови, молока и яичного белка. Проламины и глютелины относятся к растительным белкам и встречаются в семенах злаков, образуя основную массу клейковины. Эти белки нерастворимы в воде. К проламин относятся глиадин пшеницы, зеин кукурузы, гордеин ячменя. Аминокислотный состав этих белков характеризуется низким содержанием лизина, а также треонина, метионина и триптофана и чрезвычайно высоким – глутаминовой кислоты.
Представители структурных белков, так называемые протеиноиды, являются фибриллярными белками главным образом животного происхождения. Эти белки выполняют в организме опорную функцию. Они нерастворимы в воде и весьма устойчивы к перевариванию пищеварительными ферментами. К ним относятся кератины (белки волос, ногтей, эпидермиса), эластин (белок связок, соединительной ткани сосудов и мышц), коллаген (белок костной, хрящевой, рыхлой и плотной соединительной ткани). При длительном кипячении в воде коллаген превращается в водорастворимый белок – желатин (глютин). Коллаген содержит значительное количество необычных для других белков аминокислот оксипролина и оксилизина, но в нем отсутствует триптофан.
Основные функции белков в организме.
1. П л а с т и ч е с к а я. Белки составляют 15-20% сырой массы различных тканей (в сравнении – липиды и углеводы лишь 1-5%) и являются основным строительным материалом клетки, ее органоидов и межклеточного вещества. Белки наряду с фосфолипидами образуют остов всех биологических мембран, играющих важную роль в построении клеток и их функционировании.
Белки наряду с фосфолипидами образуют остов всех биологических мембран, играющих важную роль в построении клеток и их функционировании.
2. К а т а л и т и ч е с к а я. Белки являются основным компонентом всех без исключения известных в настоящее время ферментов. При этом простые ферменты представляют собой чисто белковые соединения. В построении сложных ферментов наряду с молекулами белка участвуют и низкомолекулярные соединения (коферменты). Ферментам принадлежит решающая роль в ассимиляции пищевых веществ организмом человека и в регуляции всех внутриклеточных обменных процессов.
3. Г о р м о н а л ь н а я. Значительная часть гормонов по своей природе является белками или полипептидами. К их числу принадлежит инсулин, гормоны гипофиза (АКТГ, соматотропный, тиреотропный и др.), паратиреоидный гормон.
4. Ф у н к ц и я с п е ц и ф и ч н о с т и. Чрезвычайное разнообразие и уникальность индивидуальных белков обеспечивают тканевую индивидуальную и видовую специфичность, лежащую в основе проявлений иммунитета и аллергии. В ответ на поступление в организм чужеродных для него белков – антигенов – в иммунокомпетентных органах и клетках происходит активный синтез антител, представляющих особый вид глобулинов (иммуноглобулины). Специфическое взаимодействие антигена с соответствующими антителами составляет основу иммунных реакций, обеспечивающих защиту организма от чужеродных агентов.
В ответ на поступление в организм чужеродных для него белков – антигенов – в иммунокомпетентных органах и клетках происходит активный синтез антител, представляющих особый вид глобулинов (иммуноглобулины). Специфическое взаимодействие антигена с соответствующими антителами составляет основу иммунных реакций, обеспечивающих защиту организма от чужеродных агентов.
5. Т р а н с п о р т н а я. Белки участвуют в транспорте кровью кислорода (Hb), липидов (липопротеиды), углеводов (гликопротеиды), некоторых витаминов, гормонов, лекарственных веществ и др. Вместе с тем специфические белки-переносчики обеспечивают транспорт различных минеральных солей и витаминов через мембраны клеток и субклеточных структур.
Белки организма – чрезвычайно динамичные структуры, постоянно обновляющие свой состав вследствие непрерывно протекающих и тесно сопряженных друг с другом процессов их распада и синтеза. Организм человека практически лишен резерва белка, причем углеводы и жиры также не могут служить его предшественниками. В связи с этим единственным источником пополнения фонда аминокислот и обеспечения равновесия процессов синтеза и распада белков в организме могут служить пищевые белки, являющиеся вследствие этого незаменимыми компонентами пищевого рациона.
В связи с этим единственным источником пополнения фонда аминокислот и обеспечения равновесия процессов синтеза и распада белков в организме могут служить пищевые белки, являющиеся вследствие этого незаменимыми компонентами пищевого рациона.
Белки, содержащиеся в пищевых продуктах, не могут однако, непосредственно усваиваться организмом и должны быть предварительно расщеплены в желудочно-кишечном тракте до составляющих их аминокислот, из которых организм формирует характерные для него белковые молекулы. Из 20 аминокислот, образующихся при гидролизе белков, 8 (валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин, лизин) не синтезируются в организме человека и поэтому являются незаменимыми факторами питания. Для детей в возрасте до года незаменимой аминокислотой служит также гистидин. Другие 11 аминокислот могут претерпевать в организме взаимопревращения и не являются незаменимыми. Поскольку для построения подавляющего большинства белков организма человека требуются все 20 аминокислот, но в различных соотношениях, дефицит любой из незаменимых аминокислот в пищевом рационе неизбежно ведет к нарушению синтеза белков.
При нарушении сбалансированности аминокислотного состава рациона синтез полноценных белков также нарушается, что ведет к возникновению ряда патологических изменений. В связи с этим пищевые белки следует рассматривать, прежде всего, как поставщики в организм человека незаменимых аминокислот. Наряду с использованием для синтеза белковых молекул аминокислоты могут окисляться в организме и служить источником энергии. Конечными продуктами катаболизма аминокислот являются углекислый газ, вода и аммиак, который выводится из организма в виде мочевины и некоторых других менее токсичных соединений.
Недостаточное поступление с пищей белков нарушает динамическое равновесие процессов белкового анаболизма и катаболизма, сдвигая его в сторону преобладания распада собственных белков организма, в том числе и белков ферментов.
Избыточное поступление пищевых белков также небезразлично для организма. Оно вызывает усиленную работу пищеварительного аппарата, значительную активацию процессов межуточного обмена аминокислот и синтеза мочевины, увеличивает нагрузку на клубочковый и канальцевый аппарат почек, связанную с усиленной экскрецией конечных продуктов азотистого обмена.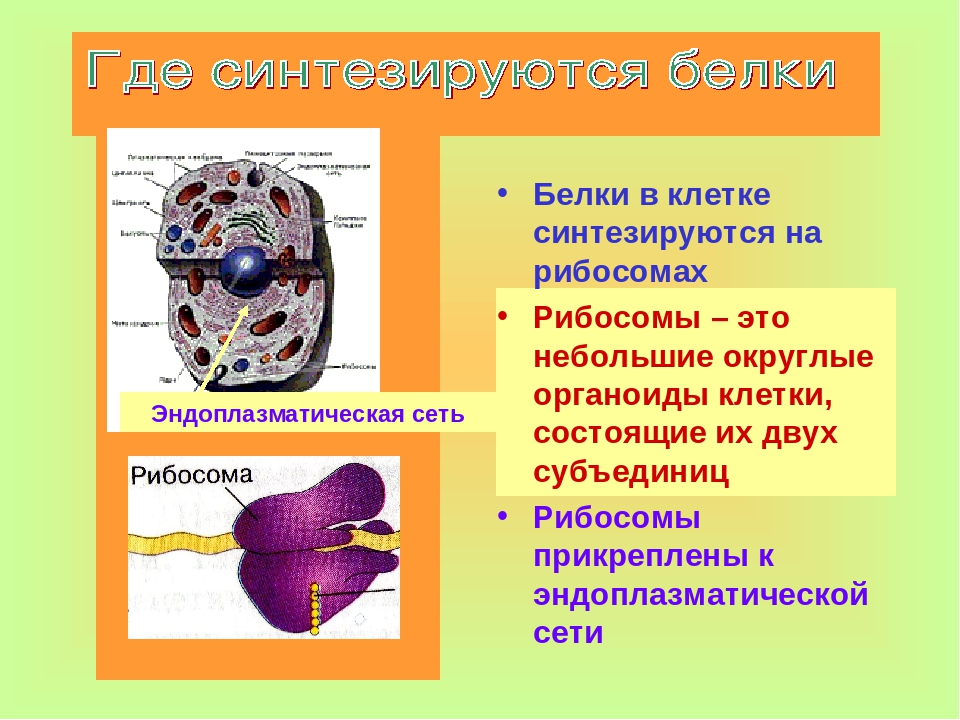 При этом может возникать перенапряжение указанных процессов с их последующим функциональным истощением. Избыточное поступление в организм белков может также вести к образованию в желудочно-кишечном тракте продуктов их гниения и неполного расщепления, способных вызывать интоксикацию человека.
При этом может возникать перенапряжение указанных процессов с их последующим функциональным истощением. Избыточное поступление в организм белков может также вести к образованию в желудочно-кишечном тракте продуктов их гниения и неполного расщепления, способных вызывать интоксикацию человека.
Важным показателем качества пищевого белка может служить и степень его усвояемости, которая объединяет протеолиз в желудочно-кишечном тракте и последующее всасывание аминокислот. По скорости переваривания протеолитическими ферментами пищевые белки можно расположить в следующей последовательности: 1) рыбные и молочные, 2) мясные, 3) белки хлеба и круп.
Хлеб и хлебобулочные изделия, крупы и макаронные изделия содержат 5-12% белка; с учетом значительного потребления этих продуктов жителями нашей страны они вносят весьма существенный вклад в обеспечение человека белком. Однако белок хлебобулочных изделий и круп дефицитен по ряду аминокислот, в первую очередь по лизину, и не является достаточно полноценным.
Как коронавирус заражает организм (схема)
Коронавирус SARS-CoV-2 ранее 2019-nCoV, вирус, вызывающий коронавирусную инфекцию (COVID-19), в настоящее время распространяется по всему миру. Известно, что по меньшей мере шесть других типов коронавируса заражают людей, причем некоторые вызывают простуду, а две вызывают эпидемии: атипичная пневмония в 2002 году и MERS в 2012 году.
Покрыты шипами
Коронавирус назван в честь короноподобных шипов, выступающих из его поверхности. Вирус заключен в пузырек маслянистых липидных молекул, который распадается при контакте с мылом.
Вход в уязвимую клетку
Вирус попадает в организм через нос, рот или глаза, а затем прикрепляется к клеткам дыхательных путей, которые продуцируют белок, называемый ACE2. Считается, что вирус возник у летучих мышей, где он мог присоединиться к аналогичному белку.
Высвобождение вирусной РНК
Вирус заражает клетку, сливая ее масляную мембрану с мембраной клетки. Оказавшись внутри, коронавирус высвобождает фрагмент генетического материала под названием РНК.
Оказавшись внутри, коронавирус высвобождает фрагмент генетического материала под названием РНК.
Освобождение камеры
Геном вируса имеет длину менее 30 000 генетических «букв». (У нас более 3 миллиардов.) Зараженная клетка считывает РНК и начинает производить белки, которые будут держать иммунную систему в страхе и помогут собрать новые копии вируса.
Антибиотики убивают бактерии и не действуют против вирусов. Но исследователи тестируют антивирусные препараты, которые могут разрушить вирусные белки и остановить инфекцию.
Создание вирусных белков
По мере прогрессирования инфекции механизм клетки начинает производить новые спайки и другие белки, которые будут образовывать больше копий коронавируса.
Сборка новых копий
Новые копии вируса собираются и переносятся на внешние края клетки.
Распространение инфекции
Каждая зараженная клетка может выпустить миллионы копий вируса, прежде чем клетка окончательно разрушится и умрет. Вирусы могут инфицировать близлежащие клетки или попасть в капли, которые покидают легкие.
Вирусы могут инфицировать близлежащие клетки или попасть в капли, которые покидают легкие.
Иммунная реакция
Большинство инфекций Covid-19 вызывают лихорадку, поскольку иммунная система борется, чтобы очистить вирус. В тяжелых случаях иммунная система может чрезмерно реагировать и начать атаковать клетки легких. Легкие закупориваются жидкостью и отмирающими клетками, что затрудняет дыхание. Небольшой процент инфекций может привести к острому респираторному дистресс-синдрому и, возможно, смерти.
Покидая тело
Кашель и чихание могут привести к попаданию вирусных капель на находящихся поблизости людей и поверхности, где вирус может оставаться заразным от нескольких часов до нескольких дней. Зараженные люди могут избежать распространения вируса, надев маску, но здоровым людям не нужно носить маску, если они не заботятся о больном человеке.
Как быть с возможной вакциной
Будущая вакцина может помочь организму вырабатывать антитела, которые нацелены на вирус SARS-CoV-2 и предотвращают его заражение человеческими клетками. Вакцина против гриппа работает аналогичным образом, но антитела, полученные из вакцины против гриппа, не защищают от коронавируса.
Вакцина против гриппа работает аналогичным образом, но антитела, полученные из вакцины против гриппа, не защищают от коронавируса.
Лучший способ избежать заражения коронавирусом и другими вирусами — мыть руки с мылом, избегать прикосновения к лицу, держаться подальше от больных людей и регулярно чистить часто используемые поверхности.
Источники: доктор Мэтью Б. Фриман и доктор Стюарт Уэстон, Univ. Мэрилендской Школы Медицины; Поля вирусологии; Медицинская вирусология Феннера и Уайта; Природа; Наука; Ланцет; Медицинский журнал Новой Англии; Центры по контролю и профилактике заболеваний.
https://www.nytimes.com/interactive/2020/03/11/science/how-coronavirus-hijacks-your-cells.html
Клетка для белки. -Мелкие животные и грызуны -Статьи
Вы планируете обновить дом для вашего грызуна, или только готовитесь стать владельцем пушистого и шустрого грызуна белки? Прежде всего, хочется порадоваться за вас и ваш выбор! Белки – подвижные, веселые, очень любопытные и умные зверьки. Наблюдать за ними – одно удовольствие – большое количество улыбок владельцам они гарантируют. Кроме того, такое животное – не просто питомец. Они становятся полноценными членами семьи. И им, как и остальным, требуется «своя комната».
Наблюдать за ними – одно удовольствие – большое количество улыбок владельцам они гарантируют. Кроме того, такое животное – не просто питомец. Они становятся полноценными членами семьи. И им, как и остальным, требуется «своя комната».
Жилплощадь.
Жилье – клетка – должно быть не просто просторным, оно должно соответствовать образу жизни животных. Заказать клетку для белок следует высотой не менее 1,5 метров. Ваши питомцы – прыгучие и подвижные животные, поэтому ширина и длина клетки рекомендуются от 60-80 см. Помимо обеспечения комфортного проживания в клетке, такие ее размеры гарантируют поддержание хорошего самочувствия белок: этот зверек подвержен заболеваниям желудочно-кишечного тракта и малая подвижность может быть чревата запорами и нерегулярным стулом.
Клетки питомцев должны иметь в своем оснащении полки и домик, хорошо зафиксированный наверху. Любые дополнительные элементы комфорта вы можете купить, клетки для белок в нашем интернет магазине Зоо Идея продаются уже в некотором оснащении:
· есть на колесиках, позволяющих передвигать эту инсталляцию в нужном направлении (например, в поиске места без сквозняков, когда проветриваете помещение),
· некоторые клетки продаются с лестницами и зонами для игр, кормушками и поилками для животных.
Меры безопасности.
Хозяева подвижных грызунов должны знать, что белки очень подвержены травмам и повреждениям при проживании в неверно подобранных клетках и не грамотном их расположении в помещении.
1. Клетка подбирается до смешного по простому принципу: чем больше и выше – тем лучше.
2. Никаких решеток – только прутья, расстояние между которыми не превысит 20 мм. Другое расположение границ «дома» может создать травмоопасную среду для животных.
3. Никакого сетчатого или решетчатого пола в клетке. Лучше сделать выбор в пользу пола с сеткой, похожей на ту, которая располагается в кошачьих туалетах.
4. Белки – животные очень чистоплотные, сами чистят шкурку. При этом такие питомцы подвержены кожным заболеваниям и требуют тщательного внимания к своему дому и регулярной ее уборки.
5. Важным элементом комфорта этих животных является температурный режим и отсутствие сквозняков. Оптимальная температура их содержания – до 25-26 °С. В случае низкой влажности и температуры от 27 °С до 30 °С в помещении, животные за короткий срок могут погибнуть от теплового удара.
В случае низкой влажности и температуры от 27 °С до 30 °С в помещении, животные за короткий срок могут погибнуть от теплового удара.
6. Нельзя ставить клетку у батареи или в местах попадания на нее прямых солнечных лучей.
7. Еще о прутьях клетки – обратите внимание на то, что выбор делать нужно в пользу оцинкованных клеток или имеющих порошковую окраску высочайшего класса. Для удобства хозяев не плохо было бы приобретать клетку с выдвижным поддоном.
8. Размещая в клетке игровые или бытовые аксессуары важно уделить внимание расстоянию между элементами. Зачем? Белки и шиншиллы ввиду своей любопытности готовы залезть в любую дыру и щель. Поэтому, что бы ваш питомец не застрял, оптимальные «зазоры» составляют от 7 см (большие) или 1,5-2 см (маленькие). Соответственно, в одних они легко проскочат, а во вторые – просто не поместятся.
9. Предметы в клетке должны быть окатыми и не иметь опасных углов. Крепления должны быть недостижимыми для животного – внешними – в идеале, или хорошо спрятанными, если они внутренние.
10. Белки любят «жить» в домиках. Во-первых, размер такого домика – не менее 20*25 (ширина и глубина) и 26 см в высоту. Диаметр входа – не менее 7-10 см. Кроме того, какой бы домик вы не выбрали – обеспечьте себе к нему доступ – съемная или подъемная крышка. Запомните – на одно животное полагается 2 домика.
11. Кормушки и поилки выбирайте из нержавейки, избегая материалов, представляющих гастрономический интерес для грызунов.
12. Камни минеральный и солевой должны быть рядом с поилкой или кормушкой.
Занимаясь дизайном клетки, не забывайте – вы хозяин грызунов, а значит – все, что можно сгрызть или перегрызть – получит по заслугам рано или поздно. Поэтому – крепления предусмотрите металлические, а размещение – безопасным для животных.
Никогда!
· Не кормите своих грызунов ядовитым для них миндалем.
· Не применяйте газеты. Не важно – какие животные живут в доме, и с какой целью вы им преподносите газеты или журналы. Они их не читают! Но получают в своих клетке или горшке источник свинца, любезно предоставленный собственным хозяином. Друг бы им газету не дал.
Друг бы им газету не дал.
· Не вешайте маленьких и симпатичных беговых колец. Минимально допустимый диаметр такой игрушки – 30 см.
Не запрещайте своим питомцам рыться в песке или земле. Поощряйте их желание быть чистыми – они так купаются. Вне клетки поставьте им такой сухой бассейн. Учтите – низкие борта и большое количество песка гарантируют вам песочницу по всему дому! Ну, или небольшой земельный участок. Это уж зависит от того, что вы им туда насыплете. В летнее жаркое время можно поставить бассейн с водой. Принцип тот же – высоко и не глубоко. Только теперь опасность грозить может не только паркету, но и самому животному. При глубине более 2-3 см грызун может просто захлебнуться.
Питание и уход.
Помимо лакомств, грызунов необходимо кормить специальными кормами, способными наполнить рацион животных необходимыми элементами, которые они в условиях домашнего содержания получить вряд ли смогут. Поэтому не будет лишним заказать корм, дающий возможность дать животным полноценное питание.
Не лишайте своего внимания на полках ЗОО-магазинов ликвидаторов неприятных запахов, шампуней и «чесательных» принадлежностей для своих любимцев. Это же касается витаминов и ветеринарных средств.
Приучите своих питомцев к приему пищи 2 раза в день – лучше утром и вечером. Днем белки малоподвижны и большой потребности в восполнении энергии путем насыщения им не требуется.
Принцип жизни белки: найти, достать и не сорваться. В природе эти животные добывают пищу себе сами – в основном шишки – и не с земли, где им опасно, а прямо с дерева, если это возможно. Радуйте своих питомцев орехами и шишками. Однако, внимательно следите за тем, что бы грызуны не переедали.
02.12.2014, 6953 просмотра.
Как жар убивает клетки / Хабр
При превышении определённой температуры клетка приходит в негодность и умирает. Одно из простейших объяснений такой непереносимости жары состоит в том, что необходимые для жизни белки – те, что извлекают энергию из еды или солнечного света, обороняются от вторжений, уничтожают отходы и т. п. – часто обладают удивительно точной формой. Начинаясь как длинные нити, они затем скручиваются в виде спиралей, «заколок для волос» и других форм, диктуемых последовательностью их составных частей. И эти формы играют огромную роль в их деятельности. Но когда температура начинает расти, связи, удерживающие белковые структуры, нарушаются: сначала самые слабые, а затем и сильные. Логично, что распространяющаяся потеря белковой структуры должна быть летальной, но до последнего времени детали того, как именно это убивает перегретые клетки, были неясны.
п. – часто обладают удивительно точной формой. Начинаясь как длинные нити, они затем скручиваются в виде спиралей, «заколок для волос» и других форм, диктуемых последовательностью их составных частей. И эти формы играют огромную роль в их деятельности. Но когда температура начинает расти, связи, удерживающие белковые структуры, нарушаются: сначала самые слабые, а затем и сильные. Логично, что распространяющаяся потеря белковой структуры должна быть летальной, но до последнего времени детали того, как именно это убивает перегретые клетки, были неясны.
Теперь же биофизики из Швейцарской высшей технической школы Цюриха изучили поведение каждого белка в клетках четырёх различных организмов при повышении температуры. Это исследование и богатый набор собранных данных, опубликованный в журнале Science, показали, что при температуре, достаточной для смерти клетки – человеческой, или же клетки кишечной палочки Escherichia coli – разрушаются лишь несколько ключевых белков. Более того, обилие белков в клетках оказалось неожиданным образом связанным с их стабильностью. Исследования позволили учёным бегло ознакомиться с фундаментальными правилами, по которым выстроена работа белков и их упорядочивание, и последствия которых, как стало понятно, простираются гораздо дальше простой смерти от жары.
Исследования позволили учёным бегло ознакомиться с фундаментальными правилами, по которым выстроена работа белков и их упорядочивание, и последствия которых, как стало понятно, простираются гораздо дальше простой смерти от жары.
Паола Пикотти, биофизик, руководивший работой, объяснила, что эксперименты отталкивались от старых и нерешённых вопросов: почему некоторые клетки выживают при высоких температурах, а другие – умирают? Бактерия Thermus thermophilus счастливо живёт в горячих источниках и в домашних нагревателях [при оптимальной температуре в 65 °C – прим. перев.], тогда как клетки E. coli чахнут при температурах выше 40 °C. Убедительные доказательства говорят о том, что дело тут в разной стабильности белков этих организмов. Но следить за белком, находящимся в живой клетке, что было бы идеальным методом изучения, очень неудобно. Изолирование белка в пробирке не даёт всех ответов, поскольку внутри организма белки сбиваются вместе и влияют на химию друг друга, или же поддерживают друг друга в необходимой форме. Чтобы понять, что именно и почему разваливается, необходимо наблюдать за белками в то время, когда они всё ещё влияют друг на друга.
Чтобы понять, что именно и почему разваливается, необходимо наблюдать за белками в то время, когда они всё ещё влияют друг на друга.
Как тепло уничтожает белки
1) Первичная структура белков – это длинные цепочки аминокислот, объединённые в заданные генами последовательности.
2) Вторичная структура – это аминокислота, которая также свёртывается в конфигурации, удерживаемые слабыми межмолекулярными связями.
3) Третичная структура – слабые связи, стабилизирующие расположение прямых и скрученных участков трёхмерной структуры белка. Их расположение позволяет белку соединяться с нужными молекулами.
Тепловая смерть. Слабые связи теряют способность удерживать третичную и вторичную структуры, и белок денатурирует, то есть разворачивается. Но не все белки разворачиваются при одной температуре – окружение белка в клетке может придавать ему дополнительную стабилизацию.
Чтобы решить поставленную задачу, команда разработала автоматизированную процедуру наблюдения. Они разрезали клетки и нагревали их содержимое поэтапно, выпуская на каждом этапе ферменты, разделявшие белки. Эти ферменты особенно хорошо разрезают развернувшиеся белки, поэтому исследователи на основе остатков разрезанных белков могли судить о том, какие белки развалились при заданной температуре. Таким образом им удалось построить денатурационные кривые для каждого из тысяч изученных белков. Дуги кривых идут от нетронутой структуры белка при комфортабельной для него температуре до полностью развёрнутого состояния при высокой температуре. Для поиска различий между кривыми разных видов живых существ, были проведены эксперименты над клетками людей, E. coli, T. thermophilus и дрожжей. «Исследование было прекрасным», – сказал Алан Драммонд [Allan Drummond], биолог из Чикагского университета, имея в виду как масштаб, так и точность процесса.
Они разрезали клетки и нагревали их содержимое поэтапно, выпуская на каждом этапе ферменты, разделявшие белки. Эти ферменты особенно хорошо разрезают развернувшиеся белки, поэтому исследователи на основе остатков разрезанных белков могли судить о том, какие белки развалились при заданной температуре. Таким образом им удалось построить денатурационные кривые для каждого из тысяч изученных белков. Дуги кривых идут от нетронутой структуры белка при комфортабельной для него температуре до полностью развёрнутого состояния при высокой температуре. Для поиска различий между кривыми разных видов живых существ, были проведены эксперименты над клетками людей, E. coli, T. thermophilus и дрожжей. «Исследование было прекрасным», – сказал Алан Драммонд [Allan Drummond], биолог из Чикагского университета, имея в виду как масштаб, так и точность процесса.
Во время наблюдений было ясно видно, что белки всех живых существ не разворачиваются все сразу при повышении температуры. «Мы увидели, что лишь небольшое подмножество белков разрушилось на самых ранних стадиях, – сказала Пикотти, – и это были ключевые белки». На диаграмме с переплетениями межбелковых связей самые хрупкие белки из этого небольшого подмножества часто обладали большим количеством связей, что означает, что они влияют на множество процессов, происходящих в клетках. «Без этих белков клетки не могут работать, – сказала Пикотти. – Когда они пропадают, вся сеть разрушается». И вместе с ней, очевидно, останавливается и жизнь клетки.
На диаграмме с переплетениями межбелковых связей самые хрупкие белки из этого небольшого подмножества часто обладали большим количеством связей, что означает, что они влияют на множество процессов, происходящих в клетках. «Без этих белков клетки не могут работать, – сказала Пикотти. – Когда они пропадают, вся сеть разрушается». И вместе с ней, очевидно, останавливается и жизнь клетки.
Этот парадокс – самые важные белки оказываются самыми хрупкими – может быть отражением того, как эволюция создала их для выполнения соответствующих задач. Если у белка есть множество ролей, его нестабильность и склонность к разворачиванию и повторному сворачиванию может стать преимуществом, поскольку она может позволить ему принимать разные формы, подходящие к разным задачам. «Многие из этих ключевых белков обладают большой гибкостью, что и делает их менее стабильными», но при этом наделяет их способностью связываться с различными целевыми молекулами в клетке, пояснила Пикотти. «Скорее всего, именно так они справляются со своими функциями.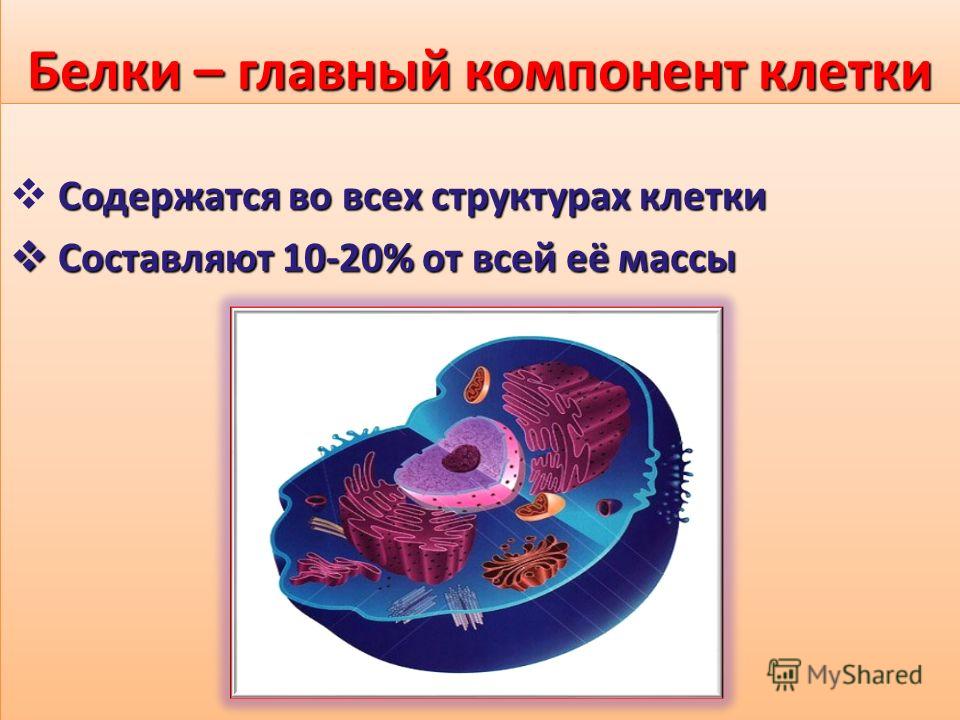 Это некий компромисс».
Это некий компромисс».
Тщательнее изучив E. coli, для которой собранные данные получились наиболее качественными, исследователи обнаружили и связь между обилием белка – количеством его копий в клетке – и его стабильностью. Чем больше копий белка делает клетка, тем больше температура требуется для его уничтожения. При этом оказывается, что большое количество копий не коррелирует с критичностью белка для выживания. Некоторые ключевые белки встречаются очень редко. Эта связь между обилием и надёжностью подтверждает идею, выдвинутую Драммонд ещё лет десять назад – у клеточной системы, изготавливающей белки, есть тенденция к тому, чтобы периодически допускать ошибки. Ошибка обычно дестабилизирует белок. Если этот белок оказывается распространённым, и такой белок в клетке появляется сотню или тысячу раз в день, тогда неправильно свернувшиеся копии, произведённые в больших количествах, могут засорить клетку. Таким образом организму выгодно было бы эволюционировать так, чтобы наиболее распространённые белки были бы и наиболее стабильными, что подтверждают полученные командой Пикотти данные.
Чтобы понять, какие качества белка делают его стабильным, исследователи сравнили данные E. coli и T. Thermophilus. Белки E. coli начали разваливаться при 40 °C, и практически полностью деградировали при 70 °C. Но при этой температуре белки T. thermophilus только начинали испытывать дискомфорт – некоторые из них держали форму и при 90 °C. Команда обнаружила, что у T. thermophilus белки обычно были короче, и некоторые типы форм и компонентов белка чаще встречались в самых стабильных из них.
Пример кривой из эксперимента. По вертикали – процент развернувшихся белков, по горизонтали – температура. Вертикальная черта – температура, при которой клетки начинают умирать. Для этого нужно развернуться всего нескольким ключевым белкам.
Открытия могут помочь исследователям разработать белки, чья стабильность подстроена под их задачи. Во многих промышленных процессах, где используются бактерии, повышение температуры повышает и отдачу – но довольно скоро бактерии начинают умирать от жары. Было бы интересно узнать, сможем ли мы стабилизировать бактерии, сделав ключевые белки более устойчивыми к температуре – сказала Пикотти.
Было бы интересно узнать, сможем ли мы стабилизировать бактерии, сделав ключевые белки более устойчивыми к температуре – сказала Пикотти.
Обилие информации по поводу того, насколько легко разворачиваются определённые белки, сильно порадовало некоторых биологов. От стабильности белка напрямую зависит вероятность его агрегации: появления комков неразвернувшихся белков, прилипающих друг к другу. Агрегаты белков могут обернуться кошмаром для клеток и мешать выполнению главных задач. К примеру, их обвиняют в появлении некоторых серьёзных неврологических проблем, таких, как болезнь Альцгеймера, при которой бляшки развернувшихся белков засоряют мозг.
Паола Пикотти
Но это не значит, что агрегация происходит только у организмов, страдающих определёнными заболеваниями. Наоборот, исследователи поняли, что возможно, она происходит постоянно, и что у здоровых клеток есть методы, при помощи которых они справляются с нею. «Я думаю, что всё чаще это явление признаётся очень распространённым», – сказал Микель Вендрусколо [Michele Vendruscolo], биохимик из Кембриджского университета. «Большинство белков неправильно сворачиваются и агрегируют внутри клеток. Самое важное, что установила команда Пикотти, это тот отрезок времени, в котором какой-либо выбранный белок находится в развёрнутом состоянии. Это время определяет степень возможной агрегации белка». Некоторые белки почти никогда не разворачиваются и не агрегируют, другие ведут себя так в определённых условиях, а иные делают так постоянно. По словам биохимика, детальное описание белков в новой работе сильно облегчит изучение и понимание этих различий между белками. Некоторые из денатурационных кривых говорят о том, что их белки агрегируют после того, как развернулись. «У них получилось отследить оба этапа – как развёртывание, так и последующую агрегацию, – сказал Вендрусколо. – В этом вся прелесть этого исследования».
«Большинство белков неправильно сворачиваются и агрегируют внутри клеток. Самое важное, что установила команда Пикотти, это тот отрезок времени, в котором какой-либо выбранный белок находится в развёрнутом состоянии. Это время определяет степень возможной агрегации белка». Некоторые белки почти никогда не разворачиваются и не агрегируют, другие ведут себя так в определённых условиях, а иные делают так постоянно. По словам биохимика, детальное описание белков в новой работе сильно облегчит изучение и понимание этих различий между белками. Некоторые из денатурационных кривых говорят о том, что их белки агрегируют после того, как развернулись. «У них получилось отследить оба этапа – как развёртывание, так и последующую агрегацию, – сказал Вендрусколо. – В этом вся прелесть этого исследования».
И хотя многие учёные интересуются агрегатами из-за наносимого ими ущерба, некоторые смотрят на это явление с другой точки зрения. Драммонд говорит, что становится ясным, что некоторые агрегаты – это не просто кусочки мусора, болтающиеся в клетке. Они содержат активные белки, продолжающие выполнять свои функции.
Представьте, что вы издалека видите дым, поднимающийся из какого-либо здания, говорит Драммонд. Вокруг здания вы видите некие фигуры, и вы представляете себе, что это тела, извлечённые из руин. Но если вы подойдёте ближе, вы можете обнаружить, что это живые люди, спасшиеся из горящего здания, ждущие, пока происшествие закончится. Так получается с исследованием агрегатов, говорит Драммонд: исследователи обнаруживают, что белки в агрегатах оказываются не жертвами, а выжившими. «Сейчас вообще появляется новая область науки, растущая взрывными темпами», – говорит он.
Комкование белков может оказаться не признаком повреждений, а способом для белка сохранять свои функции в сложной ситуации. Оно может, к примеру, защищать их от окружающей среды. А когда условия улучшаются, белки могут покидать агрегаты и сворачиваться заново. «Их форма меняется в зависимости от температуры таким образом, что на первый взгляд это кажется неправильным сворачиванием, – говорит Драммонд. – Но в этом есть какой-то иной смысл». В статье в журнале Cell от 2015 года он с коллегами определил 177 белков дрожжей, сохранивших свои функции уже после попадания в агрегаты. В работе, вышедшей в марте, эта команда описала, что если изменить один из белков так, чтобы он не смог агрегировать, то это приводит к серьёзным проблемам в функционировании клетки.
– Но в этом есть какой-то иной смысл». В статье в журнале Cell от 2015 года он с коллегами определил 177 белков дрожжей, сохранивших свои функции уже после попадания в агрегаты. В работе, вышедшей в марте, эта команда описала, что если изменить один из белков так, чтобы он не смог агрегировать, то это приводит к серьёзным проблемам в функционировании клетки.
В общем и целом, работа утверждает, что белки – удивительно динамичные структуры. Сначала они могут показаться жёсткими машинами, работающими над зафиксированными задачами, для которых подходит одна определённая форма. Но на самом деле белки могут принимать несколько различных форм во время своей нормальной работы. И в нужное время их форма может меняться так сильно, что может показаться, будто они портятся, хотя на самом деле они наоборот укрепляются. На молекулярном уровне жизнь может представлять собой постоянные соединения и разъединения связей.
Ученые описали структуру мишени коронавируса SARS-CoV-2
Renhong Yan et al. / Science, 2020
/ Science, 2020
Китайские исследователи определили кристаллическую структуру молекулы, с которой связывается SARS-CoV-2 при проникновении в клетку, сообщается в Science. Эта молекула — ангиотензин-превращающий фермент 2. Результаты работы ускорят разработку эффективных средств против коронавируса.
Чтобы попасть в клетку, SARS-CoV-2, как и другие коронавирусы, использует белок-«шип» (spike, S-белок). Им он прикрепляется к мишени на поверхности клетки-хозяина. Секвенирование генома нового коронавируса показало, что в его случае мишень — ангиотензин-превращающий фермент 2 (АПФ2). С той же молекулой связывается и вирус «атипичной пневмонии» SARS-CoV, один из ближайших родственников нового коронавируса.
Этот фермент отщепляет одну аминокислоту от ангиотензина II типа и тем самым меняет его свойства: получившаяся молекула оказывает сосудосуживающий эффект и может играть роль при остром респираторном дистресс-синдроме. Другая функция АПФ2 — модулировать перенос аминокислот через мембрану клетки. Ее фермент реализует, поддерживая нужную форму мембранного транспортера аминокислот B0AT1.
Специалисты по структурной биологии из Университета Уэстлейка в Ханчжоу под руководством Цяна Чжоу (Qiang Zhou) с помощью криоэлектронной микроскопии (замораживания отдельных молекул и «просвечивания» их электронным микроскопом) получили данные о структуре АПФ2 в присутствии B0AT1. Молекулы находились в одном из двух состояний: связанные с фрагментом белка-«шипа» коронавируса и без связи с ним. Разрешение моделей составило 2.9 Å (ангстрем). Особое внимание уделили участку, которым «шип» связывается с ангиотензин-превращающим ферментом 2.
Комплекс из двух молекул АПФ2 (ACE2, синий и голубой), двух транспортеров аминокислот (B0AT1; розовый) и двух фрагментов вирусного белка-«шипа» (RBD, желтый) и его расположение в клеточной мембране
Renhong Yan et al. / Science, 2020
/ Science, 2020
Выяснилось, что АПФ2 и B0AT1 образуют гетеродимер — молекулу из двух неодинаковых частей. Две таких молекулы, в свою очередь, формируют гомодимер. Его целостность обеспечивают взаимодействия одноименных участков двух молекул ангиотензин-превращающего фермента. «Шип» SARS-CoV-2 за счет полярных взаимодействий присоединяется к АПФ в районе участка с протеазной активностью (протеазным доменом) — того, который обеспечивает отрыв одной аминокислоты от ангиотензина II типа. Притом с одним АПФ2 может быть связан тример (комплекс по три) вирусных белков, а с описанным димером, соответственно, два тримера.
Хотя полной расшифровки структуры АПФ2 исследователи не получили, их работа дала ответ на ключевые вопросы: какие аминокислоты можно заменить во фрагменте ангиотензин-превращающего фермента 2, который связывается с S-белком SARS-CoV-2, чтобы снизить вероятность их объединения — а с ним и заражения клетки.
Зная все это, можно прицельно отбирать такие молекулы, которые способны с наибольшей эффективностью связываться либо с протеазным доменом АПФ2, либо с S-белком коронавируса и не дают двум этим веществам осуществить связывание. Это, как ожидают авторы, ускорит создание лекарственных средств против SARS-CoV-2.
Совсем недавно другая группа исследователей из Китая показала, что существует минимум две разновидности SARS-CoV-2 — более «старый» S-тип, заражение которым обычно приводит к более легким формам COVID-19, и более «молодой» и тяжело переносимый L-тип.
Светлана Ястребова
Молекулярный детектив | Институт молекулярной и клеточной биологии СО РАН
Сайт Наука в Сибири 20 июля 2017 г.
Сайт Новости Сибирской Науки 21 июля 2017 г.
Когда клетка делится, копируются не только нити ДНК, но также набор и расположение связанных с ними белков, включающих и выключающих гены. До сих пор неизвестно, какие механизмы управляют этим процессом. Учёные Института молекулярной и клеточной биологии СО РАН, кажется, вышли на след.
Эта история началась почти 20 лет назад, когда Игорь Фёдорович Жимулёв и Елена Сергеевна Беляева (работавшие на тот момент в лаборатории Института цитологии и генетики СО РАН, из коллектива которой потом вырос ИМКБ) поспорили о чём-то, с темой нашей сегодняшней статьи никак не связанном, и для разрешения спора достали препараты с хромосомами дрозофил, сделанные в 1970-х годах. Случайно исследователи обратили внимание, что в этих хромосомах репликация ДНК происходит более эффективно, чем в остальных линиях мух. Они выяснили, из какой линии дрозофил был сделан этот препарат, срочно нашли её в США и выписали в Новосибирск.
Оказалось, что необычная картина репликации ДНК у этих мух сохранялась на протяжении десятилетий, а значит — носит наследственный характер. Через несколько лет напряженной работы учёным удалось найти мутацию, вызывающую этот эффект, и охарактеризовать ген, в котором она произошла. Так был открыт ген, кодирующий белок SUUR.
Через несколько лет напряженной работы учёным удалось найти мутацию, вызывающую этот эффект, и охарактеризовать ген, в котором она произошла. Так был открыт ген, кодирующий белок SUUR.
Позже выяснилось, что белок SUUR участвует в репликации. Причём учёные заметили парадоксальный факт: как правило, мутации, затрагивающие процесс репликации, снижают эффективность этого процесса. Однако нарушение функции белка SUUR имеет абсолютно обратный эффект. Долгое время это явление не поддавалось объяснению, и только в 2015 году возникла гипотеза, объясняющая основные эффекты, c ним связанные.
“Белки образуют с ДНК сложную систему. Они обеспечивают реализацию заложенной в хромосоме генетической информации, определяют, какие гены активны, какие нет. Соответственно, когда клетка делится, ей нужно сделать точные копии не только ДНК, но и разметку из связанных с ней белков-регуляторов”, — рассказывает заведующий лабораторией геномики ИМКБ СО РАН кандидат биологических наук Степан Николаевич Белякин.
“Если мы рассмотрим клетку глаза и клетку носа, в них будут работать разные гены, при том, что ДНК там одинаковая. Активен ген или нет, определяется по тому, считывается ли с него РНК, — она выступает переносчиком информации, закодированной в ДНК, и используется для синтеза белка. С активным геном связаны специальные белки, способствующие его активации, а с неактивным — белки, которые эту активацию запрещают, — отмечает учёный. — Какие белки являются активаторами, какие репрессорами, достаточно хорошо известно. То, как они это делают, тоже более-менее понятно. Но механизм наследования этой разметки на хромосоме — довольно свежая область, и в ней пока изучено не так уж и много”.
Эту систему можно сравнить с жёстким диском компьютера. Представим, что на нём установлено сразу несколько операционных систем — Windows, Linux, Mac OS. Каждая из них записана на определённом отрезке диска, так же и на хромосоме на разных участках записаны гены, определяющие ту или иную программу развития клетки. Когда вы включаете компьютер, вы загружаете конкретную операционную систему. В клетке на хромосоме есть разметка, определяющая, какая программа развития будет запущена. Когда клетка копирует ДНК, она копирует весь “диск”, со всеми его операционными системами, но как дочерней клетке передаётся эта разметка?
Когда вы включаете компьютер, вы загружаете конкретную операционную систему. В клетке на хромосоме есть разметка, определяющая, какая программа развития будет запущена. Когда клетка копирует ДНК, она копирует весь “диск”, со всеми его операционными системами, но как дочерней клетке передаётся эта разметка?
Если белок, активирующий работу гена, свяжется с тем геном, который активным быть не должен, может нарушиться нормальное функционирование организма. В частности, это является причиной возникновения некоторых онкологических заболеваний.
Какое место здесь занимает белок SUUR? Представим себе ДНК как рельсы, по которым движется машина репликации, состоящая из большого количества известных белков и занимающаяся раздвоением путей. Сначала эта машина разделяет цепочку ДНК на две нити, а потом специальный фермент по принципу комплементарности для каждой из них достраивает недостающую часть. Когда состав доходит до конца хромосомы, получаются две копии рельсов, которые абсолютно идентичны изначальным.
Исследователи ИМКБ СО РАН обнаружили свидетельства в пользу того, что белок SUUR “путешествует” вместе с этой машиной и отвечает за то, чтобы белки, поддерживающие неактивное состояние гена, занимали в получившихся копиях нужные места. В частности, у тех самых мушек-мутантов без белка SUUR утрачена способность восстанавливать на дочерних цепях ДНК определенные белки. “У нас есть модель того, как это работает. Предположение опубликовано в 2015 году. Сейчас мы находимся в процессе тестирования этой модели”, — говорит Степан Белякин.
Дрозофиле утрата белка SUUR ничем не грозит, потому что она — организм простой и генетически продвинутый, все системы в ней очень хорошо отлажены. Если убрать с гена белок, блокирующий его активацию, это ещё не значит, что этот ген заработает, — для этого нужны другие специфические белки, способствующие активации. “Мухи без SUUR абсолютно жизнеспособны и живут себе припеваючи. Вы вынули один винтик — и весь механизм не разрушился, только немного забарахлил. Но поскольку этот механизм существует, мы его можем изучить на дрозофиле и понять, на каких принципах он работает”, — объясняет учёный.
Но поскольку этот механизм существует, мы его можем изучить на дрозофиле и понять, на каких принципах он работает”, — объясняет учёный.
Белок SUUR присутствует только у двукрылых насекомых, больше ни у кого его нет. Можно подумать, что Homo sapiens в процессе своей триумфальной эволюции отбросил SUUR за ненадобностью. Но на самом деле всё наоборот, дрозофила — это более эволюционно продвинутый организм, чем человек, просто за счёт того, что её поколение развивается всего за 10 дней, а не 20 лет, как у человека. Соответственно, она может гораздо быстрее меняться и развиваться. Получается, SUUR — это своего рода эволюционная инновация.
Однако принципы функционирования системы репликации близки у всех живых организмов — клетка так же делится, она так же должна сделать две копии хромосом со всей разметкой активных-неактивных генов. “По сути, белок SUUR сейчас — один из первых выходов на этот механизм. Мы изучаем его пока только на дрозофиле и не притворяемся, что прямо сейчас начнём применять полученные результаты, например, для лечения онкологии. Но мы этим занимаемся потому, что все остальные участники процесса репликации очень похожи — у человека, у мухи, у коровы, — говорит Степан Белякин. — Сейчас у нас на руках только один белок. Мы даже не знаем, какую биохимическую функцию он выполняет, но через него можем выйти на других участников этого механизма у дрозофилы, более консервативных (то есть присутствующих и у других организмов тоже), и, изучив их уже у человека, найти похожие механизмы и в человеческой клетке. Это как теория шести рукопожатий в социальных сетях — когда все оказываются «знакомы» друг с другом через несколько звеньев. От нас требуется восстановить эту цепочку для белка SUUR”.
Но мы этим занимаемся потому, что все остальные участники процесса репликации очень похожи — у человека, у мухи, у коровы, — говорит Степан Белякин. — Сейчас у нас на руках только один белок. Мы даже не знаем, какую биохимическую функцию он выполняет, но через него можем выйти на других участников этого механизма у дрозофилы, более консервативных (то есть присутствующих и у других организмов тоже), и, изучив их уже у человека, найти похожие механизмы и в человеческой клетке. Это как теория шести рукопожатий в социальных сетях — когда все оказываются «знакомы» друг с другом через несколько звеньев. От нас требуется восстановить эту цепочку для белка SUUR”.
Создание модели, по которой, как предполагают исследователи, действует белок SUUR, далось им нелегко. Для неё было всего несколько предпосылок, и учёным пришлось долго ломать голову, как связаны друг с другом разрозненные экспериментальные факты. Сейчас идёт ещё более трудоёмкая работа по подтверждению и дальнейшей разработке гипотезы. “Нужно ставить чёткие эксперименты, которые будут давать ответ на простые вопросы типа да или нет. Либо мы предположили правильно, либо неправильно. И если нам удаётся получить действительно хороший однозначный результат, тогда это большая удача, мы говорим — ага, здесь, на этой развилке, сворачиваем направо, и задаём следующий подобный вопрос. Такими маленькими шагами продвигается развитие гипотезы, — рассказывает исследователь. — Пока мы не можем сказать: “Да, мы проверили, всё так”. Но можем сказать: “Мы провели эксперименты, и ни один из полученных результатов не указывает на то, что это точно не так”. То есть, у нас нет данных, которые противоречат нашей теории, хотя мы всячески пытаемся их получить”.
“Нужно ставить чёткие эксперименты, которые будут давать ответ на простые вопросы типа да или нет. Либо мы предположили правильно, либо неправильно. И если нам удаётся получить действительно хороший однозначный результат, тогда это большая удача, мы говорим — ага, здесь, на этой развилке, сворачиваем направо, и задаём следующий подобный вопрос. Такими маленькими шагами продвигается развитие гипотезы, — рассказывает исследователь. — Пока мы не можем сказать: “Да, мы проверили, всё так”. Но можем сказать: “Мы провели эксперименты, и ни один из полученных результатов не указывает на то, что это точно не так”. То есть, у нас нет данных, которые противоречат нашей теории, хотя мы всячески пытаемся их получить”.
Продвигаясь такими маленькими шагами, учёные постепенно приближаются к истине. В медицине подобный процесс называется дифференциальным диагнозом, когда не понятно, чем именно болеет пациент, и врач один за другим проверяет: генетическое — не генетическое, метаболическое или инфекционное… В итоге остается всего пара-тройка направлений и среди них можно будет выделить верное.
“Наша работа, которая сейчас должна выйти в печати, в числе прочего фактически представляет доказательства того, что белок SUUR не определяет, где изначально должны связаться белки-репрессоры. Мы сравнили ранние эмбрионы дрозофилы нормальной линии и без белка SUUR. У них в самом начале, на этапе, когда это ещё маленькое яйцо из нескольких сотен клеток, репрессоры связаны одинаково. То есть эффект от отсутствия SUUR возникает позднее в развитии. Это очень сильное свидетельство в пользу нашей модели”, — говорит Степан Белякин.
Подготовила Диана Хомякова
Рисунок Ольги Посух
Тема 2. Действие инсулина
Для существования организму нужна энергия.
Основным источником энергии для клеток организма является глюкоза. Глюкоза образуется при всасывании углеводов, которые человек получает с пищей.
Когда человек не ест, нормальный уровень глюкозы крови поддерживается за счет использования запасов углеводов, которые есть в организме (гликоген печени) и синтеза глюкозы из белков. Часто спрашивают, если человек не ест, почему у него повышается глюкоза крови, откуда она берется. Ответ: из гликогена печени и распада белков. Однако запасов гликогена мало (примерно 90 грамм), а синтезировать глюкозу из белка организму крайне невыгодно, поэтому при голодании организм начинает «экономить» глюкозу и отключает ее поступление в часть органов. Т.е. при голодании глюкоза поступает только в критически важные органы (мозг, сосуды, почки, нервы).
Часто спрашивают, если человек не ест, почему у него повышается глюкоза крови, откуда она берется. Ответ: из гликогена печени и распада белков. Однако запасов гликогена мало (примерно 90 грамм), а синтезировать глюкозу из белка организму крайне невыгодно, поэтому при голодании организм начинает «экономить» глюкозу и отключает ее поступление в часть органов. Т.е. при голодании глюкоза поступает только в критически важные органы (мозг, сосуды, почки, нервы).
Не пропускает глюкозу в ткани при голодании инсулин. Образно говоря, на клетках некоторых органов «висит замок», который открывается инсулином. Когда инсулин открывает замок, глюкоза поступает в клетку. Эти ткани являются инсулинозависимыми, глюкоза может попасть в них только тогда, когда инсулин «даст разрешение». Инсулинозависимыми тканями являются мышцы, жировая ткань.
Но в некоторые органы глюкоза попадает без инсулина, там нет замков, дверь для глюкозы всегда открыта. Эти органы называются инсулинНЕзависимыми. Смысл действия инсулина: есть еда, можем прокормить всех, инсулин открывает двери в клетки для глюкозы. Нет еды, значит, будем кормить только самые важные органы, инсулин закрывает двери для глюкозы в менее важных органах (можно оставить «голодными» мышцы и жир, но мозг нельзя).
Смысл действия инсулина: есть еда, можем прокормить всех, инсулин открывает двери в клетки для глюкозы. Нет еды, значит, будем кормить только самые важные органы, инсулин закрывает двери для глюкозы в менее важных органах (можно оставить «голодными» мышцы и жир, но мозг нельзя).
Но что происходит, когда нет инсулина или он дефектный? Тогда глюкоза из углеводов пищи попадает в кровь, но не может поступить в ткани. Даже если уровень глюкозы в крови высокий, инсулинозависимые ткани голодают, дверь для глюкозы в клетке закрыта на замок, ключа нет или он сломан («голод среди изобилия»).
И в то же время в инсулинНЕзависимые ткани глюкоза поступает в излишних количествах. А что излишне, то нездорово. Глюкоза начинает связываться с белками этих тканей и повреждать их. Именно из-за этого при диабете и происходит повреждение органов-мишеней (нервов, сосудов, почек и др.).
Как происходит секреция инсулина в норме?
Минимальное количество инсулина в организме вырабатывается всегда (это называется базальная секреция инсулина). Когда человек поел, всасываются углеводы, в кровь поступает глюкоза, происходит выброс инсулина (это называется пищевой или прандиальный пик), двери открываются, глюкоза идет в клетку.
Когда человек поел, всасываются углеводы, в кровь поступает глюкоза, происходит выброс инсулина (это называется пищевой или прандиальный пик), двери открываются, глюкоза идет в клетку.
В норме секреция инсулина в ответ на прием пищи происходит в 2 фазы: первую быструю фазу (1-3 минуты) и вторую медленную (до 25-30 минут).
При сахарном диабете сначала нарушается первая (быстрая) фаза.
Новая вселенная мини-протеинов меняет клеточную биологию и генетику | Наука
Автор Митч Лесли
Мыши посрамляют бегунов-людей. Несмотря на скромные успехи, грызуны могут преодолевать 10 и более километров за ночь на колесе для упражнений. Но выделялись мыши, которых мышечный биолог Эрик Олсон из Юго-Западного медицинского центра Техасского университета в Далласе и его коллеги представили в 2015 году.На беговой дорожке мыши могли суетиться по крутому склону 10% в течение примерно 90 минут, прежде чем споткнуться, что на 31% дольше, чем у других грызунов. Эти железные мыши отличались от своих собратьев только одним маленьким отличием — исследователи генетически изменили животных так, чтобы им не хватало одного мышечного белка. Этого было достаточно, чтобы развязать превосходную мышечную производительность. «Это как будто вы отключили тормоза», — говорит Олсон.
Эти железные мыши отличались от своих собратьев только одним маленьким отличием — исследователи генетически изменили животных так, чтобы им не хватало одного мышечного белка. Этого было достаточно, чтобы развязать превосходную мышечную производительность. «Это как будто вы отключили тормоза», — говорит Олсон.
Столь же поразительной была природа важнейшего белка. В мышцах содержится огромное количество белков. Дистрофин, структурный белок, ген которого может нести мутации, вызывающие мышечную дистрофию, содержит более 3600 аминокислот.Титин, который действует как пружина, придавая мышцам эластичность, является крупнейшим известным белком, содержащим более 34 000 аминокислот. Белок, отключенный у мышей, имеет ничтожное количество 46. Хотя исследователи исследовали, как работают мышцы более 150 лет, они полностью упустили из виду огромное влияние этого крошечного белка, называемого миорегулином, на функцию мышц.
Не только Олсон и его коллеги были ошеломлены белками лилипутов. Как теперь понимают ученые, их первоначальные правила анализа геномов дискриминировали идентификацию этих молекул размером с пинту.Теперь более широкие критерии и более совершенные методы обнаружения позволяют обнаруживать крошечные белки тысячами, не только у мышей, но и у многих других видов, включая человека. «Впервые мы собираемся исследовать эту вселенную новых белков», — говорит биохимик Джонатан Вайсман из Калифорнийского университета в Сан-Франциско.
Как теперь понимают ученые, их первоначальные правила анализа геномов дискриминировали идентификацию этих молекул размером с пинту.Теперь более широкие критерии и более совершенные методы обнаружения позволяют обнаруживать крошечные белки тысячами, не только у мышей, но и у многих других видов, включая человека. «Впервые мы собираемся исследовать эту вселенную новых белков», — говорит биохимик Джонатан Вайсман из Калифорнийского университета в Сан-Франциско.
Биологи только начинают вникать в функции этих молекул, называемых микробелками, микропептидами или минипротеинами. Но их небольшой размер, кажется, позволяет им блокировать сложную работу более крупных белков, подавляя одни клеточные процессы, вызывая при этом другие.Ранние результаты показывают, что микробелки укрепляют иммунную систему, контролируют разрушение дефектных молекул РНК, защищают бактерии от жары и холода, определяют время цветения растений и обеспечивают токсичный удар для многих типов яда. «Вероятно, во всех биологических процессах будут участвовать небольшие [белки]. Мы просто не искали их раньше», — говорит биохимик Алан Сагателиан из Института биологических исследований Солка в Сан-Диего, Калифорния.
Мы просто не искали их раньше», — говорит биохимик Алан Сагателиан из Института биологических исследований Солка в Сан-Диего, Калифорния.
Яд этого хищного водяного клопа содержит более десятка мелких белков.
ЭНДРЮ УОКЕР
Маленькие белки также обещают пересмотреть текущее понимание генома. Многие из них, по-видимому, закодированы в участках ДНК и РНК, которые, как считалось, не помогают строить какие-либо белки. Некоторые исследователи предполагают, что короткие участки ДНК могут быть генами новорожденных, которые эволюционируют в более крупные гены, которые производят полноразмерные белки. Отчасти благодаря небольшим белкам, «нам нужно переосмыслить, что такое гены», — говорит микробиолог и молекулярный биолог Гизела Сторц из Национального института здоровья детей и развития человека в Бетесде, штат Мэриленд.
Несмотря на остающуюся загадку, ученые уже исследуют потенциальные возможности использования этих молекул. Одна компания продает инсектициды, полученные из небольших белков яда австралийского воронкообразного паука. В ходе клинических испытаний оценивается агент визуализации на основе еще одного крошечного белка в яде скорпиона, предназначенный для выделения границ опухолей, чтобы хирурги могли удалить их более точно. Многие фармацевтические компании сейчас ищут небольшие белки с медицинским потенциалом, говорит биохимик Гленн Кинг из Университета Квинсленда в Санкт-Петербурге.Люсия, Австралия. «Это одна из самых быстрорастущих областей».
Другие короткие аминокислотные цепи, часто называемые пептидами или полипептидами, изобилуют клетками, но они представляют собой урезанные остатки более крупных предшественников. Миорегулин и его миниатюрные собратья, напротив, рождаются маленькими. Насколько они могут быть крошечными, остается неясным. Как отмечает специалист по геномике микробов Ами Бхатт из Стэнфордского университета в Пало-Альто, Калифорния, плодовые мушки полагаются на микропротеин с 11 аминокислотами для роста нормальных ног, а некоторые микробы могут вырабатывать белки длиной менее 10 аминокислот.Но даже самые большие маленькие белки не соответствуют белкам среднего размера, таким как альфа-амилаза, фермент из 496 аминокислот в нашей слюне, который расщепляет крахмал.
До недавнего времени было обнаружено несколько небольших белков, поскольку критерий для идентификации генов был установлен около 20 лет назад. Когда ученые анализируют геном организма, они часто сканируют открытые рамки считывания (ORF), которые представляют собой последовательности ДНК, разграниченные сигналами, которые сообщают рибосомам клетки, ее линиям сборки белка, где начать и где остановиться.Отчасти для того, чтобы избежать большого количества данных, прошлые исследователи обычно исключали любую открытую рамку считывания, которая давала бы белок, содержащий менее 100 аминокислот у эукариот или 50 аминокислот у бактерий. Например, в дрожжах этот порог ограничивал список ORF примерно до 6000.
Ослабление этого критерия показывает, что клетки несут значительно больше ORF. Ранее в этом году постдок из Стэнфорда Хила Сберро Ливнат, Бхатт и его коллеги исследовали фрагменты генома микробов, населяющих четыре части человеческого тела, включая кишечник и кожу.Путем поиска небольших ORF, которые могут кодировать белки длиной от пяти до 50 аминокислот, исследователи идентифицировали около 4000 семейств потенциальных микробелков. Почти половина из них не похожи на известные белки, но последовательность для одной маленькой ORF предполагает, что соответствующий белок находится в рибосомах — это намек на то, что он может играть фундаментальную роль. «Не только гены с эзотерическими функциями были упущены из виду», когда ученые упускали из виду небольшие ОРС, — говорит Бхатт. «Это гены с ключевыми функциями.«
Впервые мы собираемся исследовать эту вселенную новых белков.
Джонатан Вайсман, Калифорнийский университет, Сан-Франциско
Другие клетки также содержат огромное количество коротких открытых рамок считывания — например, дрожжи могут производить более 260 000 молекул, содержащих от двух до 99 аминокислот. Но клетки почти наверняка не используют все эти открытые рамки считывания, и некоторые из производимых ими аминокислотных цепочек могут не работать. В 2011 году, обнаружив более 600000 коротких ORF в геноме плодовой мухи, генетик по вопросам развития Хуан Пабло Кузо из Университета Сассекса в Брайтоне, США.К. и его коллеги пытались сократить число. Они рассудили, что, если конкретная ORF имеет идентичную или почти идентичную копию у родственного вида, вероятность того, что это геномный мусор, меньше. После поиска генома другой плодовой мушки и анализа других доказательств того, что последовательности транслируются, группа в конечном итоге получила более управляемую цифру в 401 короткую ORF, которая может давать микробелки. Это все равно составляет значительную часть белкового репертуара насекомых — они содержат около 22 000 полноразмерных белков.
Вайсман и его коллеги обнаружили микробелки вторым путем, с помощью метода, который они изобрели, чтобы в целом определить, какие белки производят клетки. Чтобы создать любой белок, клетка сначала копирует ген в информационную РНК. Затем рибосомы считывают мРНК и соединяют аминокислоты в указанном порядке. Посредством секвенирования мРНК, прикрепленных к рибосомам, Вайсман и его команда точно определяют, какие клетки фактически превращаются в белки, а где на РНК рибосома начинает считываться. В исследовании Cell 2011 года он и его команда применили этот метод профилирования рибосом, также называемый Ribo-seq, к эмбриональным стволовым клеткам мыши и обнаружили, что клетки вырабатывают тысячи неожиданных белков, в том числе многие из них ниже 100-аминокислотной — отсечка кислоты.«Было совершенно ясно, что стандартное понимание игнорировало большую вселенную белков, многие из которых были короткими», — говорит Вайсман.
Сагательян и его коллеги применили третий подход, чтобы обнаружить кладезь микробелков в наших собственных клетках. Исследователи использовали масс-спектрометрию, которая включает разбиение белков на части, которые сортируются по массе, чтобы получить отличительный спектр для каждого белка. Сагателян, его тогдашний постдок Сара Славофф и коллеги применили этот метод к смесям белков из человеческих клеток, а затем вычли сигнатуры известных белков.Этот подход позволил выявить спектры 86 ранее не обнаруженных крошечных белков, самые маленькие из которых имеют длину всего 18 аминокислот, как сообщили исследователи в 2013 году в журнале Nature Chemical Biology .
Малый размер ограничивает возможности белка. Более крупные белки складываются в сложные формы, подходящие для определенной функции, например, для катализирования химических реакций. По словам химика Хулио Камареро из Университета Южной Калифорнии в Лос-Анджелесе, белки с размером меньше 50-60 аминокислот, вероятно, не складываются.Так что они, вероятно, не подходят в качестве ферментов или структурных белков.
Однако их миниатюрный размер также открывает новые возможности. «Они достаточно крошечные, чтобы поместиться в укромных уголках и трещинах более крупных белков, которые функционируют как каналы и рецепторы», — говорит Олсон. Маленькие белки часто разделяют короткие отрезки аминокислот со своими более крупными партнерами и поэтому могут связываться с этими белками и изменять их активность. Связанные микробелки также могут переносить более крупные молекулы в новые места, например, помогая им проникать в клеточные мембраны.
Микропротеин в яде скорпиона-ловца смерти был слит с флуоресцентным красителем, чтобы опухоли испускали свет в ближнем инфракрасном диапазоне. ( 1 ) Опухоль в видимом свете ( 2 ) Та же опухоль в видимом и ближнем инфракрасном свете
(Сверху вниз) ИВАН КУЗЬМИН / НАУЧНЫЙ ИСТОЧНИК; BLAZE BIOSCIENCE (2)
Из-за их притяжения к более крупным белкам маленькие белки могут дать клеткам обратимый способ включать или выключать более крупные белки.В исследовании 2016 года, проведенном в PLOS Genetics , биолог по развитию растений Стефан Венкель из Копенгагенского университета и его коллеги генетически изменили растения Arabidopsis , чтобы произвести дополнительные количества двух небольших белков. Обычно растения зацветают, когда дни достаточно длинные, но когда они производят избыточное количество двух микробелков, их цветение откладывается. Маленькие белки вызвали эту задержку, блокируя здоровенный белок CONSTANS, который запускает цветение. Они привязывают CONSTANS к другим ингибирующим белкам, которые его отключают.«Клетка использует то, что помогает ей выжить. Если короткий белок выполняет свою работу, это нормально», — говорит Сагателян.
Эти задания включают в себя другие ключевые задачи. В 2016 году Славофф, Сагательян и его коллеги показали, что человеческие клетки производят 68-аминокислотный белок, который они назвали NoBody, который может помочь управлять разрушением неисправных или ненужных молекул мРНК. Название NoBody отражает его роль в предотвращении образования процессинговых телец (P-телец), загадочных кластеров в цитоплазме, где может происходить распад РНК.Когда белок отсутствует, образуется больше Р-телец, что ускоряет разрушение РНК и изменяет внутреннюю структуру клетки. «Это показывает, что небольшие белки могут оказывать огромное влияние на клетку», — говорит Славофф.
Мышцы зависят от множества микробелков. Во время эмбрионального развития отдельные мышечные клетки сливаются в волокна, обеспечивающие сокращение. Миомиксер из 84 аминокислотных белков объединяется с более крупным белком, чтобы объединить клетки, сообщила группа Олсона в 2017 году в Science .Без него эмбриональные мыши не могут формировать мышцы и почти прозрачны.
Позже миорегулин начинает регулировать мышечную активность. Когда мышца получает стимул, клетки-хранилища высыпают кальций, заставляя волокна сокращаться и генерировать силу. Затем ионный насос SERCA начинает возвращать кальций в запасы, позволяя мышечным волокнам расслабиться. Команда Олсона обнаружила, что миорегулин связывается с SERCA и ингибирует его. Эффект ограничивает частоту сокращения мускулов мыши — возможно, гарантируя, что у животного есть запас мускулов на случай чрезвычайной ситуации, например, при побеге от хищника.Другой небольшой белок, DWORF, имеет противоположный эффект, высвобождая SERCA и позволяя мышце многократно сокращаться.
Даже тщательно изученные организмы, такие как кишечная бактерия Escherichia coli , содержат неожиданные маленькие белки, которые выполняют важные функции. В 2012 году Сторц и ее команда сообщили, что ранее неизвестный белок из 49 аминокислот под названием AcrZ помогает микробу выжить при некоторых антибиотиках, стимулируя насос, который выталкивает лекарства.
А яд, производимый множеством организмов, включая пауков, многоножек, скорпионов и ядовитых моллюсков, изобилует крошечными белками.Многие компоненты яда выводят из строя или убивают, блокируя каналы для натрия или других ионов, которые необходимы для передачи нервных импульсов. Маленькие белки «поражают эти ионные каналы с удивительной специфичностью и эффективностью», — говорит Кинг. «Они являются основными компонентами ядов и ответственны за большинство фармакологических и биологических эффектов».
Австралийский гигантский водяной клоп, убивающий рыбу, например, полагается не только на острые когти и похожие на копья рты, чтобы подчинить себе добычу. Он вводит своим жертвам смесь из более чем 130 белков, 15 из которых содержат менее 100 аминокислот, сообщили Кинг и его коллеги в прошлом году.
В отличие от гигантских белков, таких как антитела, микропротеины, доставляемые с помощью таблеток или инъекций, могут проникать в клетки и изменять их функции. Каптоприл, первый из класса лекарств от высокого кровяного давления, известных как ингибиторы ангиотензинпревращающего фермента, был разработан из небольшого белка в яде бразильской гадюки. Но лекарство, которое Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило для продажи в Соединенных Штатах в 1981 году, было обнаружено случайно, до того, как ученые выделили небольшие белки как отдельную группу.На данный момент только несколько микробелков вышли на рынок или в клинические испытания.
Исследователи рака пытаются извлечь выгоду из микробелка из яда скорпиона-ловца смерти ( Leiurus quinquestriatus, ) из Африки и Ближнего Востока. Молекула имеет загадочное притяжение к опухолям. Объединив его с флуоресцентным красителем, ученые надеются осветить границы опухолей головного мозга, чтобы хирурги могли безопасно вырезать раковые ткани. «Он освещает опухоль. Вы можете увидеть края и метастазы», - говорит Кинг.В настоящее время проводится клиническое исследование, посвященное оценке того, может ли двойная молекула помочь хирургам удалять опухоли головного мозга у детей.
Насколько важны малые белки для медицины, пока неизвестно, но они уже опровергли несколько биологических предположений. Генетик Норберт Хюбнер из Центра молекулярной медицины Макса Дельбрюка в Берлине и его коллеги обнаружили десятки новых микропротеинов в клетках сердца человека. Группа проследила их до неожиданного источника: короткие последовательности в длинных некодирующих РНК, разновидность, которая, как считалось, не продуцирует белки.После идентификации 169 длинных некодирующих РНК, которые, вероятно, считывались рибосомами, Хюбнер и его команда использовали тип масс-спектрометрии, чтобы подтвердить, что более половины из них дают микробелки в клетках сердца, результат был сообщен ранее в этом году в Cell .
Бактерии, такие как Escherichia coli , также производят множество микробелков, хотя их функции во многих случаях остаются неясными.
KWANGSIN KIM / НАУЧНЫЙ ИСТОЧНИК
Последовательности ДНК других крошечных белков также встречаются в нетрадиционных местах.Например, некоторые из них находятся рядом с ORF для более крупных белков. Ранее исследователи думали, что эти последовательности помогают управлять производством более крупных белков, но редко дают начало самим белкам. Некоторые кодирующие последовательности для недавно открытых микробелков даже вложены в последовательности, кодирующие другие, более длинные белки.
Эти геномные сюрпризы могут пролить свет на то, как возникают новые гены, говорит системный биолог Анн-Руксандра Карвунис из Университета Питтсбурга в Пенсильвании.Исследователи думали, что большинство новых генов возникает, когда существующие гены дублируются или сливаются, или когда виды обмениваются ДНК. Но для Карвуниса микробелки предполагают, что протогены могут образовываться, когда мутации создают новые сигналы запуска и остановки в некодирующей части генома. Если полученная в результате ORF продуцирует полезный белок, новые последовательности останутся в геноме и будут подвергаться естественному отбору, в конечном итоге превратившись в более крупные гены, которые кодируют более сложные белки.
В исследовании 2012 года Карвунис, который тогда был постдоком в лаборатории Марка Видаля в Институте рака Дана-Фарбер в Бостоне, и его коллеги обнаружили, что дрожжи транслируют более 1000 коротких ORF в белки, подразумевая, что эти последовательности являются протогенами.В новом исследовании Карвунис и ее команда проверили, могут ли молодые ORF быть полезными для клеток. Они генетически изменили дрожжи, чтобы увеличить выход 285 недавно разработанных ORF, большинство из которых кодируют молекулы, которые меньше стандартного порогового значения белка или чуть выше него. Для почти 10% белков увеличение их уровней усиливало рост клеток по крайней мере в одной среде. Результаты, опубликованные на сервере препринтов bioRxiv, предполагают, что эти последовательности могут стать полноценными генами, говорит Карвунис.
Славофф до сих пор вспоминает, как был поражен, когда во время интервью на постдока с Сагателяном он спросил, не захочет ли она пойти на охоту за маленькими белками. «Я никогда не думал, что может существовать такой размер белков, который до сих пор был для нас темным».
Но ставка окупилась — теперь у нее есть собственная лаборатория по поиску микробелков. Недавно она рассказала некоторым из своих постдоков и аспирантов об одном из наиболее изученных организмов, штамме K12 E.coli. Вскоре команда обнаружила пять новых микробелков. «Мы, вероятно, только царапаем поверхность», — говорит она.
Специализированная клеточная структура и функции: синтез белка
Синтез белка
Создание различных типов белка является одним из наиболее важных событий для клетки, поскольку белок не только формирует структурные компоненты клетки, но и составляет ферменты, которые катализировать производство оставшихся органических биомолекул, необходимых для жизни.В общем, генотип, кодируемый в ДНК, выражается как фенотип с помощью белка и других продуктов, катализируемых ферментами.
ДНК, размещенная в ядре, слишком велика, чтобы проходить через ядерную мембрану, поэтому она должна копироваться более мелкой однонитевой РНК (транскрипция), которая перемещается из ядра в рибосомы, расположенные в цитоплазме и грубой эндоплазматической системе. ретикулум, чтобы направить сборку белка (трансляцию). Гены на самом деле не производят белок, но они обеспечивают план в виде РНК, которая направляет синтез белка.
Транскрипция
Транскрипция происходит в ядре клетки и представляет собой перенос генетического кода от ДНК к комплементарной РНК. Ферментная РНК-полимераза?
- Присоединяется к молекуле ДНК и расстегивает ее, превращая ее в две отдельные нити.
- Связывается с промотором сегментов ДНК, которые указывают начало копируемой одиночной цепи ДНК.
- Перемещается по ДНК и сопоставляет нуклеотиды ДНК с комплементарным нуклеотидом РНК для создания новой молекулы РНК, которая повторяет структуру ДНК.
Копирование ДНК продолжается до тех пор, пока РНК-полимераза не достигнет сигнала терминации , который представляет собой определенный набор нуклеотидов, который отмечает конец копируемого гена, а также сигнализирует об отключении ДНК от вновь созданной РНК. .
Три типа РНК?
- мРНК (информационная РНК) транскрибируется с ДНК и несет генетическую информацию от ДНК, которая должна быть переведена в аминокислоты.
- тРНК (транспортная РНК)? Интерпретирует? трехбуквенные кодоны нуклеиновых кислот к однобуквенному аминокислотному слову
- рРНК (рибосомная РНК) является наиболее распространенным типом РНК, и вместе с ассоциированными белками составляют рибосомы.
Когда РНК-полимераза заканчивает копирование определенного сегмента ДНК, ДНК реконфигурируется в исходную структуру двойной спирали. Вновь созданная мРНК выходит из ядра в цитоплазму.
Трансляция
Трансляция — это преобразование информации, содержащейся в последовательности нуклеотидов мРНК, в последовательность аминокислот, которые соединяются вместе, образуя белок. МРНК перемещается к рибосомам и «читается». с помощью тРНК, которая анализирует участки трех соседних нуклеотидных последовательностей, называемых кодонами , на мРНК и переносит соответствующую аминокислоту для сборки в растущую полипептидную цепь.Три нуклеотида в кодоне специфичны для конкретной аминокислоты. Следовательно, каждый кодон сигнализирует о включении определенной аминокислоты, которая объединяется в правильной последовательности для создания определенного белка, кодируемого ДНК.
Сборка полипептида начинается, когда рибосома прикрепляется к старт-кодону , расположенному на мРНК. Затем тРНК переносит аминокислоту к рибосомам, которые состоят из рРНК и белка и имеют три сайта связывания, способствующие синтезу.Первый сайт ориентирует мРНК таким образом, чтобы кодоны были доступны для тРНК, которые занимают оставшиеся два сайта, когда откладывают свои аминокислоты, а затем высвобождаются из мРНК для поиска большего количества аминокислот. Трансляция продолжается до тех пор, пока рибосома не распознает кодон, который сигнализирует о конце аминокислотной последовательности. Полипептид, когда он завершен, находится в своей первичной структуре. Затем он высвобождается из рибосомы, чтобы начать изгибаться, чтобы принять окончательную форму и начать свою функцию.
Bionote
Каждый кодон мРНК определяет конкретную аминокислоту, которая распознается антикодоном комплементарной тРНК.Есть 20 различных аминокислот; есть также 20 различных молекул тРНК.
После того, как белки изготовлены, они упаковываются и транспортируются к месту их конечного назначения по интересному пути, который можно описать в три этапа с участием трех органелл:
- Везикулы транспортируют белки из рибосом в аппарат Гольджи , иначе комплекс Гольджи, где они упакованы в новые пузырьки.
- Везикулы мигрируют к мембране и высвобождают свой белок за пределы клетки.
- Лизосомы переваривают и перерабатывают отходы для повторного использования клеткой.
Ферменты в аппарате Гольджи модифицируют белки и заключают их в новую везикулу, которая отрастает от поверхности аппарата Гольджи. Аппарат Гольджи часто рассматривается как центр упаковки и распределения ячейки.
Везикулы — это небольшие мембранные оболочки, которые обычно образуются в эндоплазматическом ретикулуме или аппарате Гольджи и используются для транспортировки веществ через клетку.
Лизосомы представляют собой везикулы особого типа, которые содержат пищеварительные ферменты клетки и полезны для расщепления оставшихся продуктов жизнедеятельности белков, липидов, углеводов и нуклеиновых кислот на их составные части для повторной сборки и повторного использования клеткой.
Выдержка из The Complete Idiot’s Guide to Biology 2004 Глена Э. Моултона, редактора Д. Все права защищены, включая право на полное или частичное воспроизведение в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу напрямую у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476. Вы также можете приобрести эту книгу на Amazon.com и Barnes & Noble.
»Сколько белков в клетке?
Сколько белков в клетке?
Reader Mode
Будучи доминирующими игроками в клетке с точки зрения как биомассы, так и функциональности, белки получают большую долю внимания в исследованиях молекулярной и клеточной биологии.Тем не менее, небольшое смещение акцента на проблемы более количественного характера, связанные с этими белками, поднимает всевозможные вопросы, на которые нет ответа. Например, сколько белков в клетке? То есть общее количество белковых молекул, а не количество различных типов. Перед просмотром опубликованных измерений мы можем попытаться оценить это значение на основе свойств ячейки, которые мы, возможно, уже знаем.
Содержание белка приблизительно линейно зависит от объема или массы клетки. Учитывая, что объем клетки может изменяться в несколько раз в зависимости от условий роста или от того, какой конкретный штамм использовался, мы сначала проанализируем количество белков на единицу объема клетки (т.е.е. плотность числа белков), а затем умножьте их на объем клетки, чтобы найти фактическое количество белков на клетку для интересующей нас клетки.
Рис. 1: обратная сторона конверта расчета количества белков на объем клетки. Также дается приложение для выбранных модельных организмов на основе их характерных объемов клеток. Оценка основана на общих значениях параметров, более точные значения для конкретных организмов см. В основном тексте.
Наш первый метод оценки показан как «обратная сторона конверта», разработанный на Рисунке 1 с использованием округленных «общих» значений параметров.Оценка основана на знании массы белка на единицу объема (обозначается c p ). Единицами c p являются [г белка] / [мл объема клетки], и этот параметр был зарегистрирован для различных типов клеток. Обозначим через l aa среднюю длину белка в аминокислотах и среднюю массу аминокислоты m aa . В свете этих определений количество белков в единице объема равно
.
Н / В = c p / (l aa * m aa ).
В E. coli и других бактериях мы используем среднюю длину белка l аминокислот на белок, а в почкующихся дрожжах, делящихся дрожжах и клетках человека мы используем большее значение 400 аминокислот на белок. Значения округлены до одной значащей цифры (с точностью около 10-20%) в соответствии с вариациями в оценочных значениях в литературе. Используемые средние значения длины были рассчитаны путем взвешивания длин белков по их содержанию в клетке. При этом учитываются такие проблемы, как белки с высоким содержанием, как правило, меньше, чем белки с низким содержанием.
Переходя к концентрации белка в клетках, сообщений на удивление мало: старые измеренные значения для c p составляют 0,24 г / мл для E. coli и 0,28 г / мл для почкующихся дрожжей (BNID 105938, 108879, 108263). , 108874). Ожидается, что значения будут аналогичными, если значения концентрации относятся либо к общему объему клеток и белкового комплемента, включая мембранно-ассоциированные белки, либо только к объему цитоплазмы и белкам). Предполагая, что средняя масса аминокислоты составляет 100 Да и с некоторыми преобразованиями единиц, мы получаем (также схематично показано с общими значениями параметров на рисунке 1)
и
Хотя это то, к чему мы стремились, читатель может задаться вопросом о том, какое значение cp мы использовали.Мы можем вывести его на основе других более известных свойств: плотности клеток, содержания воды и белковой доли сухой массы. Общая плотность клеток d составляет около 1,1 г / мл (BNID 103875, 102239, 106439). Содержание воды, которое мы обозначаем w, составляет в E. coli ≈70%, а в почкующихся дрожжах ≈60% по массе (BNID 105482, 103689). Доля белка в сухой массе p составляет ≈55% в E. coli и ≈40% в дрожжах. Связь между этими величинами: cp = d × (1-w) × p. Подставляя числа, которые мы находим,
Таблица 1: Диапазон оценок количества белков на клетку на основе различных работ.В некоторых случаях количество выводится из дополнительной информации и не указывается как таковая. Когда объем клеток не был указан в исследовании, использовались литературные значения при аналогичных условиях. * Значение общего количества белков на клетку не было явно указано и основано на суммировании значений содержания, как указано в дополнительном материале по протеому.
cp, coli = 1,1 г / мл × (1-0,7) × 0,55 = 0,19 г / мл
и
сП, дрожжи = 1,1 г / мл × (1-0,6) × 0,4 = 0,18 г / мл.
Полученные значения меньше приведенных выше на 20-40% и приводят к оценкам ≈3 × 10 6 белка / мкм 3 и ≈2 × 10 6 белка / мкм 3 в E. coli и почкующиеся дрожжи соответственно.
Теперь мы можем перейти к использованию характеристических объемов для определения количества белков на клетку, а не на единицу объема клетки. Для клетки E. coli объемом 1 мкм 3 нечего делать, так как это наша единица объема клетки, и две оценки дают диапазон 2-4 миллионов белков на клетку.Для клеток почкующихся дрожжей размером 40 мкм 3 (гаплоид, BNID 100430, 100427) две оценки дают диапазон 90–140 миллионов белков на клетку. Экстраполируя эти плотности белков на клетки млекопитающих, можно предположить, что значение примерно 10 10 белков на клетку для характерных клеточных линий, которые имеют средний объем 2000-4000 мкм 3 .
Как эти значения соотносятся с предыдущими сообщениями в литературе? Таблица 1 показывает компиляцию значений, основанных на опубликованных исследованиях протеома.Примечательно, что во многих случаях общая сумма по всем белкам не сообщалась и была выведена для наших целей путем суммирования всех измеренных количеств. Некоторые из общих сумм соответствуют приведенным выше общим оценкам, в основном по бактериям. Напротив, многие значения для эукариотических клеток, включая клетки дрожжей и млекопитающих, в 10 раз ниже, чем предполагалось. Остается выяснить, связано ли это кажущееся несоответствие с проблемами калибровки в масс-спектрометрических исследованиях, в которых они были измерены, или неточностями в значениях параметров, используемых в оценке (Р.Milo, Bioessays 35: 1050, 2013). Мы рассматриваем это как показатель того, что существует постоянная проблема для тщательного анализа, чтобы получить окончательные ответы для тех, кто заинтересован в количественном картировании содержимого ячейки.
77162 Всего просмотров 2 просмотра Сегодня
Маркировка белков внутри живых клеток с помощью внешних флуорофоров для микроскопии
Существенные изменения:
1) Зависят ли некоторые данные (например, результаты жизнеспособности) от партии или источника SLO? Или это нужно определять заново каждый раз при заказе SLO? Я был особенно заинтересован в этом, так как сегодня днем я заметил, что некоторые поставщики продают SLO по весу, а не по единицам (и не предоставляют информацию об активности своих SLO).
Активность SLO необходимо будет определять каждый раз, когда у производителя заказывается новый SLO. Однако мы обнаружили, что если SLO поступает из того же номера партии, активность SLO является постоянной. Мы попытались использовать SLO, который предоставляется по весу, и преобразованный из веса в единицу активности с использованием коэффициента преобразования производителя, но мы обнаружили, что активность, преобразованная из веса, отличается (в нашем случае в 2 раза) от SLO, полученного по активности.Поэтому мы предлагаем в разделе «Методы», чтобы лаборатории, желающие использовать этот метод, должны протестировать активность SLO путем титрования концентрации SLO, необходимой для индукции> 75% проницаемости для молекулы маркера (например, декстрана 10 кДа), при сохранении > 90% клеток живы (по результатам тестирования с помощью окрашивания PI) после стадии восстановления. Мы согласны с рецензентами в том, что мы должны предупреждать читателей о вариациях от партии к партии. Мы добавили предупреждение в наш метод, и теперь новые предложения читаются так:
«Различные партии SLO могут иметь разную активность, поэтому сначала следует определить оптимальную концентрацию SLO.Оптимизированная рабочая концентрация SLO была определена путем тестирования диапазона концентраций SLO для каждой клеточной линии для достижения> 75% проницаемости для 10 кДа FITC-декстрана при сохранении минимума мертвых клеток (<10%) ».
2) Могут ли авторы прокомментировать, позволяет ли этот метод поглощать маленькие квантовые точки? Ранее авторы синтезировали небольшие квантовые точки, прикрепленные к нанотелам (см. Wang et al., 2014), поэтому кажется, что это будет легко проверить. Многие люди будут заинтересованы в способах помещения Q-точек в живые клетки.
Мы рады, что рецензенты признают опыт нашей лаборатории. Возможность использования маленькой квантовой точки для эффективной маркировки внутриклеточных белков фактически была одной из движущих сил этого проекта. На этом этапе нам немного повезло с получением небольших квантовых точек внутри, но оказалось, что для их эффективного ввода требуется другой тип покрытия. Стандартное покрытие, используемое в ссылке 25, требует блокирующих агентов, таких как казеин или BSA, чтобы предотвратить его неспецифическое прилипание к клеточной мембране, и, делая это, мы подозреваем, что это увеличивает размер квантовых точек.Теперь у нас есть квантовая точка нового типа с другим полимерным покрытием, которое не требует использования блокирующих белков. С их помощью мы могли бы доставить маленькие квантовые точки внутрь клеток в количестве, которое явно не вызвано эндоцитозом. Однако мы все еще работаем над функционализацией химии этих маленьких квантовых точек для нацеливания на конкретные белки. Поскольку акцент в статье делается на маркировке внутриклеточных белков и поскольку мы не доказали, что внутриклеточные белки были помечены маленькими квантовыми точками, мы решили не включать это в эту рукопись.
3) Нам действительно не нравятся последние два предложения Заключения, поскольку они относятся к возможным приложениям, которые не обсуждаются в настоящей рукописи, поэтому данные не могут быть оценены. Эти предложения следует удалить и заменить чем-то гораздо менее конкретным.
Мы согласны с рецензентами в том, что последнее предложение в заключении было сформулировано неправильно. Мы переписали предложение с более сдержанным тоном, чтобы предложить потенциальное новое приложение.Недавно измененное предложение теперь гласит:
«Наконец, этот метод не ограничивается доставкой флуоресцентных зондов; этот метод потенциально может быть распространен на другие типы микроскопии, основанные на доставке зонда, например криоэлектронную микроскопию ».
4) Надписи на рисунках для дополнительных данных нуждаются в улучшении. Разделение каждой фигуры на отдельные панели с буквами может помочь.
Мы благодарим рецензентов за то, что они указали на это и предложили улучшить читаемость нашей статьи.Мы немного увеличили дополнительный рисунок 1. Мы разделили наши дополнительные рисунки на панели с буквами, особенно для дополнительных рисунков 2 и 3. Легенды к рисункам были изменены для обозначения каждой панели рисунков.
5) К рисунку 3 — приложение к рисунку 3. Мы не уверены, что согласны с тем, что авторы усилили сигнал флуоресцентного белка, используя свой метод. Флуоресценция GFP не была улучшена, скорее белок, несущий совершенно другой флуорофор, был нацелен на GFP, и ожидается, что Atto647N будет намного ярче, чем GFP.Это ничем не отличается от нацеливания флуоресцентно меченного антитела на любой другой белок.
Мы согласны с рецензентами, что сигнал GFP не усилен. Более точное описание состоит в том, что мы перешли от наблюдения GFP к наблюдению за более фотостабильным красителем, который связан с GFP. Мы добавили короткий отрывок из повествования в наш основной текст, разъясняющий мотивацию этого приложения, и он гласит:
«FP очень хорошо подходят для визуализации ансамбля белков в клетке, и конструкции FP, прикрепленные к многочисленным интересующим внутриклеточным белкам, уже созданы.Однако по-прежнему трудно изучать эти белки до уровня одной молекулы по сигналу флуоресценции отдельных FP из-за низкой яркости и фотостабильности. Цель здесь состоит в том, чтобы маркировать FP нанотелами, конъюгированными с красителями, с фотостабильностью выше FP. Например, мы показываем, что сигнал можно улучшить в ~ 6 раз, обнаружив сигнал GBP-ATTO647N, чем сам GFP (рисунок 3 — приложение к рисунку 3a). Используя этот метод, мы можем проводить исследования отдельных молекул на обширной библиотеке существующих белковых конструкций с присоединенным FP, используя только FP связывающие нанотела, конъюгированные с флуорофором с лучшей фотостабильностью и яркостью.”
Мы также немного изменили пояснение к рисунку 3 — дополнение к рисунку 3, и теперь оно гласит:
«Улучшение обнаружения белков, прикрепленных к флуоресцентному белку, с помощью мечения нанотел».
6) Авторы заявляют, что одной из проблем существующих методов, таких как микроинъекция или электропорация, является «забота о здоровье клеток». Конечно, это тоже проблема любого применения SLO? Хотя авторы показывают данные о том, что их клетки здоровы после каждой обработки SLO, я думаю, что это необходимо перепроверять с каждым новым типом клеток, тестируемым с использованием этого метода.
Мы согласны с рецензентами в том, что целостность мембраны и здоровье клеток не являются исключительной проблемой для микроинъекций и электропорации. Мы добавили новое предложение в наш раздел результатов, оно гласит:
.
«Здоровье клеток после пермеабилизации является универсальной проблемой для любых методов, пытающихся временно нарушить целостность клеточной мембраны. Чтобы проверить здоровье клеток, мы выполнили несколько анализов жизнеспособности клеток, чтобы продемонстрировать, что клетки остаются жизнеспособными после восстановления после пермеабилизации SLO (Рисунок 1 — рисунок в приложении 1).«Мы также удалили утверждение, что« забота о здоровье клеток »- это исключительная проблема микроинъекций и электропорации.
7) Изображения довольно маленькие и плохо различимы. Поскольку основной целью статьи является качество и эффективность маркировки, мы предлагаем показывать изображения большего размера и поля зрения большего размера. Это особенно важно, поскольку уровень фоновой маркировки является ключевым моментом при оценке этой работы.
Мы согласны с рецензентами в том, что флуоресцентные изображения в статье можно улучшить, увеличив размер изображений.Мы внесли изменения в размер по всему тексту. На Рисунке 1 флуоресцентное изображение клетки увеличено примерно в 1,4 раза по сравнению с исходным размером. На Рисунке 2 размер флуоресцентных изображений был увеличен в 1,6 раза. Чтобы изображения поместились в одну фигуру, мы изменили расположение фигур с горизонтального на вертикальное. Размер изображений был увеличен для некоторых фигур на дополнительных рисунках. Что касается большего поля зрения, большинство изображений в документе, помимо рисунка 2, имеют изображения, которые уже показаны в полном поле зрения, сделанном с увеличением 100x или 150x.Рисунок 2 показан в интересующей области, чтобы показать особенности и качество мечения митохондрий. Кроме того, мы также решили проблему, указанную ниже, в которой говорилось, что отображение зеленого / пурпурного цветов может быть более удобным для зрителей, которые не различают красный / зеленый цвет. Мы заменили все фигуры с зеленого / красного на зеленый / пурпурный цвет.
8) Ссылка Kollmannsperger et al. Nat. Comm 2015 кажется актуальным и отсутствующим. Эту новую работу следует сравнить с методами маркировки «выдавливанием клеток».
Мы благодарим рецензентов за указание на недавно разработанный метод, который мы упустили. Мы добавили ссылку на эту технику вместе с другой недавно разработанной техникой «BLAST». Новый абзац теперь гласит:
.
«Наконец, два недавно разработанных метода, инструмент для биофотонной лазерной хирургии (BLAST) и сжатие клеток, являются многообещающими методами, хотя они требуют, чтобы клетки культивировались на определенных платформах, таких как искусственная поверхность или микрофлюидные каналы.”
https://doi.org/10.7554/eLife.20378.014
Роль мембранных белков в физиологии
Мембранные белки — это белки, которые являются частью клеточных мембран или взаимодействуют с ними, и они несут ответственность за выполнение большинства функций этих мембран. Мембранные белки составляют примерно одну треть белков человека и отвечают за регулирование процессов, которые помогают биологическим клеткам выжить.
Изображение предоставлено: sciencepics / Shutterstock.com
Мембранные белки имеют ряд различных структур и также расположены в разных областях мембраны. Они выполняют широкий спектр функций, и количество белков и типы белков, присутствующих на конкретной мембране, могут варьироваться.
Структура мембранного белка
Клеточные мембраны состоят из двух фосфолипидных бислоев, которые называются листочками. Эти листочки присутствуют на всех клетках, образуя барьер, окружающий каждую клетку.Мембранные белки находятся на этих бислоев фосфолипидов или они взаимодействуют с этими бислоями фосфолипидов.
Внутри липидного бислоя находятся неполярные мембранные белки, которые являются гидрофобными (водоотталкивающими), и полярные мембранные белки, которые являются гидрофильными (способны смешиваться с водой). Они напрямую связаны с липидными бислоями, которые создают барьер вокруг каждой клетки.
Интегральные мембранные белки прочно закреплены на мембране.
Белки периферической мембраны не являются постоянной частью мембраны и могут иметь гидрофобные, электростатические и другие нековалентные взаимодействия с мембраной или интегральными белками.
Интегральные белки бывают разных типов, например монотопные, битопические, политопные, липидно-заякоренные белки или трансмембранные белки.
Монотопные интегральные белки прикреплены только к одному из двух листочков клетки.
Интегральные белки Bitopic — это трансмембранные белки, которые могут однажды покрывать липидные бислои. Политопные белки также являются трансмембранными белками, которые покрывают липидные бислои более одного раза.
Заякоренный липидом белок имеет ковалентную связь с липидами, которые встроены в фосфолипидный бислой.
Функции мембранного белка
Существует множество функций, которые выполняют мембранные белки. К ним относятся:
- Соединения: соединение двух ячеек вместе
Ферментативные функции
Все ферменты представляют собой белок. В результате мембранный белок, внедренный в мембрану, иногда может быть ферментом, активный сайт которого может быть обращен к веществам за пределами липидного бислоя.
Эти типы ферментных мембранных белков могут работать в группах для выполнения определенных этапов метаболического пути, например, расщепления лактозы на углеводы, а затем на моносахариды.
Транспорт
Мембранные белки могут позволить гидрофильным молекулам проходить через клеточную мембрану. Белки транспортной мембраны бывают разных форм, и некоторым требуется энергия для изменения формы и активного перемещения молекул и других веществ через клеточную мембрану. Они делают это, высвобождая АТФ для использования в качестве источника энергии.
- Крепление: становятся точками прикрепления цитоскелета и внеклеточного матрикса
Преобразование сигнала
Некоторые мембранные белки могут иметь сайт связывания.Эти сайты связывания имеют особую форму, которая соответствует форме химического посредника. Например, эти химические посланники могут быть гормонами.
Когда гормон встречается с клеточной стенкой, он соединяется с рецепторным мембранным белком, встроенным в клеточную стенку. Гормон может изменить рецепторный белок и вызвать определенную реакцию, в зависимости от типа гормона или другого вещества, которая будет иметь место внутри клетки.
Распознавание клеток
Другая важная функция мембранных белков — идентификация и распознавание между клетками.Эта конкретная функция полезна для иммунной системы, поскольку она помогает организму распознавать чужеродные клетки, например, которые могут вызывать инфекцию. Гликопротеины — это один из типов мембранных белков, которые могут распознавать клетки.
Межклеточное соединение
Соседние клетки могут иметь мембранные белки, которые соединяются в различных соединениях. Щелевые и плотные соединения.
Эта функция помогает клеткам общаться друг с другом и передавать материалы между собой.
Приложение
Мембранные белки важны для цитоскелета, системы нитей и волокон в цитоплазме клетки и внеклеточного матрикса (ECM), который представляет собой сеть макромолекул, находящихся вне клеток, таких как коллаген, ферменты и гликопротеины. к мембранным белкам.
Присоединение филаментов или волокон в цитоплазме, обнаруженных по всей клетке, может помочь клетке сохранять свою особую форму. Он также сохраняет стабильное расположение мембранных белков.
Присоединение мембранных белков к внеклеточному матриксу может помочь ЕСМ опосредовать изменения, происходящие во внеклеточной и внутриклеточной среде.
Мембранные белки при болезнях
Некоторые заболевания связаны с мутациями мембранных белков. Одним из примеров является мутация под названием V509A, обнаруженная в рецепторе тиреотропина, причем тиреотропин является гормоном, секретируемым гипофизом, который регулирует выработку гормонов щитовидной железы.
Эта мутация увеличивает активность рецептора тиреотропина и приводит к врожденному гипертиреозу, состоянию, которое может вызывать изменения настроения, проблемы со сном и проблемы с желудком.
Другие заболевания, связанные с мутациями в мембранных белках, включают наследственную глухоту, болезнь Шарко-Мари-Тута, которая повреждает периферические нервы за пределами центральной нервной системы, и синдром Дежерина-Соттаса, который влияет на способность человека двигаться.
Изображение предоставлено: Explode / Shutterstock.com
Сводка
Мембранные белки выполняют ряд важных функций, которые помогают клеткам общаться, сохранять свою форму, выполнять изменения, вызванные химическими посредниками, а также транспортировать и обмениваться материалом.
Мембранные белки также могут играть роль в прогрессировании заболевания, поскольку иммунная система может использовать мембранные белки для идентификации потенциально вредных чужеродных молекул в организме.
Белковые хранилища и вакуоли
ХРАНЕНИЕ БЕЛКОВ
СОБИРАЕТСЯ В ER
ПБ образуются в результате процессов, регулируемых развитием, которые индуцируют синтез запасного белка в специализированных клетках и способствуют накоплению запасного белка в определенных органеллах. Все запасные белки изначально синтезируются на грубом ER (Bollini and Chrispeels, 1979; обзор Chrispeels, 1991).Эта мембранная система состоит из обширной взаимосвязанной сети канальцев и цистерн (rev. Staehelin, 1997) и служит портом входа для секреторных и мембранных белков. Запасные белки могут оставаться в ER или транспортироваться через эндомембранную систему к дистальным участкам (Figure 1; rev. Vitale and Denecke, 1999, в этом выпуске). Первоначальный синтез запасных белков может быть ограничен конкретными субдоменами ER; Однако этот вопрос еще не исследован до конца.
Поступление запасных белков в ER происходит котрансляционно и определяется N-концевым сигнальным пептидом, который отщепляется от растущей полипептидной цепи, когда он входит в просветное пространство (Von Heijn, 1984). Дальнейший процессинг запасных белков внутри ER, по-видимому, включает их фолдинг и олигомеризацию, процессы, облегчаемые просветными шаперонами и ферментами (обзор Boston et al., 1996; Vitale and Denecke, 1999, в этом выпуске). Мутации запасного белка кукурузы, например, могут индуцировать синтез молекулярного шаперон-связывающего белка (BiP), а также протеин-дисульфидизомеразы (Zhang and Boston, 1992; Li and Larkins, 1996).Кроме того, было установлено, что для образования олигомеров запасных белков 11S проглобулина (глобулина бобового типа) in vitro необходимы как АТФ, так и молекулярные шапероны (Nam et al., 1997). Кроме того, члены нескольких семейств запасных белков, включая семенной 7S (глобулин вицилинового типа), а также вегетативный запасной белок (VSP), котрансляционно гликозилируются внутри ER (обзор Bollini et al., 1983; Faye et al. , 1989; Chrispeels, 1991).
Основные вакуолярные запасные белки семян (т.е., 7S и 11S глобулины), а также многие вспомогательные запасные белки, образуют димеры, тримеры и тетрамеры в просвете ER вскоре после синтеза (Chrispeels et al., 1982a, 1982b; Ceriotti et al., 1995). Мутантные белки, которые не могут образовывать правильные четвертичные структуры, сохраняются и деградируют в ER (Vitale and Denecke, 1999, в этом выпуске). Олигомеры 7S и 11S глобулинов растворимы и транспортируются в вакуоли путем прохождения через эндомембранную систему, где они образуют PSV.Напротив, запасные белки проламина злаков образуют в ER большие олигомерные агрегаты. У кукурузы и риса эти приросты белка сохраняются в пределах ER (Larkins and Hurkman, 1978; Li et al., 1993a, 1993b), тогда как у пшеницы наросты белка отпочковываются из ER в форме PB, заключенных в ER-производная мембрана (Фигуры 1C и 1D). Эти ПБ могут секвестрироваться в провакуоли, которые в конечном итоге сливаются, образуя одну или несколько крупных центральных вакуолей, содержащих многочисленные наросты белка (Levanony et al., 1992; Галили и др., 1993; см. Marty, 1999, в этом выпуске). Сборка проламинов с образованием PBs внутри ER несомненно отражает необычные структуры этих белков (обзор Shewry and Tatham, 1998).
Все проламины растворимы в водно-спиртовых растворах, что отражает их общую гидрофобную природу. Однако существуют значительные различия в первичных структурах проламинов из разных групп злаков, таких как Triticeae (пшеница, ячмень и рожь) и Panicoideae (кукуруза, сорго и просо).Проламины обеих групп содержат типы с низким и высоким содержанием серы и имеют высокий процент (от 30 до 70%) пролина и глютамина, отсюда и название проламин. Таким образом, проламины, по-видимому, возникли в результате амплификации богатых пролином и глутамином пептидов, содержащих от трех до 20 аминокислот. В некоторых случаях эти повторяющиеся гидрофобные последовательности составляют большую часть белка.
В свете их гидрофобности можно предположить, что проламины неспецифически агрегируются в просвете ER.Если бы агрегация проламинов в белковые тела определялась просто гидрофобными взаимодействиями, ER стал бы заполнен белком, как оболочка колбасы. Вместо этого результаты нескольких недавних исследований кукурузы, ячменя и пшеницы предлагают модель, в которой проламины организуются в PB за счет специфических взаимодействий между богатыми серой и бедными серой проламинами (Rechinger et al., 1993; Coleman et al., 1996). ; Багга и др., 1997). Более того, нацеливание мРНК проламина на ER может играть важную роль в направлении этих белков к специфическим доменам мембраны, где они образуют олигомеры (Li et al., 1993а).
PBs в эндосперме кукурузы образуются непосредственно в просвете грубого ER и содержат по крайней мере четыре различных проламина — α-, β-, γ- и ∂-зеины (Larkins et al., 1989). ПБ наименьшего диаметра, по-видимому, содержат β- и γ-зеины, которые богаты цистеином и сшиты дисульфидными связями (Lending and Larkins, 1989; Lopes and Larkins, 1991). Α- и ∂-зеины проникают в матрицу β- и γ-зеинов и расширяют PB в более крупную сферическую структуру, которая достигает диаметра от 1 до 2 мкм.
Механизмы, которые ограничивают дальнейшую экспансию белкового тела, неизвестны, но похоже, что γ-zein и, возможно, β-zein организуют α- и ∂-зеины и удерживают их в просвете ER. В частности, когда β- или γ-зеины синтезируются в листьях или эндосперме трансгенного табака, они сохраняются в ER (Coleman et al., 1996; Bagga et al., 1997). Однако, когда α- или ∂-зеины синтезируются в этих тканях, оба белка, по-видимому, секретируются и разрушаются (Williamson et al., 1988; Coleman et al., 1996; Багга и др., 1997). Однако α- или ∂-зеины будут накапливаться в комплексы при совместной экспрессии с β- и γ-зеинами в трансгенном табаке. Это предполагает, что β- и γ-зеины обеспечивают механизм удержания ER для α- и ∂-зеинов. Следовательно, количество β- и γ-зеина в PB может ограничивать его рост.
Природа физических взаимодействий между белками зеина, которые ответственны за сборку PB, неизвестна; однако делеционные мутанты γ-зеина показывают, что богатые пролином повторы на N-конце белка дикого типа направляют его удержание в ER (Geli et al., 1994). Мутантный белок α-зеин с нефункциональным сигнальным пептидом (Coleman et al., 1997) заставляет β- и γ-зеины вытесняться с периферии PB, в результате чего PBs отростаются и растут нерегулярно, как мутантный α- зеин накапливается (Lending and Larkins, 1992; Zhang and Boston, 1992). Этот результат также согласуется с моделью, в которой роль β- и γ-зеинов состоит в организации и разделении более гидрофобных α- и ∂-зеинов в центре белкового тела.
Сборка проламина в ПБ — не менее сложный процесс в пшенице и ячмене.В то время как наросты проламина в этих злаках также образуются в просвете ER, они впоследствии транспортируются в PSV любым из двух разных маршрутов (Galili et al., 1993; см. Ниже). В ячмене различные типы проламинов с высоким и низким содержанием серы имеют тенденцию к разделению на отдельные ПБ в пределах ER (Rechinger et al., 1993), тогда как в пшенице наблюдается большая интеграция проламинов с высоким и низким содержанием серы. проламины в составе PB (Rubin et al., 1992).
Сложность посттрансляционной обработки проламинов пшеницы и ячменя, по-видимому, связана с их сложной структурой.Например, Altschuler et al. (1993) продемонстрировали, что богатый серой пшеничный γ-глиадин содержит серию N-концевых тандемно повторяющихся пептидов, которые заставляют его удерживаться в ER, и автономную C-концевую область, нацеленную на его секрецию. Таким образом, эффективный перенос этих белков в ER или комплекс Гольджи может определяться относительной силой сигналов нацеливания в пределах различных типов проламинов. Взаимодействия между богатыми серой и бедными серой проламинами в пшенице и ячмене не были тщательно исследованы, но эти ассоциации могут быть важны для субклеточного нацеливания, о чем свидетельствуют ультраструктурные исследования мутантов ячменя, дефицитных по богатым серой γ-гордеинам.У сорта Невский отсутствует γ3-гордеин — уникальный мономерный белок, образующий внутримолекулярные дисульфидные мостики. В эндосперме этого генотипа бедные серой β-гордеины накапливаются в ЭПР, а не транспортируются в вакуоль. Удержание B-гордеина в ER не наблюдается у мутантов, лишенных γ1- или γ2-гордеина, которые образуют межмолекулярные дисульфидные мостики (Rechinger et al., 1993). Следовательно, очевидно, что γ3-гордеин вносит вклад в транспортную способность некоторых бедных серой гордеинов.
Фигура 1.
Онтогенез органелл, участвующих в хранении белка в семенах.
(A) Обычная электронная микроскопия клеток запасающей паренхимы семян сои среднего созревания, показывающая, что комплекс Гольджи (G) секретирует плотные пузырьки (стрелки), которые блокируют предшественники запасных белков. OB, масляное тело.
(B) Очевидное слияние (стрелки) плотной везикулы (DV) с вакуолью хранения белка (PSV) в клетке паренхимы сои среднего созревания.
(C) Сканирующая электронная микроскопия развивающейся клетки эндосперма кукурузы.Наблюдается разветвленная система трубчатых грубых ER с белковыми тельцами, расположенными на концах мембран ER (стрелка).
(D) Электронная микрофотография эндосперма кукурузы через 19 дней после опыления. Шероховатый ER прерывистый в поперечном сечении, но сплошной по сечению поверхности. ER связан с белковыми тельцами (PB). CW, клеточная стенка.
Организация проламинов в наросты белков не может быть просто определена межбелковыми взаимодействиями внутри просвета ER.Возможно, что проламины нацелены на определенные области или субдомены ER через их последовательности мРНК. Механизмы нацеливания на мРНК хорошо известны в клетках животных, где было показано, что этот процесс опосредуется цитоскелетом и белками, которые взаимодействуют (наиболее часто) с 3′-некодирующей последовательностью мРНК (St. Johnston, 1995). Это устройство обеспечивает эффективный способ синтеза растворимых и секретируемых белков вблизи точки секреторного пути, в которой они необходимы, а также обеспечивает механизм разделения белков, которые в противном случае могли бы взаимодействовать ненадлежащим образом (Rings et al., 1994).
Хотя сортировка мРНК на растениях широко не исследовалась, Okita с соавторами нашли доказательства этого феномена в развитии эндосперма риса (Li et al., 1993a). Рис содержит два типа запасных белков: проламины, которые образуют сростки в просвете ЭПР; и глютелины (относящиеся к 11S глобулинам), которые синтезируются на грубом ER и затем транспортируются в PSV. Ли и др. (1993a) обнаружили, что в то время как оба типа мРНК обнаруживаются в полисомах грубого ER, транскрипты проламина преимущественно локализуются на мембранах, окружающих проламинсодержащие белковые тела, а мРНК глутелина преимущественно связаны с полисомами на цистернальном ER.Хотя механизм, ответственный за асимметричное распределение двух типов мРНК, неизвестен, это наблюдение предполагает процесс, с помощью которого мРНК проламина могут одновременно направлять синтез и организацию проламинов в белковые тела.
ПЕРЕДАЧА БЕЛКОВ ХРАНЕНИЯ ОТ ER В PSV
Мы обсудили, как проламины в кукурузе и рисе удерживаются в ЭПР-производных PB (Larkins and Hurkman, 1978; Li et al., 1993b). В других злаках, таких как пшеница, PB могут быть изолированы в одну или несколько больших центральных вакуолей, которые содержат многочисленные PB (Galili et al., 1993). Теперь мы обсудим два альтернативных пути, которые PBs могут использовать для секвестрации вакуолей (Figure 2). Один путь включает транспорт белка через комплекс Гольджи, процесс, который широко обсуждается в другом месте в этом выпуске (Sanderfoot and Raikhel, 1999). Второй путь может быть специфическим для запасных белков и происходит путем аутофагии.
Фигура 2.
Концептуальная диаграмма онтогенеза PBs и PSVs.
PB собираются путем агрегации белков внутри ER.После образования они могут либо оставаться прикрепленными к ER, либо отпадаться как отдельные органеллы. Затем PB могут либо накапливаться в цитоплазме, либо секвестрироваться в вакуоли в результате аутофагии. PSV образуются как следствие ER-синтезированных запасных белков, продвигающихся через эндомембранную секреторную систему в вакуоль для накопления.
Аутофагия — это основной путь, с помощью которого клетки растений избавляются от цитоплазматических компонентов и материалов, интернализированных из внеклеточного пространства мультивезикулярными эндосомами (обзор Herman, 1994; Robinson et al., 1998). В некоторых злаках аутофагия также используется для накопления запасных белков в обход консервативного механизма опосредованного Гольджи нацеливания и транспорта в вакуоль (Levanony et al., 1992). Запасные белки, собранные в ER, полимеризуются в структуры более высокого порядка (Shimoni and Galili, 1996), которые непосредственно секретируются из ER. PBs пшеницы не остаются в виде отдельных цитозольных структур, а вместо этого секвестрируются в провакуоли (Rubin et al., 1992). Происхождение провакуолярных мембран — будь то из комплекса Гольджи или непосредственно из ЭПР — не определено; однако известно, что эти мембраны несут маркерные белки тонопласта γ-TIP (интегральный белок тонопласта) и пирофосфатазу, оба из которых характерны для образования вакуолей, опосредованного комплексом Гольджи (G.Галили, личное сообщение). Провакуоли, содержащие секвестрированные PB, сливаются друг с другом, образуя одну или несколько больших центральных вакуолей, которые содержат многочисленные агрегаты запасных белков. Ограничивающая мембрана изолированного PB, по-видимому, переваривается вакуолярными ферментами, высвобождая оголенный агрегат проламина в вакуолярный сок. Нарастающие белки проламина впоследствии агрегируются, образуя более крупные ПБ.
Аутофагия проламинсодержащих белковых тел (рис. 2) может наблюдаться у трансгенных растений.Coleman et al. (1996) установили, что совместная экспрессия α- и γ-зеина в семенах табака приводит к продукции PB, которые, по-видимому, структурно неотличимы от PBs кукурузы. Цитозольные PB обладают ограничивающей мембраной со связанными рибосомами, которая изолирует белковый матрикс γ-зеина с включенными локулами α-зеина. Иммуноцитохимия под электронным микроскопом показала, что PBs секвестрируются в PSV в результате аутофагии. Количественные различия в содержании γ- и α-зеина в цитоплазматических и PSV-секвестрированных белковых телах указывают на то, что α-зеин нестабилен, когда PB попадает в вакуоль.Как обсуждалось выше, Bagga et al. (1995, 1997) описали аналогичные результаты для β / ∂-зеин-содержащих PBs, образованных в семенах и листьях трансгенного табака. Взятые вместе, эти результаты показывают, что аутофагический процесс, происходящий в эндосперме пшеницы, посредством которого происходящие из ER PBs секвестрируются в вакуолях, может дублироваться путем продуцирования PB в трансгенном табаке, даже если растения табака обычно не продуцируют полученные из ER PBs.
Есть недавние указания на то, что запасные белки 11S, которые обычно транспортируются в вакуоль за счет эндомембранной прогрессии, могут секвестрироваться в происходящих из ER PBs.Hara-Nishimura et al. (1998) показали, что созревающие клетки семядолей тыквы содержат ER-производные PB, которые секвестрируют предшественник запасного белка 11S. Точно так же А.Дж. Кинни и Е.М.Херман (неопубликованные данные) обнаружили, что ко-супрессия запасного белка 7S, конглицинина, в трансгенных соевых бобах способствует накоплению ПБ, которые содержат запасной белок 11S, глицинин. Эти результаты показывают, что PBs могут секвестрировать вакуолярные белки, отвлеченные от эндомембранной прогрессии, в дополнение к хорошо охарактеризованной роли PB в секвестрировании запасных белков проламина.
ТРАНСПОРТИРОВКА ХРАНИЛИЩНЫХ БЕЛКОВ ПО ЭНДОМЕМБРАННОЙ СИСТЕМЕ
Транзит белков из ER в комплекс Гольджи
Пребывание запасных белков в ER характеризуется периодом полураспада в несколько часов (Chrispeels et al., 1982a), после чего они могут проходить через комплекс Гольджи. Обычные электронные микрофотографии белковых электронно-плотных везикул, выходящих из цистерн trans комплекса Гольджи, и методы иммуногольда подтвердили, что запасные белки проходят через ER и комплекс Гольджи, прежде чем попадут в секреторные везикулы, которые образуют PSV (Рисунки 1A и 1B; Craig and Goodchild , 1984; Герман и Шеннон, 1984a, 1984b; Гринвуд и Криспилс, 1985).Помимо своей роли в транспорте и упаковке белков, комплекс Гольджи может обрабатывать происходящие из ER высокоманнозные гликановые боковые цепи вакуолярных гликопротеинов (Chrispeels, 1983; Faye et al., 1989; обзор в Staehelin and Moore, 1995). Получение ксилозильных остатков на запасном белке алейроновых клеток сои, также визуализированное с помощью иммунной электронной микроскопии, дополнительно указывает на роль медиального домена trans комплекса Гольджи в процессинге запасных белков до их прибытия в PSV (Yaklich и Герман, 1995).Гликозилирование основных белков PSV семян преимущественно связано с N, хотя спорамин вакуолярного запасного белка клубней сладкого картофеля обладает О-связанными боковыми цепями гликана (Matsuoka et al., 1995). Поскольку гликаны, по-видимому, не играют роли в нацеливании на вакуол (Sturm et al., 1988), значение гликозилирования запасных белков остается неясным.
Транзит запасных белков из комплекса Гольджи
Направление белка в вакуоль, по-видимому, происходит в комплексе Гольджи.Последовательности нацеливания на пептиды были идентифицированы и / или предполагались для многих составляющих запасающих вакуолей, включая ферменты и запасные белки (обзор Chrispeels and Raikhel, 1992; Sanderfoot and Raikhel, 1999, в этом выпуске). По-видимому, существует несколько различных типов неродственных последовательностей, нацеленных на несколько рецепторов. Наиболее охарактеризованными рецепторами являются ВР-80 и его гомологи, которые распознают последовательности N-концевого продомена, обнаруженные в вакуолярных цистеиновых протеазах (Holwerda et al., 1992) и некоторых других белках (Ahmed et al., 1997; Paris et al., 1997).
Другие нацеливающие последовательности встречаются на С-концевом продомене лектинов семейства агглютининов зародышей пшеницы и близкородственных хитиназ (Wilkins et al., 1990; Neuhaus et al., 1991). Рецептор для этих C-концевых нацеливающих последовательностей не идентифицирован. Направляющие последовательности основных запасных белков, включая семейства глобулинов 11S и 7S, а также лектины семян, также не были идентифицированы. Paris et al. (1997) показали, что рецептор ВР-80, по-видимому, связан с транс -сетью Гольджи (TGN) и производными от нее секреторными пузырьками, и они постулировали, что рецептор может отделяться от секреторных пузырьков во время перехода в вакуоль.После этого рецептор может возвращаться обратно в TGN, как и рецепторы белка вакуолей в дрожжевых клетках (Cooper and Stevens, 1996).
Хотя белки проламина в пшенице и ячмене, по-видимому, не обладают последовательностями, направленными на вакуоль, они, тем не менее, могут продвигаться к вакуоли через комплекс Гольджи. Фактически, проламины пшеницы обнаруживаются в комплексе Гольджи (Krishnan et al., 1986). Добавление последовательности тетрапептида KDEL, удерживающей ER, к глиадину пшеницы, экспрессируемому в трансгенном табаке, стабилизировало белок, что позволяет предположить, что сайт деградации находится после цис Гольджи и что глиадины проходят через эндомембранную систему (Napier et al.1997).
Запасные белки выходят из TGN упакованными в электронно-плотные везикулы диаметром ~ 0,1 мкм (рис. 1А и 2). Плотные пузырьки содержат процессированные Гольджи запасные белки-предшественники (Chrispeels, 1983). Запасные белки, по-видимому, не проникают в TGN, который остается немеченным в анализах иммунодетекции. Иммунологические методы (Harley and Beevers, 1989) предполагают, что везикулы, покрытые клатрином, опосредуют некоторый перенос в вакуоль. Эту гипотезу трудно согласовать с электронно-микроскопическими наблюдениями, которые показывают, что запасные белки покидают комплекс Гольджи упакованными в плотные пузырьки.Более того, недавнее исследование предоставляет убедительные данные, которые опровергают роль покрытых везикул в транспорте запасных белков (Hohl et al., 1996).
Созревающие клетки семядолей содержат плотные пузырьки диаметром от 0,3 до 0,5 мкм, которые несут запасные белки и, по-видимому, идентичны пузырькам секреции (см., Например, Herman and Shannon, 1985; Hara-Nishimura et al., 1993b, 1995; Robinson et al. ., 1997; дополнительное обсуждение см. В Robinson et al., 1998; рисунок 2). Внешний вид этих более крупных плотных пузырьков свидетельствует о том, что они возникают из 0.Везикулы секреции Гольджи размером 1 мкм, хотя несколько везикул секреции Гольджи 0,1 мкм должны были бы агрегироваться, чтобы учесть объем и поверхность мембраны более крупных плотных везикул. Вопрос о том, как везикулы с плотностью от 0,3 до 0,5 мкм возникают из пузырьков секреции Гольджи 0,1 мкм, может быть решен недавним наблюдением Hirschberg et al. (1997). Используя слияние зеленого флуоресцентного белка с секреторным белком, они пошли по пути синтеза и лизосомного транспорта белков к комплексу Гольджи в клетках животных и через него.Флуоресцентная световая микроскопия с увеличением времени с помощью видео показала, что начальное событие секреции Гольджи вовлекает не отдельные везикулы, а скорее волнообразную трубку везикул, которые выглядят как связанные шарики, которые выходят наружу от комплекса Гольджи вдоль элементов цитоскелета, прежде чем схлопнуться в более крупную везикулу. Повторное изучение опубликованных семенных пузырьков секреции Гольджи на фотографиях как трещин замораживания, так и тонких срезов аналогичным образом показывает удлиненные вакуоли, которые могут быть аналогичны канальцам, наблюдаемым Hirschberg et al.(1997).
Плотные пузырьки от 0,3 до 0,5 мкм также могут быть аналогичны небольшим пузырькам, заполненным белком диаметром 1,0 мкм в кончиках корней и алейроновых клетках, которые недавно были названы вторыми вакуолями (Paris et al., 1996). Эти вторые вакуоли содержат недавно синтезированные белки и обладают тонопластами с полипептидами, отличными от ранее существовавших вакуолей. Вторые вакуоли наблюдались в кончиках корней и в алейроновых клетках ячменя, где их также называют алевраин (цистеиновая протеаза) -содержащими вакуолями.Если аналогия с семенными клетками окажется верной, то вторые вакуоли будут составлять временную популяцию предвакуолярных компартментов.
PSV происходят из центральных вакуолей после Гольджи, которые лишены значительного накопления белка как в эмбриональных, так и в вегетативных клетках (Рисунок 2). Добавляются запасные белки, которые постепенно заполняют вакуоль. Это контрастирует с происходящими из ER PBs, которые образуются в виде сростков белка и не подвергаются дальнейшим изменениям. PSVs структурно дифференцируются как временные подразделения предсуществующей вакуоли, и это происходит одновременно с началом синтеза и накопления запасных белков.Craig et al. (1980) с помощью световой микроскопии проследили процесс подразделения вегетативной вакуоли клеток семядолей гороха. Их исследования и исследования нескольких других групп показывают, что это приводит к увеличению общей площади мембран до 1000 раз, поскольку единственная вегетативная вакуоль подразделяется на многочисленные PSVs (Craig et al., 1979, 1980). Не все исследователи согласны с тем, что онтогенез PSV является результатом подразделения ранее существовавшей вакуоли. Робинсон и др. (1995) утверждают, что вакуоль, которая трансформируется в PSV, синтезируется de novo и заменяет существовавшую ранее вегетативную вакуоль.Согласно этой гипотезе, именно эта новая вакуоль подразделяется на многочисленные PSV.
ХРАНЕНИЕ БЕЛКА
В PSV
Хранение белка в семенах
Наличие запасных белков определяет PSV семян. Зрелые семена содержат плотно упакованные отложения запасного белка, которые полностью заполняют PSV. Отложения белка PSV могут быть однородно аморфными или дифференцированными на субдомены, содержащие разные типы белков. Эти субдомены состоят из белкового матрикса, белкового кристаллоида, включений фитина и внутривакуолярных пузырьков, полученных в результате аутофагии.Большинство электронных микрофотографий частично заполненных PSV семян показывают агрегированные запасные белки, которые во многих случаях откладываются рядом с внутренней поверхностью тонопласта. Являются ли эти агрегации осаждением накопленных белков при низком pH или агрегацией, вызванной фиксацией, дискутировались. E.M. Herman (неопубликованные данные) исследовал замороженные созревающие семядоли сои, обнаружив, что запасные белки не кажутся плотно агрегированными, а вместо этого рассредоточены по вакуоли.Это предполагает, что агрегация белка может быть артефактом фиксации.
Запасные белки семян 7S и 11S являются членами больших семейств генов и наиболее заметными составляющими PSV (обзор Shewry et al., 1995). Белки 11S имеют древнее происхождение и обнаруживаются в хвойных деревьях, а также в семенах двудольных и однодольных (Higuchi and Fukazawa, 1987). В PSV, которые содержат кристаллоиды, белки 7S находятся в периферическом матриксе, тогда как белки 11S являются первичным компонентом кристаллоидов (Hara-Nishimura et al., 1985). У других видов белки 7S и 11S равномерно кодируются внутри PSV. Другие белки секвестрируются с запасными белками, и они могут иметь достаточную концентрацию, чтобы составлять вспомогательные запасные белки.
Лучшими примерами этих вспомогательных белков являются лектины семян, которые в некоторых бобовых могут составлять 10% или более от общего белка (обзор у Etzler, 1985). Тесно связаны с лектинами ингибиторы α-амилазы, которые защищают от насекомых, питающихся зрелыми сухими семенами (см. Обзор Chrispeels and Raikhel, 1991).Другие локализованные в PSV защитные белки включают ингибитор трипсина Kunitz-типа (Horisberger and Volanthen, 1983) и P34 (Kalinski et al., 1992), отдаленно родственный член суперсемейства папаинов, который связывает элиситор, секретируемый из Pseudomonas (Cheng et al. др., 1998). Защитные белки в сухих семенах предполагают возможность того, что насекомые будут питаться семенами, когда они не могут ответить индуцируемой реакцией.
Накопление запасных белков в вакуоли сопровождается дополнительной обработкой, которая может служить для модификации и подготовки белков к плотной упаковке.Этот процессинг включает модификации как полипептидной цепи, так и боковой цепи гликана, хотя не все белки PSV модифицируются после осаждения. Эндопротеолитическое расщепление запасных белков 11S на две цепи, связанные дисульфидным мостиком, эволюционно консервативно в семенах хвойных, однодольных и двудольных (Dickinson et al., 1989; обзор в Nielsen et al., 1995). Консервативный сайт расщепления находится на С-конце аспарагина, и была идентифицирована ответственная аспарагинспецифическая эндопептидаза, называемая энзимом вакуолярного процессинга (VPE), и был клонирован ее ген (Hara-Nishimura et al., 1993а, 1995). Nielsen с коллегами продемонстрировали, что VPE-опосредованное расщепление в консервативном аспарагиновом сайте необходимо для превращения олигомерного тример, образованного в ER, в зрелый локализованный в вакуоли запасной белок гексамера (11S) (Jung et al., 1998).
Другие протеины семян созревают аналогичным образом посредством обработки с помощью VPE. Среди наиболее необычных форм PSV-специфического процессинга — созревание проконканавалина A. Этот белок первоначально синтезируется как предшественник (Herman and Shannon, 1985), который гликозилируется в центральном коротком пептиде, который связывает N- и C- терминальные домены (Carrington et al., 1985). После расщепления по двум сайтам аспарагина гликозилированный пептид теряется, N- и C-концевые домены меняются местами, и бывший C-концевой домен лигируется с бывшим N-концевым доменом, образуя интактный и правильно уложенный белок (Bowles и др., 1986). Гликозидазы, локализованные в PSV, могут удалять открытые гликозильные остатки из гликопротеинов, в некоторых случаях удаляя остатки сахара, добавленные к боковой цепи гликана до транспорта в вакуоль (Vitale and Chrispeels, 1984).
Может показаться парадоксальным, что вакуоль служит одновременно отсеком для хранения клеточного белка и литическим отсеком.PSV содержат множество ферментов, способных полностью разрушать макромолекулы. Вакуоли запаса протеина семян содержат различные кислотные гидролазы, включая гликозидазы, фосфатазы, фосфолипазу D и нуклеазы (Nishimura and Beevers, 1978; Mettler and Beevers, 1979; Chappell et al., 1980; Herman and Chrispeels, 1980; Van der Wilden et al. ., 1980). Более того, есть доказательства того, что PSV созревающих семян действительно функционируют как общие литические компартменты, которые разлагают материалы, полученные в результате аутофагии и эндоцитоза, а также материалы, депонированные в результате прохождения через эндомембранную систему.
Протеазы представляют особую проблему для функции хранения PSV. Запасные белки семян специфически мобилизуются в результате синтеза цистеиновых протеаз de novo после прорастания (Baumgartner and Chrispeels, 1977; Baumgartner et al., 1978), и запасные белки являются хорошими субстратами для этих ферментов (обзор Müntz, 1996). Однако недавние исследования показывают, что PSV содержат активные протеазы даже при накоплении запасных белков. Экспрессия генов, кодирующих чужеродные запасные белки, такие как фазеолин и вицилин, в трансгенных семенах табака обычно приводит к стабильному накоплению белка по той же схеме, что и внутренние запасные белки.Однако некоторые запасные белки, по-видимому, разлагаются в PSV одновременно со стабильным накоплением собственных запасных белков. Напр., Мутантный фазеолин с высоким содержанием метионина (HiMet) посттрансляционно нестабилен, хотя он не настолько сильно нарушен, чтобы препятствовать его гликозилированию и правильной сборке (Hoffman et al., 1988; Lawrence et al., 1994). HiMet стабилен, пока он изолирован в просвете ER, но он быстро разрушается, когда прогрессирует до PSV (Pueyo et al., 1995). Это указывает на то, что конформация запасного белка дикого типа обеспечивает стабильность и устойчивость к колокализованной протеазе (-ам) PSV.
По мере того, как происходит подразделение и увеличение вакуоли на PSV, тонопласт изменяется с вегетативной на PSV-специфическую форму. Тонопласты PSV семян обладают дифференцированным полипептидным составом по сравнению с их предшественниками. В состав изолированных тонопластов PSV входит до 10–12 полипептидов (Mettler, Beevers, 1979; Pusztai et al., 1979; Weber et al., 1979). Из них первым, который был идентифицирован как PSV-специфический белок, был основной полипептид массой 26 кДа Phaseolus vulgaris (Mader and Chrispeels, 1984; Johnson et al., 1989). Ген, кодирующий этот белок, оказался членом семейства внутренних белков мембраны поровых белков (Johnson et al., 1990), широко распространенных в прокариотических и эукариотических клетках (обзор в Maurel, 1997; см. Также Chrispeels et al., 1999). , в этом выпуске). Было показано, что протеин массой 26 кДа, α-TIP, является аквапорином или водным каналом (Maurel et al., 1995), обеспечивая функциональное объяснение фаз высыхания и гидратации в жизненном цикле семян. Накопление α-TIP происходит во время позднего созревания семян, в первую очередь после завершения деления вегетативной вакуоли (Johnson et al., 1989, 1990; Мелрой и Герман, 1991; Иноуэ и др., 1995). Фосфорилирование α-TIP in vivo (Johnson et al., 1992), по-видимому, контролирует водные поры (Maurel et al., 1995).
Любопытно, что созревающие тонопласты PSV, по-видимому, испытывают дефицит основных белков протонной помпы тонопласта, V-АТФазы и пирофосфатазы, которые действуют по подкислению вакуоли (Maeshima et al., 1994; см. Также Sze et al., 1999, в этом выпуске. ). Как и даже если созревающий PSV подкисляется, еще предстоит определить. Inoue et al.(1995) показали, что тонопласты PSV тыквы содержат две изоформы α-TIP и четыре других распространенных белка, включая два гликопротеина 27 и 32 кДа и два других белка 73 и 80 кДа. Они определили, что белки 27 и 32 кДа образуются из одного белка-предшественника при расщеплении С-концевой стороны остатка аспарагина, что предположительно опосредуется VPE, изолированным внутри PSV. Хотя анализы мечения иммуноголотом показали, что белки массой 27 и 32 кДа связаны с тонопластом, последовательность клона кДНК, кодирующего эти белки, не указывает на трансмембранный домен, что позволяет предположить, что белки находятся на периферии внутренней поверхности PSV тонопласт.
Во время прорастания и роста проростков PSV дедифференцируются, при этом отдельные PSV сливаются, чтобы преобразовать вегетативную вакуоль. Слияние до тысячи PSV в единую вакуоль приводит к относительно небольшому изменению общего объема вакуоли (ов), но требует значительного уменьшения площади поверхности мембраны. Избыток тонопласта интернализуется, а мембранные белки PSV, включая α-TIP и периферические белки 27 и 32 кДа, разрушаются (Melroy and Herman, 1991; Inoue et al., 1995). Параллельно с этим новый тонопласт способствует преобразованию вегетативной вакуоли за счет происходящих из Гольджи везикул секреции, которые также несут ферменты, разрушающие запасные белки. Белки тонопласта, такие как пирофосфатаза, γ-TIP и V-ATPase (Maeshima et al., 1994), одновременно доставляются в дедифференцированную центральную вакуоль.
Регулирование водопроницаемости через PSV с помощью аквапоринов может поддерживаться структурой мембраны. В частности, мембраны PSV содержат высокие уровни стеринов (Herman et al., 1984), которые уменьшают текучесть мембраны, увеличивая доступность воды к гидрофильным частям мембраны и уменьшая доступ воды к внутренней части гидрофобной мембраны (Kusumi et al., 1986). Электронно-спиновый резонанс аналогичным образом установил, что PSV прорастающих семядолей тыквы обладают гораздо более жесткими мембранами, чем тонопласты реформированных вегетативных вакуолей. Предположительно, водный транспорт может регулироваться многочисленными порами α-TIP. Эта модель позволит регулировать транспорт воды во время обезвоживания и регидратации путем фосфорилирования α-TIP (Johnson et al., 1992; Maurel et al., 1995), которые, в свою очередь, могут регулироваться не охарактеризованной киназой и системой передачи сигналов.
Хранение белка в растительных тканях
Вегетативные PSV структурно отличаются от семенных PSV, хотя об онтогенезе вегетативных PSV известно гораздо меньше. Вегетативные клетки хранят широкий спектр белков (обзор в Staswick, 1994), которые не похожи на специфический для семян глобулин и запасные белки проламина. Лектины семян являются многочисленными вспомогательными запасными белками в некоторых семенах бобовых, и было показано, что изоформы лектинов семян являются важными или первичными запасными белками в листьях и коре древесных бобовых (Hankins et al., 1987, 1988). Другие VSP связаны с кислой фосфатазой (DeWald et al., 1992; обзор в Staswick, 1994) и со спорамином (Maeshima et al., 1985) и пататином из сладкого картофеля и картофеля, соответственно. В сое изоформа липоксигеназы, по-видимому, действует вместе с VSP как вспомогательный запасной белок (Tranbarger et al., 1991).
Все описанные до сих пор VSP находятся в вакуолях и, по-видимому, обрабатываются секреторной системой. Как и в семенах, VSP, по-видимому, откладываются в вакуолях посредством процесса, опосредованного Гольджи (см., E.г., Клауэр, Франчески, 1997). Вегетативные PSV были описаны в листьях, семенных стручках, стеблях, семядолях, коре и клубнях для хранения. В большинстве случаев вегетативные клетки накапливают белок в плейоморфных вакуолях, которые, по-видимому, структурно отличаются от небольших сферических PSV семян (см., Например, Greenwood et al., 1986; Herman et al., 1988). Белки, депонированные в вегетативных PSV, могут состоять из редких белковых агрегатов или плотно упакованного белка, полностью заполняющего вакуоль.Хранение растительного белка может быть ограничено специализированными клетками, такими как паравеинальный мезофилл листьев сои (Franceschi and Giaquinta, 1983a, 1983b), или может накапливаться в клетках мезофилла, которые составляют большую часть ткани, как в клубнях.
В отличие от накопления запасного белка в семенах, которое жестко регулируется программированием развития (см. Обзор Thomas, 1993), накопление VSP регулируется комплексными факторами, которые включают как изменения развития, так и сезонные изменения (см., E.г., Nsimba-Lubaki and Peumans, 1986; Wetzel et al., 1989), а также источник – сток (Staswick, 1989) и другие экологические эффекты (van Cleve and Apel, 1993). Факторы, специфичные для вакуолей хранения вегетативных клеток, в отличие от PSV семян, могут иметь больше общего с параллельной ролью первых как литических и осморегуляторных органелл, чем со специфическими требованиями к хранению и мобилизации белка.
Среди ключевых характеристик, которые отличают PSV семян от вегетативных вакуолей, является присутствие различных белков тонопластов.Вегетативные клетки обладают TIP, которые могут функционировать в осморегуляции, тогда как компетентные к высыханию клетки семян обладают α-TIP, который, вероятно, функционирует в оттоке / притоке воды во время созревания и прорастания. Отсутствует критическая информация о том, становится ли тонопласт PSV вегетативных клеток специализированным в ходе накопления или мобилизации белка и становится ли он в дальнейшем специализированным во время покоя. Хотя имеется мало информации о том, дифференцирован ли тонопласт PSV вегетативных клеток относительно специализированных полипептидов, Jauh et al.(1998) представили доказательства, показывающие, что PSV листьев сои содержит специфический TIP, который они назвали ∂-TIP. В таких системах, как соевые бобы, выделение PSV из одного типа клеток сложной ткани может вызвать трудности, но в таких системах, как клубни, где накопительных клеток много, выделение PSV может быть намного проще. Простым подходом может быть использование количественной иммуноцитохимии под электронным микроскопом для изучения процесса накопления вегетативного белка и параллельных изменений в структуре тонопластов.
Какие типы белков находятся в плазматической мембране?
В то время как липиды мембран образуют основную структуру липидного бислоя, активные функции мембраны зависят от белков. Адгезия клеток, передача энергии, передача сигналов, распознавание и транспорт клеток — это лишь некоторые из важных биологических процессов, осуществляемых мембранными белками.
Существует три способа связывания белков с плазматической мембраной: внутренние / интегральные мембранные белки, которые встроены в гидрофобную область липидного бислоя, трансмембранные белки, которые проходят через мембрану, которые могут пересекать мембрану один раз (за один проход), или многократно (многопроходный), и внешние или периферические мембранные белки, которые слабо связываются с гидрофильными поверхностями липидного бислоя или внутренние мембранные белки
Белки могут связываться с мембраной одним из трех способов.Внутренние или интегральные мембранные белки встраиваются в гидрофобную область липидного бислоя. Экспериментально эти белки можно выделить только путем физического разрушения мембраны детергентом или другим неполярным растворителем. Mono Save topic белки вставляются в одну листовку, но не покрывают мембрану. Трансмембранные белки являются классическими примерами внутренних мембранных белков. Они охватывают мембрану, как правило, в конформации α-спирали и могут проходить через мембрану несколько раз. Некоторые межмембранные белки используют β-бочки для пересечения мембраны.Эти структуры обычно имеют большие размеры и образуют каналы, заполненные водой. Внешние или периферические мембранные белки слабо связаны с гидрофильными поверхностями липидного бислоя или внутренних мембранных белков. Они образуют слабые гидрофобные, электростатические или нековалентные связи, но не встраиваются в гидрофобное ядро мембраны. Эти белки можно отделить от мембраны, не нарушая ее, путем применения полярных реагентов или растворов с высоким pH. Белки внешней мембраны могут взаимодействовать с внутренней или внешней створкой.
.