что является основными ферментативными функциями рибосомы или углеводов в организме и таблица об этом
Функции белков в природе универсальны. Белки входят в состав всех живых организмов. Мышцы, кости, покровные ткани, внутренние органы, хрящи, шерсть, кровь — все это белковые вещества.
Растения синтезируют белки из углекислого газа и воды за счет фотосинтеза. Животные организмы получают, в основном, готовые аминокислоты с пищей и на их базе строят белки своего организма.
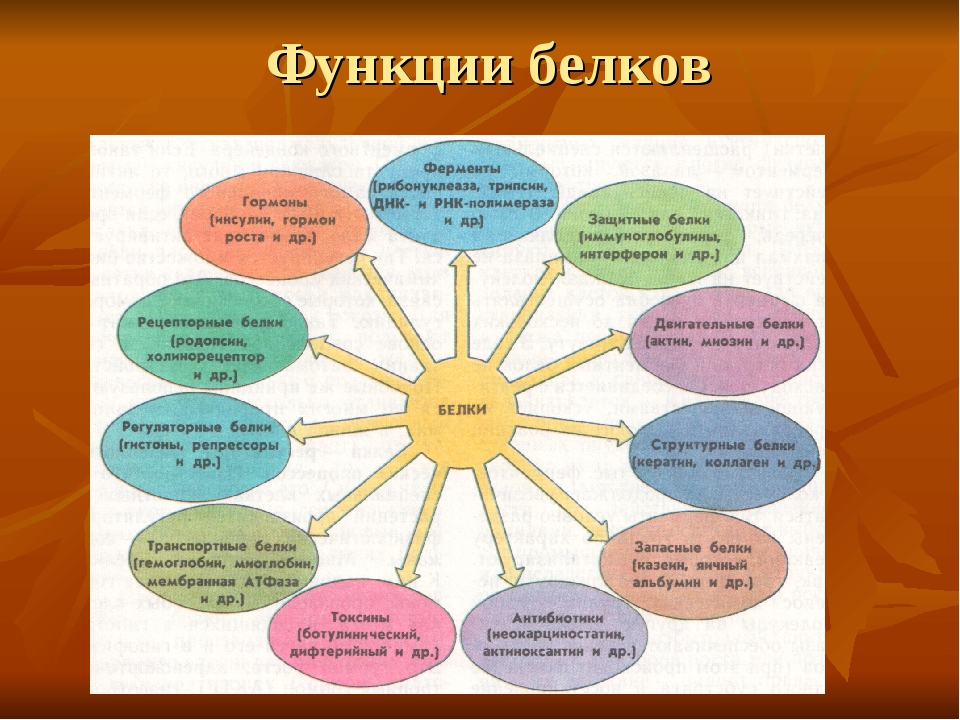
Функции белков в организме
Ни один из известных нам живых организмов не обходится без белков.
Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Каталитическая (ферментативная) функция
Каталитическая функция — одна из основных функций белков.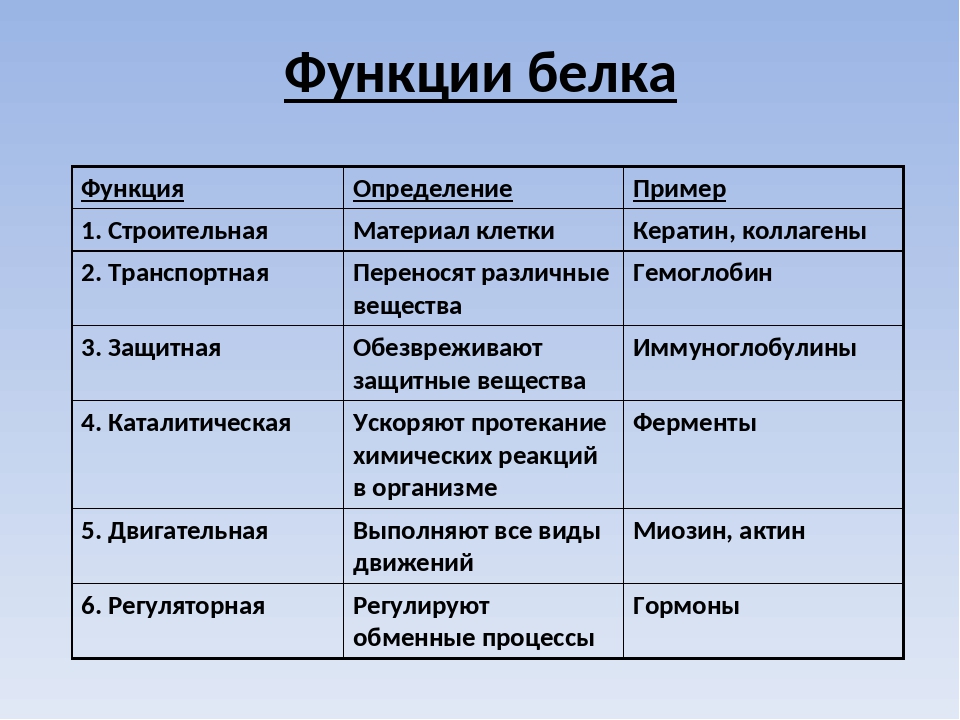 Абсолютно все биохимические процессы в организме протекают в присутствии катализаторов – ферментов. Все известные ферменты представляют собой белковые молекулы.
Абсолютно все биохимические процессы в организме протекают в присутствии катализаторов – ферментов. Все известные ферменты представляют собой белковые молекулы.
Белки – это очень мощные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой фермент.
В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами.
Например, фермент пепсин расщепляет белки в процессе пищеварения.
Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК.
Транспортная функция
Некоторые белки способны присоединять и переносить (транспортировать) различные вещества по крови от одного органа к другому и в пределах клетки.
Белки транспортируют липиды (липопротеиды), углеводы (гликопротеиды), ионы металлов (глобулины), кислород и углекислый газ (гемоглобин), некоторые витамины, гормоны и др.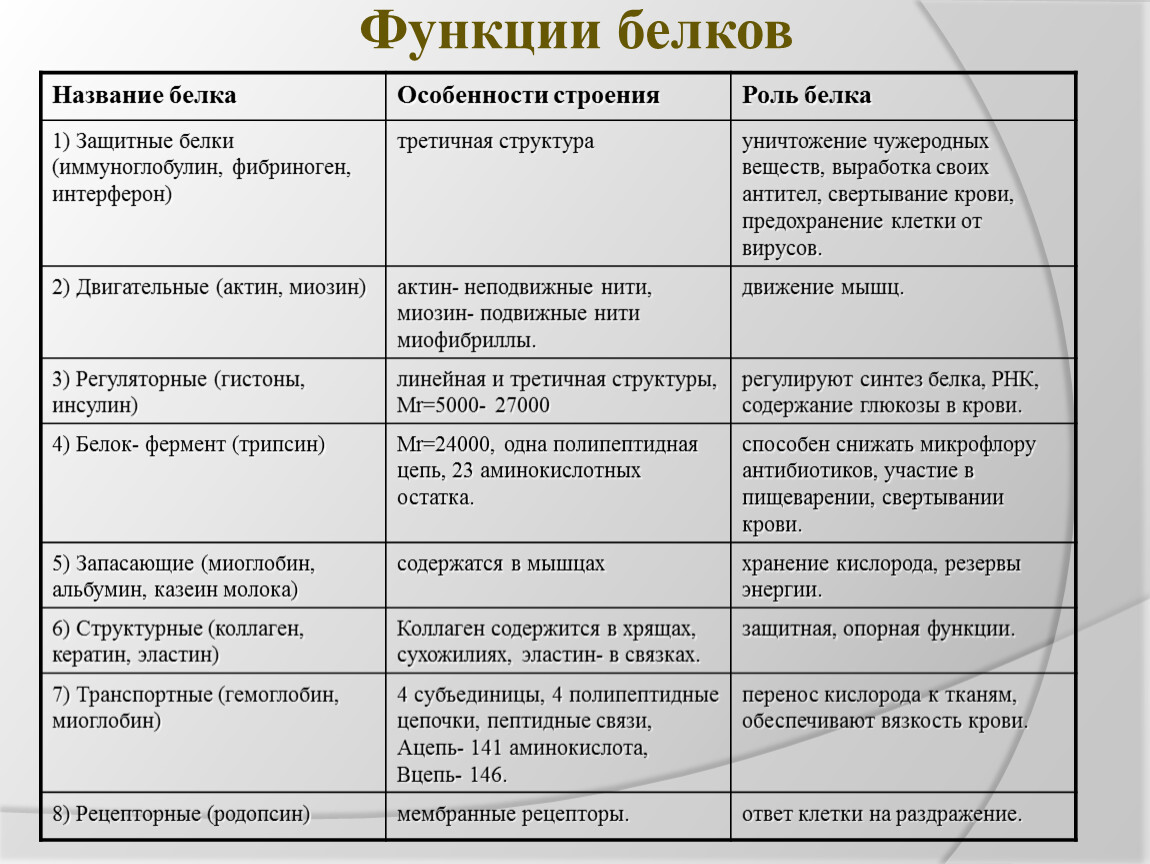 Например, альбумины крови транспортируют липиды и высшие жирные кислоты (ВЖК), лекарственные вещества, билирубин.
Например, альбумины крови транспортируют липиды и высшие жирные кислоты (ВЖК), лекарственные вещества, билирубин.
Белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин.
Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
Белок миоглобин запасает кислород в мышцах. Специфические белки-переносчики обеспечивают проникновение минеральных веществ и витаминов через мембраны клеток и субклеточных структур.
Защитная функция
Защитную функцию выполняют специфические белки (антитела — иммуноглобулины), которые вырабатываются иммунной системой организма. Они обеспечивают физическую, химическую и иммунную защиту организма путем связывания и обезвреживания веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Например, белок плазмы крови фибриноген участвует в свертывании крови (образовывает сгусток). Это защищает организм от потери крови при ранениях. Альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови.
Это защищает организм от потери крови при ранениях. Альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови.
Антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки. Интерфероны — универсальные противовирусные белки.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Сократительная (двигательная) функция
Важным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят изменение форм клеток и субклеточных частиц.
B результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
Структурная функция
Структурная функция — одна из важнейших функций белков. Белки играют большую роль в формировании всех клеточных структур.
Белки играют большую роль в формировании всех клеточных структур.
Белки – это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей, эластин стенок кровеносных сосудов, фиброин шелка и др.) выполняют почти исключительно структурную функцию. Кератин синтезируется кожей. Волосы и ногти – это производные кожи.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
Гормональная (регуляторная) функция
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Интересно знать! В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
Питательная (запасная) функция
Питательная функция осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
Рецепторная (сигнальная) функция
Некоторые белки (белки-рецепторы), встроенные в клеточную мембрану, способны изменять свою структуру под воздействием внешней среды. Так происходит прием сигналов извне и передача информации в клетку.
Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином.
Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
Энергетическая функция
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке (после их гидролиза).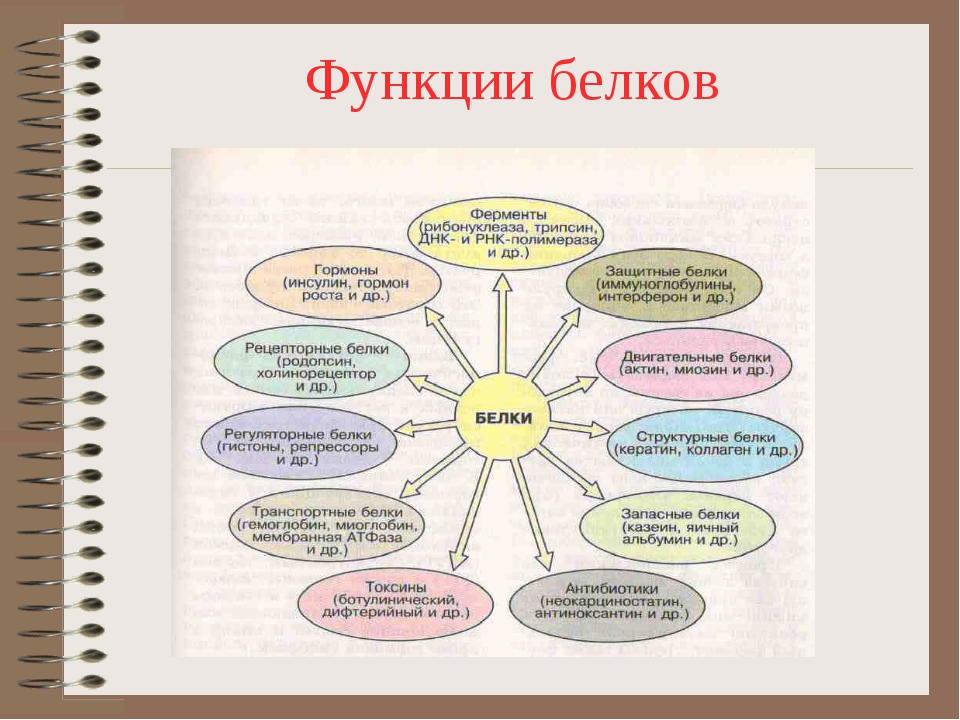 Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Источник: https://himija-online.ru/organicheskaya-ximiya/belki/funkcii-belkov-v-organizme.html
Функции белков в клетке:
- Строительная – обусловлена наличием белка во всех клеточных структурах. (Форма всех органелл клетки зависит от структуры белков).
- Каталитическая – реакции в клетке без ферментов идут медленно, так как концентрации исходных веществ (субстратов) в клетке малы. Обычно размеры молекул ферментов больше, чем размеры субстратов. Например, молекулярная масса каталазы, разрушающей пероксид водорода Н2О2, равна 250000, а самого пероксида – 34. Активный центр фермента – лишь небольшой участок его молекулы, на котором и происходит сама реакция.
 Фермент сравнивают с замком, а субстрат – с ключом, так как они должны точно подходить друг другу. Каждая реакция катализируется своим ферментом, однако существуют ферменты, которые катализируют несколько реакций.
Фермент сравнивают с замком, а субстрат – с ключом, так как они должны точно подходить друг другу. Каждая реакция катализируется своим ферментом, однако существуют ферменты, которые катализируют несколько реакций. - Двигательная – все движения обусловлены работой двигательных (сократительных) белков. В мышечных клетках при сокращении нитей более активна внедрённая между волокнами миозина за счёт энергии АТФ.
- Транспортная – белок гемоглобин транспортирует кислород и углекислый газ в организме. Через мембраны происходит транспорт различных веществ (сахар, ионы и др.).
- Защитная – осуществляется с помощью антител и антигенов. Антитела – белковые структуры β-лимфоцитов избирательно связывающиеся с чужеродными белками и клетками. Антигены – белки на поверхности клетки или в растворе, по которым Т-лимфоциты различают свои клетки и чужеродные. Убитые или ослабленные бактерии и вирусы (вакцины) несут свои антигены. При введении их в организм иммунная система вырабатывает антитела, что препятствует заболеванию.

- Энергетическая – белки являются источниками энергии. 1г белка при окислении даёт 17,6 кДж. Белок при разрушении образует СО2, Н2О, Nh4. Аммиак Nh4 ядовит, поэтому в печени он превращается в мочевину и мочевую кислоту.
- Регуляторная – пептидные гормоны, выделяемые железами внутренней секреции, изменяют обмен веществ в клетках определенных тканей.
Инсулин активирует захват молекулы глюкозы клеткой и синтез из неё гликогена. Без инсулина клетки голодают, так как не поглощают глюкозу, в результате чего развивается сахарный диабет. Т-лимфоциты передают с помощью белков информацию о чужеродных клетках β-лимфоцитам.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Свойства белков так же разнообразны, как и функции. Одни растворяются в воде и образуют коллоидные растворы, другие растворяются в разбавленных растворах солей. Некоторые нерастворимы, например, белки кожи.
ХИМИЧЕСКИЕ СВОЙСТВА
В радикалах АК-остатков белков содержатся различные функциональные группы, способные вступать в химические реакции:
- восстановления;
- этерификации;
- лкилирования;
- нитрования.

Будучи амфотерным соединением белок реагирует и с кислотами, и со щелочами.
Источник: https://megaobuchalka.ru/9/32081.html
Функции белков
Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Первые слова из определения Ф.Энгельсом понятия жизни «Жизнь есть способ существования белковых тел, …. » до сих пор, по прошествии полутора веков, не потеряли своей правильности и актуальности.
Структурная функция
Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности).
К данной функции можно отнести участие в создании органелл – рибосомы.
Ферментативная функция
Все ферменты являются белками. В то же время есть данные о существовании рибозимов, т.е. рибонуклеиновых кислот, обладающих каталитической активностью.
Гормональная функция
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками.
Рецепторная функция
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортная функция
Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (связывание кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
Транспорт веществ через мембраны осуществляют белки — Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры.
Резервная функция
В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
Сократительная функция
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Защитная функция
Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови — например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны.
Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны.
К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови.
Белковая буферная система участвует в поддержании кислотно-щелочного состояния.
Существуют белки, которые являются предметом особого изучения:
Монеллин – выделен из африканского растения, обладает очень сладким вкусом, не токсичен и не способствует ожирению.
Резилин – обладает почти идеальной эластичностью, составляет „шарниры» в местах прикрепления крыльев насекомых.
Белки со свойствами антифриза обнаружены у антарктических рыб, они предохраняют кровь от замерзания
Источник: https://biokhimija.ru/belki/belki.html
Функции белка в клетке: структура белковой молекулы, виды органического вещества
Каждая клетка живого организма функционирует за счет содержания необходимых компонентов. Они выполняют важную роль, стимулируют обменные процессы и способствуют обновлению.
Они выполняют важную роль, стимулируют обменные процессы и способствуют обновлению.
Особенно важны функции белка в клетке. Органические компоненты могут иметь разный состав, строение, некоторые отличия в жизненном цикле. Сегодня специалисты используют различные методы для исследования молекул и выявления их особенностей.
Что такое белки
Белки представляют собой органические соединения, имеющие различный состав и выполняющие важные функции в организме всех живых существ. Существует несколько видов этих молекул, каждый из которых имеет значение в процессе жизнедеятельности.
Состав
Органические вещества являются высокомолекулярными, поэтому могут включать в свой состав различные аминокислоты и другие соединения. Набор важных компонентов в каждой молекуле закладывается генетическим кодом животного или человека.
Основные компоненты каждой молекулы:
- углерод;
- кислород;
- азот;
- водород;
- сера.
Первый компонент обнаруживается в белке в наибольшем количестве, последний — не более 5 % от состава.
История открытия
Первый белок был получен необычным способом. Его выделили из пшеничной муки в виде клейковины. Произошло открытие в 1728 году, сделал его Якопо Беккари, итальянец. В качестве отдельного биологического класса молекулы белка были выделены в XVIII веке после обнародования работ французского ученого и химика Антуана де Фуркруа.
Другие ученые одновременно с французом отметили, что молекулы имеют свойство коагулировать (объединяться) под воздействием некоторых кислот или в процессе нагревания.
На тот момент ученые смогли изучить только альбумин, фибрин и глютен.
Только через 100 лет, в XIX веке, другие исследователи, изучив состав простых белков, отметили, что при нагревании происходит выделение аминокислот. Это помогло сделать вывод, что молекулы включают в себя довольно большое количество важных и разных аминокислот, а состав каждой из них индивидуален.
В 1836 году Мульдер предложил первую структурную формулу белков, основанную на теории радикалов.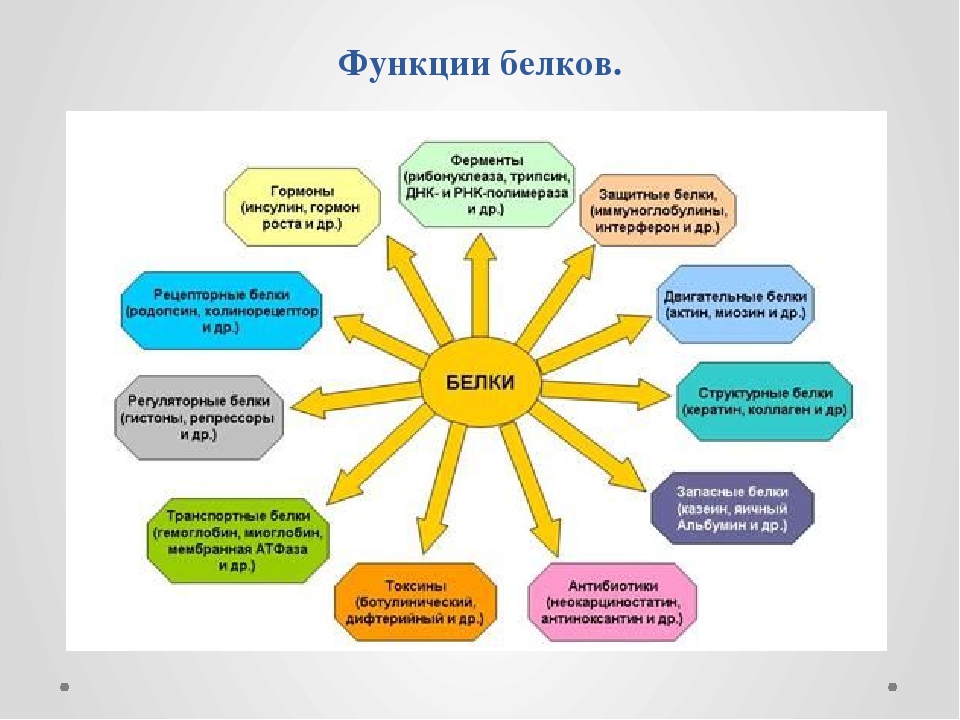 Он и еще несколько ученых вывели формулу протеинов, что в переводе с греческого означает «первый».
Он и еще несколько ученых вывели формулу протеинов, что в переводе с греческого означает «первый».
Мульдер также определил почти точную молекулярную массу наиболее простого белка, равную 131 дальтону. Дальтон — единица измерения молекул, называемая еще атомной массой или углеродной единицей.
Позже ученые выявили, что молекулярная масса может быть различной и зависит от состава и структуры органического соединения. В 1880-х годах русский ученый Данилевский изучил пептидные группы и доказал их существование в белковой молекуле. К этому времени большинство аминокислот уже были изучены.
В 1894 году немецкий ученый и физиолог Альбрехт Коссель рассказал о своем предположении. Он считал, что именно аминокислоты являются основными структурными элементами белковой молекулы.
Его теория была подтверждена в начале ХХ века химиком из Германии Эмилем Фишером. Ученый в ходе своего эксперимента доказал, что каждая молекула содержит около 20 аминокислот.
Важность белка в живом организме была признана только в 1926 году благодаря эксперименту американца Джеймса Самнера. После этого начинается активное изучение структур молекулы, выделяются различные виды. В 60—80-ых годах ХХ века исследования продолжаются.
После этого начинается активное изучение структур молекулы, выделяются различные виды. В 60—80-ых годах ХХ века исследования продолжаются.
К 2012 году в базе данных насчитывалось около 87 тысяч структур. Сегодня методы изучения молекулы усовершенствованы, поэтому работа в этом направлении продолжается.
Строение
Белок считается макромолекулой, поскольку имеет большой размер и множество составляющих. В строении белков присутствуют разные аминокислоты или их остатки, они чередуются с полипептидными цепями.
В молекулу могут входить следующие аминокислоты:
- глицин;
- аланин;
- изолейцин;
- серин;
- лейцин;
- валин;
- треонин.
Эти встречаются в составе наиболее часто, сочетаются с пептидными цепями и аминокислотными остатками.
Классификация
Существуют несколько классификаций белков в зависимости от состава, строения, формы, растворимости в воде. Чаще всего молекулы делят на простые и сложные с учетом строения.
К простым относятся следующие:
- Альбумины — жизненно необходимы животным и человеку. Содержатся во многих продуктах, хорошо растворяются в воде, соленых жидкостях под воздействием кислот. Являются основной составляющей мышечных тканей в организме, формируют резерв на случай длительного голодания.
- Глобулины в воде слабо растворяются. Являются составляющими крови, мышечной ткани, оказывают влияние на свертываемость, выполняют защитную функцию.
- Протамины — низкомолекулярные белки, хорошо растворимые в воде. В организме выполняют структурную функцию, являются строительным материалом для мышц и других тканей.
- Гистоны — низкомолекулярные вещества, содержат большое количество лизина и аргинина. Принимают участие в формировании структуры молекул ДНК, предупреждают передачу генетической информации к РНК.
- Проламины — растительные белки с невысокой пищевой ценностью.
 Создают в организме резерв.
Создают в организме резерв. - Глютелины — растительные вещества, принимающие участие в формировании клеточной оболочки. Денатурация происходит в солевых растворах, в воде они не растворимы.
- Протеноиды — животные белки, богатые аминокислотами, не растворяются в воде, кислотах, щелочах, солевых жидкостях. Входят в состав костной, хрящевой ткани, связок, сухожилий.
Среди сложных белков выделяют фосфопротеины, гликопротеины, нуклеопротеины, липопротеины, хромопротеины, металлопротеины.
Каждый вид имеет свои особенности:
- Фосфопротеины — сложные белки, содержащие остатки фосфорной кислоты, связывающиеся с пептидными цепями. Выполняют в организме защитную, строительную, энергетическую функции.
- Гликопротеины — сложные органические компоненты, содержащие углеводный остаток. Принимают участие в выработке ферментов, выполняют защитную и секреторную функции, стимулируют образование важных для жизнедеятельности гормонов.
- Нуклеопротеины состоят из нуклеиновых кислот (нуклеотиды), наиболее распространенные РНК и ДНК. Содержатся в мембранах клетки, формируют генетический код человека.
- Липопротеины содержат липиды (жиры), присутствуют в лимфе и плазме крови, не растворяются в воде. Выполняют транспортировочную функцию, переносят липиды по всему организму.
- Хромопротеины называют «цветными белками». В составе содержат окрашивающий компонент. Участвуют в транспортировке кислорода. Яркий представитель вида — гемоглобин.
- Металлопротеины содержат ионы металла в составе. Транспортируют металл в организме, создают его резерв.
Любой из видов играет важную роль в метаболических процессах.
Функции
Различные виды белков выполняют в организме важные функции. При отсутствии основных типов нарушаются все жизненно важные процессы.
Каталитическая
Катализ реакций в организме осуществляется благодаря наличию ферментов, являющихся белками по своему составу и строению. Ферменты помогают расщеплять сложные вещества на простые, облегчают их переработку.
Ферменты помогают расщеплять сложные вещества на простые, облегчают их переработку.
Благодаря этому возможно поступление полезных компонентов ко всем тканям, органам, регенерация клеток, осуществление нормального метаболизма.
Структурная
Осуществляется благодаря коллагену и эластину. Белки являются важным строительным элементом, стимулируют формирование костной ткани, мышц, хрящей, связок и сухожилий.
Выделяют 4 структуры белковой молекулы:
- Первичная структура представляет собой последовательность остатков аминокислот, чередующихся с полипептидной цепью. Встречается во многих тканях, на протяжении жизни организма не меняет строения.
- Вторичная структура — упорядочивание фрагментов полипептидной цепи, подверженное стабилизации за счет наличия водородных связей.
- Третичная структура — строение полипептидной цепи пространственного типа. При детальном рассмотрении можно увидеть, что строение напоминает вторичную структуру, но присутствуют гидрофобные взаимодействия.

- Четвертичная структура представляет собой белковое соединение, состоящее из нескольких пептидных цепей в одном комплексе.
Благодаря различной структуре белковых молекул осуществляется построение всех клеток и тканей в организме.
Защитная
Физическая защита осуществляется благодаря наличию в клетках и тканях коллагена, отвечающего за прочность и предотвращающего повреждения. Химическая защита осуществляется благодаря способности белков связывать токсины, выводить их из организма.
Иммунная защита возможна благодаря способности некоторых белков стимулировать образование лимфоцитов, уничтожать вирусы, патогенные микроорганизмы.
Сигнальная и регуляторная
Регуляция всех процессов в клетках осуществляется с участием белков, представленных ферментами. Часто компоненты связываются с другими веществами, стимулируют процессы регенерации, регулируют метаболизм.
Многие внутриклеточные белки осуществляют сигнальную функцию, помогают передавать информацию между тканями, клетками, органами. Обычно сигнальную функцию выполняют белки-гормоны.
Обычно сигнальную функцию выполняют белки-гормоны.
Транспортная
Транспортная функция осуществляется в основном за счет белка-гемоглобина. Он доставляет кислород ко всем тканям и клеткам, переправляет в легкие углекислый газ для выведения его наружу. Ученые нашли во всех живых организмах молекулы, напоминающие по строению гемоглобин.
Запасная и моторная
Запасная или резервная функция возможна благодаря наличию в клетке белков, содержащих аминокислоты. Они служат источником питания и энергии при недостаточном поступлении подобных компонентов с пищей.
Моторная или двигательная функция играет важную роль. Разные виды белковых молекул принимают участие в сокращении мышечных волокон, передвижении лейкоцитов и других клеток для обеспечения иммунной защиты.
Свойства
Белковые соединения обладают физическими и химическими свойствами, отличающими их от других молекул.
Физические
Физические свойства позволяют выявить белок среди других соединений в живом организме.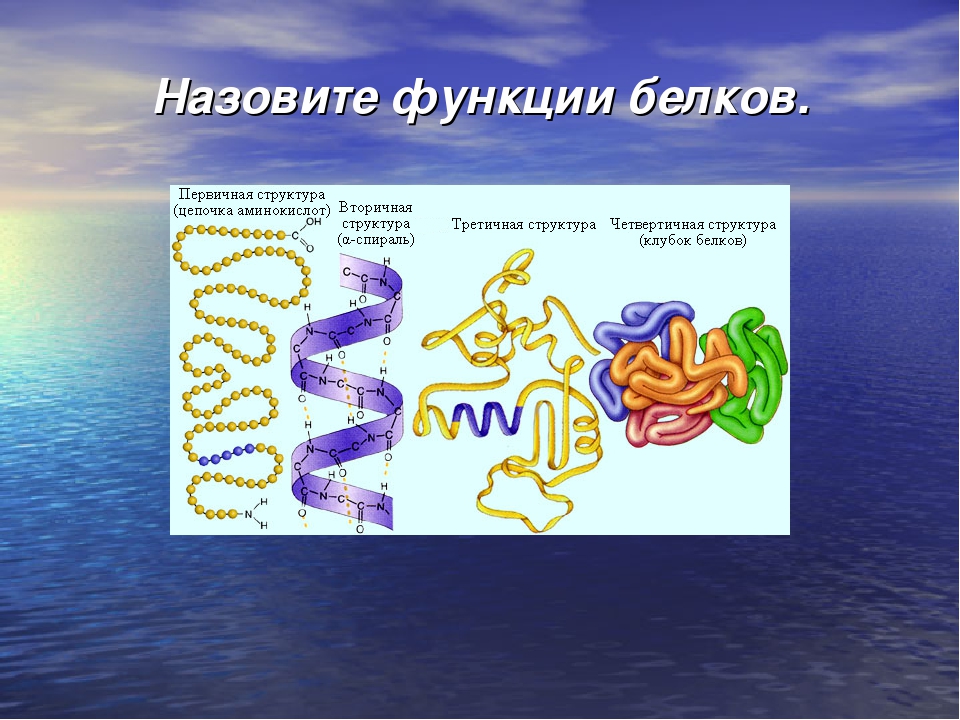
Основными будут следующие:
- вес молекулы может достигать 1 млн дальтон;
- при попадании в водный раствор происходит формирование коллоидной системы;
- в зависимости от кислотности среды отличается заряд белкового соединения;
- самый крупный сегодня белок — титин.
Молекулярная масса у каждого соединения отличается, определяется разными способами.
Химические
При определенных условиях белковые соединения проявляют свои химические свойства.
Наиболее частыми реакциями будут следующие:
- Амфотерность — способность белков в зависимости от условий проявлять основные свойства и кислотные.
- Денатурация — изменение биологической активности соединения в результате потери вторичной, третичной или четвертичной структуры. Может быть механической, физической и химической, обратимой и необратимой, полной и неполной.
Химические свойства белков изучаются различными методами для выявления особенностей молекул.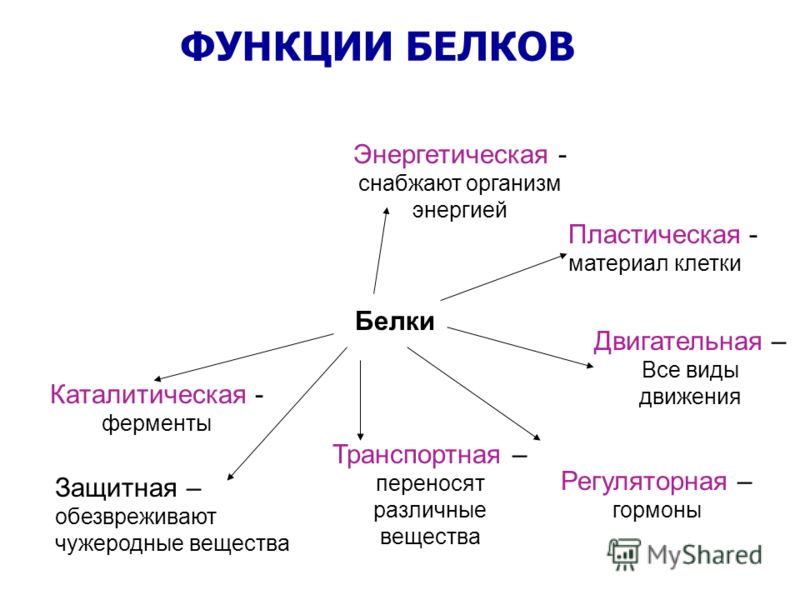
Этапы синтеза белка
Биосинтез белка представляет собой процесс, состоящий из нескольких этапов, в ходе которых происходит созревание соединений. Протекает во всех живых организмах.
Основные этапы синтеза:
- Инициация. Образование аминоацеладинелата одновременно с активацией аминокислоты в присутствии АТФ и специфического фермента.
- Элонгация. Присоединение образовавшейся кислоты к специфичной тРНК с последующим освобождением аденозинмнофосфата.
- Терминация. Связывание соединения аминокислоты и тРНК с рибосомами.
- Трансляция. Включение аминокислоты в белковую молекулу с одновременным высвобождением тРНК.
У разных живых организмов процесс может проходить с разной скоростью, но последовательность этапов неизменна.
Методы изучения
Сегодня исследование белковых соединений продолжается в современных лабораториях.
Популярные методы изучения:
- Метод клеточной и молекулярной биологии используется с целью фиксирования локализации молекул в клетках, наблюдения за синтезом веществ.
 Для стимулирования реакции используются антитела. Наблюдение проводится посредством микроскопа. На предметное стекло помещается подготовленный белок и антитела, проводится эксперимент, результаты фиксируются.
Для стимулирования реакции используются антитела. Наблюдение проводится посредством микроскопа. На предметное стекло помещается подготовленный белок и антитела, проводится эксперимент, результаты фиксируются. - Биохимический метод предполагает изучение чистого белка, избавленного от дополнительных компонентов. Для дальнейшего изучения используют центрифугирование, высаливание, электрофокусирование.
- Протеомика — наука, изучающая совокупность белковых соединений в составе одной клетки. Для исследования используются специальные приборы, соединения, белковые микрочипы, позволяющие изучать сразу несколько молекул в клетке.
Благодаря новейшим современным методикам возможно прогрессирование науки в области исследования живых клеток и их составляющих.
Биологическое значение
Биологическое значение органических соединений объясняется множеством полезных функций. Компоненты принимают участие во всех жизненно важных процессах в организме, являются незаменимым строительным материалом, стимулируют выработку лимфоцитов, отвечающих за стойкость иммунной системы животного или человека.
При отсутствии сложных белков невозможно образование гормонов, новых клеток и регенерация тканей. Без белковых молекул в организме не осуществляется процесс дыхания, поскольку невозможен перенос кислорода и выведение углекислого газа.
Особенно важное значение имеют белки для человека, поскольку некоторые виды помогают связывать и выводить из организма токсины, вредные соединения. Длительное отсутствие в питании белка приводит к постепенному истощению и смерти организма.
Интересные факты
Некоторые интересные факты о белковых соединениях доказывают важность их в живых организмах.
Наиболее интересными считаются следующие:
- Около 50 % от сухого веса организма приходится на белки.
- Вирусы почти полностью состоят из этого компонента, некоторые на 95 %.
- Более 30 % органических веществ у человека концентрируется в мышцах.
- Клетки головного мозга состоят преимущественно из белковых молекул.
- Волосы на теле и голове человека представлены ороговевшими клетками, состоящими из белковых молекул.

- Недостаток вещества в пище отрицательно отражается на всех процессах.
- В более чем 50 % случаев аллергия на белок у человека проявляется в детском возрасте.
- Человеку одинаково необходим растительный и животный белок.
- Детям белковые соединения необходимы в больших количествах, чем взрослым.
- Яичный белок считается наиболее качественным и легко усваивается.
Белки в организме — незаменимый и необходимый ежедневно компонент, позволяющий обеспечивать здоровье и правильное функционирование клеток.
Источник: https://obrazovanie.guru/nauka/biologiya/funktsii-belka.html
Основные биологические функции белков
Белки входят в состав каждой клетки и составляют около 50% ее сухой массы. Они играют ключевую роль в обмене веществ, реализуют важнейшие биологические функции, лежащие в основе жизнедеятельности всех организмов.
Среди большого разнообразия функций, выполняемых белками, первостепенное значение имеют структурная, или пластическая, и каталитическая. Это универсальные функции, поскольку они присущи всем живым организмам.
Это универсальные функции, поскольку они присущи всем живым организмам.
Структурные белки формируют каркас внутриклеточных органелл и внеклеточных структур, а также участвуют в стабилизации клеточных мембран. Такие структурные белки, как коллаген и эластин составляют основу соединительной и костной тканей высших животных и человека. Структурными белками, в частности, являются кератины кожи, волос, ногтей, шерсти, когтей, рогов, копыт, перьев, клювов, а также фиброин шелка, паутины.
Каталитически активными белками являются ферменты. Они ускоряют химические реакции, обеспечивая тем самым необходимые скорости протекания обменных процессов в клетке.
Многие белки, присущие отдельным живым организмам, выполняют специфические функции, среди которых наиболее важными являются транспортная, регуляторная, защитная, рецепторная, сократительная, запасная и некоторые др.
Транспортные белки переносят различные молекулы и ионы внутри организма. Например: гемоглобин — кислород от легких к тканям; миоглобин — кислород внутри клеток; сывороточный альбумин с током крови — жирные кислоты, а также ионы некоторых металлов. Ту же функцию выполняют специфические белки, транспортирующие различные вещества через клеточные мембраны.
Ту же функцию выполняют специфические белки, транспортирующие различные вещества через клеточные мембраны.
Регуляторные белки участвуют в регуляции обмена веществ как внутри клеток, так и в целом организме. Например, такие сложные процессы, как биосинтез белков и нуклеиновых кислот, протекают под строгим «контролем» множества регуляторных белков. Специфические белковые ингибиторы регулируют активность многих ферментов.
Защитные белки формируют защитную систему живых организмов. Например, иммуноглобулины (антитела) и интерфероны предохраняют организм от проникновения в его внутреннюю среду вирусов, бактерий, чужеродных соединений, клеток и тканей. Белки свертывающей системы крови — фибриноген, тромбин — препятствуют потере крови при повреждениях кровеносных сосудов.
Рецепторные белки воспринимают сигналы, поступающие из внешней среды, и воздействуют на внутриклеточные процессы. Например, белки-рецепторы, сосредоточенные на поверхности клеточных мембран, избирательно взаимодействуют с регуляторными молекулами (например, гормонами).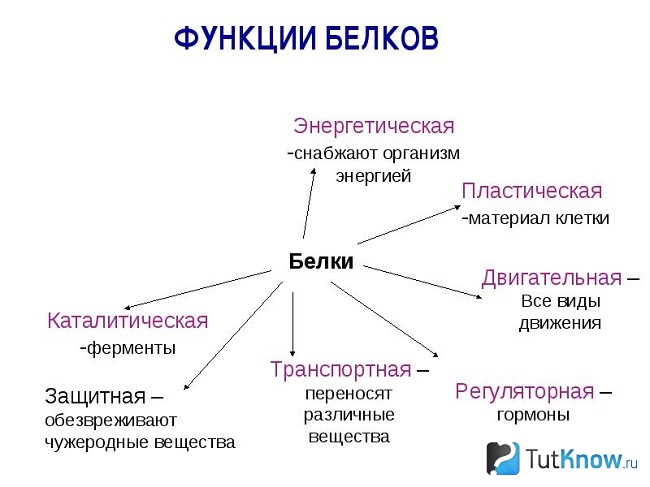
Рецепторными белками являются родопсин, участвующий в зрительном акте, вкусовой сладкочувствительный и обонятельный белки.
Сократительные белки способны преобразовывать свободную химическую энергию в механическую работу. Например, белки мышц миозин и актин обеспечивают мышечное сокращение.
Запасные белки представляют собой резервный материал, предназначенный для питания развивающихся клеток. Запасными белками являются яичный альбумин, глиадин пшеницы,
Казеин кукурузы, казеин молока и многие другие. Запасные белки — существенный источник пищевого белка для человека.
Некоторые организмы вырабатывают токсические белки. Таковы яды змей, дифтерийный токсин, рицин семян клещевины, лектины семян бобовых и др.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
4. Функции белков
1. Биологическая
Биологическая
химия —
наука о химических основах жизнедеятельности,
т.е. о химической структуре и превращениях
молекул, составляющих живое. «Минимальная
клетка» т.е. клетка, содержащая набор
структур, обязательных для обмена
веществ, энергии и для самовоспроизведения.
К таким структурам относятся следующие
образования (субклеточные — с позиций
морфологии и над молекулярные — с
позиций химии):
мембрана,
отграничивающая клетку от окружения и
разделяющая ее внутреннее пространство
на функционально различающиеся отсеки;
мигохондрии
— образования,
высвобождающие и запасающие энергию
химических связей;
ядро,
где локализованы молекулы-носители
генетической информации;
рибосомы,
где генетическая информация реализуется
путем синтеза биологически активных
молекул в согласии с «инструкцией»,
доставляемой сюда из ядра;
лизосомы,
переваривающие
сложные питательные вещества и посторонние
частицы;
аппарат
Гольджи,
участвующий в биогенезе мембран и
яизосом, в синтезе гликолипидов и
фосфолипидов,
Благодаря разработке
методов выделения субклеточных структур
стало возможным изучение их химического
состава. Оказалось, что все многообразие
Оказалось, что все многообразие
молекул, обнаруживаемых в этих частицах
из разных по происхождению Клеток, можно
свести к небольшому числу классов’ 1)
макромолекулы (белки, углеводы, липиды),
2) низкомолекулярные биологически
активные органические соединения;?)
минеральные вещества.
Все это позволяет
конкретизировать задачи биохимии,
необходимость изучать
1) строение и функции
молекул живого;
2) структуру и
функции над молекулярных образований;
3) механизмы
поступления во внутреннюю среду
пластических и биологически активных
материалов;
4) механизмы
высвобождения, накопления и использования
энергии;
5) механизмы
воспроизведения.
Исходя
из наших прагматических позиций,
определяемых темой книги, знание основ
биохимии необходимо медику для того,
чтобы освоить прикладной раздел
—клиническую биохимию.
Предмет
клинической биохимии — изучение
нарушений химических процессов
жизнедеятельности и методов выявления
этих нарушений для их устранения или
исправлении. дел биохимии, необходимый
дел биохимии, необходимый
врачу, изучает нарушения химических
процессов жизнедеятельности и методы
их выявления
с тем, чтобы определить пути исправления
или устранения эгих нарушений Изучение
отклонений л базируется на представлениях
о есчесиюнном течении процессов. «
Согласно приведенному
выше определению живому организму
свойственны следующие функции’
1.
Извлечение из внешней среды и превращение
в приемлемые для организма формы
химических соединений — материала для
возобновления структур.
2. Химическое
преобразование оказавшихся во внутренней
среде соединений (расщепление и синтез,
трансформация) и выведение во внешнюю
среду продуктов, которые более не
используются (конечные продукты).
3. Высвобождение
.энергии, заключенной в поступающих
извне соединениях, ее -запасание в
приемлемой для организма форме и
использование в процессах жизнедеятельности.
Реализуются
эти функции в общем виде следующим
образом. 1. Исючниками материален для
1. Исючниками материален для
Возобновления с’|рукгур и энергообеспечения
служат пищевые продукты, в составе
которых организм получает углеводы,
липиды, белки, некоторые биологически
активные соединения (например, витамины)
и минеральные вещества Белки, углеводы
и липиды в усваиваемые формы преобразуются
в пищевартельном тракте при участии
активных компонентов, которые выделяются
ссо’1 не; с»; кующими железами желудка,
кишечника, поджелудочной железы и
поступают с желчью. Преобразование
макромолекул заключается в их
деполимеризации, т.е. в разрушении
полимеров до мономеров (белков — до
аминокислот, углеводов — до простых
Сахаров, липидов — до свободных жирных
кислот и глицерола). Низкомолекулярные
биологически
активные и минеральные вещества
всасываются во внутреннюю среду
преимущественно без какой-либо
предварительной химической трансформации.
2. Химические соединения с током крови
поступают в органы (ткани), где включаются
в процессы синтеза (образование
специфических для тканей организма
человека белков, углеводов, липидов и
регуляторных соединений), процессы
окислительно-восстановительного
распада, в ходе которого высвобождается
энергия химических связей. Промежуточные
Промежуточные
продукты используются в синтезе
биологически активных веществ или
выполняют регуляторные функции.
3. Высвобождение
энергии в ходе окислительно-восстановительного
распада сопряжено с ее запасанием в
форме универсальных носителей. Они
используются как источники энергии для
выполнения всех видов работы, свойственных
живому.
Все
перечисленные процессы протекают в
организме повсеместно, однако можно
отметить и локализацию их в отдельных
органах и тканях. Графическое изображение
процессов — объекта биологической
химии
В задачу последующих
разделов книги входит описание структуры
биомолекул, детализация превращений,
которым они подвергаются в процессе
переваривания, описание механизмов
всасывания и транспортировки мономе-ров
кровью и лимфой, расшифровка
последовательности реакций, обеспечивающих
синтез специфических соединений,
окислительный распад белков, липидов
и углеводов. Таким образом, схема получает
конкретное содержание в объеме,
достаточном для понимания проблем
клинической биохимии.
АТФ ———————————АДФ
+ Н3Ро4 + Энергия
3.Молекула
белка —
неразветвляющийся (линейный) полимер,
минимальная структурная единица которого
(мономер) представлена аминокислотой.
Аминокислоты в молекуле белка
соединены карбамидной (пептидной)
связью.
Белок может включать
несколько полипептидных цепей, соединение
которых между собой происходит за
счет непептидных связей. В этом случае
молекула имеет характер сополимера.
Следовательно, белковая молекула —
линейный полимер или сополимер,
образованный из аминокислот, соединенных
пептидной связью.
Итак,
полипептидная цепь включает в себя
соединенные пептидной связью аминокислоты
У одной из аминокислот, занимающей
крайнее положение в цепи, остается
свободной аминогруппа (C-концевая
аминокислота и соответственно
N-концевой полюс полипептида), у другой,
находящейся на противоположном
конце, — свободный карбоксил (С-концевая
аминокислота и соответственно С-полюс
полипептида)Аминокислотным остаткам
в составе полипептида (белка), не имеющим
свободного карбоксила, придано окончание
«ил», те представленная пептид-ная
цепочка именуется
фенилаланил-аланил-аспарагинил-глутаминил-гис-тидин
При изображении структурных формул
пептидов или белков принято располагать
слева N-концевую,
справа С-концевую аминокислоту
Первичная
структура
— понятие, обозначающее последовательность
аминокислотных остатков в белке
Пептидная связь — основной вид связи,
определяющий первичную структуру
Возможно и присутствие дисульфидных
связей между двумя остатками цистеина
в одной полипептидной цепи с образованием
цистина Такая же связь (дисульфидный
мостик) может возникать и между остатками
цистеина, принадлежащими разным
полипептидным цепям в белковой молекуле,
сополимерном образовании Изучение
первичной структуры требует следующих
операций 1) разделение сополимеров-полипептидов
путем разрыва дисуль-фидных связей; 2)
разделение цепей и гидролиз до
свободных аминокислот; 3) определение
аминокислотного состава; 4) определение
последовательности аминокислот.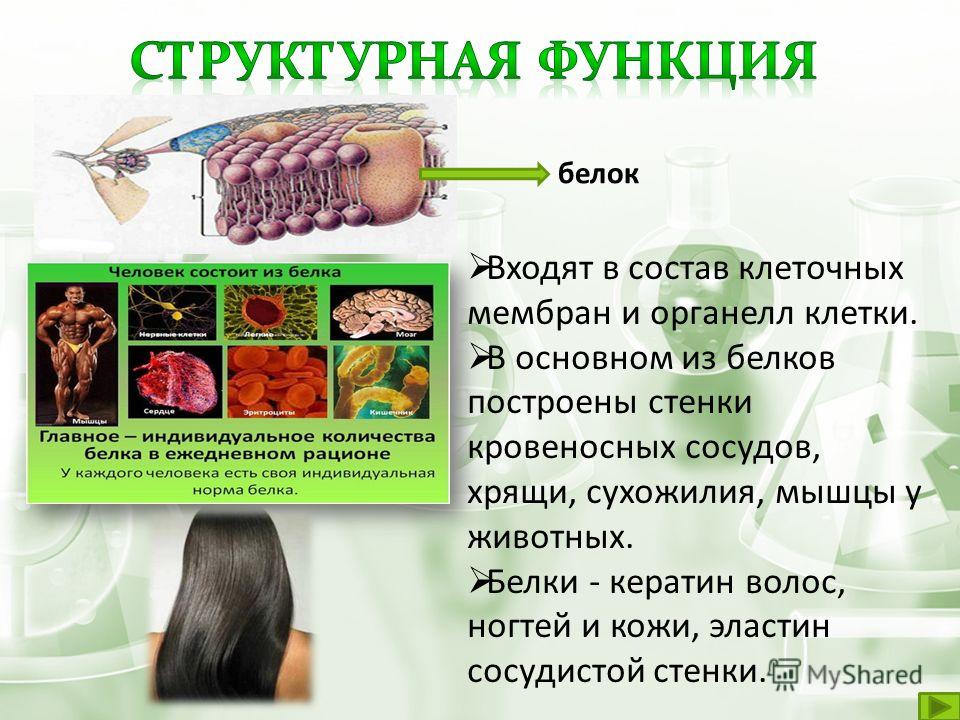 Так,
Так,
если молекула содержит только 10 видов
аминокислот и каждый из них повторяется
по 2 раза (всего 20 остатков), то число
возможных вариантов белков равно 1020.
Вторичная
структура
характеризует форму
белковой
цепи в пространстве. Эта форма изменяется
в зависимости от набора аминокислот
и их последовательности в полипеп-тидной
цепи. Различают два основных варианта
вторичной структуры -спираль
и -
конфигурацию Форму -спирали
имеют многие белки. Представить ее
можно как правильную спираль,
образованную на поверхности цилиндра.
Шаг спирали, т.е. расстояние между
витками, — 5,4 А виток образуется 3,6
аминокислотных остатка, т.е. 36
аминокислотных остатков образуют
10 витков спирали. Устойчивость
спиралевидной конфигурации
определяется многочисленными водородными
связями между СО- и NН-группами
пептидных связей Конфигурация
свойственна небольшому числу белков,
в молекуле которых есть более одной
полипептидной цепи. По форме эту
По форме эту
структуру можно сравнивать с мехами
гармошки (складчатая структура). В
отличие от а-цепей здесь водородные
связи образуются между СО- и NН-группами
пептидных связей двух полипептидных
цепей, расположенных параллельно, но
таким образом, что N-концевому
полюсу одной цепи соответствует
С-концевой полюс другой.
Электростатические
и водородные взаимодействия участвуют
в стабилизации вторичной структуры,
однако в меньшей степени, чем водородные.
Третичная
структура
представляет собой более высокий
порядок организации белковой молекулы
в пространстве. Возникает благодаря
изгибам полипептидной цепи (цепей)
в участках, содержащих остатки пролина,
дикарбоновых и диаминовых кислот.
Представить эту конфигурацию можно
как спираль,
образованную на
цилиндре, ось которого периодически
меняет направление, что приводит к
образованию клубка.
Характер третичной
организации устанавливают с помощью
рентгенос-труктурного анализа. Наиболее
Наиболее
полно изучена третичная структура
гемоглобина (рис.5).
В этой структуре
гидрофильные (полярные) группы
располагаются на поверхности молекул,
гидрофобные — сближены между собой в
ее внутренних областях. Они выполняют
важную роль в поддержании третичной
структуры, это важнейший вид взаимодействий.
Наряду с гидрофобными в сохранении
третичной структуры участвуют водородные
и электростатические взаимодействия.
Белки по форме
клубка делят на две группы: близкие к
шару (глобуле) — глобулярные, близкие
к вытянутому эллипсу — фибриллярные
(нитевидные).
Четвертичная
структура.
Многие белки образуются путем объединения
одинаковых или неодинаковых молекул
(субъединиц) в более сложное образование
— молекулу с четвертичным уровнем
организации (четвертичной структурой).
Субъединицы соединяются слабыми
связями, которые легко диссоциируют
под действием кислых и солевых растворов,
мочевины, детер-
гентов с
высвобождением субъединиц. Классический
Классический
пример молекулы с четвертичной структурой
— фермент лактатдегидрогеназа, который
содержит четыре субъединицы (одинаковые
или двух типов).
Интересен
белок оболочки вируса табачной мозаики
— он состоит из 2130 субъединиц (рис.6).Форма
молекул характеризуется соотношением
осей белковой молекулы, которая
пространственно представляет собой
эллипсоид вращения. Для большей
части
глобулярных белков
это соотношение составляет от 2 до 30,
для фибриллярных — больше 30.
Каталитическая
или ферментативная.
Все химические превращения в живом
организме протекают при участии
катализаторов. Биологические катализаторы
(ферменты) по химической природе белки,
следовательно, катализируют в
организме химические превращения, из
которых складывается обмен веществ.
Транспортная
функция. Белки транспортируют или
переносят биологически значимые
соединения в организме. В одних случаях
транспортируемое соединение сорбируется
белковой молекулой.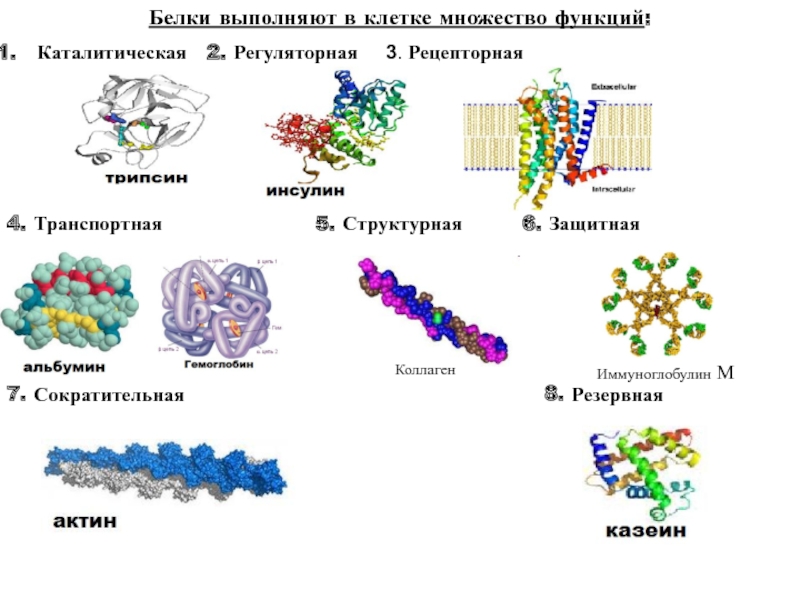 Это защищает от
Это защищает от
разрушения и обеспечивает перенос с
током крови (например, транспорт
альбумином некоторых гормонов,
витаминов, лекарственных соединений).
Этот вид транспорта называют пассивным.
В других случаях пассивный транспорт
сочетается с депонированием (запасанием)
тех или иных соединений (например,
трансфер-рин плазмы крови не только
переносит железо, но и запасает
(накапливает) его при избытке). С помощью
мембранных белков переносятся соединения
из зон с низкой концентрацией в зону с
высокой. Это сопряжено с заметным
потреблением энергии и называется
активным транспортом (например, транспорт
ионов натрия из цитоплазмы и калия в
цитоплазму).
Механохимическая
функция —
способность некоторых белков изменять
конформацию, уменьшать длинник молекулы,
т.е. укорачивать или сокращать молекулы.
Такие белки называют сократительными
(некоторые мышечные белки). Название
вытекает из того, что сократительные
белки выполняют механическую работу
за счет энергии химических связей.
Структурная
(пластическая)
функция выполняется белками — элементами
клеточных мембран (эти белки могут
обнаруживать каталитическую или
транспортную активность), но главным
образом фибриллярными белками. Последние
в составе соединительных тканей
обеспечивают их прочность и эластичность’
кератин шерсти и волос, коллагены
сухожилий, кожи, хрящей, стенок сосудов
и связывающих тканей.
Гормональная
функция
(функция управления) реализуется
гормонами пептидной или белковой
природы. Они, влияя на продукцию или
активность белков-ферментов, изменяют
скорость катализируемых ими химических
реакций, т.е. в конечном счете управляют
обменными процессами.
Защитная
функция
белков реализуется антителами,
интерферонами и фибриногеном.
Антитела —
соединения белковой природы, синтез
которых индуцируется в процессе
иммунного ответа — реакции организма
на проникновение во внутреннюю среду
посторонних белков или других антигенных
компонентов (например, высокомолекулярных
углеводов). Антитела, соединяясь с
Антитела, соединяясь с
антигеном, образуют нерастворимый
комплекс, делая антиген безопасным для
организма.
Интерфероны —
гликопротеины, синтезирующиеся клеткой
после проникновения в нее вируса. В
отличие от антител интерфероны
взаимодействуют не с антигеном, а
вызывают образование внутриклеточных
ферментов Они блокируют синтез вирусных
белков, препятствуя копированию вирусной
информации. Это приостанавливает
размножение вируса.
Фибриноген —
растворимый белок плазмы, который на
последней стадии процесса свертывания
крови трансформируется в фибрин —
нерастворимый белок. Фибрин образует
каркас тромба, ограничивающего
кровопотерю
Плазмин — белок
плазмы крови, катализирующий расщепление
фибрина. Это обеспечивает восстановление
проходимости сосуда, закупоренного
фибриновым сгустком.
Энергетическая
функция белков
обеспечивается за счет части аминокислот,
высвобождающихся при расщеплении белка
в тканях В процессе окислительно-восстановительного
распада аминокислоты высвобождают
энергию и синтезируют энергоноситель
— АТФ. На долю белка приходится около
На долю белка приходится около
18% энергопотребления у человека.
Молекула белка —
линейный полимер, или сополимер,
структурная единица которого —
соединенные пептидными связями
аминокислоты — характеризуется сложной
пространственной организацией,
включающей три или четыре уровня
Набор аминокислот и их последовательность
лежат в основе многообразия и уникальности
белковых молекул, в основе их
физико-химических свойств. Они же
определяют и множественность функций,
свойственных белкам в живом организме.
6.
Классификация
белков
Систематизировать
белки по структурно-функциональным
параметрам невозможно, так как
первичные структуры известны лишь для
части из них.
По составу белки
можно разделить на простые и сложные,
первые содержат в молекуле только
аминокислоты, вторые — еще и другие
структуры (добавочные или простетические
группы).
Простые белки по
растворимости и пространственному
строению разделяют на глобулярные
и фибриллярные.
Глобулярные белки
отличаются шарообразной формой молекулы
(эллипсоид вращения), растворимы в
воде и в разбавленных солевых растворах.
Хорошая растворимость объясняется
локализацией на поверхности глобулы
заряженных аминокислотных остатков,
окруженных гидратной оболочкой, что
обеспечивает хороший контакт с
растворителем. К этой группе относятся
все ферменты и большинство других
биологически активных белков, исключая
структурные.
Среди глобулярных
белков можно выделить’
1) альбумины —
растворимы в воде в широком интервале
рН (от 4 до 8,5), осаждаются 70-100%-ным
раствором сульфата аммония;
2) полифункциональные
глобулины с большей молекулярной
массой, труднее растворимы в воде,
растворимы в солевых растворах, часто
содержат углеводную часть;
3) гистоны —
низкомолекулярные белки с высоким
содержанием в молекуле остатков аргинина
и лизина, что обусловливает их основные
свойства;
4) протамины
отличаются еще более высоким содержанием
аргинина (до 85%), как и гистоны, образуют
устойчивые ассоциаты с нуклеиновыми
кислотами, выступают как регуляторные
и репрессорные белки — составная часть
нуклеопротеинов;
5) проламины
характеризуются высоким содержанием
глутаминовой кислоты (30-45%) и пролина
(до 15%), нерастворимы в воде, растворяются
в 50-90%—яом этаноле;
6) глутелины
содержат около 45% глутаминовой кислоты,
как и проламины, чаще содержатся в
белках злаков.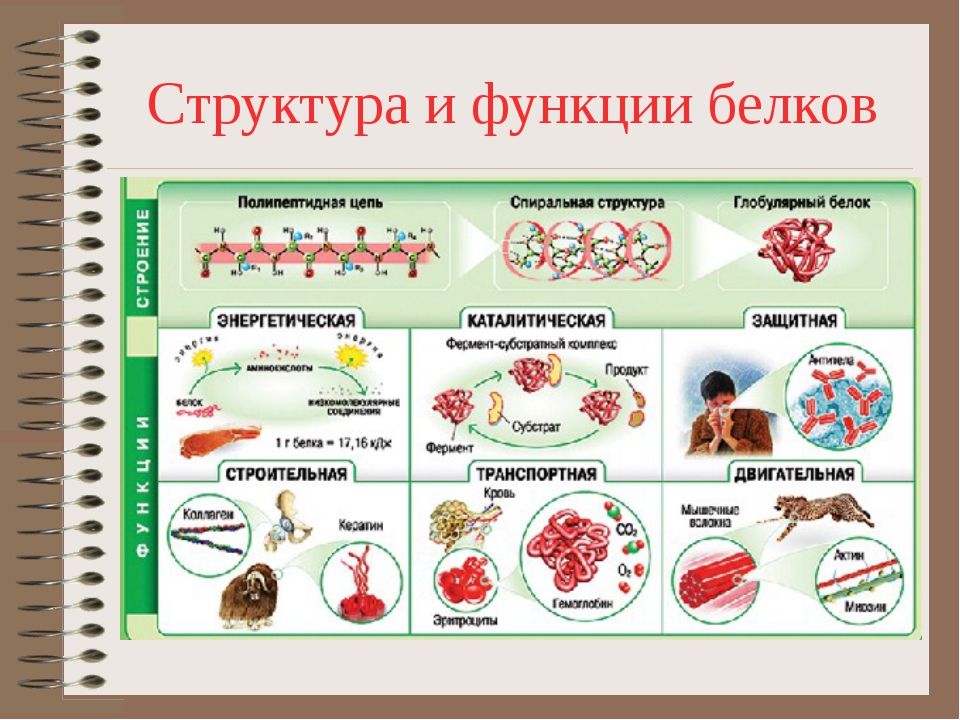
Фибриллярные
белки характеризуются волокнистой
структурой, практически не растворимы
в воде и солевых растворах. Полипептидные
цепи в молекулах расположены параллельно
одна другой. Участвуют в образовании,
структурных элементов соединительной
ткани (коллагены, кератины, эластины).
Сложные белки
(протеиды) содержат наряду с протеиногенными
аминокислотами органический или
неорганический компонент иной природы
— простетическую группу. Она связана
с полипептидной цепью ковалентно,
гетеропо-лярно или координационно.
Важнейшие представители: гликопротеины
(нейтральные сахара, аминосахара, кислые
производные моносахаридов), липопротеины
(триацилглицериды, фосфолипиды и
холестерол), металлопротеины (ион
металла, связанный ионной или
координационной связью), фосфопротеины
(остатки фосфорной кислоты, связанные
через остаток серина или треонина),
нуклеопротеины (нуклеиновые кислоты),
хромопротеины (окрашенный компонент
— пигмент или хромоген).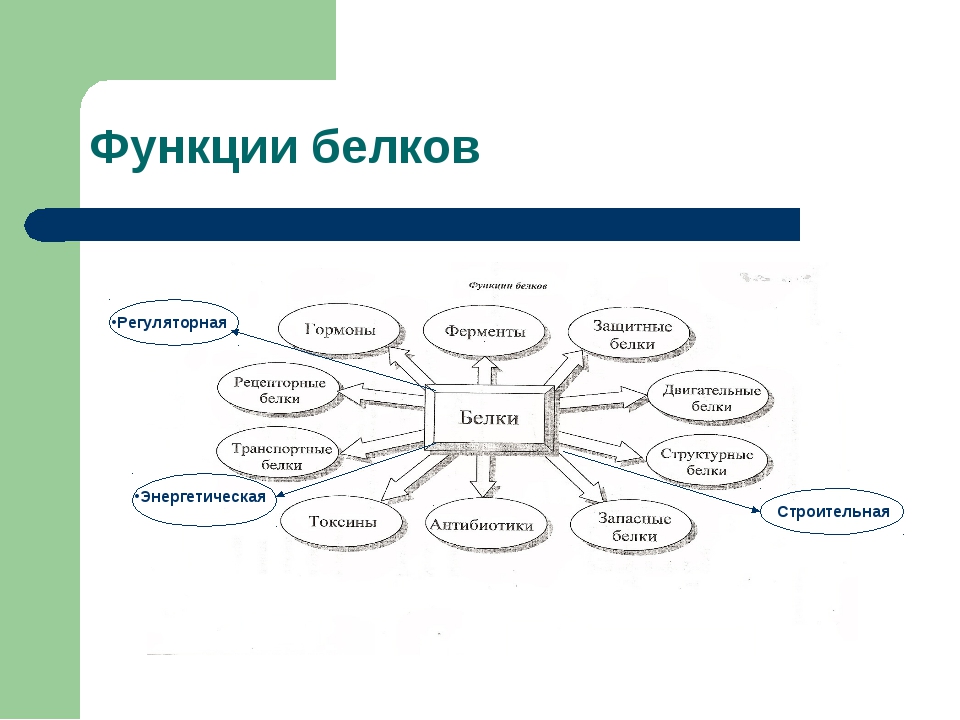
Из множества
сложных белков мы рассмотрим только
нуклеопротеиды и важнейший хромопротеид
— гемоглобин.
Нуклеопротеиды
— соединения, молекула которых состоит
из простого белка и нуклеиновой кислоты:
дезоксирибонуклеиновой (ДНК) или
рибонуклеиновой (РНК).
ДНК — неразветвленный
полимер, образованный из связанных
между собой нуклеотидов, содержащих
дезоксирибозу. Нуклеотид включает одно
из четырех азотистых оснований
(аденин (А), тимин (Т), гуанин (Г) или
цитозин (Ц), остаток рибозы и фосфорной
кислоты (Р). Нуклеотиды в полимере
соединены между собой через остаток
фосфорной кислоты, образующей эфирную
связь с С-3 в остатке рибозы предшествующего
нуклеотида .
Для ДНК всех видов
клеток характерно равенство между
количеством остатков аденина и тимина
(А = Т), гуанина и цитозина (Г = Ц) — правил
Чаргаффа, т.е. число пуриновых оснований
равно числу пиримидиновыз Отношение
А + Т к Г + Ц варьирует у разных видов в
широких пределах -от 0,35 до 2,70.
Относительно друг
друга цепи расположены так, что пуриновому
основанию в одной из них соответствует
пиримидиновое основание в другой. Эти
основания комплементарны друг к другу,
т.е. пространственно взаимодополняют
одна другую.
В молекуле основания
связаны водородными мостиками’ двумя
между А и Т и тремя — между Ц и Г .
ДНК ядра животных
клеток представляет собой не одну
молекулу, а состоит из многих,
распределенных по разным (у человека
по 46) хромосомам. Как уже сказано, по
первичной структуре, т.е. набору
нуклеотидов, во всех клетках организма
ДНК совершенно одинакова, в том числе
и в специализированных клетках, но
отличается по характеру белкового
компонента.
РНК в отличие от
ДНК, которая находится преимущественно
в ядре, содержится в основном в цитоплазме,
главным образом в рибосомах (это
определяет их название), в небольшом
количестве — в ядрах, главным образом
— ядрышках.
Сходна по первичной
структуре с ДНК, отличаясь следующим:
1) вместо дезоксирибозы
содержит рибозу;
2) вместо тимина
— урацил (тимин присутствует в очень
малых количествах).
Как
и ДНК, РНК — это полимерная цепь,
построенная по аналогичному Принципу,
не обладает строгой упорядоченностью
вторичной структуры (спи-рализованные
участки менее протяженны, чем в ДНК,
местами образует петли, на протяжении
которых азотистые основания связаны
водородными мостиками по принципу
комп-лементарности в пределах одной
цепи (рис.13).
В отличие от ДНК
рибонуклеиновые кислоты разнообразны.
Наиболее тяжелые происходят из рибосом
— рибосомные РНК. Внутри растворимой
клеточной фракции содержится растворимая
РНК или транспортная (функциональное
название). Третья разновидность —
информационные РНК.
Рибосомные РНК
(р-РНК) связаны с белками рибосомы,
представленными десятками разновидностей
в пределах одной и той же рибосомы.
Гемоглобин (НЬ) —
важнейший хромопротеид, обладающий
уникальной функцией
— перенос кислорода
и углекислоты.
Белковый компонент
НЬ — глобин, небелковый — гем. Структура
НЬ неодинакова у разных видов и может
иметь варианты у одного вида или одной
особи. Отличия касаются белковой
части — последовательности
аминокислот. Структура гема идентична
у всех позвоночных.
Молекула глобина
содержит четыре полипептидные цепи,
которые удерживаются вместе
нековалентными связями. Гемоглобин А
— основной гемоглобин взрослого
человека— состоит из двух видов
поли-пептидных цепей — а и р. О
разновидностям гемоглобина, связанных
с вариантами структуры глобина, мы
будем говорить ниже.
Последовательности
аминокислот в НЬА (вообще в гемоглобине
20 видов животных) расшифрованы полностью
Гем — молекула,
построенная из четырех гетероциклов,
содержащих азот — пиррольных колец.
Остатки пиррола
соединены в молекуле гема по а-углеродным
атомам метиновыми мостиками (-СН=),
[3-углеродные атомы замещены в пиррольных
кольцах метильными группами (4), винильными
{2) и остатками пропионовой кислоты (2).
С атомами азота
пиррольных колец в геме связан ион
двувалентного железа. Кроме того, железо
взаимодействует с атомом азота в
остатках гистидина (Гис 87 а-субъединицы,
Гис 92 [3-субъединицы). С белковой частью
молекулы гем связан еще и электростатическим
взаимодействием через пропиониловые
остатки. Со стороны белка в этих связях
участвуют остатки основных аминокислот
(лизин, аргинин).
7.Классификация
аминокислот:
1. По строению
соединений, получающихся при расщеплении
углеродной цепи аминокислоты в организме,
различают:
а) глюкопластичные
(глюкогенные) — при недостаточном
поступлении углеводов или нарушении
их превращения они через щавелевоуксусную
и фосфоэнолпировиноградную кислоты
превращаются в глюкозу (глюкогенез)
или гликоген. К этой группе относятся
глицин, аланин, серии, трвопин, валин,
аспарагииовая и глутами новая кислота,
аргинин, гистидин и метионин;
б) кетопластичные
(кетогенные) — ускоряют образование
кетоновых тел — лейцин, изолейцин,
тирозин и фенилаланин (три последние
могут быть и глюкогенными)
2. В зависимости
от того, могут ли аминокислоты
синтезироваться в организме или
обязательно должны поступать в составе
пищи, различают:
а) заменимые;
6) незаменимые.
К незаменимым
относятся гистидин, изолейцин, лейцин,
лизин, метионин, фенилаланин, треонин,
триптофан, валин В детском возрасте
незаменимы также аргинин и гистидин
(взрослый организм не требует их
поступления с пищей).
По структуре
различают семь классов аминокислот:
Ряд непротеиногенных
аминокислот входит в состав некоторых
биологически активных соединений
— о них расскажем позже
8.Денатурация
белка —
следствие разрыва слабых связей,
ведущего к разрушению вторичной и
третичной структур. Молекула
денатурированного белка неупорядоченна
— она приобретает характер случайного
(«статистического») клубка. Как правило,
денатурация белка необратима, но в
некоторых случаях после устранения
денатурирующего агента может произойти
«ренатурация» — восстановление
вторичной и третичной структур, а
следовательно, и свойств.
Денатурирующие
агенты’ высокие температуры (разрыв
водородных и гидрофобных связей),
кислоты и основания (нарушение
электростатических связей), органические
растворители (нарушение преимущественно
гидрофобных связей), мочевина и
гуанидин (нарушение водородных связей).
К денатурирующим
агентам относятся также детергенты,
соли тяжелых металлов, ультрафиолет и
другие виды излучений.
Денатурация не
нарушает ковалентных связей, но повышает
их доступность для других факторов, в
частности для энзимов,
Строение и функции белков
Доказано, что белки составляют, в среднем, до 50% от сухой массы практически всех живых существ. Основным структурным элементом белка является аминокислота. В составе каждой из аминокислот имеется карбоксильная (кислотная) и аминогруппа. При комбинации этих групп появляется пептидная связь, поэтому второе название белков – полипептиды.
Структуры белка
1. Первичная структура — цепь, состоящая из аминокислот, соединенных пептидной связью (мощной, ковалентной). При чередовании 20 аминокислот в разном порядке образуется множество разнообразных белков. В случае замены в определенной белковой цепочке хотя бы одной аминокислоты полностью меняется структура и, соответственно, функции белка. Поэтому первичная структура по праву является основной в белке.
2. Вторичная. Это спираль, форма которой поддерживается водородными связями (относительно слабыми).
3. Третичная структура – это шар, или так называемая глобула. Она образована, благодаря четырем видам связей. Из них наиболее мощная дисульфидная (так называемый серный мостик). Более слабыми являются такие связи, как гидрофобные, ионные, водородные). Функции белка определяются формой глобулы, по которой белки сильно отличаются друг от друга. Вследствие денатурации происходит изменение формы белка, что влечет нарушение его функции.
4. Четвертичная структура характерна не для всех белков. Представлена несколькими глобулами, объединенными друг с другом теми же связями, что и в третичной структуре. Ярким примером является гемоглобин.
Денатурация
Это процесс внешнего влияния на белок, который приводит к изменению формы его глобулы. Воздействие на белок оказывает высокая температура, избыточная соленость, кислотность, реакции с другими веществами. В случае, когда воздействие на белок не сильное (например, повышение температуры на 1 градус), возникает обратимая денатурация. При значительных воздействиях белок подвергается необратимой денатурации. В этом случае повреждаются все структуры, за исключением первичной.
Функции белков
В любом живом организме белки выполняют множество разных функций. Самые важные из них:
1. Структурная (строительная) заключается в том, что любая живая клетка состоит, в большей степени, из белков и воды.
2. Ферментативная выражается в том, что существуют белки-ферменты, выполняющие роль ускорителей химических реакций. Это происходит, так как активная часть фермента подходит к определенному веществу как ключик к замку.
3. Защитная функция ярко прослеживается на примере организма животного, где белки-антитела иммунной системы уничтожают болезнетворные микроорганизмы.
Похожие материалы:
Каталитическая функция белков: примеры. Основные функции белков
Белки представляют собой природные органические соединения, которые обладают высокомолекулярным строением. Молекула данных веществ является неразветвляющимся полимером. Белки построены из 20 аминокислот. Именно они представляют структурную минимальную единицу молекулы – мономер. Все составляющие белка соединены между собой полипептидной, по-другому — карбамидной, связью в достаточно длинные цепи. При этом молекулярная масса может составлять от нескольких тысяч и до миллионов атомных частиц.
Каким может быть белок
Чтобы определить основные функции белка, стоит разобраться в строении подобных веществ. На данный момент существует две разновидности этого важного для человека компонента: фибриллярные и глобулярные. Различают их в основном благодаря разнице в строении белковой молекулы.
Глобулярное вещество прекрасно растворяется не только в воде, но и в солевых растворах. При этом молекула такого белка обладает шарообразной формой. Такую хорошую растворимость можно легко объяснить расположением заряженных остатков аминокислот, которые окружены гидратной оболочкой, на поверхности глобулы. Именно это и обеспечивает такие хорошие контакты с различными растворителями. Стоит отметить, что в группу глобулярных компонентов входят все ферменты, а также практически все биологически активные белки.
Что касается фибриллярных веществ, то их молекулы обладают волокнистой структурой. Каталитическая функция белков очень важна. Поэтому сложно представить ее выполнение без вспомогательных веществ. Фибриллярные белки не растворяются ни в солевых растворах, ни в обычной воде. Их молекулы располагаются параллельно в полипептидных цепях. Такие вещества участвуют в процессах образования некоторых структурных элементов соединительных тканей. Это эластины, кератины, коллагены.
Особую группу составляют сложные белки, которые состоят не только из аминокислот, но и нуклеиновых кислот, углеводов и прочих веществ. Все эти компоненты играют особую роль. Особое значение имеет каталитическая функция белков. Помимо этого, вещества подобного плана являются дыхательными пигментами, гормонами, а также надежной защитой для любого организма. Биосинтез белка осуществляется на рибосомах. Этот процесс определяется при трансляции кодом нуклеиновых кислот.
Каталитическая функция белков
Катализ разнообразных химических веществ – это самая главная функция белков. Подобные процессы осуществляются ферментами. Это белки, которые обладают каталитическими специфическими свойствами. Каждый из подобных веществ может осуществлять одну или же несколько похожих реакций. Катализируют ферменты процесс расщепления сложных молекул, а также их синтез. По-другому эти реакции называют катаболизмом и анаболизмом. Каталитическая функция белков подразумевает также репарацию и репликацию ДНК, а также матричный синтез РНК.
Что такое катализ
Уже к 2013 году учеными было выявлено чуть более 5 тысяч ферментов. Подобные вещества способны влиять на ход практически любых биохимических реакций. Чтобы стала более понятной каталитическая функция белков, стоит разобраться, что же такое катализ. С греческого языка это понятие переводится как «прекращение». Катализ представляет собой изменение скорости протекания любой химической реакции. Происходит это под действием определенных соединений. Ферментами выполняется каталитическая функция белков. Примеры этого явления встречаются в повседневной жизни постоянно. Просто человек этого не замечает.
Пример каталитической функции
Чтобы понять, как действуют ферменты, стоит рассмотреть несколько примеров. Итак, в чем заключается каталитическая функция белков. Примеры:
- При фотосинтезе рибулезобифосфаткарбоксилаза осуществляет катализ фиксации СО2.
- Перекись водорода расщепляется до кислорода и воды.
- ДНК синтезирует ДНК-полимераза.
- Амилаза способна расщепляет до мальтозы крахмал.
- Деградация угольной кислоты: СО2 + Н2О НСО3 + Н+.
Каталитическая функция белков заключается в ускорении любых химических превращений. К подобным реакциям относится синтез, распад веществ, перенос отдельных атомов или электронов от одного компонента к другому.
Транспортная функция
Жизнедеятельность любой клетки должна поддерживаться различными веществами, которые являются для них не только строительным материалом, но и своеобразной энергией. Биологические функции белков включают и транспортную. Именно эти компоненты поставляют в клетки все важные вещества, ведь мембраны построены из нескольких слоев липидов. Именно здесь и находятся различные белки. При этом гидрофильные участки все сосредоточены на поверхности, а хвостики — в толще мембран. Такое строение не позволяет проникать внутрь клеток очень важным веществам – ионам щелочных металлов, аминокислотам и сахарам. Белки переносят все эти компоненты внутрь клеток для их питания. Например, гемоглобин транспортирует кислород.
Рецепторная
Основные функции белка обеспечивают не только питание клеток живых организмов, но и помогают распознать сигналы, которые поступают из внешней среды и соседних клеток. Самый яркий пример такого явления – рецепторы ацетилхолина, который расположен на мембране около межнейронных контактов. Сам процесс очень важен. Белки выполняют рецепторную функцию, их взаимодействие с ацетилхолином проявляется специфическим образом. В результате внутрь клетки передается сигнал. Однако спустя некоторое время нейромедиатор обязательно должен быть удален. Только в этом случае клетка сможет получить новый сигнал. Именно эту функцию выполняет один из ферментов – ацетилхолтнэстераза, который выполняет расщепление до холина и ацетата гидролизацетилхолина.
Защитная
Иммунная система любого живого существа способна отвечать на появление в организме чужеродных частиц. В данном случае срабатывает защитная функция белка. В организме происходит выработка большого количества лимфоцитов, которые способны наносить вред патогенным бактериям, макромолекулам, раковым клеткам и прочее. Одна из групп данных веществ осуществляет выработку особых белков — иммуноглобулинов. Происходит выделение данных веществ в кровеносную систему. Иммуноглобулины распознают чужеродные частицы и образуют высоко специфический комплекс определенной стадии уничтожения. Так осуществляется защитная функция белка.
Структурная
Функции белка в клетке протекают незаметно для человека. Некоторые вещества имеют по большей части структурное значение. Подобные белки обеспечивают механическую прочность отдельных тканей в организмах. Прежде всего, это коллаген. Это основной компонент внеклеточного матрикса всех соединительных тканей в живом организме.
Стоит отметить, что у млекопитающих коллаген составляет примерно 25 % от общей массы белков. Синтез данного компонента происходит в фибробластах. Это основные клетки любой соединительной ткани. Первоначально образуется проколлаген. Это вещество является предшественником и проходит химическую обработку, которая состоит в окислении до гидроксипролина остатков пролина, а также до гидрксилина остатков лизина. Коллаген образуется в виде трех пептидных цепей, скрученных в спираль.
Это не все функции белков. Биология — достаточно сложная наука, которая позволяет определить и распознать множество явлений, протекающих в организме человека. Каждая функция белка играет особую роль. Так, в эластичных тканях, например в легких, стенках кровеносных сосудов и коже имеется эластин. Этот белок способен растягиваться, а затем возвращаться к исходной форме.
Двигательные белки
Мышечные сокращения – это процесс, при котором происходит превращение энергии, запасенной в молекулах АТФ в виде пирофосфатных макроэргических связей, именно в механическую работу. В данном случае функции белка в клетке выполняют миозин и актин. Каждый из них имеет свои особенности.
Миозин обладает необычайным строением. Этот белок состоит из нитевидной достаточно длиной части – хвоста, а также из нескольких глобулярных головок. Выделяется миозин, как правило, в виде гексамера. Этот компонент образуется несколькими совершенно одинаковыми полипептидными цепями, каждая из которых обладает молекулярной массой в 200 тысяч, а также 4 цепями, молекулярная масса которых составляет всего 20 тысяч.
Актин представляет собой глобулярный белок, который обладает способностью полимеризоваться. При этом вещество образует достаточно длинную структуру, которую принято называть F-актином. Только в таком состоянии компонент может нормально взаимодействовать с миозином.
Примеры основных функций белков
Ежесекундно в клетках живого организма протекают всевозможные процессы, которые невозможны были бы без белков. Примером рецепторной функции подобных веществ может послужить сообщение клеткам адренорецептором о присоединении адреналина. Под воздействием света происходит разложение родопсина. Подобное явление запускает реакцию и возбуждает палочку.
Что касается структурной функции, то лучшим примером в данном случае может послужить действие коллагена. Это вещество придает соединительным тканям больше упругости.
Примером транспортной функции является перенос гемоглобином кислорода по всему живому организму.
В заключение
Это все основные биологические функции белков. Каждая из них очень важна для живого организма. При этом определенная функция выполняется соответствующим белком. Отсутствие подобных компонентов может привести к нарушению работы определенных органов и систем в организме.
§4. Свойства и функции белков
1. Как называется процесс нарушения природной структуры белка, при котором сохраняется его первичная структура? Действие каких факторов может приводить к нарушению структуры белковых молекул?
Процесс нарушения природной структуры белков под влиянием каких-либо факторов без разрушения первичной структуры называется денатурацией. Денатурация белков может быть вызвана действием различных факторов, например, высокой температуры, концентрированных кислот и щелочей, тяжёлых металлов.
2. Чем фибриллярные белки отличаются от глобулярных? Приведите примеры фибриллярных и глобулярных белков.
Молекулы фибриллярных белков имеют вытянутую, нитевидную форму. Глобулярные белки характеризуются компактной округлой формой молекул. К фибриллярным белкам относятся, например, кератин, коллаген, миозин. Глобулярными белками являются глобулины и альбумины крови, фибриноген, гемоглобин и др.
3. Назовите основные биологические функции белков, приведите соответствующие примеры.
● Структурная функция. Белки входят в состав всех клеток и межклеточного вещества, являются компонентами различных структур живых организмов. Например, у животных белок коллаген входит в состав хрящей и сухожилий, эластин – в состав связок и стенок кровеносных сосудов, кератин является важнейшим структурным компонентом перьев, волос, ногтей, когтей, рогов, копыт.
● Ферментативная (каталитическая) функция. Белки-ферменты являются биологическими катализаторами, ускоряя протекание химических реакций в живых организмах. Например, пищеварительные ферменты амилаза и мальтаза расщепляют сложные углеводы до простых, пепсин – белки до пептидов, под действием липаз происходит расщепление жиров до глицерина и карбоновых кислот.
● Транспортная функция. Многие белки способны присоединять и переносить различные вещества. Например, гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют высшие карбоновые кислоты, а глобулины – ионы металлов и гормоны. Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из неё.
● Сократительная (двигательная) функция. Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Например, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения, тубулин входит в состав микротрубочек веретена деления, ресничек и жгутиков эукариотических клеток.
● Регуляторная функция. Некоторые белки и пептиды участвуют в регуляции различных физиологических процессов. Например, гормоны белково-пептидной природы инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) – процессы роста и физического развития.
● Сигнальная функция заключается в том, что некоторые белки, входящие в состав цитоплазматической мембраны клеток, в ответ на действие внешних факторов изменяют свою пространственную конфигурацию, тем самым обеспечивая приём сигналов из внешней среды и передачу информации в клетку. Например, белок опсин, входящий в состав пигмента родопсина, воспринимает свет и обеспечивает возникновение зрительного возбуждения рецепторов (палочек) сетчатки глаза.
● Защитная функция. Белки предохраняют организм от вторжения чужеродных объектов и от повреждений. Например, иммуноглобулины (антитела) участвуют в иммунном ответе, интерферон защищает организм от вирусной инфекции. Фибриноген, тромбопластин и тромбин обеспечивают свёртывание крови, предотвращая кровопотерю.
● Токсическая функция. Многие живые организмы выделяют белки-токсины, которые являются ядами для других организмов.
● Энергетическая функция. После расщепления до аминокислот белки могут служить источником энергии в клетке. При полном окислении 1 г белка выделяется 17,6 кДж энергии.
● Запасающая функция. Например, в семенах растений запасаются особые белки, которые используются при прорастании зародышем, а затем и проростком в качестве источника азота.
4. Что такое ферменты? Почему без их участия протекание большинства биохимических процессов в клетке было бы невозможным?
Ферменты – белки, которые выполняют функцию биологических катализаторов, т. е. ускоряют протекание химических реакций в живых организмах. Они катализируют реакции синтеза и расщепления различных веществ. Без участия ферментов эти процессы протекали бы слишком медленно или не протекали бы вовсе. Практически все процессы жизнедеятельности организмов обусловлены ферментативными реакциями.
5. В чем заключается специфичность ферментов? Какова её причина? Почему ферменты активно функционируют лишь в определённом диапазоне температуры, рН и других факторов?
Специфичность ферментов заключается в том, что каждый фермент ускоряет только одну реакцию либо действует только на определённый тип связи. Эта особенность объясняется соответствием пространственной конфигурации активного центра фермента тому или иному субстрату (субстратам).
Ферменты являются белками. Изменение рН, температуры и других факторов может вызвать денатурацию ферментов, в результате чего они теряют способность связываться со своими субстратами.
6. Почему белки, как правило, используются в качестве источников энергии лишь в крайних случаях, когда в клетках исчерпаны запасы углеводов и жиров?
Белки – основа жизни. Они выполняют чрезвычайно важные биологические функции, многие из которых (ферментативную, транспортную, двигательную и др.) не способны выполнять ни углеводы, ни жиры. Белки, использованные в качестве энергетического субстрата, дают столько же энергии, сколько и углеводы (1 г – 17,6 кДж) и в 2,2 раза меньше, чем жиры (1 г – около 39 кДж). Кроме того, при полном расщеплении белков (в отличие от углеводов и жиров) образуются не только СО2 и Н2О, но также соединения азота и серы, причём некоторые из них токсичны для организма (например, NH3). Поэтому энергетическую функцию у живых организмов выполняют прежде всего углеводы и жиры.
7*. У многих бактерий в процессах синтеза веществ, необходимых для нормального роста и размножения, участвует парааминобензойная кислота (ПАБК). В то же время в медицине для лечения ряда бактериальных инфекций используются сульфаниламиды — вещества, по структуре сходные с ПАБК. Как вы думаете, на чём основано лечебное действие сульфаниламидов?
С помощью фермента (дигидроптероатсинтетазы) бактерии осуществляют превращение ПАБК в продукт (дигидроптероевую кислоту), который далее используется для синтеза необходимых ростовых факторов. Из-за структурного сходства с ПАБК, сульфаниламиды также способны связываться с активным центром этого фермента, блокируя его работу (т.е. наблюдается конкурентное ингибирование). Это ведёт к нарушению синтеза ростовых факторов и нуклеиновых кислот у бактерий.
* Задания, отмеченные звёздочкой, предполагают выдвижение учащимися различных гипотез. Поэтому при выставлении отметки учителю следует ориентироваться не только на ответ, приведённый здесь, а принимать во внимание каждую гипотезу, оценивая биологическое мышление учащихся, логику их рассуждений, оригинальность идей и т. д. После этого целесообразно ознакомить учащихся с приведённым ответом.
Дашков М.Л.
Сайт: dashkov.by
Вернуться к оглавлению
| < Предыдущая | Следующая > |
|---|
Функции белков
Перед
подробным изучением роли белков, давайте вспомним функции углеводов и липидов.
Углеводы:
структурная, энергетическая и запасающая. Итого три.
У липидов побольше: те же энергетическая, запасающая и структурная. Плюс
специфические: защитная, теплоизоляционная и регуляторная. Итого шесть.
А
что с белками? Забегая вперёд, скажем, что у белков их около десяти. Почему так
много? Нетрудно догадаться.
Из
предыдущих уроков вы знаете, что белки имеют более сложное строение и
отличаются огромным разнообразием. А поэтому и выполняют в живых организмах
чрезвычайно важные и многообразные функции.
Итак,
проследим за работой этих трудяг и выясним, почему же именно они являются
незаменимыми составляющими жизни.
Начнём
с самой основополагающей и солидной функции – строительной, или структурной.
Белки
являются неотъемлемой составляющей всех клеток, всех тканей всех живых
организмов. Как вы помните, вместе с фосфолипидами они входят в состав
цитоплазматических мембран. Из белков построен цитоскелет
клетки, о котором подробнее вы узнаете совсем скоро, мышечные волокна также
представлены белками. Белок коллаген является основным элементом
хрящей и сухожилий. Кстати, коллаген –
лидер среди белков у млекопитающих. Его содержание в организме может достигать
до 35% от всех белков.
Кератин – важнейший структурный компонент перьев, ногтей, рогов,
волос, копыт у животных.
В
составе связок, лёгких, в стенках артерий мы обнаружим белок эластин.
Следующая
функция по важности мало уступает первой. Но если структурная не таит в себе каких-либо
особых секретов, то ферментативная, или каталитическая – и
сегодня загадка для учёных. Здесь речь идёт о тех белках, которые способны
ускорять химические реакции, выступая в роли катализаторов. Или
точнее – биологических катализаторов. Называются они ферментами и
способны увеличивать скорость протекания химической реакции в миллионы и
миллиарды раз. Только вдумайтесь! Неорганическим катализаторам такие
способности и не снились. Их эффективность ограничивается сотнями и тысячами
раз.
Подробнее
с теорией, которая описывает механизм работы ферментов, вы познакомитесь
немножко позже.
Далее
транспортная функция. Многие белки обладают способностью легко
присоединять к себе различные вещества, переносить и легко отдавать в нужном
месте. Первым примером такого белка, который мы сразу вспомним, будет, конечно
же, гемоглобин эритроцитов позвоночных животных. Он связывает и переносит
кислород. Ну и немножко углекислый газ.
Жирные
кислоты в организме транспортируются альбуминами крови.
Глобулины переносят ионы металлов и гормоны.
Белки цитоплазматической мембраны обеспечивают транспорт веществ в клетку и из
неё.
Сократительная,
или двигательная функция. Мы знаем, что одним из признаков живых существ
является способность к движению. Передвигаться могут отдельные клетки, ткани,
органы и целые организмы. В основе работы мышц, а также внутриклеточных
сокращений лежит способность изменять свои размеры белков актина
и миозина. А белок тубулин
обеспечивает перемещение хромосом при делении клетки, движение ресничек и
жгутиков эукариотических клеток.
Пептиды
и белки могут выполнять и роль гормонов, изменяя скорость протекания различных
физиологических процессов. Выполняя регуляторную функцию.
Как вы помните из восьмого класса, инсулин
и глюкагон поддерживают постоянную концентрацию глюкозы в крови.
А гормон роста соматотропин отвечает,
соответственно, за рост и физическое развитие вашего организма.
Сигнальная
функция. Некоторые белки, входящие в состав плазмалеммы, могут изменять свою
структуру под действием различных внешних факторов. Тем самым они обеспечивают
приём сигналов из внешней среды и передают полученную информацию в клетку.
Помните, как работает наше зрение? При попадании света на светочувствительный
пигмент родопсин, он распадается. В ответ на появление продуктов
распада родопсина возникает нервный импульс, который и формирует зрительные
ощущения. Так вот, составляющая пигмента родопсина – белок опсин.
Существуют
белки, которые стоят на страже целостности организмов. Они способны защищать
внутреннюю среду от повреждений и вторжения чужеродных тел. Любой живой
организм постоянно подвержен проникновению незваных объектов (антигенов). Но в
здоровом организме незваные гости быстро нейтрализуются при помощи лейкоцитов.
Последние
вырабатывают специальные белки – иммуноглобулины (антитела),
которые подавляют деятельность антигенов. Тем самым обеспечивая иммунный ответ.
Например, от вирусных инфекций защищает белок интерферон. А от
чрезмерной потери крови – фибриноген, тромбопластин
и тромбин. Обеспечивая её свёртывание.
Токсическая
функция. Белки могут не только защищаться, но и нападать.
Хотя защита – это тоже нападение.
Многие живые существа способны вырабатывать и выделять белки-токсины.
Это характерно для ряда животных, а особенно грибов, растений, микроорганизмов.
Например, пептидную природу имеет дифтерийный токсин. Возможно, вы слышали о
нём. Вырабатывается бактерией Corynebacterium diphtheriae (бацилла
Лёффлера) и нарушает синтез белков.
В ответ на проникновение белков-токсинов, некоторые организмы способны
вырабатывать антитоксины, подавляющие действие ядов. А если такие антитоксины
не вырабатываются, то их можно ввести. При укусе той же змеи спасают жизнь
человеку, вводя специфический антитоксин. Но только специфический. То есть для
каждой змеи свой.
Запасающая
функция. В первую очередь эту функцию выполняют, как мы уже сказали,
углеводы и жиры. Но в семенах растений запасаются именно резервные белки.
Зачем? Для прорастания зародыша нужен азот. А углеводы и липиды азота, как
известно, не содержат. Вот почему семена некоторых растений (бобовые) содержат
даже полноценные белки, заменяющие мясо.
Энергетическая
функция. Несмотря на свою ценность, в крайних случаях белки
могут выступать и всего лишь источником энергии для организма. Но происходит
это только тогда, когда расходовались все углеводы и жиры. Как и углеводы,
белки при расщеплении 1 грамма дают 17,6 кДж энергии.
6 Основные функции белков | Здоровое питание
Эллен Суонсон Topness Обновлено 20 декабря 2018 г.
Белок — важное вещество, которое содержится в каждой клетке человеческого тела. На самом деле, за исключением воды, белок является самым распространенным веществом в вашем теле. Этот белок вырабатывается вашим организмом с использованием потребляемых вами диетических белков. Он используется во многих жизненно важных процессах и поэтому требует постоянной замены. Вы можете добиться этого, регулярно потребляя продукты, содержащие белок.
Ремонт и обслуживание
Белок называют строительным блоком организма. Это называется так, потому что белок жизненно важен для поддержания тканей тела, включая развитие и восстановление. Волосы, кожа, глаза, мышцы и органы состоят из белка. Вот почему детям нужно больше белка на фунт веса тела, чем взрослым; они растут и развивают новые белковые ткани.
Энергия
Белок является основным источником энергии. Если вы потребляете больше белка, чем нужно для поддержания тканей тела и других необходимых функций, ваше тело будет использовать его для получения энергии.Если в этом нет необходимости из-за достаточного потребления других источников энергии, таких как углеводы, белок будет использоваться для создания жира и станет частью жировых клеток.
Гормоны
Белок участвует в создании некоторых гормонов. Эти вещества помогают контролировать функции организма, связанные с взаимодействием нескольких органов. Инсулин, небольшой белок, является примером гормона, регулирующего уровень сахара в крови. Он предполагает взаимодействие таких органов, как поджелудочная железа и печень.Секретин — еще один пример белкового гормона. Это вещество способствует процессу пищеварения, стимулируя поджелудочную железу и кишечник, чтобы вырабатывать необходимые пищеварительные соки.
Ферменты
Ферменты — это белки, которые увеличивают скорость химических реакций в организме. Фактически, большинство необходимых химических реакций в организме не могло бы происходить эффективно без ферментов. Например, один тип ферментов помогает переваривать большие молекулы белка, углеводов и жиров в более мелкие молекулы, а другой помогает создавать ДНК.
Транспортировка и хранение молекул
Белок является основным элементом транспортировки определенных молекул. Например, гемоглобин — это белок, который переносит кислород по всему телу. Белок также иногда используется для хранения определенных молекул. Ферритин — это пример белка, который соединяется с железом и хранится в печени.
Антитела
Белок образует антитела, которые помогают предотвратить инфекции, болезни и болезни. Эти белки идентифицируют и помогают уничтожить антигены, такие как бактерии и вирусы.Они часто работают вместе с другими клетками иммунной системы. Например, эти антитела идентифицируют, а затем окружают антигены, чтобы удерживать их, пока они не будут уничтожены лейкоцитами.
Основные функции белка в организме — видео и стенограмма урока
Обеспечьте структуру
Итак, мы говорили об аминокислотах, которые являются строительными блоками белков, но мы также могли бы сказать, что сами белки являются строительными блоками организма.
И это подводит нас к первой важной функции белка, которая состоит в обеспечении структуры. Структурные белки составляют неотъемлемые части вашего тела. Например, кератин — это белок, содержащийся в волосах, ногтях и коже, который помогает укрепить эти структуры. Внутри вашего тела белок обеспечивает структуру каждой клетке. Коллаген, который представляет собой структурный белок, содержащийся в различных соединительных тканях, обеспечивает основу для связок, которые удерживают ваши кости вместе, и сухожилий, которые прикрепляют мышцы к этим костям.
Регулируют процессы в организме
Белки также регулируют процессы в организме. Например, ферменты — это белки, которые ускоряют химические реакции в организме. Без них основные действия, такие как расщепление пищи, которую вы едите, происходили бы слишком медленно, чтобы поддерживать вашу жизнь. Вы можете думать о ферментах как о белках, которые ускоряют процессы в организме, так же, как утренний кофе заставляет ваш день двигаться вперед.
На процессы в организме также влияют гормоны — белки, регулирующие деятельность клеток или органов.Гормоны подобны химическим посланникам, которые передают приказ от одной части вашего тела к другой, так же как Пол Ревер нес сообщение о том, что британцы приходят к людям в его колонии. Например, инсулин — это гормон, который регулирует уровень сахара в крови, передавая клеткам вашего тела сообщение о том, сколько сахара присутствует в вашей крови.
Транспортные материалы
Другая функция белка — транспортировка материалов по вашему телу. Прекрасным примером этого является гемоглобин, белок, переносящий кислород, который содержится в красных кровяных тельцах.Когда вы вдыхаете воздух в легкие, молекулы кислорода из этого воздуха ждут в клетках ваших легких, чтобы прокатиться на эритроците, что-то вроде жителя Нью-Йорка, ожидающего такси. Как только кислород присоединяется к гемоглобину этого эритроцита, он может путешествовать по вашему телу.
Помогите с иммунитетом
Некоторые белки являются защитниками и помогают с иммунитетом. Например, антитела — это белки, которые могут распознавать чужеродных захватчиков в вашем теле. Эти бдительные белки похожи на соседские стражи, и они работают вместе с другими клетками вашей иммунной системы, чтобы помочь предотвратить инфекции, болезни и болезни.
Обеспечивают энергией
Итак, мы узнали, что белки обеспечивают структуру, регулируют процессы в организме, транспортируют материалы и помогают укрепить иммунитет. Белки подобны рабочим лошадкам тела, но они настолько бескорыстны, что готовы отказаться от всего, что могут, ради выполнения своей последней функции — обеспечения энергией.
Видите ли, чтобы обеспечить энергию, молекула белка должна быть разрушена и разбита на аминокислотные части. Белок не является основным источником энергии для вашего тела, эта ответственность ложится на плечи углеводов, но если ваша диета не обеспечивает достаточного количества топлива из углеводов, можно использовать белок.
Например, если вы соблюдаете диету для тяжелой потери веса, ваше тело расщепляет белки и использует их аминокислоты для производства топлива. Это гарантирует, что ваше тело всегда будет иметь энергию, но соблюдение сверх строгой диеты также лишает ваше тело белков, необходимых для поддержания структур тела и выполнения необходимых функций, что в конечном итоге делает вас слабее.
Итоги урока
Давайте рассмотрим.
Белок — это большая молекула, состоящая из аминокислот, которая способна выполнять многие важные функции в организме.
Его можно использовать для придания структуры, как мы видим с кератином, который представляет собой тип белка, обнаруженного в ваших волосах, ногтях и коже, и в коллагене, который является структурным белком, обнаруженным в различных соединительных тканях, таких как ваши связки и сухожилия.
Белки также регулируют процессы в организме. Например, ферменты — это белки, которые ускоряют химические реакции в организме, а гормоны, такие как инсулин, — это белки, регулирующие активность клеток или органов.
Некоторые белки переносят материалы по всему телу, например, гемоглобин, белок, переносящий кислород, содержащийся в красных кровяных тельцах.Другие белки помогают с иммунитетом, как мы видим с антителами, которые представляют собой белки, которые могут распознавать чужеродных захватчиков в вашем теле. И, если организму это нужно, белки также могут быть расщеплены для получения энергии.
Результаты обучения
В конце этого урока вы будете готовы:
- Определить белок
- Перечислить цели и функции белка
- Объясните, когда и почему белок используется в качестве энергии
белков и тело | Государственный университет Оклахомы
Опубликовано апр.2021 | Id: T-3163
К
Дженис Р. Херманн
Белок — питательное вещество
Белок — это питательное вещество, необходимое организму для роста и поддержания себя. Рядом с водой,
белок — самое многочисленное вещество в нашем организме. Почти все это знают
мышцы состоят из белка.На самом деле в каждой клетке тела есть белок.
Кроме того, другие важные части тела, такие как волосы, кожа, глаза и органы тела
все сделаны из белка.
Многие вещества, контролирующие функции организма, такие как ферменты и гормоны, также являются
сделано из белка. Другие важные функции белка включают формирование клеток крови.
и создание антител для защиты от болезней и инфекций.
Аминокислоты
Белки состоят из более простых веществ, называемых аминокислотами. Есть 20 аминокислот
в белке, который мы едим каждый день. Организм берет эти аминокислоты и связывает их
вместе в очень длинные струны. Вот как организм вырабатывает различные белки.
он должен нормально функционировать.Девять из аминокислот называются незаменимыми , потому что организм не может их вырабатывать. Эти незаменимые аминокислоты должны поступать из продуктов.
мы едим.
На рисунке 1 показана диаграмма гормона инсулина, регулирующего уровень глюкозы (сахара) в крови.
Инсулин — это очень маленький белок. Многие белки состоят из тысяч аминокислот.
нанизаны вместе.Буквы в кружках — это аббревиатуры аминокислоты.
это в том месте. Белки могут быть очень сложными из-за всех комбинаций
аминокислот, составляющих цепи.
Продукты, содержащие белок
Как растительная, так и животная пища содержат белок.Продукты, обеспечивающие все необходимое
аминокислоты называются высококачественными белками. Продукты животного происхождения, такие как мясо, рыба, птица, яйца и молочные продукты, — это все
высококачественные источники белка. Это продукты, о которых люди обычно думают, когда
хочу съесть белок. Незаменимые аминокислоты в продуктах животного происхождения находятся в нужном месте
остаток средств.
Продукты, которые не обеспечивают хороший баланс всех незаменимых аминокислот, называются
низшего качества белков.Растительные продукты содержат белки более низкого качества. Большинство фруктов и овощей
плохие источники белка. Другие растительные продукты, такие как запеченная фасоль, колотый горох и чечевица,
арахис и другие орехи, семена и зерна, такие как пшеница, являются лучшими источниками. Они вносят свой вклад
много белка. Однако в каждом типе растительного белка мало одного или
больше незаменимых аминокислот. Это делает их белком более низкого качества.Животное
белки содержат лучший баланс незаменимых аминокислот, чем растительные белки.
Людям, не употребляющим продукты животного происхождения, следует вместе есть разные виды растительной пищи.
или в тот же день, чтобы получить правильный баланс и количество незаменимых аминокислот
их тела нуждаются. Сочетание бобов и риса, или бобов и кукурузы, или арахисового масла и
хлеб содержит все незаменимые аминокислоты в нужном количестве.Эта еда
комбинации смешивают продукты из разных групп растений, чтобы дополнить предоставленные аминокислоты
каждым.
Комбинирование продуктов любых двух из следующих групп растений дает более высокое качество
белок:
- Бобовые , такие как сушеные бобы, горох, арахис, чечевица и соя
- Зерновые , такие как пшеница, рожь, рис, кукуруза, овес и ячмень
- Семена и орехи , такие как семена подсолнечника и тыквы, пекан и грецкие орехи
Сочетание небольшого количества животного белка с большим количеством растительного продукта может
также удовлетворить потребности человека в белке.Таким образом, комбинируя небольшое количество любого из следующих
продукты животного происхождения с любой из перечисленных выше групп растений будут иметь более высокое качество
белок.
- Яйца
- Молочные продукты , такие как молоко, сыр и йогурт
- Мясо , такое как говядина, птица, рыба, баранина и свинина
Рисунок 1 .Аминокислоты в белке инсулина.
Другие применения белка
Три основных питательных вещества обеспечивают калории: белок, углеводы и жир. Каждый грамм
белка и углеводов обеспечивает 4 калории.Лучшее использование протеина — восстановление
и поддерживать ткани тела. Если люди едят больше белка, чем нужно для поддержания тканей
и ремонтировать, их тела используют это для энергии. Если он не нужен для энергии, их
тела используют дополнительный белок для производства жира. Затем он становится частью жировых клеток. Если люди
не едят достаточно калорий, белок в пище и в своем организме будет использоваться для получения энергии.
В этом случае белок не используется по своему основному назначению, а именно для поддержания
тело.Получение достаточного количества белка и сбалансированное питание с достаточным количеством калорий являются
важный. Таким образом, белок будет использоваться для тканей и других функций белка.
Жиры и углеводы будут использоваться для удовлетворения энергетических потребностей.
Требования к белкам
Белок нужно есть каждому человеку.Сколько протеина ему нужно, зависит от его
или ее размер тела и особые потребности, такие как рост. Детям нужно больше белка на фунт
веса тела, чем у взрослых, потому что они растут и строят новые белковые ткани.
Беременным и кормящим женщинам требуется больше белка для роста ребенка и его производства.
молоко. Норма потребления с пищей (DRI) говорит нам о среднем количестве белка.
человеку нужен каждый день.Рассчитайте потребность в белке по формуле 0,8 грамма
белка на каждый килограмм массы тела. Чтобы найти вес в килограммах, разделите вес
фунтов на 2,2.
Пример :
Вес человека = 165 фунтов
165 фунтов / 2.2 фунта
за килограмм
75 кг X 0,8 грамма
за килограмм
Этому человеку требуется 60 граммов белка в день.
Другой простой сокращенный подход — умножить массу тела в фунтах на 0.4. Это
это приблизительная оценка, требующая меньшего количества вычислений.
Пример :
165 фунтов X 0,4 = 66 граммов в день.
Важно помнить, что дополнительный белок не дает особой пользы.
Люди не хранят дополнительный диетический белок в виде мускулов тела. Дополнительный белок сверх
ежедневная потребность не приведет к увеличению мышечной массы, быстрому росту волос и не защитит от
болезни. Белок сверх необходимого расщепляется и используется для получения энергии,
или он превращается в жир и хранится в жировых клетках. Слишком мало белка приведет к
постепенное разрушение белковых тканей организма и потеря мышечной ткани.Тело будет
не смогут нормально функционировать в этих условиях.
Лучший способ удовлетворить потребность в белке — съесть рекомендованное количество пищи из каждого продукта.
групп продуктов питания MyPlate Plan USDA. Рекомендуемые суммы для каждого плана MyPlate USDA
Группа продуктов питания каждый день для контрольной диеты на 2000 калорий:
- 6 унций.зерен
- 21/2 чашки овощей
- 2 чашки фруктов
- 3 стакана молочных продуктов
- 5 1/2 унций. белковой пищи
- 6 чайных ложек масла
В таблице 1 показано содержание белков и жиров в различных распространенных пищевых продуктах.
Чтобы получить необходимый белок без излишка жиров или насыщенных жиров, выбирайте нежирные продукты.
мяса и нежирной рыбы и снимите кожу с птицы. Вареные зерна и фасоль, горох
и чечевица с низким содержанием жира, если вы не добавляете жир при приготовлении, и она недорогая.
источники белка. Орехи и арахисовое масло являются хорошими источниками белка, но они также
с высоким содержанием жира.Яйца также являются недорогим источником белка. Выбирайте обезжиренные молочные продукты
продукты часто и не добавляют жир при приготовлении или подаче этих продуктов.
Наблюдая за источниками белка и соблюдая диету в соответствии с планом MyPlate USDA, люди
могут быть уверены, что получают достаточно белка для удовлетворения своих потребностей без
лишний жир, который им не нужен.
Таблица 1. Белок в обычных продуктах питания, граммы на порцию
| Еда и размер порции | Белок | жир |
|---|---|---|
| Курица, легкое мясо, без кожи, 3 унции, приготовленная | 26.3 | 3,0 |
| Жаркое из свинины, 3 унции, приготовленное | 23,9 | 8,9 |
| Курица, темное мясо, 3 унции, приготовленная | 23,3 | 9,3 |
| Говядина, стейк, 3 унции, приготовленная | 22.6 | 4,9 |
| Сыр Чеддер, 3 унции | 21,1 | 28,2 |
| Творог, обезжиренный 1/2 стакана | 15.6 | 2,2 |
| Молоко обезжиренное, 1 стакан | 8,4 | 0,4 |
| Яйцо, 1 целое | 6,3 | 5,3 |
| Арахисовое масло, 2 столовые ложки | 7.9 | 16,0 |
| Запеченная фасоль, 1/2 стакана | 6,6 | 1,3 |
| Семена подсолнечника, 1/4 стакана | 6,2 | 15,9 |
| Пекан, 1/4 стакана | 2.3 | 20,2 |
| Овсянка, 3/4 стакана | 4,6 | 1,8 |
| Рис 1/2 стакана | 2.8 | 0,3 |
| Цельнозерновой хлеб, 1 ломтик | 2,6 | 1,5 |
| Белый хлеб, 1 слайд | 2,5 | 0,9 |
| Яблоко, 1 целое | 0.3 | 0,5 |
| Зеленая фасоль, 1/2 стакана | 0,9 | 0,1 |
| Брокколи, 1/2 стакана | 2,3 | 0,1 |
Список литературы
Уитни, Э.Н. и Рольфес, С. (2015) Понимание питания , 14-е изд. Wadsworth Cengage Learning, Белмонт, Калифорния.
Министерство сельского хозяйства США. Выберите MyPlate.gov. Доступно по адресу: www.choosemyplate.gov
.
Дженис Р. Херманн, доктор философии, RD / LD
Специалист по питанию
Была ли эта информация полезной?
ДА НЕТ
8 основных функций белков с примерами (классификация белков по функциям)
Если вы хотите выбрать биомолекулу, которую можно назвать «универсалом», то это, несомненно, белки.Белки — это биомолекулы, которые могут играть множество ролей внутри клетки. Это рабочая сила внутри ячеек, которая выполняет множество функций.
Белки состоят из 20 различных видов аминокислот, соединенных ковалентными связями, называемыми пептидными связями. Несмотря на то, что известно более 300 аминокислот, только 20 называются стандартными аминокислотами, поскольку они присутствуют почти во всех клетках.
Классификация белков на основе функции
1. Белки — это ферменты: Ферменты — это биологические катализаторы, участвующие почти во всех биологических реакциях.Ферменты ускоряют биологические реакции, снижая энергию активации без каких-либо изменений. Почти все ферменты представляют собой глобулярные белки.
Примеры: протеаза, амилаза, каталаза, липаза и т. Д.
2. Как структурные белки: Обычно инертны к биологическим реакциям.
Примеры:
-
Коллаген является структурным белком и наиболее распространенным белком у животных
-
Кератин — структурный белок ногтей, волос, перьев, панциря черепахи и т. Д.
-
Фиброин в паутине
-
Ресилин в петлях крыльев некоторых насекомых
3.Транспортные белки или белки-носители
Он участвует в транспортировке основных биологических факторов или молекул к различным частям организмов.
Примеры:
-
Hb эритроцитов переносит кислород в разные ткани
-
Плазма крови содержит липопротеины, переносящие липиды из печени в другие органы
-
Церулоплазмин, транспортный белок, переносящий медь в крови
,00
4.Пищевые или запасные белки
Примеры:
5. Белки в движении: сократительные или моторные белки
6. Защитные белки: Антитела, участвующие в иммунном ответе, представляют собой белки.
7. Регуляторные белки: Многие белки участвуют в передаче сигналов. Пептидные гормоны присутствуют и регулируют клеточную и физиологическую активность.
Примеры:
8. Токсичные белки: Функция — защита
Примеры:
Таким образом, обладая поразительным разнообразием функций, белки являются самой распространенной бимолекулой в клетке.
Каково основное назначение белка в живых организмах?
Обновлено 28 ноября 2018 г.
Автор: Анджела Огунджими
Белок — это питательное вещество, необходимое вашему организму для роста, а также для поддержания и поддержания вашей жизни. После воды белок является самым богатым веществом в вашем теле. Возможно, вы знаете, что ваши мышцы состоят из белка, но это вещество в различных формах выполняет другие важные функции. Например, белки помогают клеткам развиваться и общаться, действуют как ферменты и гормоны, осуществляют транспорт питательных веществ по кровотоку и восстанавливают поврежденные ткани.Другими словами, вы не можете жить без белка.
Мышечная масса
Строительными блоками белков являются аминокислоты. Двадцать известных аминокислот соединяются вместе, образуя различные виды белков. Белки, называемые актином и миозином, составляют большую часть ваших мышечных волокон. Они скользят мимо друг друга, образуя поперечные мостики, которые позволяют мышцам сокращаться. Они позволяют двигаться практически во всех формах: от моргания глаз до бега, прыжков и танцев. Ваше сердце, печень, легкие и большинство органов вашего тела состоят из белков.
Формирование клеток
В каждой клетке вашего тела есть белок. Огромные кластеры белков объединяются, чтобы построить клетки, выполняя такие задачи, как копирование генов во время деления клеток и разработка новых белков. Белковые рецепторы вне клетки связываются с белками-партнерами внутри клетки. Белок-носитель используется для образования гемоглобина, части красных кровяных телец, которая переносит кислород по всему телу. Белок также является важной частью вашей иммунной системы, поскольку он является важным ингредиентом антител, вырабатываемых вашим организмом для защиты от инфекций.
Уход и восстановление тканей
Белок необходим, чтобы помочь вашему телу восстанавливать клетки и создавать новые. Ваши волосы, кожа и ногти состоят из определенного типа белка, который также необходим для поддержания их целостности, а также для восстановления и замены тканей. Например, если вы упадете и у вас появится синяк, протеин очень сильно влияет на заживление ваших ран. Белки также поддерживают ваше тело. Например, коллаген — это волокнистый белок в хрящах и сухожилиях, который поддерживает кости и поддерживает кожу.
Ферменты и гормоны
Ферменты — это белки, которые контролируют химические реакции в организме. Многие гормоны по сути являются белками-посланниками, которые говорят вашим клеткам, как себя вести. Ферменты в слюне, желудке и кишечнике — это белки, которые помогают пищеварению. Инсулин — это пример белка, который действует как гормон. Его задача — помочь переместить сахар в ваши клетки, чтобы обеспечить им топливо.
Источник энергии
В качестве макроэлемента или питательного вещества, которое вам нужно в довольно больших количествах, ваш организм может использовать белок в качестве источника энергии.У здоровых, хорошо питающихся людей ваше тело будет пытаться сберечь запасы протеина, прежде чем погрузиться в них. В конце концов, у них есть важная работа. Однако, если у вас недостаточно углеводов или жиров, можно использовать белок. С другой стороны, если вы потребляете больше белка, чем нужно вашему организму, он может откладываться в виде жира.
Белок — обзор | Темы ScienceDirect
Белки
Белки — это больше, чем мясо, птица, рыба, яйца, молочные продукты и молочные продукты или овощи.Белок — это строительные блоки в этих незаменимых для жизни продуктах. Неудивительно, что греческое слово «белок» — prota , что означает «первостепенное значение».
Белок был впервые открыт и назван химиками в 1800-х годах. Белок был известен своей центральной ролью в живых организмах в начале 1900-х годов и идентифицирован по его структуре в 1950-х годах. Первыми белками, которые были изучены, были уреаза , фермент; инсулин , гормон; и гемоглобин и миоглобин , белки крови и мышц, которые помогают идентифицировать многие функции, которые белок выполняет в организме человека [1,2].
Morsel
«Птица для повара — то же самое, что холст для художника».
— Антельм Брилья-Саварен (французский эпикюр, гастроном, юрист и политик, 1755–1826)
Аминокислоты , структурные строительные блоки, которые существуют в этих и других белках, отвечают за функции организма и, в конечном итоге, для жизни. Эти микроскопические аминокислоты являются основными единицами белковой пищи, которую вы потребляете: говядины, молочных продуктов, рыбы, баранины, бобовых, орехов и семян, свинины, птицы, морепродуктов, овощей и даже некоторых фруктов!
В этой главе исследуются источники и функции белка в рационе человека.Он сравнивает и сравнивает животные и растительные белки и их роль в здоровье и болезнях, особенно пищевой аллергии. Вы узнаете о некоторых белках, которые могут быть для вас новыми, например, об аналогах мяса, морских белках и соевых продуктах. Вы узнаете, как выбрать, приготовить, приготовить и запечь эти необычные и более привычные виды протеина. Вы определите, сколько белка необходимо ежедневно, и как это влияет на выбор продуктов. Вы поймете, как в рецептах можно добавить немного протеина с прекрасным вкусом, и что слишком много протеина может быть опасно для здоровья.Наконец, вы узнаете, как магия науки о питании и искусство приготовления пищи помогают превратить белковые продукты в вкусные рецепты.
Проблема с белками
Какой белок считается достаточным в рационе человека? Что такое слишком мало или слишком много белка? Сколько белков следует употреблять по сравнению с углеводами или жирами? Это постоянные вопросы с момента открытия белка, и они продолжают оставаться противоречивыми сегодня.
Потребность в белке зависит от многих факторов, и то, что безопасно и подходит для одного человека, может не подходить для другого.Как и в случае с другими питательными веществами в обычном рационе, умеренность является ключевым моментом. Существуют ситуации, требующие большего количества белка, и состояния, вызывающие «истощение» или потерю белка и перегрузку белком.
Прочный фундамент, основанный на науке о белке, необходим для понимания роли белка в здоровье и болезнях, а также для преобразования этой информации в рекомендации по питанию и кулинарные приложения. «Проблема с белками» будет еще раз рассмотрена в конце этой главы, чтобы можно было сделать обоснованные выводы и действия.
Знакомство с белком | Статьи
Белок — это важный макроэлемент, который способствует построению, поддержанию, регулированию и восстановлению тканей организма. В частности, основные функции белка в организме включают:
- , служащие ферментами для катализирования реакций в таких процессах, как метаболизм, репликация ДНК и пищеварение [Shils 2006]
- , служащие определенными гормонами и антителами
- регулирует основные процессы в организме, включая распределение воды в организме, транспортировку питательных веществ и сокращение мышц
- помогает поддерживать кислотно-щелочной баланс
- обеспечивает источник энергии — около 4 калорий на грамм
- помогает сохранить здоровье кожи, волос и ногтей.
В рекомендациях по рекомендуемой диете рекомендуется, чтобы белок составлял от 5% до 20% калорий, ежедневно потребляемых детьми в возрасте 1–3 лет, и 10–30% от общего количества потребляемой энергии для детей в возрасте 4–18 лет.
Белок — это химическое соединение, которое содержит те же атомы, что и углеводы и жир: углерод (C), водород (H) и кислород (O), но белок также содержит атомы азота (N). Эти атомы C, H, O и N организованы в аминокислоты, которые связаны в цепи, образуя белки.Размеры и структуры белков сильно различаются по сложности, что позволяет белкам выполнять в клетке самые разные функции. Например, структура аминокислоты лизина показана ниже.
| Лизин |
|---|
|
H 2 N — (CH 2 ) — COOH | NH 2 |
Аминокислоты
Аминокислоты подразделяются на незаменимые или заменимые.Наш организм может вырабатывать заменимые аминокислоты, но не незаменимые аминокислоты. Эти 8 незаменимых аминокислот должны поступать в наш рацион.
| Essential | Необходимо в определенных случаях | Несущественное | Несекретный |
|---|---|---|---|
|
|
|
|
Потребность в аминокислотах зависит от возраста и состояния здоровья человека; у детей способность синтезировать несколько заменимых аминокислот развита не полностью.
Аминокислоты соединяются вместе, образуя белки. Они соединяются посредством реакции конденсации. Когда молекула воды отделяется от 2 аминокислот, образуется связь с образованием дипептида. Большинство белков представляют собой полипептиды длиной от 100 до 300 аминокислот.
Роль белка в пище
Роль белка в пище заключается не в непосредственном обеспечении организма белками, а в обеспечении аминокислот, из которых организм может производить свои собственные белки. Чтобы вырабатывать телесный белок, клетка должна иметь все необходимые аминокислоты одновременно.Пищевой белок должен поставлять незаменимые аминокислоты и достаточное количество азота для синтеза других.
Полные и неполные белки
Белки также можно разделить на полные и неполные. Полный белок — это белок, содержащий все незаменимые аминокислоты; неполный белок не имеет одной или нескольких незаменимых аминокислот.
| Белки | Описания | Источники питания |
|---|---|---|
| Полные белки | Белки, содержащие все незаменимые аминокислоты | Продукты животного происхождения, такие как мясо, яйца, молоко и молочные продукты |
| Неполные белки | Белки, в которых обычно не хватает одной или нескольких незаменимых аминокислот | Растительные продукты, такие как зерна, бобовые и орехи / семена |
Неполные источники белка можно комбинировать для создания полных белков.Детям, соблюдающим вегетарианскую диету, важно употреблять разнообразную растительную пищу, чтобы получать достаточно белка. Например, сочетание зерна и бобовых (рис и бобы), зерна и ореха / семени (булочка из цельной пшеницы с семенами кунжута) или бобовых и орехов / семян (перегной, который представляет собой нут и кунжутную пасту) создает питательные полные белковые комбинации, обеспечивающие хороший аминокислотный баланс при смешивании в надлежащих количествах. Если вегетарианская диета допускает яйца, молоко или сыр, которые являются полноценными белками, включение таких продуктов с зерновыми или бобовыми даст дополнительный синергетический эффект с аминокислотами.
Заключение
Хорошее понимание белков, включая их важную роль в организме и способы, которыми диетический белок поддерживает рост, развитие и поддержание тканей организма, может помочь оценить ценность этого макроэлемента.
Здоровая диета включает в себя баланс питательных источников белков. Диета с низким содержанием этого важного питательного вещества или с его дефицитом на самом деле не является «сбалансированной» и требует корректировки, чтобы наилучшим образом поддерживать общее состояние здоровья.
Ссылки:
Комитет по питанию Американской академии педиатрии. Клейнман РЭ, изд. Справочник по педиатрическому питанию. 6-е издание. © 2009 Американская педиатрическая академия.
Референсные нормы приема пищи (DRI): рекомендуемые дозы для отдельных лиц, макроэлементы
Совет по пищевым продуктам и питанию, Институт медицины, Национальные академии
http://www.iom.edu/Activities/Nutrition/SummaryDRIs/~/media/Files/ Активность% 20Файлы / Питание / DRI / 5_Summary
% 20Table% 20Tables% 201-4.pdf
Министерство здравоохранения и социальных служб США и Министерство сельского хозяйства США. Рекомендации по питанию для американцев, 2010 г.
http://www.cnpp.usda.gov/DGAs2010-DGACReport.htm
Shils ME et al., Eds. Современное питание в здоровье и болезнях. Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс, 2006.
.