Аминокислоты. Состав аминокислот. Химические свойства аминокислот
Состав аминокислот
Аминокислоты — это производные углеводородов. В состав аминокислот входят молекулы, у которых есть два вида функциональных групп: карбоксильная группа, имеющая кислотные свойства и аминогруппа, обладающая основными свойствами этого вещества.
Состав аминокислот можно выразить формулой: NH2-R-COOH.
Примерами аминокислот могут быть:
- Аминоуксусная NH2-СH2-COOH
- Аминопропионовая NH2-СH2-СH2-COOH
- Аминокапроновая NH2-(СH2)5-COOH
- Аминоэнантовая NH2-(СH2)6-COOH
- Аминобензойная NH2-С6H4-COOH
Глутаминовая кислта. АминокислотыГлицин. АминокислотыАцетилхолин. АминокислотыДофамин. АминокислотыСератонин. Аминокислоты
АминокислотыАцетилхолин. АминокислотыДофамин. АминокислотыСератонин. Аминокислоты
В зависимости от расположения этих функциональных групп возникает множество изомеров. Наибольший интерес представляет А-аминокислоты, то есть аминокислоты, в которых карбоксильная группа и аминогруппа находятся рядом. Именно А-аминокислоты входят в состав белков!
Аминокислоты — это твёрдые кристаллические вещества, что объясняется строением их молекул. В состав аминокислот входит внутренняя соль, где соль, надо понимать, как сложное вещество с химической точки зрения!).
Получение аминокислот
Получение аминокислот связано с гидролизом белков, но их можно синтезировать из карбоновых кислот, для чего сначала получают хлорпроизводные кислоты, которые затем обрабатывают аммиаком.
Сератонин. АминокислотыСератонин. АминокислотыСератонин. Аминокислоты
Химические свойства аминокислот
Химические свойства аминокислот определяются наличием двух противоположных по свойствам функциональных групп (карбоксильная группа и аминогруппа), входящих в состав аминокислот, что придает им амфотерные свойства (свойства и кислоты, и основания одновременно). Так, аминокислоты вступают в химическую реакцию с основаниями и спиртами, при этом образуются химические соединения, аналогичные продуктам реакции карбоновых кислот со щелочами и спиртами — соли и сложные эфиры.
Так, аминокислоты вступают в химическую реакцию с основаниями и спиртами, при этом образуются химические соединения, аналогичные продуктам реакции карбоновых кислот со щелочами и спиртами — соли и сложные эфиры.
Как основания, аминокислоты легко взаимодействуют с кислотами, при этом образуются соли.
Сератонин. Аминокислоты
Химические свойства аминокислот позволяют им взаимодействовать друг с другом, но такое взаимодействие отличается от привычных реакций. В результате химических реакции могут образовываться соединения с большим числом аминокислотных остатков — полипептиды. Группа атомов — CO — NH, входящих в состав аминокислот, называется пептидной группой, а связь между атомами азота и углерода — пептидная связь или амидная связь. Благодаря этим связям остатки аминокислот соединяются молекулах белков и некоторых волокон (например, в капроне)
Аминокислоты как «кирпичики», из которых построены белки, применяются в медицине: их прописывают больным и сильно и сильно ослабленным после тяжёлых операций и лечения, при заболеваниях желудочного тракта, а также нервных заболеваний. Аминокислоты используют в сельском хозяйстве в качестве добавки к корму животных.
Аминокислоты используют в сельском хозяйстве в качестве добавки к корму животных.
Аминокапроновая кислота и аминоэнантовая кислота, служат исходным сырьём для получения синтетических волокон «капрон» и «энант».
Аминопропионовая кислота — образуется при гидролизе натурального шёлка. А вот её остаток содержится почти во всех белках!
Аминоуксусная кислота — представляет собой белое кристаллические вещество, которое очень хорошо растворимо в воде. Она имеет сладкий вкус, поэтому её второе название гликоль.
Сколько аминокислот входит в состав белков, как они называются?
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Сколько аминокислот входит в состав белков, как они называются?
Белок является главным строительным материалом для организма. Его структура сложная и многоступенчатая. Какие аминокислоты входят в его состав?
Белок очень важен для организма, так как является строительным материалом. Его основой являются аминокислоты. Эти вещества отвечают за разные функции и нужны для поддержания нормального состояния организма.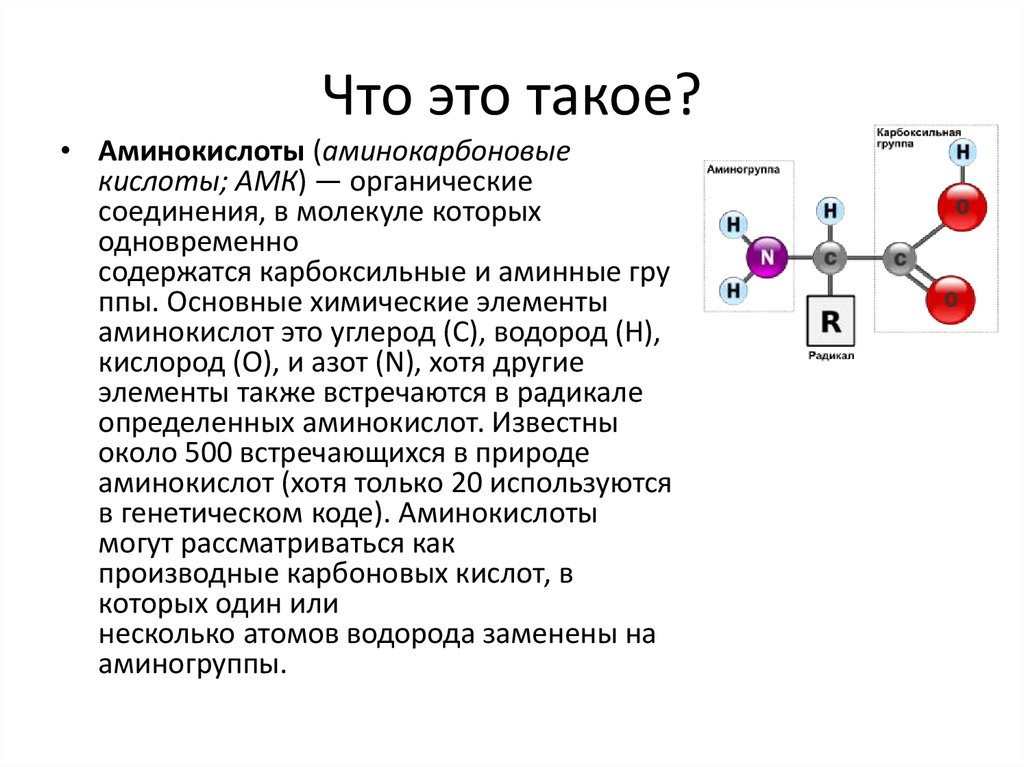
Основные свойства аминокислот
Аминокислоты обладают следующими свойствами:
- Быстро и хорошо растворяются в жидкой среде.
- По форме напоминают кристаллы.
- При воздействии высоких температур могут расплавиться.
- Имеют некоторые признаки кислот и оснований одновременно.
- Получаются в процессе белкового гидролиза.
Для чего аминокислоты нужны организму?
Биологическая роль аминокислот заключается в следующем:
- обеспечивают правильную работу иммунной системы;
- синтезируют глюкозу и участвуют в углеводном обмене;
- выступают в роли строительного материала для мышц и сухожилий;
- помогают спортсменам при наборе мышечной массы;
- поддерживают здоровье соединительных тканей;
- помогают поврежденным тканям быстрее восстановиться;
- участвуют в выработке энергии;
- выводят из организма вредные вещества и токсины;
- участвуют в образовании гормонов;
- поддерживают печень в порядке;
- помогают поддерживать нормальную работу головного мозга;
- обеспечивают бодрость духа и хорошее настроение;
- повышают работоспособность человека и его творческий потенциал;
- помогают нервным клеткам защититься от вредного воздействия алкогольных напитков;
- улучшают психическое здоровье человека;
- участвуют в жировом обмене;
- поддерживают работу органов желудочно-кишечного тракта;
- регулируют работу щитовидной железы;
- поддерживают в норме массу тела;
- замедляют естественные процессы старения.
Сколько аминокислот входит в состав белков?
В состав белков входят следующие незаменимые аминокислоты:
- Лейцин, нужный для набора мышечной массы и контроля массы тела.
- Изолейцин, стимулирующий выделение энергии.
- Лизин, отвечающий за укрепление иммунитета и повышение защитных сил организма.
- Фенилаланин, обеспечивающий правильную работу центральной нервной системы.
- Метионин, ответственный за эффективное и быстрое сжигание подкожного жира.
- Треонин, оказывающий положительное влияние на центральную нервную систему.
- Триптофан, формирующий полезные для жизнедеятельности гормоны.
- Валин, ускоряющий процессы обмена веществ.
Также белок образуют несколько заменимых аминокислот. К ним относятся:
- Аланин, необходимый для процессов углеводного обмена и выведения из организма токсических веществ.

- Аспарагиновая кислота, обеспечивающая человеку энергичность и прилив бодрости.
- Аспарагин, обеспечивающий работу центральной нервной системы и головного мозга.
- Гистидин, вырабатывающий кровяные тельца красного цвета.
- Серин, отвечающий за правильную и эффективную работу головного мозга и за протекание когнитивных процессов.
- Цистеин, подающий в организм кератин.
- Аргинин, оздоравливающий кожу, кости, мышечную ткань и сухожилия.
- Глютаминовая кислота, без которой невозможна нормальная работа головного и спинного мозга.
- Глютамин, предотвращающий атрофию мышечных волокон.
- Глицин, ускоряющий процессы свертываемости крови.
- Пролин, стимулирующий выработку коллагена.
- Тирозин, поддерживающий в норме аппетит и артериальное давление.
Внимание! В состав белков входят разные аминокислоты, заменимые и незаменимые.Они обеспечивают правильное формирование протеинов и эффективную работу всего организма.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Aминокислоты — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.
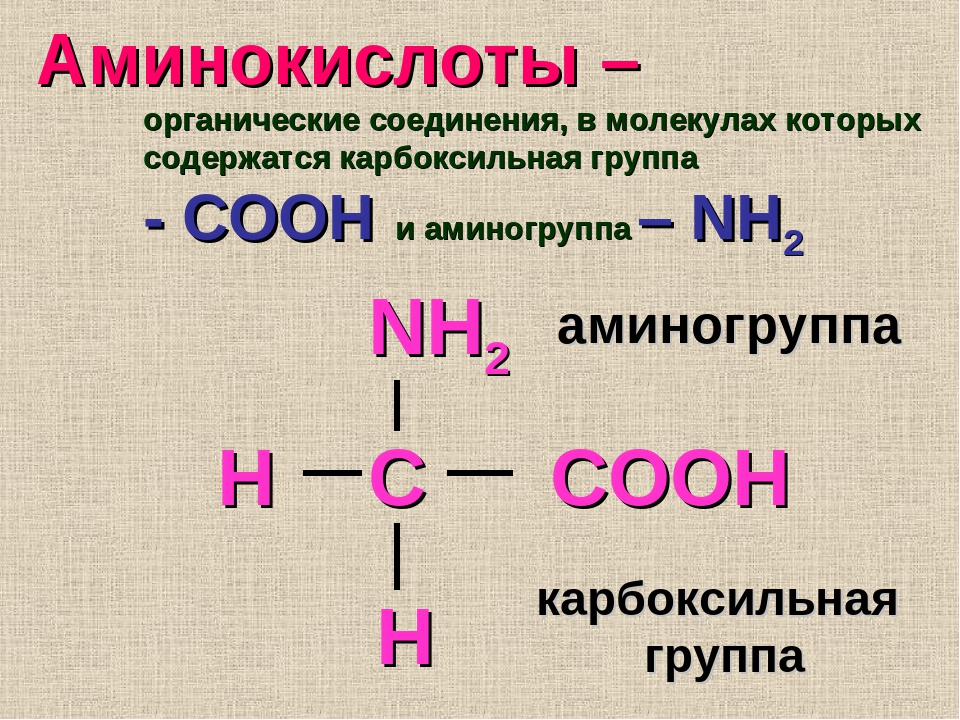
Аминокислоты — это органические вещества, в молекулах которых содержатся две функциональные группы: карбоксильная −COOH и аминогруппа −Nh3.
Состав аминокислот можно выразить формулой:
Примеры аминокислот
Аминокислоты — это производные карбоновых кислот, в молекулах которых вместо атома водорода содержится аминогруппа.
Самая простая аминокислота — аминоуксусная, или глицин .
Гомологом глицина является аланин. Его формулу можно записать следующим образом:
Аминокислоты могут содержать в радикале разные группы атомов. Так, в молекуле фенилаланина содержится бензольное кольцо. Его структурная формула:
В молекуле серина содержится гидроксильная группа:
В состав аминокислот могут также входить атомы некоторых элементов. Например, в молекуле цистеина содержится атом серы. Формула цистеина может быть представлена следующим образом:
Физические свойства
Аминокислоты — кристаллические вещества, хорошо растворимые в воде. Они могут быть сладкие, безвкусные и даже горькие. Температуры плавления всех аминокислот выше \(22\) °С.
Они могут быть сладкие, безвкусные и даже горькие. Температуры плавления всех аминокислот выше \(22\) °С.
Химические свойства
Функциональные группы определяют химические свойства аминокислот: карбоксильная — кислотные, а аминогруппа — основные. Основность аминогруппы связана со способностью атома азота присоединять к себе протоны водорода за счёт свободной электронной пары:
−N..h3+H+→−Nh4+.
Аминокислоты способны реагировать как с кислотами, так и с основаниями с образованием солей:
Аминокислоты — амфотерные органические соединения, имеющие одновременно кислотные и основные свойства.
Благодаря наличию двух функциональных групп аминокислоты способны взаимодействовать друг с другом и соединяться в более сложные вещества — пептиды:
При взаимодействии аминокислот образуются молекулы полимера (полипептида) и воды.
Реакция образования полимера, сопровождающаяся выделением низкомолекулярного вещества, называется реакцией поликонденсации.
При взаимодействии молекул аминокислот между их остатками возникает связь, которая называется пептидной связью.
Пептидная связь — связь, возникающая между остатком аминогруппы одной молекулы аминокислоты и остатком карбоксильной группы другой молекулы аминокислоты −NH−CO− в полипептидах.
Применение аминокислот
Аминокислоты используются как лекарства. В сельском хозяйстве их применяют для подкормки животных. Некоторые аминокислоты служат исходными веществами для синтеза полимеров (например, капрона).
Аминокислоты — это… Что такое Аминокислоты?
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 10 апреля 2012. |
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
История
Открытие аминокислот в составе белков
Физические свойства
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Общие химические свойства
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т. е. находятся в состоянии внутренних солей.
е. находятся в состоянии внутренних солей.
- NH2 —CH2COOH N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
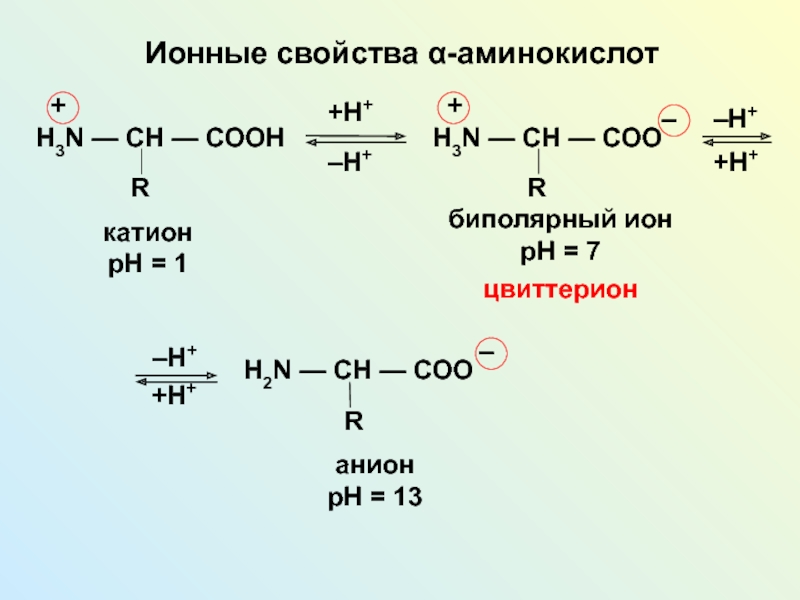
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
Данную особенность «живых» аминокислот весьма трудно объяснить, так как в реакциях между оптически неактивными веществами L и D-формы образуются в одинаковых количествах. Возможно, выбор одной из форм (L или D) — просто результат случайного стечения обстоятельств: первые молекулы, с которых смог начаться матричный синтез, обладали определенной формой, и именно к ним «приспособились» соответствующие ферменты.
D-аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: так в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[2], что может быть использовано для определения возраста млекопитающих. Рацемизация остатков аспарагиновой также отмечена при старении коллагена, предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутремолекулярном ацилировании пептидного азота свободной карбоксильной группой аспарагиновой кислоты[3].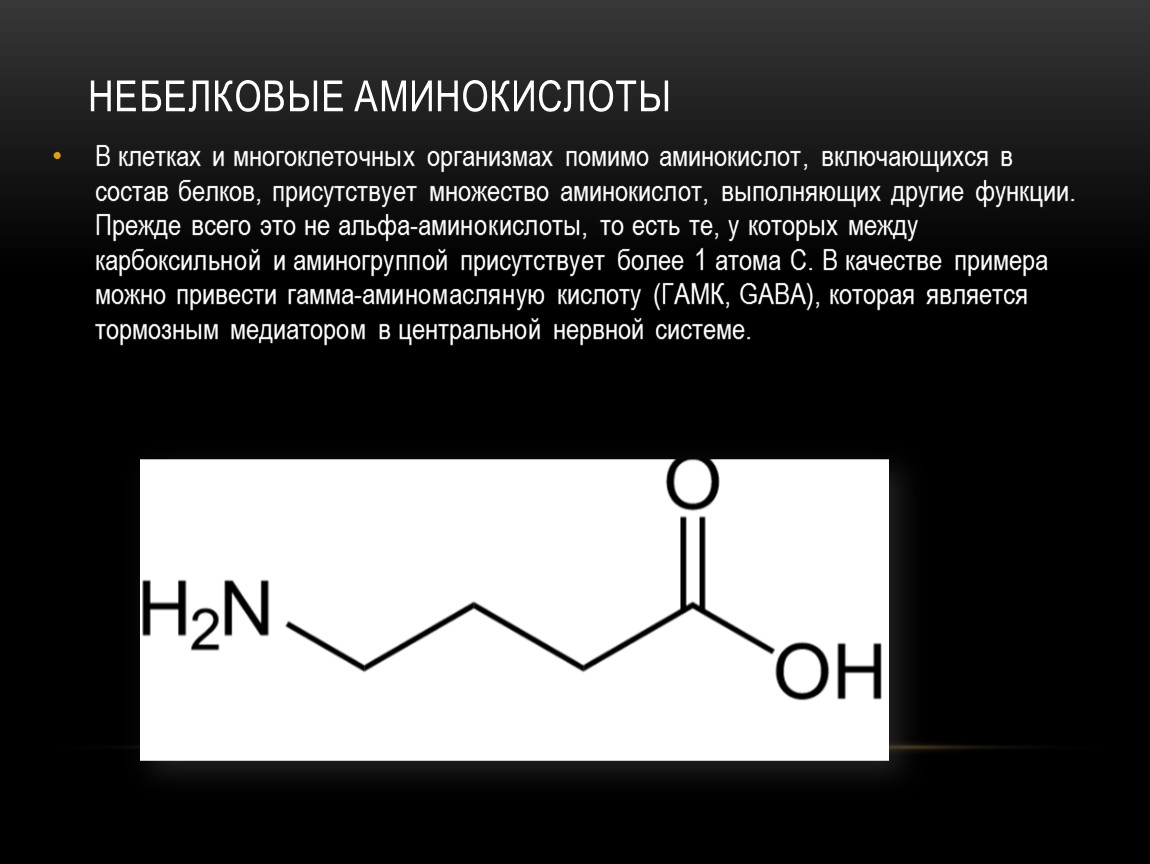
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих.
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путем нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-я и 22-я аминокислоты.
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся не решённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20-ти протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Для запоминания однобуквенного обозначения протеиногенных аминокислот используется мнемоническое правило (последний столбец).
Классификация
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
- Полярные заряженные отрицательно при pH<7: аспартат, глутамат
- Полярные заряженные положительно при pH>7: лизин, аргинин, гистидин
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями. По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы: глюкогенные (при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат), кетогенные (распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды), глюко-кетогенные (при распаде образуются метаболиты обоих типов).
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты[4].
Примечания
См. также
Ссылки
Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с. [1]
Плазмозамещающие и перфузионные растворы — АТХ код: B05
| B05A |
|
||
|---|---|---|---|
| B05B |
|
||
| B05C |
|
||
| B05D |
|
||
| B05X |
|
||
| B05Z |
Анализ мочи на аминокислоты (31 показатель)
Комплексное исследование, направленное на определение содержания аминокислот и их производных в моче в целях диагностики врождённых и приобретенных нарушений аминокислотного обмена.
Состав комплекса: Аланин • Аргинин • Аспарагиновая кислота • Цитруллин • Глутаминовая кислота • Глицин • Метионин • Орнитин • Фенилаланин • Тирозин • Валин • Лейцин • Изолейцин • Серин • Аспарагин • Alpha-аминоадипиновая кислота • Глутамин • Таурин • Гистидин • Треонин • 1-метилгистидин • 3-метилгистидин • Gamma-аминомасляная кислота • Alpha-аминомасляная кислота • Лизин • Цистин • Триптофан • Гомоцистин • Фосфоэтаноламин • Фосфосерин • Этаноламин
Синонимы русские
Аминокислотный профиль, скрининг аминоацидопатий.
Синонимы английские
Amino acid profile, screening of aminoacidopathy.
Метод исследования
Высокоэффективная жидкостная хроматография.
Единицы измерения
Ммоль/моль креат. (миллимоль на моль креатинина).
Какой биоматериал можно использовать для исследования?
Среднюю порцию утренней мочи.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Исключить прием мочегонных препаратов в течение 48 часов до сбора мочи (по согласованию с врачом).
Общая информация об исследовании
Аминокислоты – это органические соединения, которые являются основными структурными компонентами белков. В свободном или связанном состоянии они участвуют в ферментативных реакциях, гормональных процессах, выполняют роль нейротрансмиттеров, участвуют в метаболизме холестерола, регуляции рН, контроле воспалительных реакций.
Всего в составе белковых молекул в организме человека было обнаружено 20 аминокислот, из которых часть является незаменимыми, то есть они не синтезируются в организме и должны постоянно присутствовать в употребляемой человеком пище. К незаменимым аминокислотам относятся лизин, гистидин, аргинин, треонин, валин, метионин, триптофан, фенилаланин, лейцин, изолейцин. К заменимым относятся аланин, аргинин, цистин, цистеин, гистидин, глицин, серин, аспарагиновая кислота, тирозин, пролин, оксипролин, глутаминовая кислота. Помимо этого, известен ряд аминокислот, которые являются производными и важными биологическими компонентами других аминокислот.
Анализ аминокислот в моче позволяет оценить их качественный и количественный состав, получить информацию об имеющемся дисбалансе, что может свидетельствовать о пищевых и метаболических нарушениях, лежащих в основе большого числа заболеваний. Следует отметить, что снижение количества той или иной аминокислоты в моче происходит раньше, чем в плазме крови. Учитывая эти обстоятельства и доступность исходного биоматериала, определение аминокислот в моче может быть рекомендовано для оценки ранних изменений аминокислотного состава.
Для определения качественного и количественного состава аминокислот в моче используется метод высокоэффективной жидкостной хроматографии. Он относится к современным хроматографическим методам анализа. Хроматография – это метод разделения и определения веществ, основанный на распределении компонентов между двумя фазами – подвижной и неподвижной. Жидкостная хроматография – метод разделения и анализа сложных смесей веществ, в котором подвижной фазой является жидкость. Он позволяет разделить и выявить количественно более широкий круг веществ с различной молекулярной массой и размерами, в данном случае аминокислот в моче. Исследуются следующие аминокислоты и их производные.
Аланин является одним из источников синтеза глюкозы и регулятором уровня сахара в крови, а также важным энергетическим компонентом для органов центральной нервной системы.
Аргинин участвует в ряде ферментативных реакций и выведении из организма остаточного азота в составе мочевины, креатинина, орнитина, в репаративных процессах.
Аспарагиновая кислота участвует в реакцияхцикла переаминирования и мочевины, синтезе пуриновых и пиримидиновых оснований, регуляции синтеза иммуноглобулинов.
Цитруллин участвует в стимуляции процессов иммунной системы, в процессах детоксикации в печени.
Глутаминовая кислота является нейромедиаторной аминокислотой, стимулирующей передачу возбуждения в синапсах центральной нервной системы. Участвует в обмене белков, углеводов, окислительно-восстановительных процессах, детоксикационных процессах и выведении аммиака из организма. Также принимает участие в синтезе других аминокислот, ацетилхолина, АТФ (аденозинтрифостфата), в переносе ионов калия, входит в состав скелетной мускулатуры.
Глицин является нейромедиаторной аминокислотой, регулирующей процессы торможения и возбуждения в центральной нервной системе. Участвует в выработке порфиринов, пуриновых оснований. Повышает обменные процессы в головном мозге, улучшает умственную работоспособность.
Метионин – это аминокислота, которая необходима для синтеза адреналина, холина. Участвует в обмене жиров, фосфолипидов, витаминов, активирует действие гормонов, ферментов, белков. Является источником серы в выработке серосодержащих аминокислот, в частности цистеина. Метионин также обеспечивает процессы детоксикации, способствует пищеварению, является одним из источников синтеза глюкозы.
Орнитин участвует в синтезе мочевины, снижении концентрации аммиака в плазме крови, регулирует кислотно-щелочной баланс в организме человека. Необходим для синтеза и высвобождения инсулина и соматотропного гормона, для нормального функционирования иммунной системы.
Фенилаланин необходим для синтеза нейромедиаторов: адреналина, норадреналина, допамина. Улучшает работу центральной нервной системы, функционирование щитовидной железы.
Аминокислота тирозин необходима в биосинтезе меланинов, дофамина, адреналина, гормонов щитовидной железы. Улучшает работу надпочечников, щитовидной железы, гипофиза.
Валин является важным источником для функционирования мышечной ткани, участвует в поддержании баланса азота в организме, регулирует восстановительные процессы в поврежденных тканях.
Лейцин является важным компонентом в синтезе холестерина, других стероидов и гормона роста и, следовательно, участвует в процессах регенерации тканей и органов.
Изолейцин участвует в энергетических процессах организма, регулирует уровень глюкозы в крови, необходим для синтеза гемоглобина и также участвует в регенерации кожи, мышечной, хрящевой и костной тканей.
Гидроксипролин является компонентом большинства органов и тканей организма человека, входит в состав коллагена.
Аминокислота серин необходима для синтеза пуриновых и пиримидиновых оснований, а также для ряда других аминокислот (цистеина, метионина, глицина). Участвует в обмене жирных кислот и жиров, в функционировании некоторых ферментов.
Аспарагин является важным регулятором процессов, происходящих в центральной нервной системе (возбуждение-торможение), участвует в метаболизме и синтезе аминокислот в печени.
Альфа-аминоадипиновая кислота является одним из продуктов конечного обмена аминокислот.
Глутамин участвует в синтезе углеводов, других аминокислот, нуклеиновых кислот, ферментов. Обеспечивает поддержание кислотно-щелочного равновесия, необходим для синтеза белков скелетной и гладкомышечной мускулатуры, обладает антиоксидантной активностью.
Таурин способствует увеличению энергетической активности клеток, участвует в процессах заживления и регенерации, нормализует функциональное состояние клеточных мембран.
Гистидин является исходным веществом при синтезе гистамина, мышечных белков, большого числа ферментов. Входит в состав гемоглобина, участвует в процессах регенерации и роста тканей.
Треонин необходим в синтезе коллагена и эластина, регулирует обмен веществ за счет участия в функционировании работы печени, белковом и жировом обмене.
1-метилгистидин и 3-метилгистидин являются одними из показателей распада белков мышечной ткани.
Гамма-аминомасляная кислота в основном содержится в центральной нервной системе и головном мозге. Участвует в обменных процессах в данных органах, в процессах нейромедиаторной передачи импульсов, оказывая тормозящее действие на нервную активность, а также играет роль в метаболизме глюкозы.
Альфа-аминомасляная кислота участвует в синтезе некоторых белков и является продуктом биосинтеза офтальмовой кислоты, являющейся структурным компонентом хрусталика глаза.
Пролин входит в состав большинства белков, а также является компонентом инсулина, адренокортикотропного гормона, коллагена. Способствует восстановлению кожи, соединительной ткани.
Лизин входит в состав большинства белков, необходим дляроста, восстановления тканей, синтеза гормонов, ферментов, антител, синтеза коллагена.
Цистин является компонентом множества белков и донором тиольных групп для пептидов, что играет важную роль в их метаболизме и биологической активности. Входит в состав инсулина, соматотропного гормона.
Для чего используется исследование?
- Для диагностики аминокислотного состава мочи.
- Для диагностики врождённых и приобретенных нарушений аминокислотного обмена.
- Для диагностики первичных аминоацидопатий.
- Для скрининговой диагностики вторичных аминоацидопатий.
- Для контроля проводимой лекарственной терапии.
- Для оценки нутритивного статуса.
Когда назначается исследование?
- При подозрении на нарушение аминокислотного обмена, аминоацидопатии.
- При нарушении питания, диете, приеме белковых препаратов, гормональных веществ.
- При подозрении на нарушение обмена, состава аминокислот в организме человека.
- При подозрении на врождённые и приобретенные аминоацидопатии.
Что означают результаты?
Референсные значения (ммоль/моль креат.)
|
Аминокислота
|
1-3 года
|
3-6 лет
|
6-9 лет
|
9-18 лет
|
18 лет и
|
|
1-метилгистидин (1MHIS)
|
15 — 177
|
5 — 397
|
7 — 217
|
7 — 230
|
5,5 — 195
|
|
3-метилгистидин (3MHIS)
|
6 — 175
|
1 — 289
|
0,3 — 173
|
0,3 — 85
|
1,6 — 87
|
|
Аланин (ALA)
|
8 — 144
|
7 — 86
|
6,5 — 104
|
5,5 — 96
|
3,2 — 76
|
|
Alpha-аминоадипиновая к-та
|
0,4 — 43
|
0,8 — 15
|
0,5 — 26
|
0,3 — 34
|
0,3 — 13
|
|
Alpha-аминомасляная к-та
|
0,4 — 14
|
0,5 — 6,4
|
0,3 — 13
|
0,4 — 7,1
|
0,2 — 10,6
|
|
Аргинин (ARG)
|
2 — 40,5
|
1,5 — 45
|
1,2 — 38
|
0,5 — 23
|
0,5 — 24
|
|
Аспарагин (ASN)
|
3 — 83,5
|
1 — 71,5
|
1 — 65
|
0,5 — 57
|
0,5 — 60
|
|
Аспарагиновая кислота (ASP)
|
1 — 22
|
0,5 — 23
|
0,3 — 24
|
0,3 — 28
|
0,2 — 20
|
|
Валин (VAL)
|
0,8 — 20,3
|
0,4 — 14
|
0,4 — 9,5
|
0,3 — 9
|
0,3 — 7,5
|
|
Gamma-аминомасляная к-та (GABA)
|
1,9 — 130
|
0,5 — 100
|
0,4 — 35
|
0,3 — 40
|
0,3 — 25
|
|
Гистидин (HIS)
|
27 — 290
|
20 — 285
|
20 — 185
|
17 — 210
|
8 — 150
|
|
Глицин (GLY)
|
19 — 460
|
19 — 265
|
19 — 290
|
16 — 295
|
11 — 210
|
|
Глутамин (GLN)
|
4 — 155
|
5 — 104
|
5 — 95
|
4 — 87
|
2 — 53
|
|
Глутаминовая кислота (GLU)
|
0,9 — 53,5
|
0,6 — 30
|
0,5 — 22
|
0,6 — 13
|
0,3 — 20
|
|
Гомоцистин (HCY)
|
0,6 — 55
|
0,2 — 12
|
0,2 — 25
|
0,3 — 40
|
0,3 — 10
|
|
Изолейцин (ILEU)
|
0,4 — 16,5
|
0,5 — 29,5
|
0,4 — 16
|
0,25 — 14
|
0,3 — 7
|
|
Лейцин (LEU)
|
0,9 — 20,3
|
0,9 — 17,8
|
0,9 — 8,7
|
0,2 — 9,2
|
0,4 — 7,4
|
|
Лизин (LYS)
|
6 — 143
|
3,1 — 97
|
2,3 — 59
|
1,5 — 55
|
1,3 — 45
|
|
Метионин (MET)
|
1,5 — 14
|
0,7 — 19,6
|
0,6 — 20,8
|
0,4 — 10,5
|
0,4 — 9,5
|
|
Орнитин (ORN)
|
0,9 — 30
|
0,8 — 27,2
|
0,5 — 18
|
0,5 — 19,8
|
0,3 — 14
|
|
Серин (SER)
|
3,7 — 161
|
15,7 — 115
|
9 — 102
|
9,2 — 83
|
5,3 — 58
|
|
Таурин (TAU)
|
16,5 — 390
|
13,8 — 335
|
13 — 282
|
12,9 — 300
|
6 — 240
|
|
Тирозин (TYR)
|
1,15 — 41,1
|
1,1 — 21
|
1,3 — 23
|
1 — 17,8
|
0,5 — 12,5
|
|
Треонин (THRE)
|
2,4 — 68
|
3,1 — 55
|
2,6 — 39
|
2,5 — 40
|
1,6 — 23,5
|
|
Триптофан (TRP)
|
2 — 49
|
1,5 — 42
|
1,5 — 47
|
0,8 — 45
|
0,8 — 20
|
|
Фенилаланин (PHE)
|
1,4 — 21,5
|
0,8 — 19
|
0,8 — 17
|
0,7 — 12
|
0,4 — 7,5
|
|
Фосфосерин (PSE)
|
2,2 — 17,8
|
1,2 — 30
|
1,2 — 17,7
|
0,8 — 16,3
|
0,6 — 14
|
|
Фосфаэтаноламин (PET)
|
1,6 — 118
|
1,8 — 131
|
1,5 — 110
|
1 — 55
|
0,6 — 46
|
|
Цистин (CYS)
|
1,7 — 12,2
|
0,9 — 9,8
|
0,8 — 7,3
|
0,6 — 7,2
|
0,5 — 8,7
|
|
Цитруллин (CIT)
|
0,35 — 8,7
|
0,3 — 5
|
0,4 — 4,8
|
0,2 — 5,1
|
0,15 — 5,4
|
|
Этаноламин (ETA)
|
14 — 129
|
6,5 — 134
|
8 — 105
|
4 — 131
|
4,5 — 94
|
Причины повышения и понижения:
- сердечно-сосудистые заболевания;
- сердечная недостаточность;
- эпилепсия;
- депрессии;
- тревожность;
- бессонница;
- энцефалопатии;
- синдром хронической усталости;
- рассеянный склероз;
- ревматоидный артрит;
- эректильная дисфункция;
- хронические заболевания почек;
- хронические заболевания печени;
- сахарный диабет;
- диета, голодание;
- множественные травмы;
- ожоги.
Что может влиять на результат?
- Возраст;
- пол;
- диета и употребляемая пища;
- лекарственные препараты, в частности белковые и гормональные препараты, биологически активные добавки;
- голодание;
- прием алкоголя.
Скачать пример результата
Также рекомендуется
[06-011] Белковые фракции в сыворотке
[06-034] Мочевина в сыворотке
[06-021] Креатинин в сыворотке (с определением СКФ)
[06-038] Белок общий в моче
[06-057] Креатинин в суточной моче
Кто назначает исследование?
Терапевт, врач общей практики, педиатр, нефролог, анестезиолог-реаниматолог, неонатолог, ревматолог, хирург.
Литература
- Amino acids. In The Metabolic and Molecular Bases of Inherited Disease. Eighth edition. Edited by CR Scriver, AL Beaudet, WS Sly, et al. New York, McGraw-Hill, 2001, pp 1667-2105.
- Camargo SMR, Bockenhauer D, Kleta R: Aminoacidurias: Clinical and molecular aspects. Kidney Int 2008;73:918-925.
- Fauci, Braunwald, Kasper, Hauser, Longo, Jameson, Loscalzo Harrison’s principles of internal medicine, 17th edition, 2009.
- Шаповалова Е.Н., Пирогов А.В. Хроматографические методы анализа. Методическое пособие для специального курса. – Москва, 2007.
Сколько аминокислот входит в состав белка
Опубликовано: 20.03.2020Время на чтение: 4 минуты5373
Какие аминокислоты входят в состав белка
Аминокислоты, или аминокарбоновые, кислоты (АМК) — очень крупная группа соединений. Известное на сегодня количество таких веществ, существующих природе, достигает пятисот. Но в клетках и тканях человеческого организма их намного меньше: порядка 170. А в составе белка, ответственного за передачу генетической информации, совсем «мало» — двадцать три. Наиболее важными для организма человека являются следующие аминокарбоновые соединения:
- аланин,
- аргинин,
- аспарагин,
- валин,
- гамма-аминомасляная кислота,
- глютаминовая кислота,
- глютамин,
- глютатион,
- глицин,
- гистидин,
- диметилглицин,
- изолейцин,
- карнитин,
- лейцин,
- лизин,
- метионин,
- орнитин,
- пролин,
- серин,
- таурин,
- треонин,
- триптофан,
- тирозин,
- фенилаланин,
- цитруллин,
- цистеин и цистин.
Каждая аминокислота играет собственную роль как в синтезе белка, так и в других процессах, определяющих здоровье человека, его уровень энергии, умственные способности и пр.
Как посчитать количество
Сколько аминокислот в белке, определяется самим белком. В полноценном протеине (он так и называется — полноценный) обнаруживается весь аминокарбоновый состав. В неполноценном отсутствует несколько АМК. Кроме того, белки могут быть простыми (в их состав входят только аминокислоты) и сложными (аминокислотный «комплекс» дополнен другими химическими соединениями). Но во всех случаях именно аминокарбоновые кислоты являются основой для построения молекулы протеина, и без этих веществ невозможна правильная работа организма.
Заменимые и незаменимые аминокислоты
Весь «набор» аминокислот можно распределить в такие группы:
- Заменимые. Эти вещества, входящие в состав белка, могут синтезироваться в организме человека из веществ, которые поступают вместе с пищей. При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент.
- Незаменимые. Эти аминокислоты неспособны синтезироваться организмом и могут поступать в него только в готовом виде, вместе с пищей.
- Условно-незаменимые. В эту группу входят аминокислоты, которые в норме синтезируются в организме человека. Но после перенесенных заболеваний, при высоком уровне стресса, проживании в неблагоприятной экологической обстановке и др. их синтез резко снижается или прекращается вовсе.
Роль аминокислот в организме
Когда речь заходит о белке в организме человека, с ним ассоциируют набор мышечной массы. Соответственно, белок рассматривают в качестве «топлива» для мышц. Но это лишь одна из функций протеина, который в теле человека представлен огромным разнообразием. Белок — это комплекс аминокислот, соединенных между собой пептидами. В зависимости от того, как АМК распределены в молекуле протеина и каким образом они соединены, меняется структура белка, его функции и другие характеристики. Возможно, кого-то это удивит, но под протеинами следует понимать не только «кирпичики» для набора мышечной массы, но и:
- коллаген — естественный «каркас», обеспечивающий упругость кожи, входящий в состав хрящевой ткани и пр.;
- нейромедиаторы — соединения, которые обеспечивают правильную интерпретацию нервных сигналов и их передачу между всеми органами и тканями;
- гормоны — вещества, регулирующие все функции организма: от работы репродуктивной системы до психических реакций.
Этот список можно еще продолжать.
Причины дефицита аминокислот
Даже при современном уровне доступности любой информации продолжает существовать заблуждение о том, что весь набор аминокислот можно получить только из пищи животного происхождения. На самом деле, аминокарбоновые кислоты синтезируется и в растениях. Но биодоступность (усвояемость) таких АМК немного ниже, чем их продуктов животного происхождения.
Вегетарианство. Людям, придерживающимся принципов веганства, следует более тщательно контролировать свой рацион, чтобы гарантированно получать из пищи незаменимые аминокислоты.
Высокие нагрузки. Еще одна группа риска — люди, подвергающиеся чрезмерным физическим или психическим нагрузкам. При таких обстоятельствах расход аминокислот существенно выше, так как им приходится восстанавливать клеточные и тканевые ресурсы, израсходованные во время тренировок или стресса.
Некоторые заболевания. Они также могут быть причиной дефицита аминокислот. В частности, нарушения всасывания питательных веществ, при которых определенные вещества, потребляемые вместе с пищей, проходят через организм «транзитом» и неспособны принять участие в синтезе аминокислот или восполнении их дефицита.
Как предупредить дефицит аминокислот
Контроль над сбалансированным и регулярным питанием — основа поддержания аминокислотного состава на нужном уровне. Но это не всегда возможно, и вот почему. Если использовать только продукты питания, невозможно положить в тарелку только аминокислоты. Приходится учитывать еще и калорийность приема пищи, содержание в блюде жиров, углеводов, клетчатки и пр. В итоге число потребленных аминокислот может ограничиваться двумя-тремя, но быть серьезно «обремененным» лишними калориями. Эта проблема особенно актуальна для спортсменов, людей, следящих за фигурой, и тех, кому жирная или калорийная пища нежелательна с точки зрения здоровья.
Niteworks от HERBALIFE Nutrition
В описанных выше ситуациях на помощь могут прийти специальные добавки, например Niteworks от HERBALIFE Nutrition*. В состав продукта входят аминокислоты, поддерживающие правильную работу сердца и сосудов, повышающие эластичность стенок сосудов. Одна порция напитка, приготовленного с этой пищевой добавкой, способна поддерживать уровень ряда важных аминокислот на нормальном уровне в течение суток*.
Как проявляется дефицит
При дефиците аминокислот в организме могут возникать следующие неприятные симптомы:
- быстрая умственная и физическая утомляемость;
- мышечная слабость;
- боль в суставах, нарушение их подвижности;
- отеки;
- «необъяснимые» приступы голода;
- снижение остроты зрения;
- ухудшение состояния волос, ногтей, кожи.
На перечисленные симптомы особенно важно обратить внимание, если вы длительное время придерживаетесь ограничительной диеты, испытываете стрессы, подвергаетесь тяжелым физическим нагрузкам, перенесли какое-либо заболевание. Но во всех случаях следует предварительно проконсультироваться с врачом, так как признаки белкового дефицита неспецифичны и схожи с симптомами ряда заболеваний.
* БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
Узнайте, как питаться
сбалансированно
и контролировать
свой весУзнать больше
2020-03-20
Автор: Будь в Форме
Оцените материал!
Добавить отзыв
Отзывы
СветЛана
| 19.12.2020 21:52
Полезная информация
|
💊 Состав препарата Кетоаналоги аминокислот ✅ Применение препарата Кетоаналоги аминокислот Сохраните у себя Поделиться с друзьями Пожалуйста, заполните поля e-mail адресов и убедитесь в их правильности Описание активных компонентов препарата Кетоаналоги аминокислот Приведенная научная информация является обобщающей и не может быть использована для принятия Дата обновления: 2020.11.30 Владелец регистрационного удостоверения:Код ATX: V06DD (Аминокислоты, включая комбинации с полипептидами) Лекарственная форма
Форма выпуска, упаковка и состав
|
| 1 таб. | |
| D,L-метил-оксо-2-кальций валеринат (α-кетоаналог изолейцина) | 67 мг |
| метил-4-оксо-2-кальций валеринат (α-кетоаналог лейцина) | 101 мг |
| оксо-2-фенил-3-кальций пропионат (α-кетоаналог фенилаланина) | 68 мг |
| метил-оксо-2-кальций бутират (α-кетоаналог валина) | 86 мг |
| D,L-гидрокси-2-кальция метилбутират (α-гидроксианалог метионина) | 59 мг |
| лизина моноацетат | 105 мг |
| треонин | 53 мг |
| триптофан | 23 мг |
| гистидин | 38 мг |
| тирозин | 30 мг |
Вспомогательные вещества: кросповидон — 20 мг, макрогол 6000 — 50 мг, крахмал прежелатинизированный — 50 мг, повидон К30 — 8 мг, магния стеарат — 4 мг.
Пленочная оболочка: опадрай 85F620005 желтый — 23 мг (поливиниловый спирт — 12,4 мг; титана диоксид — 6,6 мг; макрогол 3350 — 1,2 мг; тальк — 1 мг; краситель хинолиновый желтый (Е104) — 1,8 мг).
20 шт. — блистеры (5) и фольги алюминиевой — пачки картонные из пленки полиэтилентерефталатной. фольги алюминиевой и пленки полиэтиленовой.
24 шт. — блистеры (4) и фольги алюминиевой — пачки картонные из пленки полиэтилентерефталатной. фольги алюминиевой и пленки полиэтиленовой.
Фармакологическое действие
Питательное средство при почечной недостаточности. Обеспечивает поступление в организм незаменимых аминокислот при минимальном поступлении азота.
После абсорбции, кето- и гидроксикислоты могут трансаминироваться с образованием соответствующих незаменимых аминокислот, при этом аминогруппа переносится от заменимых аминокислот. В силу повторного использования аминогруппы, замедляется образование мочевины и снижается накопление уремических токсинов. Кето- и гидроксикислоты не вызывают гиперфильтрацию в оставшихся нефронах. Кетосодержащие добавки положительно влияют на почечную гиперфосфатемию и вторичный гиперпаратиреоз. Более того, возможно улучшение течения остеодистрофии. Применение данного средства с одновременным соблюдением диеты с очень низким содержанием белка позволяет снизить поступление азота, не допуская при этом нежелательных явлений вследствие неполноценного питания и недостаточного поступления белка с пищей.
Фармакокинетика
Процессы абсорбции у пациентов с уремией, принимающих аминокислоты, по-видимому, не приводят к нарушению их плазменных концентраций, т.е. абсорбция не нарушается. Изменения плазменных концентраций, вероятно, возникают на этапах, следующих после абсорбции аминокислот; они выявляются на ранней стадии заболевания.
Индивидуальные концентрации кетокислот увеличиваются до пяти раз от исходных. Cmax достигаются в течение 20-60 мин, спустя 90 мин концентрации возвращаются к исходным. Таким образом, абсорбция из ЖКТ очень быстрая. Одновременное повышение плазменных концентраций кетокислот и соответствующих аминокислот свидетельствует о высокой скорости трансаминирования. Ввиду наличия в организме физиологических путей утилизации кетокислот, экзогенные кетокислоты, по-видимому, быстро встраиваются в метаболические циклы. Кетокислоты проходят те же пути катаболизма, что и обычные аминокислоты.
Показания активных веществ препарата
Кетоаналоги аминокислот
Профилактика и лечение у взрослых и детей от 3 лет нарушений, обусловленных патологическим белковым метаболизмом при хронической почечной недостаточности, с одновременным соблюдением низкобелковой диеты, не превышающей количество белка в сутки у взрослых 40 г, у детей от 3 до 10 лет — 1.4-0.8 г/кг/сут, от 10 лет — 1-0.6 г/кг/сут. СКФ у таких пациентов, как правило, не превышает 25 мл/мин.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Внутрь, по индивидуальной схеме — в зависимости от возраста и веса, в сочетании с низкобелковой диетой.
Побочное действие
Со стороны обмена веществ: очень редко — гиперкальциемия.
Прочие: возможно — аллергические реакции.
Противопоказания к применению
Повышенная чувствительность к компонентам средства; нарушение обмена аминокислот; гиперкальциемия.
Пациентам с наследственной фенилкетонурией следует учитывать, что данное средство содержит фенилаланин.
Применение при беременности и кормлении грудью
Клинические данные о применении данного средства у беременных отсутствуют. При беременности следует применять с осторожностью.
Опыт применения в период грудного вскармливания отсутствует. Если применение средства необходимо в период кормления грудью, то грудное вскармливание должно быть прекращено.
Применение при нарушениях функции почек
Препарат разрешен для применения при нарушении функции почек
Применение у детей
Противопоказано применение у детей в возрасте до 3 лет.
Особые указания
Необходимо регулярно контролировать сывороточную концентрацию кальция.
Необходимо обеспечить достаточную калорийность пищи.
При одновременном применении с алюминия гидроксидом необходимо контролировать плазменную концентрацию фосфатов.
Лекарственное взаимодействие
Одновременное применение с лекарственными препаратами кальция может привести к гиперкальциемии или усилить ее.
Чтобы не нарушать абсорбцию в кишечнике, данное средство не следует принимать совместно с лекарственными препаратами, способными образовывать с кальцием трудно растворимые соединения (например, тетрациклинами, такими производными хинолона, как ципрофлоксацин и норфлоксацин; препаратами железа, фтора и эстрамустина). Между приемом данного средства и таких препаратов следует соблюдать интервал не менее 2 ч.
Чувствительность к сердечным гликозидам и, следовательно, риск аритмий, повышается по мере увеличения концентрации кальция в плазме.
По мере уменьшения симптомов уремии под влиянием данного средства необходимо снижение дозы алюминия гидроксида.
На фоне применения данного средства необходимо контролировать концентрации фосфатов в плазме.
Сохраните у себя
Поделиться с друзьями
Пожалуйста, заполните поля e-mail адресов и убедитесь в их правильности
Аминокислотный состав — Протеопедия, жизнь в 3D
Из Proteopedia
Proteopedia linkproteopedia link
Аминокислотный состав белка относится к процентному содержанию каждой аминокислоты в последовательности этого белка. Процент, иногда называемый молевым процентом, рассчитывается для каждой из 22 стандартных аминокислот как количество этой аминокислоты, деленное на общее количество аминокислот в белковой цепи или молекуле.
Пример
В качестве примера приведем аминокислотный состав ацетилхолинэстеразы Torpedo californica (Тихоокеанский электрический луч), структура которого 2ace. Каноническая последовательность изоформы имеет длину 586. В зрелой форме сигнальный пептид удаляется с аминоконца, а пропептид удаляется с карбокси-конца, оставляя зрелую длину 537, со следующим составом:
Средние составы
Средние составы были рассчитаны для большого количества белков из различных таксонов.Они перечислены в загружаемой электронной таблице amino-acid-composition.xlsx.zip. Обнадеживает совпадение таблиц, составленных в 1993, 1998 и 2008 годах (цитаты в таблице).
Вышеуказанные проценты были определены для нескольких тысяч последовательностей различных белков длиной 200 остатков с идентичностью последовательностей ниже 50% [1] . Эти данные включены в таблицу, ссылка на которую приведена выше.
Детерминанты аминокислотного состава
GC-content генома организма является сильнейшей детерминантой аминокислотного состава на уровне генома. [2] [3] [4] .
Другие, более слабые влияния:
- Температура роста (мезофилия / термофилия / гипертермофилия). У термофилов больше глутаминовой кислоты (с уменьшением глутамина) и больше лизина и аргинина [2] . Вероятно, это связано с большим количеством солевых мостиков в белках термофилов, которые, как полагают, вносят вклад в термостабильность [5] .
- Длина цепи . Белки термофилов в среднем короче белков мезофилов.Средняя длина составляет 283 и 340 соответственно [2] . Исследование ~ 550 000 белков длиной 50-200 аминокислот [1] пришло к выводу:
- Увеличивается с длиной, достигая плато: Ala, Asp, Glu, Gly, Pro, Val; меньшее увеличение для Gln и Thr.
- Уменьшается с длиной: Cys, Phe, His, Ile, Lys, Met, Asn, Ser.
- Leu и Tyr наиболее высоки в коротких и длинных цепях и реже встречаются в белках среднего размера.
- Пики Arg в белках среднего размера.
- Trp постоянна и составляет около 1,4% для длин 75-200.
- Линкеры по сравнению с доменами : линкеры между доменами имеют больше полярных остатков, тогда как компактные домены имеют больше гидрофобных остатков [3] .
- Среда обитания : Среда, в которой живет организм, оказывает незначительное влияние на средний состав его белков [4] .
- Изменчивость состава ранжирует археи> бактерии> эукариоты [3] .
Калькуляторы композиции
- EMBL-EBI EMBOSS-PepStats создает таблицу, которую легко импортировать в электронную таблицу. В таблице есть как однобуквенные, так и трехбуквенные сокращения аминокислот, отсортированы по однобуквенным кодам .
| Импорт данных композиции в Excel: Скопируйте только столбцы данных, вставьте в текстовый редактор и сохраните в текстовый файл. В Excel в существующей (возможно, пустой) электронной таблице — Файл, Импорт, Текст.Отметьте 3 варианта разделителей: табуляция, пробел, рассматривать последовательные разделители как один. Приступите к импорту. |
- ProtParam ExPASy создает таблицу, которую легко импортировать в электронную таблицу. В таблице есть как однобуквенные, так и трехбуквенные сокращения аминокислот, отсортированы по трехбуквенным кодам . Он также предлагает вывод CSV, альтернативный формат, понятный для электронных таблиц.
Список литературы
- ↑ 1.0 1.1 Carugo O. Аминокислотный состав и размер белка.Protein Sci. 2008 декабрь; 17 (12): 2187-91. DOI: 10.1110 / ps.037762.108. Epub 2008, 9 сентября. PMID: 18780815 doi: http: //dx.doi.org/10.1110/ps.037762.108
- ↑ 2,0 2,1 2,2 Tekaia F, Yeramian E, Dujon B. Аминокислотный состав геномов, образ жизни организмов и тенденции эволюции: глобальная картина с анализом соответствий. Ген. 2002 4 сентября; 297 (1-2): 51-60. DOI: 10.1016 / s0378-1119 (02) 00871-5. PMID: 12384285 doi: http: //dx.doi.org/10.1016/s0378-1119 (02) 00871-5
- ↑ 3.0 3,1 3,2 Brune D, Andrade-Navarro MA, Mier P. Полное протеомное сравнение аминокислотного состава доменов и линкеров. BMC Res Notes. 2018 9 февраля; 11 (1): 117. DOI: 10.1186 / s13104-018-3221-0. PMID: 29426365 doi: http: //dx.doi.org/10.1186/s13104-018-3221-0
- ↑ 4,0 4,1 Моура А., Саважо М.А., Алвес Р. Относительные сигнатуры аминокислотного состава организмов и окружающей среды. PLoS One. 2013 25 октября; 8 (10): e77319. DOI: 10,1371 / журнал.pone.0077319., eCollection 2013. PMID: 24204807 doi: http: //dx.doi.org/10.1371/journal.pone.0077319
- ↑ Chan CH, Yu TH, Wong KB. Стабилизирующий солевой мостик увеличивает термостабильность белка за счет уменьшения изменения теплоемкости при разворачивании. PLoS One. 2011; 6 (6): e21624. Epub 2011, 24 июня. PMID: 21720566 doi: 10.1371 / journal.pone.0021624
Аминокислотный состав — Протеопедия, жизнь в 3D
Из Proteopedia
Proteopedia linkproteopedia link
Аминокислотный состав белка относится к процентному содержанию каждой аминокислоты в последовательности этого белка.Процент, иногда называемый молевым процентом, рассчитывается для каждой из 22 стандартных аминокислот как количество этой аминокислоты, деленное на общее количество аминокислот в белковой цепи или молекуле.
Пример
В качестве примера приведем аминокислотный состав ацетилхолинэстеразы Torpedo californica (Тихоокеанский электрический луч), структура которого 2ace. Каноническая последовательность изоформы имеет длину 586. В зрелой форме сигнальный пептид удаляется с аминоконца, а пропептид удаляется с карбокси-конца, оставляя зрелую длину 537, со следующим составом:
Средние составы
Средние составы были рассчитаны для большого количества белков из различных таксонов.Они перечислены в загружаемой электронной таблице amino-acid-composition.xlsx.zip. Обнадеживает совпадение таблиц, составленных в 1993, 1998 и 2008 годах (цитаты в таблице).
Вышеуказанные проценты были определены для нескольких тысяч последовательностей различных белков длиной 200 остатков с идентичностью последовательностей ниже 50% [1] . Эти данные включены в таблицу, ссылка на которую приведена выше.
Детерминанты аминокислотного состава
GC-content генома организма является сильнейшей детерминантой аминокислотного состава на уровне генома. [2] [3] [4] .
Другие, более слабые влияния:
- Температура роста (мезофилия / термофилия / гипертермофилия). У термофилов больше глутаминовой кислоты (с уменьшением глутамина) и больше лизина и аргинина [2] . Вероятно, это связано с большим количеством солевых мостиков в белках термофилов, которые, как полагают, вносят вклад в термостабильность [5] .
- Длина цепи . Белки термофилов в среднем короче белков мезофилов.Средняя длина составляет 283 и 340 соответственно [2] . Исследование ~ 550 000 белков длиной 50-200 аминокислот [1] пришло к выводу:
- Увеличивается с длиной, достигая плато: Ala, Asp, Glu, Gly, Pro, Val; меньшее увеличение для Gln и Thr.
- Уменьшается с длиной: Cys, Phe, His, Ile, Lys, Met, Asn, Ser.
- Leu и Tyr наиболее высоки в коротких и длинных цепях и реже встречаются в белках среднего размера.
- Пики Arg в белках среднего размера.
- Trp постоянна и составляет около 1,4% для длин 75-200.
- Линкеры по сравнению с доменами : линкеры между доменами имеют больше полярных остатков, тогда как компактные домены имеют больше гидрофобных остатков [3] .
- Среда обитания : Среда, в которой живет организм, оказывает незначительное влияние на средний состав его белков [4] .
- Изменчивость состава ранжирует археи> бактерии> эукариоты [3] .
Калькуляторы композиции
- EMBL-EBI EMBOSS-PepStats создает таблицу, которую легко импортировать в электронную таблицу. В таблице есть как однобуквенные, так и трехбуквенные сокращения аминокислот, отсортированы по однобуквенным кодам .
| Импорт данных композиции в Excel: Скопируйте только столбцы данных, вставьте в текстовый редактор и сохраните в текстовый файл. В Excel в существующей (возможно, пустой) электронной таблице — Файл, Импорт, Текст.Отметьте 3 варианта разделителей: табуляция, пробел, рассматривать последовательные разделители как один. Приступите к импорту. |
- ProtParam ExPASy создает таблицу, которую легко импортировать в электронную таблицу. В таблице есть как однобуквенные, так и трехбуквенные сокращения аминокислот, отсортированы по трехбуквенным кодам . Он также предлагает вывод CSV, альтернативный формат, понятный для электронных таблиц.
Список литературы
- ↑ 1.0 1.1 Carugo O. Аминокислотный состав и размер белка.Protein Sci. 2008 декабрь; 17 (12): 2187-91. DOI: 10.1110 / ps.037762.108. Epub 2008, 9 сентября. PMID: 18780815 doi: http: //dx.doi.org/10.1110/ps.037762.108
- ↑ 2,0 2,1 2,2 Tekaia F, Yeramian E, Dujon B. Аминокислотный состав геномов, образ жизни организмов и тенденции эволюции: глобальная картина с анализом соответствий. Ген. 2002 4 сентября; 297 (1-2): 51-60. DOI: 10.1016 / s0378-1119 (02) 00871-5. PMID: 12384285 doi: http: //dx.doi.org/10.1016/s0378-1119 (02) 00871-5
- ↑ 3.0 3,1 3,2 Brune D, Andrade-Navarro MA, Mier P. Полное протеомное сравнение аминокислотного состава доменов и линкеров. BMC Res Notes. 2018 9 февраля; 11 (1): 117. DOI: 10.1186 / s13104-018-3221-0. PMID: 29426365 doi: http: //dx.doi.org/10.1186/s13104-018-3221-0
- ↑ 4,0 4,1 Моура А., Саважо М.А., Алвес Р. Относительные сигнатуры аминокислотного состава организмов и окружающей среды. PLoS One. 2013 25 октября; 8 (10): e77319. DOI: 10,1371 / журнал.pone.0077319., eCollection 2013. PMID: 24204807 doi: http: //dx.doi.org/10.1371/journal.pone.0077319
- ↑ Chan CH, Yu TH, Wong KB. Стабилизирующий солевой мостик увеличивает термостабильность белка за счет уменьшения изменения теплоемкости при разворачивании. PLoS One. 2011; 6 (6): e21624. Epub 2011, 24 июня. PMID: 21720566 doi: 10.1371 / journal.pone.0021624
Аминокислотный состав — Протеопедия, жизнь в 3D
Из Proteopedia
Proteopedia linkproteopedia link
Аминокислотный состав белка относится к процентному содержанию каждой аминокислоты в последовательности этого белка.Процент, иногда называемый молевым процентом, рассчитывается для каждой из 22 стандартных аминокислот как количество этой аминокислоты, деленное на общее количество аминокислот в белковой цепи или молекуле.
Пример
В качестве примера приведем аминокислотный состав ацетилхолинэстеразы Torpedo californica (Тихоокеанский электрический луч), структура которого 2ace. Каноническая последовательность изоформы имеет длину 586. В зрелой форме сигнальный пептид удаляется с аминоконца, а пропептид удаляется с карбокси-конца, оставляя зрелую длину 537, со следующим составом:
Средние составы
Средние составы были рассчитаны для большого количества белков из различных таксонов.Они перечислены в загружаемой электронной таблице amino-acid-composition.xlsx.zip. Обнадеживает совпадение таблиц, составленных в 1993, 1998 и 2008 годах (цитаты в таблице).
Вышеуказанные проценты были определены для нескольких тысяч последовательностей различных белков длиной 200 остатков с идентичностью последовательностей ниже 50% [1] . Эти данные включены в таблицу, ссылка на которую приведена выше.
Детерминанты аминокислотного состава
GC-content генома организма является сильнейшей детерминантой аминокислотного состава на уровне генома. [2] [3] [4] .
Другие, более слабые влияния:
- Температура роста (мезофилия / термофилия / гипертермофилия). У термофилов больше глутаминовой кислоты (с уменьшением глутамина) и больше лизина и аргинина [2] . Вероятно, это связано с большим количеством солевых мостиков в белках термофилов, которые, как полагают, вносят вклад в термостабильность [5] .
- Длина цепи . Белки термофилов в среднем короче белков мезофилов.Средняя длина составляет 283 и 340 соответственно [2] . Исследование ~ 550 000 белков длиной 50-200 аминокислот [1] пришло к выводу:
- Увеличивается с длиной, достигая плато: Ala, Asp, Glu, Gly, Pro, Val; меньшее увеличение для Gln и Thr.
- Уменьшается с длиной: Cys, Phe, His, Ile, Lys, Met, Asn, Ser.
- Leu и Tyr наиболее высоки в коротких и длинных цепях и реже встречаются в белках среднего размера.
- Пики Arg в белках среднего размера.
- Trp постоянна и составляет около 1,4% для длин 75-200.
- Линкеры по сравнению с доменами : линкеры между доменами имеют больше полярных остатков, тогда как компактные домены имеют больше гидрофобных остатков [3] .
- Среда обитания : Среда, в которой живет организм, оказывает незначительное влияние на средний состав его белков [4] .
- Изменчивость состава ранжирует археи> бактерии> эукариоты [3] .
Калькуляторы композиции
- EMBL-EBI EMBOSS-PepStats создает таблицу, которую легко импортировать в электронную таблицу. В таблице есть как однобуквенные, так и трехбуквенные сокращения аминокислот, отсортированы по однобуквенным кодам .
| Импорт данных композиции в Excel: Скопируйте только столбцы данных, вставьте в текстовый редактор и сохраните в текстовый файл. В Excel в существующей (возможно, пустой) электронной таблице — Файл, Импорт, Текст.Отметьте 3 варианта разделителей: табуляция, пробел, рассматривать последовательные разделители как один. Приступите к импорту. |
- ProtParam ExPASy создает таблицу, которую легко импортировать в электронную таблицу. В таблице есть как однобуквенные, так и трехбуквенные сокращения аминокислот, отсортированы по трехбуквенным кодам . Он также предлагает вывод CSV, альтернативный формат, понятный для электронных таблиц.
Список литературы
- ↑ 1.0 1.1 Carugo O. Аминокислотный состав и размер белка.Protein Sci. 2008 декабрь; 17 (12): 2187-91. DOI: 10.1110 / ps.037762.108. Epub 2008, 9 сентября. PMID: 18780815 doi: http: //dx.doi.org/10.1110/ps.037762.108
- ↑ 2,0 2,1 2,2 Tekaia F, Yeramian E, Dujon B. Аминокислотный состав геномов, образ жизни организмов и тенденции эволюции: глобальная картина с анализом соответствий. Ген. 2002 4 сентября; 297 (1-2): 51-60. DOI: 10.1016 / s0378-1119 (02) 00871-5. PMID: 12384285 doi: http: //dx.doi.org/10.1016/s0378-1119 (02) 00871-5
- ↑ 3.0 3,1 3,2 Brune D, Andrade-Navarro MA, Mier P. Полное протеомное сравнение аминокислотного состава доменов и линкеров. BMC Res Notes. 2018 9 февраля; 11 (1): 117. DOI: 10.1186 / s13104-018-3221-0. PMID: 29426365 doi: http: //dx.doi.org/10.1186/s13104-018-3221-0
- ↑ 4,0 4,1 Моура А., Саважо М.А., Алвес Р. Относительные сигнатуры аминокислотного состава организмов и окружающей среды. PLoS One. 2013 25 октября; 8 (10): e77319. DOI: 10,1371 / журнал.pone.0077319., eCollection 2013. PMID: 24204807 doi: http: //dx.doi.org/10.1371/journal.pone.0077319
- ↑ Chan CH, Yu TH, Wong KB. Стабилизирующий солевой мостик увеличивает термостабильность белка за счет уменьшения изменения теплоемкости при разворачивании. PLoS One. 2011; 6 (6): e21624. Epub 2011, 24 июня. PMID: 21720566 doi: 10.1371 / journal.pone.0021624
Полнопротеомное сравнение аминокислотного состава доменов и линкеров | BMC Research Notes
Методы
Мы выбрали 38 полных и хорошо аннотированных референсных протеомов (дополнительный файл 1).Они были получены из UniProt [7], выпуск 2016_01. Для исследования аминокислотного состава цельного протеома учитывались все последовательности; при изучении доменов и линкеров отбрасывали белки без аннотированных доменов. Линкеры были определены как последовательности, фланкированные двумя доменами. Файл, содержащий все домены SMART с описанием функций домена, был загружен из SMART [8]. Мы используем этот список как словарь всех возможных доменных имен.
Графики результатов были созданы с использованием пакетов ggplot2 [9] и [10] R.Для обработки данных использовались пакеты R dplyr [11] и reshape2 [12].
Результаты
Протеомы 38 видов были сначала проанализированы на предмет их общепротеомного аминокислотного состава. Наблюдаемые различия больше у архей, чем у бактерий, и у бактерий, чем у эукариот (рис. 1). Эукариоты обладают наибольшей вариабельностью по пролину, цистеину и аспарагину. Аминокислоты, которые в целом демонстрируют высокую вариабельность у разных видов, — это лизин, аланин и изолейцин, в то время как гистидин, триптофан и метионин различаются в наименьшей степени.Цистеин чаще встречается у эукариот, чем у архей и бактерий, тогда как изолейцин менее распространен у эукариот. Dictyostelium discoideum (ddi) выделяется высоким содержанием аспарагина, глутамина и изолейцина и низким содержанием аланина, валина и аргинина [13]. Геном D. discoideum является A + T-богатым, поэтому высокая доля N, Q и I, которые кодируются кодонами с высоким содержанием A + T, в то время как аминокислоты с пониженной частотой кодируются кодонами с более высокое содержание G + C.
Рис. 1
Аминокислотный состав 38 эталонных протеомов. Филогенетические отношения между видами можно увидеть на дереве под сокращениями названий видов. Количество белковых последовательностей, извлеченных из каждого протеома, показано у основания столбцов
.
Затем мы изучили дифференциальное использование аминокислот в доменах и линкерах. Для каждого из видов мы рассчитали их аминокислотный состав, учитывая только участки, аннотированные либо как домены, либо как линкеры (рис.2). В линкерах чаще встречаются пролин и глутамин, но также менее специфично полярные и заряженные аминокислоты. В доменах чаще встречаются аминокислоты с гидрофобными боковыми цепями, такие как лейцин и валин, а также ароматические фенилаланин и тирозин. Эти результаты были ожидаемыми, поскольку домены имеют тенденцию быть глобулярными, а линкеры более открытыми, поэтому имеют тенденцию иметь более полярные или заряженные остатки.
Рис. 2
Дифференциальное использование аминокислот в доменах по сравнению с линкерами в каждом протеоме.Каждая точка представляет собой процент использования аминокислоты в одном из протеомов в линкерах по сравнению с доменами. Черная пунктирная линия — это пополам, а серые пунктирные линии отмечают двукратное увеличение, так что аминокислот на этих линиях либо в два раза больше в линкерах, чем в доменах (верхняя пунктирная линия), либо в два раза больше в доменах (нижняя пунктирная линия). line)
Чтобы любой пользователь мог сравнить аминокислотный состав определенного аннотированного домена со средним аминокислотным составом в доменах, у всех видов одновременно (соответственно линкеров), мы разработали сценарий R, который использует структуру shiny [ 14].Он называется «Относительная аминокислотная композиция в домашних и линкерах» (RACCOON), и ее можно загрузить с нашего веб-сайта [15]. RACCOON позволяет пользователю выбрать набор SMART-доменов по имени или путем строкового поиска их имен и описаний. После выбора набора их аминокислотный состав сравнивается с составом фона всех доменов (в 38 протеомах). Такой же анализ представлен для линкеров выбранных доменов. Этот второй анализ направлен на выявление тенденций в аминокислотном составе, которые могут выявить предубеждения (и, следовательно, функциональность), связанные с рассматриваемыми доменами.Этот анализ является исследовательским, но актуальным, учитывая наше текущее понимание функции белков, которое до сих пор фокусировалось больше на глобулярных доменах, чем на менее упорядоченных областях. Все больше данных, указывающих на то, что неупорядоченные области играют роль в регуляции, взаимодействии и заболевании, мотивируют эти усилия.
Чтобы проиллюстрировать наш подход, мы выбрали набор доменных имен, используя в RACCOON регулярное выражение «ДНК-связывание | ДНК-связывание» и включая домены из SMART, описание которых соответствует запросу (рис.3). Свойства каждой аминокислоты сравниваются между желаемым признаком (выбранные домены или окружающие их линкеры) и соответствующим фоном (все домены или все линкеры, соответственно). На рисунке 3а показаны результаты для Arg в ДНК-связывающих доменах (зеленые точки). Затем вычисляются различные переменные, чтобы представить распределение этих значений.
Рис. 3
Состав ДНК-связывающих доменов и окружающих их линкеров по сравнению со средним значением для доменов / линкеров. a Результаты, полученные в RACCOON при выборе аминокислоты Arg в доменах (подробности см. В основном тексте). b Направление увеличения среднего избыточного представительства в выбранных доменах и окружающих линкерах по сравнению со всеми доменами и линкерами во всех протеомах, среднее кратное отклонение использования аминокислот по всем протеомам, средний процент использования аминокислот по всем протеомам, и разброс значений (сумма квадратов евклидовых расстояний до центроида)
Две переменные сравнивают долю каждой аминокислоты в выбранном домене или линкерах по сравнению со всеми доменами или линкерами: направление обогащения и среднее кратное отклонение.Направление обогащения — это доля протеомов, для которых данная аминокислота присутствует больше, чем в фоновом режиме. Значение 1 указывает на то, что во всех рассмотренных протеомах данная аминокислота чаще встречается в этом признаке. Среднее кратное отклонение составляет | (f / b) — 1 |, где f — средний процент аминокислоты в выбранном элементе, а b — средний процент аминокислоты в фоновом режиме; более высокие значения указывают на отклонение распределения от фона. Направление задается предварительно рассчитанным направлением обогащения.
Среднее содержание — это переменная, которая описывает процент использования аминокислот только в выбранном объекте без контраста с фоном. Наконец, дисперсия — это сумма квадратов евклидовых расстояний протеомов до средней точки их распределения; большие значения указывают на более высокую изменчивость между видами.
Когда мы вычисляем значения для всех остатков (рис. 3b), мы можем увидеть значения, которые мы получили для Arg в контексте: использование Arg в ДНК-связывающих доменах постоянно выше во всех протеомах, чем в фоновом режиме (направление обогащения = 1), как и в случае Lys, Gln и Glu.Разделение Arg в ДНК-связывающих доменах от фона большое (среднее кратное отклонение = 0,6), только сравнимое с таковым для Lys. Его среднее содержание делает Arg одним из наиболее частых остатков в ДНК-связывающих доменах, сравнимым с Leu, который не был обогащен. Использование Arg в ДНК-связывающих доменах более вариабельно для протеомов (5–11%), чем на фоне всех доменов (3–7%), что приводит к среднему значению дисперсии.
Результаты для линкеров, окружающих ДНК-связывающие домены, очень разные: они показывают процентное содержание Arg и Lys, аналогичное фону линкеров.И линкеры, и домены обогащены Gln, а линкеры обогащены Ser, а домены — нет. Серины в неупорядоченных областях часто являются мишенью для фосфорилирования [16] и могут указывать на то, что линкеры, окружающие ДНК-связывающие домены, содержат много потенциальных регуляторных сайтов. Высокий процент Gln может быть связан с участками polyQ, которые более распространены в белках со многими партнерами по взаимодействию, свойством ядерных белков и, в частности, факторов транскрипции [17], которые являются ДНК-связывающими белками.И Ser, и Glu демонстрируют высокую дисперсию в линкерах, а не в доменах, что позволяет предположить, что это свойство может изменяться у рассматриваемых видов.
Ядерные белки, как известно, содержат высокие уровни Arg и Lys; это может быть связано с мотивами, богатыми аргинином / лизином, которые используются в качестве сигналов ядерной локализации, которые, как было описано, перекрываются или соседствуют с ДНК-связывающими доменами [18]. Дополнительным объяснением является то, что они используются для взаимодействия с отрицательно заряженным сахарно-фосфатным остовом ДНК [19].Тот факт, что это обогащение не проявляется в линкерах, намекает на функцию, которая требует структурированной области, указывая, таким образом, на то, что специфичность в распознавании ДНК (или белка) партнера является необходимым общим механизмом.
Обсуждение
Анализ аминокислотного состава протеомов показывает высокую гетерогенность между видами, особенно между архей и бактериями (рис. 1). Это может быть связано с тем, что они очень разнородны как по своей геномной архитектуре, так и по окружающей среде.Аминокислотный состав у эукариот менее гетерогенный, особенно внутри многоклеточных видов, за исключением D. discoideum с его Q- и N-богатым протеомом [20].
Дифференциальное использование аминокислот в доменах и линкерах (рис. 2) иллюстрирует картину чрезмерно представленных гидрофильных аминокислот в линкерах и гидрофобных аминокислот в доменах. Важная часть энергии сворачивания белка обеспечивается за счет сокрытия гидрофобных поверхностей внутри белка [21], таким образом, предпочтительное использование гидрофобных аминокислот в хорошо структурированных областях домена.Напротив, более гибкие линкерные области требуют более высокой растворимости, что объясняет чрезмерную представленность гидрофильных аминокислот в этих областях. Единственным исключением является пролин, который имеет гидрофобную боковую цепь и, как ожидается, будет меньше использоваться в линкерах. Пролин не позволяет альфа-спиралям продолжаться и вызывает нарушения в окружающей структуре белка из-за своей особой структуры [22]. Таким образом, он хорошо подходит для индукции перехода от хорошо структурированного домена к более гибкому линкеру.Аминокислоты, которые в любом случае почти не представлены в избытке, обычно в небольшом количестве и содержат специальные функциональные группы, такие как цистеин и метионин, которые содержат серу, или гистидин и триптофан, которые содержат азотсодержащие ароматические кольца.
Аминокислотный состав, обнаруженный в определенных доменах и окружающих их линкерах, дает возможность анализировать группы доменов с общими характеристиками или функциями и проверять, можно ли выделить из них определенный аминокислотный профиль.Например, наш анализ ДНК-связывающих доменов предполагает обогащение аминокислотами линкеров, окружающих эти домены, что может указывать на функциональность в этих, вероятно, неупорядоченных областях. Кроме того, этот анализ указывает на особенности, специфичные для домена, таким образом предполагая, что известные смещения в положительно заряженных остатках (Arg, Lys) могут иметь функции, связанные со структурированными частями ДНК-связывающих белков. Этот примерный анализ учитывал большое количество доменов с общей функцией.Предостережение заключается в том, что если выбор доменов невелик, например, по сравнению с одним доменом с несколькими примерами, в результатах могут быть перекосы просто потому, что вы будете рассматривать несколько семейств белков. Чтобы предупредить пользователя, на графике, показывающем значения для аминокислоты в RACCOON (рис. 3a), точки окрашены в зависимости от количества доменов или линкеров, соответствующих запросу: зеленый, если больше десяти; красный, если меньше десяти, но больше пяти; и желтый в противном случае.
В заключение, мы представили анализ аминокислотного состава, различая домены и их линкеры, как ценный инструмент для оценки еще одного уровня информации из белковых последовательностей.Комбинированный анализ доменов и линкеров обеспечивает интересную информацию об их различиях в составе и может предоставить дополнительные свидетельства для моделей молекулярных взаимодействий и для предсказания функции белков.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
ЧАСТОТА АМИНОКИСЛОТ
ЧАСТОТА АМИНОКИСЛОТ
АМИНОКИСЛОТНАЯ ЧАСТОТА
Введение: Генетическая информация, содержащаяся в мРНК, находится в форме кодонов, последовательностей из трех нуклеотидов, которые транслируются в аминокислоты, которые затем объединяются в белки.На определенных участках структуры белка аминокислотный состав не имеет решающего значения. Однако некоторые аминокислоты встречаются в таких местах до шести раз чаще, чем другие аминокислоты. В 1960-х годах молекулярные биологи пытались определить, является ли аминокислотный состав отражением генетического кода или определенные аминокислоты были естественным образом выбраны как оптимальные.
Важность: аминокислотный состав на некритических участках в структуре белка может влиять или не влиять на общее качество белка.Если определенные аминокислоты оптимальны для структуры белка, естественный отбор должен был действовать в течение эволюционного времени, чтобы увеличить частоту этих аминокислот. Альтернативная гипотеза состоит в том, что аминокислотный состав на сайте — это просто случайная перестановка генетического кода. Мы можем использовать вероятности, чтобы ответить на вопросы об эволюции аминокислот.
Вопрос: Является ли частота встречаемости определенных аминокислот просто следствием случайных перестановок генетического кода или продуктом естественного отбора?
Методы: Если конкретная аминокислота в некотором роде адаптивна, то это должно происходить чаще, чем ожидалось случайно.Это можно легко проверить, вычислив ожидаемую частоту встречаемости аминокислот и сравнив с наблюдаемой. Кодоны и наблюдаемые частоты конкретных аминокислот приведены в таблице.
|
Аминокислоты |
Кодоны |
Наблюдаемая частота у позвоночных |
|
Аланин |
GCU, GCA, GCC, GCG |
7.4% |
|
Аргинин |
CGU, CGA, CGC, CGG, AGA, AGG |
4,2% |
|
аспарагин |
AAU, AAC |
4,4% |
|
Аспарагиновая кислота |
GAU, GAC |
5,9% |
|
Цистеин |
УГУ, УГК |
3.3% |
|
Глутаминовая кислота |
ГАА, ГАГ |
5,8% |
|
Глютамин |
CAA, CAG |
3,7% |
|
Глицин |
GGU, GGA, GGC, GGG |
7,4% |
|
Гистидин |
CAU, CAC |
2.9% |
|
Изолейцин |
AUU, AUA, AUC |
3,8% |
|
лейцин |
CUU, CUA, CUC, CUG, UUA, UUG |
7,6% |
|
Лизин |
AAA, AAG |
7,2% |
|
метионин |
августа |
1.8% |
|
Фенилаланин |
УУУ, УУК |
4,0% |
|
Пролин |
CCU, CCA, CCC, CCG |
5,0% |
|
Серин |
UCU, UCA, UCC, UCG, AGU, AGC |
8,1% |
|
Треонин |
ACU, ACA, ACC, ACG |
6.2% |
|
Триптофан |
UGG |
1,3% |
|
Тирозин |
УАУ, ОАК |
3,3% |
|
Валин |
ГУУ, ГУА, ГУК, ГУГ |
6,8% |
|
Стоп-кодоны |
UAA, UAG, UGA |
— |
Частоты оснований ДНК в природе 22.0% урацила, 30,3% аденина, 21,7% цитозина и 26,1% гуанина. Ожидаемая частота конкретного кодона затем может быть рассчитана путем умножения частот каждой основы ДНК, составляющей кодон. Ожидаемая частота встречаемости аминокислоты затем может быть рассчитана путем сложения частот каждого кодона, который кодирует эту аминокислоту.
Например, кодоны РНК для тирозина — это UAU и UAC, поэтому случайное ожидание его частоты составляет (0,220) (0,303) (0,220) + (0,220) (0,303) (0.217) = 0,0292. Поскольку 3 из 64 кодонов являются бессмысленными или стоп-кодонами, эта частота для каждой аминокислоты умножается на поправочный коэффициент 1,057.
Построив график зависимости ожидаемой частоты от наблюдаемой частоты, мы можем увидеть, встречаются ли некоторые аминокислоты чаще или реже, чем ожидалось случайно. Если наблюдаемые и ожидаемые частоты близки к равным, мы ожидаем линии с наклоном = 1.
Интерпретация: Исключая выброс, аргинин, корреляция между наблюдаемой и ожидаемой частотами была очень значимой (r = 0.89). Только частота аргинина (Arg), по-видимому, является продуктом естественного отбора, действующего на один или несколько кодонов аргинина.
Выводы: Средний аминокислотный состав пассивно отражает случайные перестановки генетического кода. Другими словами, вместо того, чтобы быть оптимальными отдельные аминокислоты, наиболее важным параметром, определяющим частоту аминокислот в белке, является просто количество кодонов, кодирующих его.
Дополнительные вопросы:
1.Рассчитайте ожидаемые частоты для некоторых аминокислот.
2. Посмотрите на выбросы аргинина. Это происходит чаще или реже, чем ожидалось? Можете ли вы придумать какие-нибудь гипотезы, почему это могло быть?
Источники: Дайер, К. Ф. 1971. Тихая революция: новый синтез биологических знаний. Журнал биологического образования 5 : 15-24
Кинг, Дж. Л. и Т. Х. Джукс. 1969. Недарвиновская эволюция. Наука 164 : 788-798
Авторское право 1999 г., M.Билз, Л. Гросс, С. Харрелл
Аминокислотные композиции 27 пищевых рыб и их значение в клиническом питании
Белки и аминокислоты являются важными биомолекулами, которые регулируют ключевые метаболические пути и служат предшественниками для синтеза биологически важных веществ; кроме того, аминокислоты являются строительными блоками белков. Рыба является важным пищевым источником качественных белков и аминокислот животного происхождения и играет важную роль в питании человека. В настоящем исследовании было изучено содержание сырого протеина и аминокислотный состав важных пищевых рыб из различных местообитаний.Содержание сырого протеина было определено методом Кьельдаля, аминокислотный состав проанализирован с помощью высокоэффективной жидкостной хроматографии, и была получена информация о 27 промысловых рыбах. Анализ показал, что холодноводные виды богаты лизином и аспарагиновой кислотой, морские рыбы — лейцином, мелкие местные рыбы — гистидином, а карпы и сомы — глутаминовой кислотой и глицином. Обогащенная база знаний по питанию повысит полезность рыбы как источника качественных белков и аминокислот животного происхождения и поможет в их включении в рекомендации по питанию и рекомендации пациентов для удовлетворения конкретных потребностей в питании.
1. Введение
Аминокислоты — важные биомолекулы, которые одновременно служат строительными блоками белков и являются промежуточными звеньями в различных метаболических путях. Они служат предшественниками для синтеза широкого спектра биологически важных веществ, включая нуклеотиды, пептидные гормоны и нейротрансмиттеры. Более того, аминокислоты играют важную роль в передаче сигналов клетками и действуют как регуляторы экспрессии генов и каскада фосфорилирования белков [1], транспорта питательных веществ и метаболизма в клетках животных [2], а также врожденных и клеточно-опосредованных иммунных ответов.
Аминокислоты в основном получают из белков, содержащихся в рационе, и качество диетического белка оценивается по соотношению незаменимых и заменимых аминокислот. Высококачественные белки легко усваиваются и содержат незаменимые аминокислоты (EAA) в количествах, которые соответствуют потребностям человека [3]. Белки, наиболее распространенные макромолекулы, обнаруживаемые в биологических системах, присутствуют в различных формах, таких как структурные элементы, ферменты, гормоны, антитела, рецепторы, сигнальные молекулы и т. Д., Выполняющие определенные биологические функции.Белок необходим для основных функций организма, включая обеспечение незаменимыми аминокислотами, а также развитие и поддержание мышц. Неадекватное потребление качественных белков и калорий с пищей приводит к белково-энергетической недостаточности (PEM) (или белково-калорийной недостаточности, PCM), которая является наиболее смертельной формой недоедания / голода. Kwashiorkor и marasmus , — экстремальные состояния ПКМ, которые чаще всего наблюдаются у детей, вызваны хроническим дефицитом белка и энергии, соответственно. PCM также встречается у взрослых с хроническим дефицитом питания.Около 870 миллионов человек в мире страдают от хронической белковой недостаточности; 80% детей, страдающих ПКМ, — из развивающихся стран [3, 4]. В этом контексте рыба может сыграть жизненно важную роль, поскольку это важный и более дешевый источник качественных белков животного происхождения. Следовательно, существует необходимость в получении и документировании информации о питании многочисленных разновидностей и видов доступных промысловых рыб. По сравнению с другими источниками пищевых белков животного происхождения, потребители имеют широкий выбор рыбы с точки зрения доступности, поскольку существует множество разновидностей и видов рыб, особенно в тропических странах [5].Настоящее исследование было предпринято для получения информации о содержании белка и аминокислотном составе важных пищевых рыб с целью расширения возможностей их использования в лечебном питании для диетических рекомендаций.
2. Материалы и методы
2.1. Этическое заявление
Авторы подтверждают, что все проведенные исследования соответствуют этическим принципам, включая соблюдение требований законодательства страны исследования.
2.2. Сбор и обработка проб
Свежепойманную рыбу собирали либо в пунктах выгрузки, либо на местных рыбных рынках и доставляли в лабораторию во льду.Всего для анализа по аминокислотам были включены 27 видов: карпы Catla catla , Labeo rohita и Cirrhinus mrigala , сомы Sperata seenghala , Heteropneustes fossilis и 9000chus smallbats 6 Amblypharyngodon mola , Puntius sophore , Anabas testudineus (все пресноводные рыбы) и Tenualosa ilisha (проходные), холодноводные рыбы Oncorhynchus mykiss 000500050006 Neolissochilus hexagonolepis и Cyprinus carpio ; морские рыбы Thunnus albacares , Stolephorus waitei , Stolephorus commersonii, Rastrelliger kanagurta , Nemipterus japonicas , Sardinella longiceps , Katsuwonus, Leiognathus splendens и Trichiurus lepturus, и моллюски Crassostrea madrasensis , Perna viridis . Рыбу очищали, очищали от окалины, дегидрировали, измельчали, гомогенизировали и хранили при -40 ° C до использования.
2.3. Аминокислотный анализ
Содержание сырого протеина определяли по методу Кьельдаля [6]. Аминокислотный состав определяли согласно Ishida et al. [7] и был описан ранее [8]. Вкратце, мышечный белок гидролизовали 6 н. Соляной кислотой при 110 ° C в анаэробных условиях в течение 24 часов.Гидролизованные образцы нейтрализовали 6 н. NaOH и дериватизировали с использованием набора (AccQ-Fluor Reagent, WAT052880, Waters). Дериватизированные образцы вводили в высокоэффективную жидкостную хроматографию (ВЭЖХ) (1525, Waters), оборудованную колонкой C 18 RP и детектором флуоресценции (2475, Waters). Аминокислоты были идентифицированы и количественно определены путем сравнения со временами удерживания и площадями пиков стандартов (WAT088122, Waters). Для анализа триптофана мясной фарш переваривали 5% (мас. / Об.) NaOH в течение 24 часов и нейтрализовали до pH 7.0 с 6 н. HCl. Содержание триптофана измеряли спектрофотометрически при длине волны 530 нм [9]. Все данные представлены как среднее ± стандартное отклонение.
3. Результаты и обсуждение
Физиологическая роль пищевых белков заключается в обеспечении субстратов, необходимых для синтеза белков организма и других метаболически важных азотсодержащих соединений. Следовательно, содержание незаменимых в питательном отношении аминокислот (АК) в пищевых белках обычно является основным фактором, определяющим питательные качества белка [10].Более того, аминокислоты связаны с проблемами со здоровьем, а дефицит аминокислот приводит к ряду заболеваний. Следовательно, знание аминокислотного состава продуктов питания служит основой для определения их потенциальной питательной ценности. Это также может позволить оценить изменения питательной ценности, которые могут возникнуть при приготовлении, переработке и хранении пищевых продуктов [11].
АК традиционно классифицируются как незаменимые в питательном отношении (EAA), «несущественные» (NEAA) или условно незаменимые (CEAA) [1].Аргинин, цистин, гистидин, лейцин, лизин, метионин, треонин, триптофан, тирозин и валин являются EAA, глутамин, глутаминовая кислота, глицин, пролин и таурин являются CEAA, а аспарагиновая кислота, серин и аланин являются NEAA для питание человека. Однако недавно была предложена концепция функциональных аминокислот (ФАА). FAA — это те, которые участвуют и регулируют ключевые метаболические пути для улучшения здоровья, выживания, роста, развития, лактации и размножения организмов [1, 12].FAA также имеют большие перспективы в профилактике и лечении метаболических заболеваний (например, ожирения, диабета и сердечно-сосудистых заболеваний), ограничения внутриутробного развития, бесплодия, кишечной и неврологической дисфункции и инфекционных заболеваний. Аргинин, цистин, лейцин, метионин, триптофан, тирозин, аспартат, глутаминовая кислота, глицин, пролин и таурин классифицируются как FAA в питании человека [12].
Рыба является важным источником качественных белков животного происхождения, и сообщалось, что рыбный белок обладает большим эффектом насыщения, чем другие источники животных белков, такие как говядина и курица [13].По сравнению с другими источниками пищевых белков животного происхождения, потребители имеют широкий выбор рыбы с точки зрения доступности, поскольку существует множество разновидностей и видов рыб, особенно в тропических странах [4]. Здесь мы сообщаем о содержании сырого протеина и аминокислотном составе 27 пищевых рыб с Индийского субконтинента (таблицы 1 и 2), которые могут быть полезны при консультировании пациентов и рекомендации видов для пациентов с особыми потребностями и, таким образом, могут быть полезны в клинической медицине.Распределение аминокислот у разных видов обсуждается ниже. Не было заметных различий в аминокислотном составе рыб одного вида из разных мест.
| (а) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (б) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (c) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Классификация АК как «незаменимые», «несущественные» или «условно необходимые» с точки зрения питания соответствует Wu 2013 [12]. a Условно незаменимые аминокислоты; c функциональных аминокислот в соответствии с питанием человека (Wu 2010, 2013) [1, 12]. Значения представлены как среднее ± стандартное отклонение трех повторов; nd: не обнаружено. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
| Условно незаменимые аминокислоты; c функциональных аминокислот в соответствии с питанием человека. | ||||||||||||||||||||||||||||||||||||||||
Аргинин играет важную роль в делении клеток, заживлении ран, удалении аммиака, иммунной функции и высвобождении гормонов. Он также является предшественником биологического синтеза оксида азота, который играет важную роль в нейротрансмиссии, свертывании крови и поддержании кровяного давления. Его добавляют для выздоровления при ряде заболеваний, таких как сепсис, преэклампсия, гипертония, эректильная дисфункция, беспокойство и т. Д. Содержание аргинина в холодноводных рыбах O.mykiss (г 100 г белка -1 ), T. putitora, и N. hexagonolepis оказались очень высокими среди исследованных рыб и могут быть рекомендованы при дефиците аргинина [14]. Аналогичные уровни аргинина были зарегистрированы в мойве мелкой кормовой рыбы ( Mallotus villosus ) (%) [15].
Лейцин — единственная пищевая аминокислота, которая может стимулировать синтез мышечного белка [16] и играет важную терапевтическую роль в стрессовых состояниях, таких как ожоги, травмы и сепсис [17].Было обнаружено, что в качестве пищевой добавки лейцин замедляет деградацию мышечной ткани за счет увеличения синтеза мышечных белков. Лейцин был очень высоким в морских рыбах S. waitei и R. kanagurta (и г 100 -1 г белка соответственно), карпе L. rohita и C. mrigala, и сомах C .. batrachus и H. fossilis (Таблица 1), что выше, чем у европейского морского окуня (%), морского леща (%) и камбалы () [18].
Метионин используется для лечения заболеваний печени, улучшения заживления ран и лечения депрессии, алкоголизма, аллергии, астмы, отравления медью, побочных эффектов радиации, шизофрении, отмены лекарств и болезни Паркинсона [19]. Было обнаружено, что содержание метионина в морской рыбе S. waitei (4,0 ± 0,4 г 100 -1 г белка) и холодноводной рыбе T. putitora (г 100 -1 г белка) было самым высоким среди рыб и даже выше, чем у баранины [20], и сопоставим с таковым у кайрелей Channa striatus (%), Channa micropeltes (%) и Channa lucius () [21].
Глутаминовая кислота играет важную роль в метаболизме аминокислот из-за ее роли в реакциях трансаминирования и необходима для синтеза ключевых молекул, таких как глутатион, которые необходимы для удаления высокотоксичных пероксидов и кофакторов полиглутамата фолиевой кислоты. Эта аминокислота оказалась одной из самых распространенных аминокислот у карпов C. catla , L. rohita и C. mrigala и сомов C. batrachus и H.fossilis (таблица 1). Аналогичные значения глутаминовой кислоты были зарегистрированы у других видов рыб, таких как скумбрия [22] и красный лосось [23], а также в говядине [24]. Глицин играет важную роль в регуляции метаболизма, предотвращении повреждения тканей, повышении антиоксидантной активности, стимулировании синтеза белка и заживлении ран, а также повышении иммунитета и лечении метаболических нарушений при ожирении, диабете, сердечно-сосудистых заболеваниях, ишемии-реперфузии, раке и различные воспалительные заболевания [2].Было обнаружено, что сом H. fossilis содержит наибольшее количество глицина, за ним следует A. testudineus (таблица 1), что намного выше, чем содержание глицина в европейском морском окуле, дораде морского леща, тюрбо, Channa striatus , Channa micropeltes , Channa lucius и [18, 21].
Триптофан является предшественником серотонина, нейромедиатора мозга, который, согласно теории, подавляет боль. Свободный триптофан попадает в клетки мозга с образованием серотонина.Таким образом, добавка триптофана использовалась для увеличения выработки серотонина в попытке повысить толерантность к боли [25]. Триптофан также является предшественником мелатонина, триптамина и кинуренина и играет важную роль в функционировании нейромедиаторов, таких как дофамин и нордофамин. Добавка триптофана используется при лечении боли, бессонницы, депрессии, сезонного аффективного расстройства, булимии, предменструального дисфорического расстройства, синдрома дефицита внимания / гиперактивности и хронической усталости [26].Было обнаружено, что рыба T. putitora содержит наибольшее количество триптофана среди исследованных рыб (таблица 1).
Гистидин играет множество ролей во взаимодействии с белками [27], а также является предшественником гистамина. Он также необходим для роста и восстановления тканей, для поддержания миелиновых оболочек и для удаления тяжелых металлов из организма [28]. Было обнаружено, что морская рыба Rastrelliger kanagurta содержит большое количество гистидина. Мелкие аборигенные рыбы A.testudineus , A. mola, и P. sophore [29] также были богаты гистидином.
Лизин — это EAA, который экстенсивно необходим для оптимального роста, и его дефицит приводит к иммунодефициту [30]. Лизин используется для профилактики и лечения герпеса. Его принимают внутрь или наносят непосредственно на кожу. Содержание лизина было очень высоким в S. commersonii (г 100 -1 г белка) и T. putitora (г 100 -1 г белка).По содержанию аминокислот T. putitora было аналогично Channa striatus (%), Channa micropeltes (%) и Channa lucius (%) [21].
Треонин используется для лечения различных заболеваний нервной системы, включая спастичность позвоночника, рассеянный склероз, семейный спастический парапарез и боковой амиотрофический склероз [31]. Было обнаружено, что содержание треонина в S. waitei является самым высоким среди изученных видов рыб (Таблица 1). Следовательно, эта рыба может служить естественной добавкой треонина.
Изолейцин — это аминокислота с разветвленной цепью, которая необходима для формирования мышц и правильного роста [32]. Пациенты с хронической почечной недостаточностью (ХПН), находящиеся на гемодиализе, имеют низкий уровень в плазме крови аминокислот с разветвленной цепью (BCAA) лейцина, изолейцина и валина. Нарушения в пуле аминокислот в плазме можно исправить с помощью соответствующих добавок с высоким содержанием белка [33]. O. mykiss , как было обнаружено, содержит наибольшее количество изолейцина среди изученных видов рыб (6,5 г на 100 г белка -1 ), за которым следует л.rohita и может использоваться для добавления изолейцина.
Хотя NEAA de novo синтезируются в организме, некоторые из NEAA с точки зрения питания играют важную роль в регулировании экспрессии генов и уровней микро-РНК, передаче сигналов клеток, кровотоке, транспорте питательных веществ и метаболизме в клетках животных, развитии коричневого жира. ткань, рост и метаболизм кишечных микробов, антиоксидантные реакции, а также врожденные и клеточно-опосредованные иммунные ответы [1]. Аспарагиновая кислота (FAA) является предшественником метионина, треонина, изолейцина и лизина АК и регулирует секрецию важных гормонов.Точно так же серин является предшественником глицина, цистеина и триптофана и играет важную роль в передаче сигналов в клетке. Серин также используется для лечения шизофрении. Было обнаружено, что содержание аспарагиновой кислоты и серина у S. commersonii было самым высоким среди исследованных рыб, за которым следует R. kanagurta .
База знаний, обогащенная данными об аминокислотном составе 27 важных пищевых рыб, будет полезна в клиническом питании для выпуска рекомендаций для пациентов, рекомендаций по питанию и консультирования.Хотя варка и кипячение вызывают потерю содержания аминокислот в различной степени [34], конечное содержание пропорционально содержанию сырца [35]. Таким образом, в целом, холодноводные виды могут быть рекомендованы для лизина и аспарагиновой кислоты, морских рыб — для лейцина, мелких местных рыб — для гистидина, а карпов и сомов — для глутаминовой кислоты и глицина. Однако для конкретного пациента могут быть полезны данные об аминокислотном составе отдельных видов, представленные в таблице 1.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Бимал Моханти является координатором и главным исследователем проекта. Бимал Моханти, Т. В. Санкар и А. П. Шарма задумали и разработали исследование. Сбор и анализ проб пресноводных рыб были выполнены Арабиндой Маханти, Сатабди Гангули, Тандримой Митрой, Судешной Банерджи, Прасенджитом Парией, Дебаджитом Дасом, Биджай Бехера, Мэриленд Афтабуддин, Дипеш Дебнатх, Байдьянат Пол и Н.Шридхар; морские рыбы — Т. В. Санкар, Каджал Чакраборти, Анандан Рангасами, Сусила Мэтью, Куруккан Куннатх Аша, П. Виджаягопал, К. К. Виджаян и П. Т. Лаксманан; и холодноводные рыбы Дебаджит Сарма, Ниту Сахи, М. С. Ахтар, Пушпита Дас. Подготовкой рукописи занимались Арабинда Маханти, Сатабди Гангули и Бимал Моханти. Проект редактировал Бимал Моханти.
Выражение признательности
Эта работа финансировалась Индийским советом сельскохозяйственных исследований, Отдел рыболовства в рамках информационно-просветительской деятельности (№ 3) по «Профилированию питательных веществ и оценке рыбы как диетического компонента» (http: // www.cifri.ernet.in/outreach). Авторы благодарны доктору С.