2. Основные этапы катаболизма и анаболизма Этапы катаболизма
Катаболизм
– расщепление крупных молекул с
выделением энергии, заключенной в их
структуре и запасание ее в форме АТФ.
Полный распад крупных молекул
осуществляется в 3 этапа:
1)
Подготовительный
(распад сложных
молекул до их составных компонентов):
белки → аминокислоты; сложные углеводы
→ моносахариды; липиды → спирты и высшие
жирные кислоты; полинуклеотиды →
мононуклеотиды.
Этот
процесс осуществляется без участия
кислорода, и АТФ здесь не образуется.
Он происходит либо в желудочно-кишечном
тракте (если речь идет о расщеплении
сложных веществ, поступающих с пищей),
либо в клетках организма (при распаде
собственных, или тканевых сложных
молекул).
Расщепление
сложных веществ, поступающих с пищей,
всегда происходит путем гидролиза при
участии соответствующих гидролитических
ферментов желудочно-кишечного тракта.
Расщепление собственных белков, липидов
и нуклеотидов также осуществляется
путем гидролитического распада, а что
касается углеводов – их распад в клетках
организма может происходить как путем
гидролиза, так и путем фосфоролиза.
2)
Этап универсализации
(высвободившиеся в результате
подготовительного этапа низкомолекулярные
органические соединения, такие как
моносахариды, аминокислоты, глицерин,
жирные кислоты, подвергаются дальнейшей
метаболизации с образованием относительно
небольшого круга веществ, чаще всего,
это ПВК либо другие кетокислоты,
ацетилкоэнзим А или сукцинилкоэнзим
А.
Этот
этап также осуществляется в клетках
организма без участия кислорода
(например, гликолиз, β-окисление
жирных кислот).
АТФ при этом может образовываться, но
относительно немного.
3) Этап полного
распада (происходит в митохондриях
клеток, причем, исключительно в аэробных
условиях).
В
основе этого процесса лежат такие этапы
аэробного дыхания как цикл Кребса и
окислительное фосфорилирование, в
результате которых промежуточные
метаболиты, образовавшиеся на этапе
универсализации, полностью окисляются
до воды и углекислого газа с высвобождением
энергии, которая аккумулируется в форме
макроэргических химических связей АТФ.
Этапы анаболизма
Анаболизм
– синтез крупных молекул из мелких,
идущий с затратой энергии. В
клетках животных и растений протекает
множество анаболических реакций, в ходе
которых из мелких молекул строятся
более крупные.
Каждая
клетка обычно сама синтезирует для себя
необходимые белки, нуклеотиды, липиды,
полисахариды и другие сложные вещества,
а не получает их готовыми из других
клеток (к примеру, гликоген, находящийся
в мышцах, синтезируется в мышечных
волокнах, а не приносится кровью из
печени).
Исходным
сырьем для процессов биосинтеза являются
сравнительно немногие вещества, в том
числе ацетилкоэнзим А, глицин,
сукцинилкоэнзим А, рибоза, ПВК и глицерин.
Можно выделить
следующие этапы анаболизма:
1)
Образование промежуточных метаболитов
(ПВК, ацетилкоэнзима А, фосфоглицеринового
альдегида и др.), необходимых для
прохождения дальнейших этапов биосинтеза.
2)
Образование структурных блоков
(аминокислот, моносахаридов, высших
жирных кислот и др.), необходимых для
синтеза сложных органических молекул.
3) Биосинтез сложных
(и в том числе высокомолекулярных)
соединений: белков и пептидов, сложных
углеводов, липидов, полинуклеотидов.
Каждый этап
биосинтеза катализируется отдельным
ферментом.
Некоторые
реакции в биосинтетических процессах
не требуют доставки энергии извне, хотя
в целом происходящие в клетках процессы
синтеза нуждаются в поступлении энергии.
Синтез сложных
молекул и их расщепление регулируется
при помощи различных, обособленных друг
от друга механизмов.
studfile.net
2. Энергетический обмен (катаболизм, диссимиляция)
Универсальным источником энергии во всех клетках служит АТФ (аденозинтрифосфат, или аденозинтрифосфорная кислота).
Все энергетические затраты любой клетки обеспечиваются за счёт универсального энергетического вещества — АТФ.
АТФ синтезируется в результате реакции фосфорилирования, то есть присоединения одного остатка фосфорной кислоты к молекуле АДФ (аденозиндифосфата):
АДФ + h4PO4+ 40 кДж = АТФ + h3O.
Энергия запасается в форме энергии химических связей АТФ. Химические связи АТФ, при разрыве которых выделяется много энергии, называются макроэргическими.
При распаде АТФ до АДФ клетка за счёт разрыва макроэргической связи получит приблизительно \(40\) кДж энергии.
Энергия для синтеза АТФ из АДФ выделяется в процессе диссимиляции.
Энергетический обмен (диссимиляция, катаболизм) — это совокупность химических реакций постепенного распада органических соединений, сопровождающихся высвобождением энергии, часть которой расходуется на синтез АТФ.
В зависимости от среды обитания организма, диссимиляция может проходить в два или в три этапа.
Процессы расщепления органических соединений у аэробных организмов происходят в три этапа: подготовительный, бескислородный и кислородный.
В результате этого органические вещества распадаются до простейших неорганических соединений.
У анаэробных организмов, обитающих в бескислородной среде и не нуждающихся в кислороде (а также у аэробных организмов при недостатке кислорода), ассимиляция происходит в два этапа: подготовительный и бескислородный.
В двухэтапном энергетическом обмене энергии запасается гораздо меньше, чем в трёхэтапном.
Первый этап — подготовительный
Подготовительный этап заключается в распаде крупных органических молекул до более простых: полисахаридов — до моносахаридов, липидов — до глицерина и жирных кислот, белков — до аминокислот.
Этот процесс называется пищеварением. У многоклеточных организмов он осуществляется в желудочно-кишечном тракте с помощью пищеварительных ферментов. У одноклеточных организмов — происходит под действием ферментов лизосом.
В ходе биохимических реакций, происходящих на этом этапе, энергии выделяется мало, она рассеивается в виде тепла, и АТФ не образуется.
Второй этап — бескислородный (гликолиз)
Второй (бескислородный) этап заключается в ферментативном расщеплении органических веществ, которые были получены в ходе подготовительного этапа. Кислород в реакциях этого этапа не участвует.
Биологический смысл второго этапа заключается в начале постепенного расщепления и окисления глюкозы с накоплением энергии в виде \(2\) молекул АТФ.
Процесс бескислородного расщепления глюкозы называется гликолиз.
Гликолиз происходит в цитоплазме клеток.
Он состоит из нескольких последовательных реакций превращения молекулы глюкозы C6h22O6 в две молекулы пировиноградной кислоты — ПВК C3h5O3 и две молекулы АТФ (в виде которой запасается примерно \(40\) % энергии, выделившейся при гликолизе). Остальная энергия (около \(60\) %) рассеивается в виде тепла.
C6h22O6 + h4PO4+ 2АДФ = C3h5O3+2АТФ +2h3O.
Получившаяся пировиноградная кислота при недостатке кислорода в клетках животных, а также клетках многих грибов и микроорганизмов, превращается в молочную кислоту C3H6O3.
HOOC−CO−Ch4пировиноградная кислота→НАД⋅H+H+лактатдегидрогеназаHOOC−CHOH−Ch4молочная кислота.
В мышцах человека при больших нагрузках и нехватке кислорода образуется молочная кислота и появляется боль. У нетренированных людей это происходит быстрее, чем у людей тренированных.
При недостатке кислорода в клетках растений, а также в клетках некоторых грибов (например, дрожжей), вместо гликолиза происходит спиртовое брожение: пировиноградная кислота распадается на этиловый спирт C2H5OH и углекислый газ CO2:
C6h22O6+2h4PO4+2АДФ=2C2H5OH+2CO2+2АТФ+2h3O.
Третий этап — кислородный
В результате гликолиза глюкоза распадается не до конечных продуктов (CO2 и h3O), а до богатых энергией соединений (молочная кислота, этиловый спирт) которые, окисляясь дальше, могут дать её в больших количествах. Поэтому у аэробных организмов после гликолиза (или спиртового брожения) следует третий, завершающий этап энергетического обмена — полное кислородное расщепление, или клеточное дыхание.
Этот этап происходит на кристах митохондрий.
Третий этап, так же как и гликолиз, является многостадийным и состоит из двух последовательных процессов — цикла Кребса и окислительного фосфорилирования.
Третий (кислородный) этап заключается в том, что при кислородном дыхании ПВК окисляется до окончательных продуктов — углекислого газа и воды, а энергия, выделяющаяся при окислении, запасается в виде \(36\) молекул АТФ (\(2\) молекулы в цикле Кребса и \(34\) молекулы в ходе окислительного фосфорилирования).
Этот этап можно представить себе в следующем виде:
2C3h5O3+6O2+36h4PO4+36АДФ=6CO2+42h3O+36АТФ.
Вспомним, что ещё две молекулы АТФ запасаются в ходе бескислородного расщепления каждой молекулы глюкозы (на втором, бескислородном, этапе). Таким образом, в результате полного расщепления одной молекулы глюкозы образуется \(38\) молекул АТФ.
Суммарная реакция энергетического обмена:
C6h22O6+6O2=6CO2+6h3O+38АТФ.
Для получения энергии в клетках, кроме глюкозы, могут быть использованы и другие вещества: липиды, белки. Однако ведущая роль в энергетическом обмене у большинства организмов принадлежит сахарам.
Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
www.yaklass.ru
6. Общие пути катаболизма.
1.
ФЕРМЕНТЫ или энзимы — белки, выполняющие
роль катализаторов в живых организмах.
Осн. ф-ции ферментов- ускорять превращение
в-в, поступающих в организм и образующихся
при метаболизме (для обновления клеточных
структур, для обеспечения его энергией
и др.), а также регулировать биохим.
процессы (напр., реализацию генетич.
информации), в т. ч. в ответ на изменяющиеся
условия. По рекомендации Международного
биохимического союза, Ф. разделяют на
6 классов: 1) оксидоредуктазы, 2) трансферазы,
3) гидролазы, 4) лиазы, 5) изомеразы, 6)
лигазы (синтетазы). Рекомендована
следующая нумерация Ф. Шифр (индекс)
каждого Ф. содержит 4 числа, разделённых
точками. Первая цифра указывает класс,
вторая – подкласс, третья – подподкласс,
четвёртая – порядковый номер в данном
подподклассе. Так, Ф. аргиназа, расщепляющий
аргинин на орнитин и мочевину, имеет
шифр 3.5.3.1, т. е. относится к классу
гидролаз, подклассу Ф., действующих на
непептидные С–N-cвязи, и подподклассу
Ф., расщепляющих эти связи в линейных
(не циклических) соединениях.
2.Ферментопатии
— болезни и патологические состояния,
обусловленные полным отсутствием
синтеза ферментов или стойкой
функциональной недостаточностью
ферментных систем органов и тканей.
Среди врожденных ферментопатий наиболее
часто встречается недостаточность
дисахаридаз (лактазы, сахаразы, изомальтазы
и др.), пептидаз (глутеновая энтеропатия),
энтерокиназы. Приобретенные ферментопатии
могут быть следствием токсического
воздействия ксенобиотиков и мутагенов
внешней среды, они ответственны за
многообразные проявления так называемые
экопатологии человека. Приобретенные
ферментопатий наблюдаются при заболеваниях
(хронический энтерит, болезнь Крона,
дивертикулез с дивертикулитом и др.) и
резекции тонкой кишки, заболеваниях
других органов пищеварения (панкреатит,
гепатит, цирроз печени) и органов
эндокринной системы (диабет, гипертиреоз),
а также при приеме некоторых лекарственных
препаратов (антибиотики, цитостатики
и др.) и облучении.
Активность
фермента выражают количеством субстрата,
превращенного ферментом в единицу
времени при оптимальных для фермента
условиях.
Витамин
В2, рибофлавин. Коферментная форма: ФМН
и ФАД.
Витамин
В3, пантотеновая кислота. Коферментная
форма — КоА.
Витамин
В5 (PP), никотиновая кислота. Коферментная
форма: НАД и НАДФ.
Витамин
В12 имеет две коферментные формы:
метилкобаламин и 5 — дезоксиаденозилкобаламин.
3.
Регуляции
синтеза и каталитической активности
ферментов:
1.
Влияние
закона действия масс.
В катализируемой ферментом обратимой
химической реакции, например А + В <=>
С + D, концентрация компонентов реакции
и соответственно направление реакции
будут регулироваться влиянием закона
действия масс. Оно, в частности, может
быть показано в обратимой реакции
трансаминирования, катализируемой
ферментом аланинаминотрансферазой:
Аланин + α-Кетоглутарат <=> Пируват +
Глутамат.
2.
Изменение
количества фермента.
На бактериях хорошо изучен феномен
индуцированного синтеза ферментов при
выращивании их на среде, где единственным
источником углерода и энергии служит
тот или иной углевод, например глюкоза.
Замена в среде глюкозы на лактозу
приводит к индуцированному или адаптивному
синтезу фермента галактозидазы,
расщепляющей лактозу на глюкозу и
галактозу.
3.
Проферменты.
Протеолитические ферменты пищеварительного
тракта, а также поджелудочной железы
синтезируются в неактивной форме – в
виде проферментов (зимогенов). Регуляция
в этих случаях сводится к превращению
проферментов в активные ферменты под
влиянием специфических агентов или
других ферментов – протеиназ.
4.
Химическая
модификация фермента.
Некоторые белки при формировании
третичной структуры подвергаются
постсинтетической химической модификации.
Оказалось, что активность ряда ключевых
ферментов обмена углеводов, в частности
фосфорилазы, гликогенсинтазы и др.,
также контролируется путем фосфорилирования
и дефосфорили-рования, осуществляемого
специфическими ферментами – протеинкиназой
и протеинфосфатазой, активность которых
в свою очередь регулируется гормонами.
5.
Аллостерическая
регуляция.
Во многих строго биосинтетических
реакциях основным типом регуляции
скорости многоступенчатого ферментативного
процесса является ингибирование по
принципу обратной связи. Это означает,
что конечный продукт биосинтетической
цепи подавляет активность фермента,
катализирующего первую стадию синтеза,
которая является ключевой для данной
цепи реакции. Поскольку конечный продукт
структурно отличается от субстрата, он
связывается с аллостерическим
(некаталитическим) центром молекулы
фермента, вызывая ингибирование всей
цепи синтетической реакции.
6.
Другие
типы регуляции активности ферментов.
Абсолютное количество присутствующего
в клетке фермента регулируется временем
его синтеза и распада. К регуляторным
механизмам могут быть отнесены также
конкуренция ферментов за общий субстрат,
выключение активности одного из
изоферментов (у множественных форм
ферментов), влияние концентраций
кофакторов и явление компартментализации.
Различают
обратимое и необратимое ингибирование.
Если ингибитор вызывает стойкие изменения
пространственной третичной структуры
молекулы фермента или модификацию
функциональных групп фермента, то такой
тип ингибирования называется необратимым.
Обратимое ингибирование в свою очередь
разделяют на конкурентное и неконкурентное
в зависимости от того, удается или не
удается преодолеть торможение
ферментативной реакции путем увеличения
концентрации субстрата.
Конкурентное
ингибирование может быть вызвано
веществами, имеющими структуру, похожую
на структуру субстрата, но несколько
отличающуюся от структуры истинного
субстрата. Такое ингибирование основано
на связывании ингибитора с активным
центром.
Неконкурентное
обратимое ингибирование не может быть
ослаблено или устранено повышением
концентрации субстрата, так как эти
ингибиторы присоединяются к ферменту
не в активном центре, а в другом месте.
4.
Окисление биологическое (клеточное или
тканевое дыхание)
— окислительно-восстановительные
реакции, протекающие в клетках организма,
в результате которых сложные органические
вещества окисляются при участии
специфических ферментов кислородом,
доставляемым кровью. Конечными продуктами
биологического окисления являются вода
и двуокись углерода.
Реакции
отщепления водорода осуществляются
ферментами класса дегидрогеназ, причем
атомы водорода (т. е. протоны + электроны)
присоединяются к коферментам:
никотинамидадениндинуклеотиду (НАД),
никотинамидадениндинуклеотид-фосфату
(НАДФ), флавинадениндинуклеотиду (ФАД)
и др.
Оксидоредуктазы
— класс ферментов,
катализирующихокислительно-восстановительные
реакции. Играют важную роль в
обеспеченииклеток энергией. Важнейшие
группы оксидоредуктаз:
дегидрогеназы,гидроксилазы, оксигеназы,
оксидазы, пероксидазы.
Оксидоредуктазы
катализируют биохимические процессы,
сопровождающиеся выделением энергии.
Оксидоредуктазы
чрезвычайно важны для клетки, так как
с их помощью осуществляются определенные
экзотермические реакции, в результате
которых бактерии получают энергию,
необходимую для их жизнедеятельности.
Оксидоредуктазы
ускоряют протекание химических процессов,
связанных с высвобождением энергии.
Оксидоредуктазы
ускоряют химические процессы, протекающие
в клетке, в результате которых
высвобождается энергия. Процессы
окисления неразрывно связаны с
фосфорилированием органических веществ,
так называемым окислительным
фосфо-рилированием, — объединенным
процессом переноса электронов и
аккумуляции энергии дыхания вследствие
эстерификации неорганического фосфата
в макроэргические соединения типа АТФ.
Анаэробные
дегидрогеназы являются двухкомпонентными
ферментами и легко диссоциируют при
диализе, распадаясь на более активные
коферменты. Коферментами являются
никотинамидаде-ниндинуклеотид (НАД) и
никотинамидадениндинуклеотидфосфат
(НАДФ). Эти коферменты очень реакционноспособны
в окислительно-восстановительных
системах. Они играют важную роль в
процессе алкогольного брожения.
Анаэробные
дегидрогеназы являются двухкомпонентными
ферментами и легко диссоциируют при
диализе, распадаясь на более активные
коферменты. Коферментами являются
никотинамидаде-ниндинуклеотид (НАД) и
никотинамидадениндинуклеотидфосфат
(НАДФ). Эти коферменты очень реакционноспособны
в окислительно-восстановительных
системах. Они играют важную роль в
процессе алкогольного брожения.
5.
Аденозинтрифосфа́т—
нуклеотид, играет исключительно важную
роль в обмене энергии и веществ в
организмах; в первую очередь соединение
известно как универсальный источник
энергии для всех биохимических процессов,
протекающих в живых системах.
Субстратное
фосфорилирование
— синтез богатых энергией фосфорных
соединений за счёт энергии
окислительно-восстановительных реакций
Гликолиза (катализируемых
фосфоглицеральдегиддегидрогеназой и
енолазой) и при окислении α-кетоглутаровой
кислоты в Трикарбоновых кислот цикле
(под действием α-кетоглутаратдегидрогеназы
и сукцинаттиокиназы). Для бактерий
описаны случаи С. ф. при окислении
пировиноградной кислоты. С. ф., в отличие
от фосфорилирования в цепи переноса
электронов (см. Окислительное
фосфорилирование), не ингибируется
«разобщающими» ядами (например,
динитрофенолом) и не связано с фиксацией
ферментов в мембранах митохондрий.
Вклад С. ф. в клеточный фонд АТФ в аэробных
условиях значительно меньше, чем вклад
фосфорилирования в цепи переноса
электронов.
Окислительное
фосфорилирование
— один из важнейших компонентов
клеточного дыхания, приводящего к
получению энергии в виде АТФ. Субстратами
окислительного фосфорилирования служат
продукты расщепления органических
соединений — белки, жиры и углеводы.
Однако
чаще всего в качестве субстрата
используются углеводы. Так, клетки
головного мозга не способны использовать
для дыхания никакой другой субстрат,
кроме углеводов.
Коэффициент
фосфорилирования
В
расчете на каждый атом поглощенного
кислорода (или на каждую пару переносимых
электронов) митохондрии образуют
максимум три молекулы АТФ (т. е. связывают
три молекулы Н3Р04 с АДФ). Отношение
количества связанной Н3Р04к( Скачано с
dsmahelp.org.ua) количеству поглощенного
кислорода (О) называют коэффициентом
фосфорили-рования и обозначают Р/О;
следовательно, коэффициент Р/О < 3.
ФАД-зависи-мые дегидрогеназы мембраны
митохондрий не являются протонными
насосами (см. рис. 8.4): в этом случае в
цепи переноса электронов действуют
только два пункта перекачки протонов
— комплексы III и IV, и коэффициент Р/О не
может быть больше двух.
Метаболизм
представляет собой высоко координированную
и целенаправленную клеточную активность,
обеспеченную участием многих
взаимосвязанных ферментативных систем,
и включает два неразрывных процесса
анаболизм и катаболизм.
Он
выполняет три специализированные
функции:
Энергетическая
– снабжение клетки химической энергией,
Пластическая
– синтез макромолекул как строительных
блоков,
Специфическая
– синтез и распад биомолекул, необходимых
для выполнения специфических клеточных
функций.
Анаболизм
– это биосинтез белков, полисахаридов,
липидов, нуклеиновых кислот и других
макромолекул из малых молекул-предшественников.
Поскольку он сопровождается усложнением
структуры, то требует затрат энергии.
Источником такой энергии является
энергия АТФ.
Также
для биосинтеза некоторых веществ (жирные
кислоты, холестерол) требуются богатые
энергией атомы водорода – их источником
является НАДФН. Молекулы НАДФН образуются
в реакциях окисления глюкозо-6-фосфата
в пентозном пути и оксалоацетата
малик-ферментом. В реакциях анаболизма
НАДФН передает свои атомы водорода на
синтетические реакции и окисляется до
НАДФ. Так формируется НАДФ-НАДФН-цикл.
Катаболизм
– расщепление и окисление сложных
органических молекул до более простых
конечных продуктов. Оно сопровождается
высвобождением энергии, заключенной в
сложной структуре веществ. Большая
часть высвобожденной энергии рассеивается
в виде тепла. Меньшая часть этой энергии
«перехватывается» коферментами
окислительных реакций НАД и ФАД, некоторая
часть сразу используется для синтеза
АТФ.
Следует
заметить, что атомы водорода, высвобождаемые
в реакциях окисления веществ, могут
использоваться клеткой только по двум
направлениям:
на
анаболические реакции в составе НАДФН.
на
образование АТФ в митохондриях при
окислении НАДН и ФАДН2 .
Весь
катаболизм условно подразделяется на
три этапа:
I
этап
Происходит
в кишечнике (переваривание пищи) или в
лизосомах при расщеплении уже ненужных
молекул. При этом освобождается около
1% энергии, заключенной в молекуле. Она
рассеивается в виде тепла.
II
этап
Вещества,
образованные при внутриклеточном
гидролизе или проникающие в клетку из
крови, на втором этапе обычно превращаются
в пировиноградную кислоту, ацетильную
группу (в составе ацетил-S-КоА) и в
некоторые другие мелкие органические
молекулы. Локализация второго этапа –
цитозоль и митохондрии.
Часть
энергии рассеивается в виде тепла и
примерно 13% энергии вещества усваивается,
т.е. запасается в виде макроэргических
связей АТФ.
III
этап
Все
реакции этого этапа идут в митохондриях.
Ацетил-SКоА включается в реакции цикла
трикарбоновых кислот и окисляется до
углекислого газа. Выделенные атомы
водорода соединяются с НАД и ФАД и
восстанавливают их. После этого НАДН и
ФАДН2 переносят водород в цепь дыхательных
ферментов, расположенную на внутренней
мембране митохондрий. Здесь в результате
процесса под названием «окислительное
фосфорилирование» образуется вода
и главный продукт биологического
окисления – АТФ.
Часть
выделенной на этом этапе энергии молекулы
рассеивается в виде тепла и около 46%
энергии исходного вещества усваивается,
т.е. запасается в связях АТФ и ГТФ.
7.
Ци́кл трикарбо́новых кисло́т (цикл
Кре́бса, цитра́тный цикл)
— центральная часть общего пути
катаболизма, циклический биохимический
аэробный процесс, в ходе которого
происходит превращение двух- и
трёхуглеродных соединений, образующихся
как промежуточные продукты в живых
организмах при распаде углеводов, жиров
и белков, до CO2. При этом освобождённый
водород направляется в цепь тканевого
дыхания, где в дальнейшем окисляется
до воды, принимая непосредственное
участие в синтезе универсального
источника энергии — АТФ.
Цикл
Кребса регулируется «по механизму
отрицательной обратной связи», при
наличии большого количества субстратов
(ацетил-КоА, оксалоацетат), цикл активно
работает, а при избытке продуктов реакции
(NADH, ATP) тормозится. Регуляция осуществляется
и при помощи гормонов, основным источником
ацетил-КоА является глюкоза, поэтому
гормоны, способствующие аэробному
распаду глюкозы, способствуют работе
цикла Кребса. Такими гормонами являются:
инсулин и адреналин. Глюкагон стимулирует
синтез глюкозы и ингибирует реакции
цикла Кребса.
Как
правило работа цикла Кребса не прерывается
за счёт анаплеротических реакций,
которые пополняют цикл субстратами:
Пируват + СО2 + АТФ = Оксалацетат(субстрат
Цикла Кребса) + АДФ + Фн.
Функции
Интегративная
функция — цикл является связующим
звеном между реакциями анаболизма и
катаболизма.
-
Катаболическая
функция — превращение различных
веществ в субстраты цикла: -
Жирные
кислоты, пируват,Лей,Фен — Ацетил-КоА.
Арг,
Гис, Глу — α-кетоглутарат.
Фен,
тир — фумарат.
Оксалацетат
— глюкоза, Асп, Асн.
Сукцинил-КоА
— синтез гема.
CО2
— реакции карбоксилирования.
-
Водорододонорная
функция — цикл Кребса поставляет на
дыхательную цепь митохондрий протоны
в виде трех НАДН.Н+ и одного ФАДН2. -
Энергетическая
функция — 3 НАДН.Н+ дает 7.5 моль АТФ, 1
ФАДН2 дает 1.5 моль АТФ на дыхательной
цепи. Кроме того в цикле путем субстратного
фосфорилирования синтезируется 1 ГТФ,
а затем из него синтезируется АТФ
посредствам трансфосфорилирования:
ГТФ + АДФ = АТФ + ГДФ.
8.
Глико́лиз
—
ферментативный процесс последовательного
расщепления глюкозы в клетках,
сопровождающийся синтезом АТФ. Гликолиз
при аэробных условиях ведёт к образованию
пировиноградной кислоты (пирувата),
гликолиз в анаэробных условиях ведёт
к образованию молочной кислоты (лактата).
Гликолиз является основным путём
катаболизма глюкозы в организме животных.
Результат
Результатом
гликолиза является превращение одной
молекулы глюкозы в две молекулы
пировиноградной кислоты (ПВК) и образование
двух восстановительных эквивалентов
в виде кофермента НАД∙H.
Полное
уравнение гликолиза имеет вид:
Глюкоза
+ 2НАД+ + 2АДФ + 2Фн = 2НАД∙Н + 2ПВК + 2АТФ +
2h3O + 2Н+.
При
отсутствии или недостатке в клетке
кислорода пировиноградная кислота
подвергается восстановлению до молочной
кислоты, тогда общее уравнение гликолиза
будет таким:
Глюкоза
+ 2АДФ + 2Фн = 2лактат + 2АТФ + 2h3O.
Таким
образом, при анаэробном расщеплении
одной молекулы глюкозы суммарный чистый
выход АТФ составляет две молекулы,
полученные в реакциях субстратного
фосфорилирования АДФ.
У
аэробных организмов конечные продукты
гликолиза подвергаются дальнейшим
превращениям в биохимических циклах,
относящихся к клеточному дыханию. В
итоге после полного окисления всех
метаболитов одной молекулы глюкозы на
последнем этапе клеточного дыхания —
окислительном фосфорилировании,
происходящем на митохондриальной
дыхательной цепи в присутствии кислорода,
— дополнительно синтезируются ещё 34
или 36 молекулы АТФ на каждую молекулу
глюкозы.
Значение
Гликолиз
— катаболический путь исключительной
важности. Он обеспечивает энергией
клеточные реакции, в том числе и синтез
белка. Промежуточные продукты гликолиза
используются при синтезе жиров. Пируват
также может быть использован для синтеза
аланина, аспартата и других соединений.
Благодаря гликолизу производительность
митохондрий и доступность кислорода
не ограничивают мощность мышц при
кратковременных предельных нагрузках.
9.
Глюкозо-лактатный
цикл (цикл Кори) — Начинается
с образования лактата в мышцах в
результате анаэробного гликолиза
(особенно в белых мышечных волокнах,
которые бедны митохондриями по сравнению
с красными). Лактат переносится кровью
в печень, где в процессе глюконеогенеза
превращается в глюкозу, которая затем
с током крови может возвращаться в
работающую мышцу.
Итак
печень снабжает мышцу глюкозой и,
следовательно, энергией для сокращений.
В печени часть лактата может окисляться
до СО2 и Н2О, превращаясь в пируват и
далее в общих путях катаболизма.
Аланин
(2-аминопропановая кислота) — алифатическая
аминокислота.
α-Аланин
входит в состав многих белков, β-аланин
— в состав ряда биологически активных
соединений.
Аланин
легко превращается в печени в глюкозу
и наоборот. Этот процесс носит название
глюкозо-аланинового цикла и является
одним из основных путей глюконеогенеза
в печени.
Химические
свойства
взаимодействие
с основаниями
Nh3-C2h5-COOH
+ NaOH
→ Nh3-C2h5-COONa
+ h3O
взаимодействие
с кислотами
Nh3-C2h5-COOH
+ HCl
→ HOOC-C2h5-Nh3•HCl
взаимодействие
со спиртами
Nh3-C2h5-COOH
+ C2H5OH → Nh3-C2h5-CO-С2Н5 + h3O
образование
пептидной связи
Nh3-C2h5-COOH
+ Nh3-C2h5-COOH
→ Nh3-C2h5-CO-NH-C2h5-COOH
+ h3O
10.
Обмен
гликогена
Гликоген
обнаруживается в цитоплазме и ядрах
клеток в виде прозрачных капель. Он
хорошо растворим в воде. Поэтому ткани,
исследуемые па гликоген, необходимо
предохранять от воздействия водных
растворов и фиксировать в безводном
спирте, ацетоне и др. Правильнее говорить
не о гликогене, а о гликогенах с различной
степенью полимеризации и растворимости.
В связи с этим возникают трудности в
гистохимическом его изучении.
Непосредственно
синтез гликогена осуществляют следующие
ферменты:
1.
Фосфоглюкомутаза – превращает
глюкозо-6-фосфат в глюкозо-1-фосфат;
2.
Глюкозо-1-фосфат-уридилтрансфераза –
фермент, осуществляющий ключевую реакцию
синтеза. Необратимость этой реакции
обеспечивается гидролизом образующегося
дифосфата;
3.
Гликогенсинтаза – образует α1,4-гликозидные
связи и удлиняет гликогеновую цепочку,
присоединяя активированный С1 УДФ-глюкозы
к С4 концевых остатков гликогена;
4.
Амило-α1,4-α1,6-гликозилтрансфераза,»гликоген-ветвящий»
фермент – переносит фрагмент с минимальной
длиной в 6 остатков глюкозы на соседнюю
цепь с образованием α1,6-гликозидной
связи.
Фермент
фосфорилаза, регулирующий распад
гликогена, существует в двух формах:
неактивной фосфорилазы b и высокоактивной
фосфорилазы a. Превращение неактивной
фосфорилазы b в активную фосфорилазу a
происходит в результате реакции переноса
фосфатной группы с АТФ на OH-группу серина
— одной из аминокислот в белковой цепи
фермента. Для этой реакции переноса
необходим еще один фермент — специфическая
киназа, а также специфический кофактор
— циклическая адениловая кислота.
Подготовительным этапом при активации
фосфорилазы является образование из
АТФ циклической адениловой кислоты;
эта реакция происходит при участии
фермента аденилциклазы, связанной с
мембранами клеток. Активность аденилциклазы
стимулируется гормонами адреналином
или глюкагоном. Благодаря этому сложному
механизму оба гормона вызывают повышение
содержания сахара в крови млекопитающих.
Биологическое
значение обмена гликогена в печени и
мышцах
Сравнение
этих процессов позволяет сделать
следующие выводы:
-
синтез
и распад гликогена протекают по разным
метаболическими путям; -
печень
запасает глюкозу в виде гликогена не
столько для собственных нужд, сколько
для поддержания постоянной концентрации
глюкозы в крови, и, следовательно,
обеспечивает поступление глюкозы в
другие ткани. Присутствие в печени
глюкозо-6-фосфатазы обусловливает эту
главную функцию печени в обмене
гликогена; -
функция
мышечного гликогена заключается в
освобождении глюкозо-6-фосфата,
потребляемого в самой мышце для окисления
и использования энергии; -
синтез
гликогена — процесс эндергонический.
Так на включение одного остатка глюкозы
в полисахаридную цепь используется 1
моль АТФ и 1 моль УТФ; -
распад
гликогена до глюкозо-6-фосфата не требует
энергии; -
необратимость
процессов синтеза и распада гликогена
обеспечивается их регуляцией.
11.
Пентозо-фосфатный путь расщепления
глюкозы: протекает
в цитоплазме клеток и включает две
стадии: 1) окислительная 2)неокислительная.
В
ходе окислительноо этапа образуются
НАДФН, а также фосфорилированные пентозы.
Неокислительная
стадия: в ней происходит превращение
пентоз, при этом образуются промежуточные
продукты С3,С4,С6 углеродных атомов. В
пентозо-фосфатном пути, в который
вступают 6 молекул глюкозы, одна
расщепляется до СО2, а остальные
регенирируются.
Окислительная
стадия:
1.
Глюкозо-6-фосфат + 6 НАДФ = 6-Фосфоглюко-нолактон
+ 6 НАДФН + 6Н+
2.
6-Фосфоглюконолактон=6-Фосфоглюконат
3.
6-Фосфоглюконат + 6 НАДФ=6 Риболозо-5-фосфат
+ 6 НАДФН + 6 H+ + 6CO2
4.
2 Рибулозо-5-фосфат=2 Рибозо-5-фосфат
5.
4 Рибулозо-5-фосфат = 4 2-Ксилулозо-5-фосфат
Значение
пентозо-фосфатного пути: Образование
пентозы используется для синтеза
нуклеотканных коферментов, мононуклеотидов(
АМФ, УМФ, ЦМФ, ТМФ) и нуклеиновых кислот.
Пентозо-фосфатный
путь сост. 50% НАДФН необходимого организму.
ПФП наиболее активен в печени, жировой
ткани, коре надпочечников, щитовидной
железе, эритроцитах.
studfile.net
Специфические и общие пути катаболизма
В катаболизме
различают три стадии:
1). Полимеры
превращаются в мономеры (белки – в
аминокислоты, углеводы в моносахариды,
липиды – в глицерол и жирные кислоты).
Химическая энергия при этом рассеивается
в виде тепла.
2).
Мономеры превращаются в общие продукты,
в подавляющем большинстве в ацетил-КоА.
Химическая энергия частично рассеивается
в виде тепла, частично накапливается в
виде восстановленных коферментных форм
(НАДН, ФАДН2),
частично запасается в макроэргических
связях АТФ (субстратное фосфорилирование).
1-ая
и 2-ая стадии катаболизма относятся к
специфическим
путям, которые уникальны для метаболизма
белков, липидов и углеводов.
3).
Заключительный этап катаболизма,
сводится к окислению ацетил-КоА до СО2
и Н2О
в реакциях цикла трикарбоновых кислот
(цикла Кребса) – общий
путь катаболизма. Окислительные реакции
общего пути катаболизма сопряжены с
цепью тканевого дыхания. При этом энергия
(40-45%) запасается в виде АТФ (окислительное
фосфорилирование).
В результате
специфических и общих путей катаболизма
биополимеры (белки, углеводы, липиды)
распадаются до СО2, Н2О иNH3, которые являются
основными конечными продуктами
катаболизма.
Метаболиты в норме и при патологии
В живой клетке
ежесекундно образуются сотни метаболитов.
Однако их концентрации поддерживаются
на определенном уровне, который является
специфической биохимической константой
или референтной величиной. При болезнях
происходит изменение концентрации
метаболитов, что является основой
биохимической лабораторной диагностики.
К нормальным метаболитам относят
глюкозу, мочевину, холестерол, общий
белок сыворотки крови и ряд других.
Выход концентрации этих веществ за
пределы физиологических норм (повышение
либо снижение) говорит о нарушении их
обмена в организме. Более того, ряд
веществ в организме здорового человека
обнаруживается только в определенных
биологических жидкостях, что обуславливается
спецификой их метаболизма. Например,
белки сыворотки крови в норме не проходят
через почечный фильтр и, соответственно,
не обнаруживаются в моче. Но при воспалении
почек (гломерулонефрите) белки (в первую
очередь альбумины) проникают через
капсулу клубочка, появляются в моче –
протеинурия и трактуются как патологические
компоненты мочи.
Патологическими
метаболитами являются миеломные белки
(белки Бенс-Джонса), парапротеины при
макроглобулинемии Вальденштрема,
накопление аномального гликогена при
гликогенозах, разнообразных фракций
сложных липидов при сфинголипидозах и
т.д. Они обнаруживаются только при
болезнях и для здорового организма не
характерны.
Уровни изучения обмена веществ
Уровни изучения
обмена веществ:
-
Целый организм.
-
Изолированные органы
(перфузируемые). -
Срезы тканей.
-
Культуры клеток.
-
Гомогенаты тканей.
-
Изолированные клеточные
органеллы. -
Молекулярный уровень
(очищенные ферменты, рецепторы и т.д.).
Довольно часто
для изучения метаболизма используют
радиоактивные изотопы (3H,32P,14C,35S,18O),
которыми помечают вещества, вводимые
в организм. Затем можно проследить
клеточную локализацию этих веществ,
определить период полураспада и их
метаболические пути.
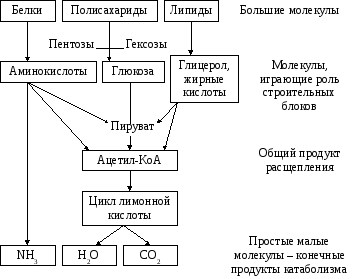
Рис. 8.1. Схема
специфических и общих путей катаболизма
studfile.net
Стадии катаболизма питательных веществ.
Опубликовано в Биохимические основы сбалансированного питания. Ответы.
Катаболизм – совокупность химических реакций превращения высокомолекулярных соединений в низкомолекулярные. Это сложный ферментативный процесс, в котором принято выделять три основные стадии (рисунок).
Рисунок. Три стадии катаболизма питательных веществ (обозначены римскими цифрами).

На первой стадии крупные биомолекулы расщепляются на составляющие их строительные блоки: полисахариды превращаются в пентозы и гексозы, жиры – в жирные кислоты, глицерол и другие компоненты, белки – в аминокислоты. Это происходит в желудочно-кишечном тракте, а также в лизосомах клетки. Реакции катализируют ферменты, относящиеся к классу гидролаз. Относительная энергоотдача составляет менее 1% всей высвобождаемой энергии.
На второй стадии строительные блоки превращаются в более простые молекулы. Моносахариды, глицерол и большинство аминокислот расщепляются до одного и того же трёхуглеродного метаболита – пирувата. Это происходит в цитоплазме клеток. В дальнейшем пируват, а также жирные кислоты и некоторые аминокислоты окисляются до ацетильного остатка, связанного с коэнзимом А (ацетил-КоА). Эти реакции протекают уже в митохондриях клетки. Пируват и ацетил-КоА, находящиеся на пересечении нескольких метаболических путей, можно отнести кключевым или узловым метаболитам. Относительная энергоотдача второй стадии катаболизма около 20%; выделяемая энергия может быть частично аккумулирована в виде АТФ.
На третьей стадии происходит окисление ацетильной группы в цикле трикарбоновых кислот Кребса до СО2 и восстановленных форм коферментов НАД и ФАД. Эти коферменты окисляются в дыхательной цепи до Н2О; выделяемая энергия аккумулируется в АТФ. Все эти реакции протекают в митохондриях. Относительная энергоотдача третьей стадии — около 80%.
Различают общий и специфические пути катаболизма. К специфическим путям катаболизма веществ того или иного класса относят главным образом реакции первой и второй стадии катаболизма, которые для каждого класса могут существенно различаться. Третья стадия, одинаковая для всех классов питательных веществ, называется общим путём катаболизма.
biohimist.ru
Катаболизм основных пищевых веществ, стадии. Понятие о специфических и общих путях катаболизма.
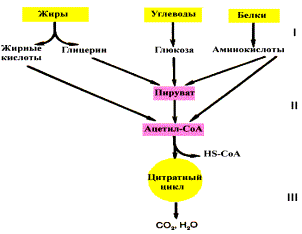
Если процесс катаболизма рассматривать с общей точки зрения, то можно выделить три основные его части:
Расщепление в пищеварительном тракте. Это гидролитические реакции, превращающие сложные пищевые вещества в относительно небольшое число простых метаболитов: глюкоза, аминокислоты, глицерин, жирные кислоты.
Специфические пути катаболизма. Простые метаболиты подвергаются специфическим реакциям расщепления, в результате которых образуется либо пировиноградная кислота, либо ацетил — КоА. Причем ацетил — КоА может образоваться из пирувата в результате окислительного декарбоксилирования. Могут также образоваться другие соединения, непосредственно включающиеся в цитратный цикл.
Цитратный цикл и дыхательная цепь завершают расщепление пищевых веществ до конечных продуктов — СО2 и Н2О.
Следовательно, начиная со стадии образования пирувата происходит унификация путей катаболизма. Из большого числа исходных соединений образуется всего два — пируват и ацетил — СоА. Процесс, начинающийся от пирувата, называется общим путем катаболизма и в свою очередь включает:
окислительное декарбоксилирование пирувата
цитратный цикл.
Именно в общем пути катаболизма образуется основная масса субстратов для реакций дегидрирования. Совместно с дыхательной цепью и окислительным фосфорилированием общий путь катаболизма является основным источником энергии в форме АТР.
51 Пировиноградная кислота, пути ее образования. Окислительное декарбоксилирование пировиноградной кислоты: последовательность реакций, строение пируватдегидрогеназного комплекса.
Пировиноградная кислота (формула С3Н4O3) — α-кетопропионовая кислота. Бесцветная жидкость с запахом уксусной кислоты; растворима в воде, спирте иэфире. Используется обычно в виде солей — пируватов. Пировиноградная кислота содержится во всех тканях и органах и, являясь связующим звеном обмена углеводов, жиров и белков, играет важную роль в обмене веществ. Концентрация пировиноградной кислоты в тканях изменяется при болезнях печени, некоторых формах нефрита, раке, авитаминозах, особенно при недостатке витамина В1. Нарушение обмена пировиноградной кислоты приводит к ацетонурии (см.).
См. также Окисление биологическое.
Пировиноградная кислота содержится во всех тканях и органах. В крови человека в норме находится 1 мг%, а в моче 2 мг%. П. к. играет важную роль в обмене веществ, являясь связующим звеном обмена углеводов, жиров и белков. В организме П. к. образуется в результате анаэробного распада углеводов (см. Гликолиз). В дальнейшем, под действием пируватдегидрогеназы П. к. превращается в ацетил-КоА, который используется при синтезе жирных кислот, ацетилхолина, а также может передать свой ацил на щавелевоуксусную кислоту для дальнейшего окисления до CO2 и H2O (см. Окисление биологическое). П. к. также участвует в реакциях переаминирования и гликогенолиза.
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+. Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением:
СН3-СО-СООН + NAD+ + HSKoA → Ch4-CO ∼SKoA + NADH + H+ + CO2
В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетил- КоА. Один атом водорода оказывается в составе NADH, а другой в виде Н+ поступает в среду. Реакция необратима, поскольку ΔG0′ = -33,5 кДж/моль.
Строение пируватдегидрогеназного комплексаПроцесс окислительного декарбоксилирования пирувата катализирует сложнооргани-зованный пируватдегидрогеназный комплекс. В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидролипоилдегидрогеназа (Е3), а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота,. FAD, NAD+ и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза. Все эти ферменты и коферменты объединены в мультиферментную систему, содержащую разные количества каждого из ферментов и имеющую молекулярную массу более 6×106. В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3). Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидроли-поилдегидрогеназа — FAD.Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные «кронштейны», переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой.
Окислительное декарбоксилирование пируватаПревращение пирувата в ацетил-КоА включает 5 стадий
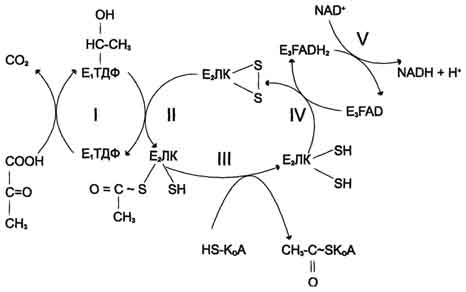
Стадия I.На этой стадии пируват соединяется с ТДФ в составе Е1 и подвергается декарбоксилированию.
Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2.
Стадия П.Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты.
Стадия III.На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2.
Стадия IV.На стадии IV дигидролипоилде-гидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD — простетическую группу фермента Е3.
Стадия V. На стадии V восстановленный FADH2 передаёт водород на NAD+ с образованием NADH.
Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH) образование высокоэнергетической тиоэфирной связи в ацетил-КоА
52 Ацетил-КоА, пути образования и превращения в организме. Значение этих процессов.
С пищей в организм поступают разнообразные жирные кислоты, в том числе и незаменимые. Значительная часть заменимых жирных кислот синтезируется в печени, в меньшей степени — в жировой ткани и лактирующей молочной железе. Источником углерода для синтеза жирных кислот служит ацетил-КоА, образующийся при распаде глюкозы в абсорбтивном периоде. Таким образом, избыток углеводов, поступающих в организм, трансформируется в жирные кислоты, а затем в жиры.
1. Синтез пальмитиновой кислоты
Образование ацетил-КоА и его транспорт в цитозоль
Синтез жирных кислот происходит в абсорбтивный период. Активный гликолиз и последующее окислительное декарбоксилирование пирувата способствуют увеличению концентрации ацетил-КоА в матриксе митохондрий. Так как синтез жирных кислот происходит в цитозоле клеток, то ацетил-КоА должен быть транспортирован через внутреннюю мембрану митохондрий в цитозоль. Однако внутренняя мембрана митохондрий непроницаема для ацетил-КоА, поэтому в матриксе митохондрий ацетил-КоА конденсируется с оксалоацетатом с образованием цитрата при участии цитратсинтазы:
Ацетил-КоА + Оксалоацетат -> Цитрат + HS-КоА.
Затем транслоказа переносит цитрат в цитоплазму (рис. 8-35).
Перенос цитрата в цитоплазму происходит только при увеличении количества цитрата в митохондриях, когда изоцитратдегидрогеназа и α-кетоглутаратдегидрогеназа ингибированы высокими концентрациями NADH и АТФ. Эта ситуация создаётся в абсорбтивном периоде, когда клетка печени получает достаточное количество источников энергии. В цитоплазме цитрат расщепляется под действием фермента цитратлиазы:
Цитрат + HSKoA + АТФ → Ацетил-КоА + АДФ + Pi + Оксалоацетат.
Ацетил-КоА в цитоплазме служит исходным субстратом для синтеза жирных кислот, а окса-лоацетат в цитозоле подвергается следующим превращениям (см. схему ниже).
Пируват транспортируется обратно в матрикс митохондрий. Восстановленный в результате действия малик-фермента NADPH используется как донор водорода для последующих реакций синтеза жирных кислот. Другой источник NADPH — окислительные стадии пентозофосфатного пути катаболизма глюкозы.
Образование малонил-КоАиз ацетил-КоА — регуляторная реакция в биосинтезе жирных кислот.
Первая реакция синтеза жирных кислот — превращение ацетил-КоА в малонил-КоА. Фермент, катализирующий эту реакцию (ацетил-КоА-карбоксилаза), относят к классу лигаз. Он содержит ковалентно связанный биотин (рис. 8-36). В первой стадии реакции СО2 ковалентно связывается с биотином за счёт энергии АТФ, во второй стадии СОО— переносится на ацетил-КоА с образованием малонил-КоА. Активность фермента ацетил-КоА-карбоксилазы определяет скорость всех последующих реакций синтеза жирных кислот.
53 Цикл трикарбоновых кислот: последовательность реакций, характеристика ферментов. Связь между общими путями катаболизма и цепью переноса электронов и протонов.
Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК) — заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил-КоА окисляется до 2 молекул СО2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ. Связь между атомами углерода в ацетил-КоА устойчива к окислению. В условиях организма окисление ацетильного остатка происходит в несколько этапов, образующих циклический процесс из 8 реакций:

Последовательность реакций цитратногоцикла
Образование цитрата

В реакции образования цитрата углеродный атом метильной труппы ацетил-КоА связывается с карбонильной группой оксалоацетата; одновременно расщепляется тиоэфирная связь и освобождается коэнзим A (ΔG0′ = -37,6 кДж/моль). Равновесие реакции в клетке сильно сдвинуто вправо, о чём свидетельствует отрицательная величина стандартной свободной энергии. Реакция сопровождается потерей большого количества энергии в виде теплоты. Катализирует реакцию цитрат синтаза, фермент, локализованный в матриксе митохондрий.
infopedia.su
Вопрос 45.Катаболизм жк и его этапы.
β-Окисление
— специфический путь катаболизма жирных
кислот, при котором от карбоксильного
конца жирной кислоты последовательно
отделяется по 2 атома углерода в виде
ацетил-КоА. Метаболический путь —
β-окисление — назван так потому, что
реакции окисления жирной кислоты
происходят у β-углеродного атома. Реакции
β-окисления и последующего окисления
ацетил-КоА в ЦТК служат одним из основных
источников энергии для синтеза АТФ по
механизму окислительного фосфорилирования.
β-Окисление жирных кислот происходит
только в аэробных условиях.
Активация
жирных кислот
Перед тем,
как вступить в различные реакции, жирные
кислоты должны быть активированы, т.е.
связаны макроэргической связью с
коферментом А:
RCOOH + HSKoA + АТФ
→ RCO ~ КоА + АМФ + PPi.
Реакцию
катализирует фермент ацил-КоАсин-тетаза.
Выделившийся в ходе реакции
пирофосфатгидролизуется ферментом
пирофосфатазой: Н4Р2О7 + Н2О → 2 Н3РО4.
Выделение
энергии при гидролизе макроэргической
связи пирофосфата смещает равновесие
реакции вправо и обеспечивает полноту
протекания реакции активации.
Ацил-КоАсинтетазы находятся как в
цитозоле, так и в матриксе митохондрий.
Эти ферменты отличаются по специфичности
к жирным кислотам с различной длиной
углеводородной цепи. Жирные кислоты с
короткой и средней длиной цепи (от 4 до
12 атомов углерода) могут проникать
вматрикс митохондрий путём диффузии.
Активация этих жирных кислот происходит
в матриксе митохондрий. Жирные кислоты
с длинной цепью, которые преобладают в
организме человека (от 12 до 20 атомов
углерода), активируются ацил-КоАсинтетазами,
расположенными на внешней мембране
митохондрий.
Транспорт
жирных кислот с длинной углеводородной
цепью вмитохондриях
β-Окисление
жирных кислот, происходит в матриксе
митохондрий, поэтому после активации
жирные кислоты должны транспортироваться
внутрь митохондрий. Жирные кислоты с
длинной углеводородной цепью переносятся
через плотную внутреннюю мембрану
митохондрий с помощью карнитина. Карнитин
поступает с пищей или синтезируется из
незаменимых аминокислот лизина и
метионина. В реакциях синтеза карнитина
участвует витамин С (аскорбиновая
кислота). В наружной мембране митохондрий
находится фермент карнитинацилтрансфераза
I (карнитин-пальмитоилтрансфераза I),
катализирующий реакцию с образованием
ацилкарнитина. Образовавшийся ацилкарнитин
проходит через межмембранное пространство
к наружной стороне внутренней мембраны
и транспортируется с помощью
карнитинацилкарнитинтранс-локазы на
внутреннюю поверхность внутренней
мембраны митохондрий, где фермент
карнитинацилтрансфераза II катализирует
перенос ацила на внутримитохондриальныйКоА
(рис. 8-26). Таким образом, ацил-КоА становится
доступным для ферментов β-окисления.
Свободный карнитин возвращается на
цитозольную сторону внутреннеймембраны
митохондрий той же транслоказой. На
внутренней поверхности внутренней
мембраны находится фермент
карнитинацилтрансфераза II, катализирующий
обратный перенос ацила с карнитина на
внутримитохондриальныйКоА. После этого
ацил-КоА включается в реакции β-окисления.
β-Окисление жирных кислот — специфический
путь катаболизма жирных кислот,
протекающий в матриксе митохондрий
только в аэробных условиях и заканчивающийся
образованием ацетил-КоА. Водород из
реакций β-окисления поступает в ЦПЭ, а
ацетил-КоА окисляется в цитратном цикле,
также поставляющем водород для ЦПЭ.
Поэтому β-окисление жирных кислот —
важнейший метаболический путь,
обеспечивающий синтез АТФ в дыхательной
цепи. β-Окисление начинается с
дегидрирования ацил-КоА FAD-зависимой
ацил-КоАдегидрогеназой с образованием
двойной связи между α- и β-атомами
углерода в продукте реакции — еноил-КоА.
Восстановленный в этой реакции кофермент
FADh3 передаёт атомы водорода в ЦПЭ на
кофермент Q. В результате синтезируются
2 молекулы АТФ (рис. 8-27). В следующей
реакции р-окисления по месту двойной
связи присоединяется молекула воды
таким образом, что ОН-группа находится
у β-углеродного атома ацила, образуя
β-гидроксиацил-КоА. Затем β-гидроксиацил-КоА
окисляется NАD+-зависимой дегидрогеназой.
Восстановленный NADH, окисляясь в ЦПЭ,
обеспечивает энергией синтез 3 молекул
АТФ. Образовавшийся β-кетоацил-КоА
подвергается тиолитическому расщеплению
ферментом тиолазой, так как по месту
разрыва связи С-С через атом серы
присоединяется молекула кофермента А.
В результате этой последовательности
из 4 реакций от ацил-КоА отделяется
двухуглеродный остаток — ацетил-КоА.
Жирная кислота, укороченная на 2 атома
углерода, опять проходит реакции
дегидрирования, гидратации, дегидрирования,
отщепления ацетил-КоА. Эту последовательность
реакций обычно называют «циклом
β-окисления», имея в виду, что одни и
те же реакции повторяются с радикалом
жирной кислоты до тех пор, пока вся
кислота не превратится в ацетильные
остатки.
Регуляция
скорости β-окисления
β-Окисление
— метаболический путь, прочно связанный
с работой ЦПЭ и общего пути катаболизма.
Поэтому его скорость регулируется
потребностью клетки в энергии, т.е.
соотношениями АТФ/АДФ и NADH/NAD+, так же,
как и скорость реакций ЦПЭ и общего пути
катаболизма (см. раздел 6). Скорость
β-окисления в тканях зависит от доступности
субстрата, т.е. от количества жирных
кислот, поступающих в митохондрии.
Концентрация свободных жирных кислот
в крови повышается при активации
ли-полиза в жировой ткани при голодании
под действием глюкагона и при физической
работе под действием адреналина. В этих
условиях жирные кислоты становятся
преимущественным источником энергии
для мышц и печени, так как в результате
β-окисления образуются NADH и ацетил-КоА,
ингибирующие пируватдегидрогеназный
комплекс. Превращение пирувата,
образующегося из глюкозы, в ацетил-КоА
замедляется. Накапливаются промежуточные
метаболиты гликолиза и, в частности,
глюкозо-6-фосфат. Глюкозо-6-фосфат
ингибирует гексокиназу и, следовательно,
препятствует использованию глюкозы в
процессе гликолиза. Таким образом,
преимущественное использование жирных
кислот как основного источника энергии
в мышечной ткани и печени сберегает
глюкозу для нервной ткани и эритроцитов.
Скорость β-окисления зависит также от
активности фермента карнитинацилтрансферазы
I. В печени этот фермент ингибируется
малонил-КоА, веществом, образующимся
при биосинтезе жирных кислот. В
абсорбтивный период в печени активируется
гликолиз и увеличивается образование
ацетил-КоА из пирувата. Первая реакция
синтеза жирных кислот — превращение
ацетил-КоА в малонил-КоА. Малонил-КоА
ингибирует β-окисление жирных кислот,
которые могут использоваться для синтеза
жира.
studfile.net