Какова функция белков в клетке?
Белки играют исключительно большую роль в процессах жизнедеятельности клетки и организма, им свойственны следующие функции.
Структурная. Входят в состав внутриклеточных структур‚ тканей и органов. Например, коллаген и эластин служат компонентами соединительной ткани: костей‚ сухожилий‚ хрящей; фиброин входит в состав шелка‚ паутины; кератин входит в состав эпидермиса и его производных (волосы‚ рога‚ перья) . Образуют оболочки (капсиды) вирусов.
Ферментативная. Все химические реакции в клетке протекают при участии биологических катализаторов — ферментов (оксидоредуктазы, гидролазы, лигазы, трансферазы, изомеразы, и лиазы) .
Регуляторная. Например, гормоны инсулин и глюкагон регулируют обмен глюкозы. Белки–гистоны участвуют в пространственной организации хроматина, и тем самым влияют на экспрессию генов.
Транспортная. Гемоглобин переносит кислород в крови позвоночных, гемоцианин в гемолимфе некоторых беспозвоночных, миоглобин — в мышцах.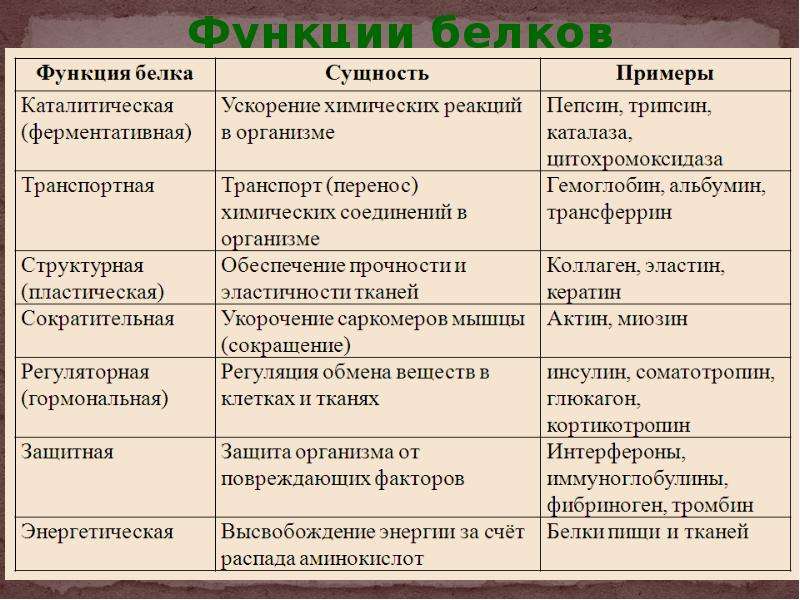 Сывороточный альбумин служит для транспорта жирных кислот‚ липидов и т. п. Мембранные транспортные белки обеспечивают активный транспорт веществ через клеточные мембраны (Na+, К+-АТФаза) . Цитохромы осуществляют перенос электронов по электронтранспортным цепям митохондрий и хлоропластов.
Сывороточный альбумин служит для транспорта жирных кислот‚ липидов и т. п. Мембранные транспортные белки обеспечивают активный транспорт веществ через клеточные мембраны (Na+, К+-АТФаза) . Цитохромы осуществляют перенос электронов по электронтранспортным цепям митохондрий и хлоропластов.
Защитная. Например, антитела (иммуноглобулины) образуют комплексы с антигенами бактерий и с инородными белками. Интерфероны блокируют синтез вирусного белка в инфицированной клетке. Фибриноген и тромбин участвуют в процессах свертывания крови.
Сократительная (двигательная) . Белки актин и миозин обеспечивают процессы мышечного сокращения и сокращения элементов цитоскелета.
Сигнальная (рецепторная) . Белки клеточных мембран входят в состав рецепторов и поверхностных антигенов.
Запасающие белки. Казеин молока, альбумин куриного яйца, ферритин (запасает железо в селезенке) .
Белки-токсины. Дифтерийный токсин
Энергетическая функция. При распаде 1 г белка до конечных продуктов обмена (СО2, Н2О, Nh4, Н2S, SО2) выделяется 17‚6 кДж или 4‚2 ккал энергии
Сигнальная функция белка — это.
 .. Что такое Сигнальная функция белка?
.. Что такое Сигнальная функция белка?
Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между тканями, клетками или организмами.
Сигнальную функцию выполняют белки-гормоны. Связывание гормона с рецептором является сигналом, запускающим в клетке физиологические процессы. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Например, инсулин снижает содержание сахара в крови, гормон роста регулирует рост скелета, лептин регулирует аппетит.
Клетки могут взаимодействуют друг с другом на расстоянии с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся цитокины, факторы роста и др.
Цитокины — небольшие пептидные информационные молекулы. Они регулируют взаимодействия между клетками, определяют жизнедеятельность клеток, их выживаемость, стимулируют или подавляют рост, дифференциацию, функциональную активность и апоптоз (явление программируемой клеточной смерти), обеспечивают согласованность и упорядоченность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить фактор некроза опухолей, который передаёт сигналы воспаления между клетками организма[1].
Примером цитокинов может служить фактор некроза опухолей, который передаёт сигналы воспаления между клетками организма[1].
Белковую природу имеют также некоторые феромоны. Так, половой феромон (sex-inducing pheromone) вольвокса — гликопротеид[2]. Пептидные феромоны встречаются у самых разных организмов — от бактерий [1] до млекопитающих[3]
Ссылки
- ↑ Повещенко АФ., Абрамов ВВ., Козлов ВВ. Цитокины — факторы нейроэндокринной регуляции. Успехи Физиологических Наук. 2007 — 38(3):40-6
- ↑ Armin Hallmann, Klaus Godl, Stephan Wenzl and Manfred Sumper. The highly efficient sex-inducing pheromone system of Volvox. Trends in Microbiology Volume 6, Issue 5, 1 May 1998, Pages 185—189
- ↑ Touhara K. Molecular biology of peptide pheromone production and reception in mice. Adv Genet. 2007;59:147-71.
Свойства функции белков
При изучении темы поставлены задачи о
формировании знаний о важнейших свойствах и
функциях белков. Проводится практическая работа
Проводится практическая работа
по наблюдению расщепления пероксида водорода
ферментом каталазой. Повторяется материал, и
контролируются знания учащихся.
Урок проводится в два этапа. На первом
этапе в ходе беседы и рассказа учитель объясняет
функции белков, демонстрируя таблицы по общей
биологии. Объясняется значение каталазы в
растительной и животной клетке, ее функции –
расщепление опасно для клетки Н2О2 до
кислорода и воды.
Перечисляются функции –
каталитическая, энергетическая, транспортная,
строительно-регуляторная, двигательная,
защитная, запасающая, приводятся примеры.
На втором этапе проводится
практическая работа по обнаружению
каталитической функции каталазы и явления
денатурации. Учащимися делается общий вывод
после окончания работы.
В конце урока подводятся итоги,
выставляются отметки, закрепляется новая тема,
выясняются трудные вопросы и задается домашнее
задание.
Тема: Свойства и функции белков.
Задачи:
- Сформулировать знания о важнейших свойствах и
функциях белков. - Провести практическую работу по наблюдению
расщепления пероксида водорода ферментом
каталазой. - Повторить материал и проконтролировать знания
учащихся по теме “Строение белков”.
Оборудование:
1. Раздаточный материал:
1) Штатив с тремя пробирками. В первой
пробирке кусочек сырого мяса, во второй пробирке
кусочек сырого картофеля, в третьей пробирке
кусочек вареного картофеля.
2) Склянка с 3% раствором Н2О2.
3) Баночки с элодеей.
4) Микроскопы и покровные стекла.
2. Демонстрационный материал:
1) Таблицы по общей биологии.
2) Кодограмма.
3) Тесты.
Ход урока
I.
 Повторение и опрос домашнего задания
Повторение и опрос домашнего задания
проводятся несколькими методами:
1) Работа у доски (Приложение №2).
2) Компьютерное тестирование (Приложение №3).
3) Устное повторение по вопросам:
– Что такое белок?
– Что такое липиды?
– Какие вещества образуют основу клеточной
мембраны?
– Какую функцию выполняют углеводы?
– Из чего состоят белки?
II. Изучение нового материала.
Учитель использует таблицы по общей биологии.
На первом этапе в ходе беседы учитель объясняет
все функции белков. Объясняется значение
каталазы в растительной и животной клетке: ее
присутствие во всех клетках растений и животных,
ее функции – расщепление опасного для клетки
пероксида водорода до кислорода и воды.
Рассказ учителя:
Аминокислотный состав, структура белковой
молекулы определяют его свойства. Белки являются
амфотерными соединениями, сочетают в себе
основные и кислотные свойства. Чем больше
Чем больше
кислотных аминокислот в белке, тем ярче выражены
его кислотные свойства.
Есть белки растворимые, есть нерастворимые,
выполняющие механические функции (фиброин,
кератин, коллаген). Есть белки необычайно
активные (ферменты), есть химически неактивные,
устойчивые к воздействию различных условий
среды и крайне неустойчивые.
Внешние факторы могут вызывать структурные
организующие молекул белки. Процесс утраты
трехмерной конформации, присущей данной
молекуле белка, называют денатурацией.
Учитель демонстрирует таблицы, где показаны
структуры белка.
Денатурация может быть: обратимой и
необратимой, называются причины.
Благодаря сложности разнообразию форм и
состава белки играют важную роль в
жизнедеятельности клетки и организма в целом,
функции их разнообразны:
- Строительная.
- Транспортная.
- Регуляторная.
- Защитная.
- Двигательная.
- Запасающая.
- Энергетическая.
- Каталитическая.
Белки участвуют в образовании
клеточных и внеклеточных структур, входят в
состав клеточных мембран шерсти, волос,
сухожилий, стенок сосудов и т. д.
д.
Некоторые белки способны
присоединять различные вещества и переносить их
к различным тканям и органам тела(гемоглобин).
Большая группа белков
организма принимает участие в регуляции
процессов обмена веществ. Такими белками
являются гормоны – биологически активные
вещества. Гормон инсулин регулирует уровень
сахара в крови путем повышения проницаемости
клеточных мембран для глюкозы, способствует
синтезу гликогена, увеличивает образование
жиров из углеводов.
В ответ на проникновение в организм
чужеродных белков или микроорганизмов
образуются особые белки – антитела, способные
связывать и обезвреживать их. Фибрин,
образующийся из фибриногена, способствует
остановке кровотечений.
Особые сократительные белки
участвуют во всех видах движений клетки и
организма.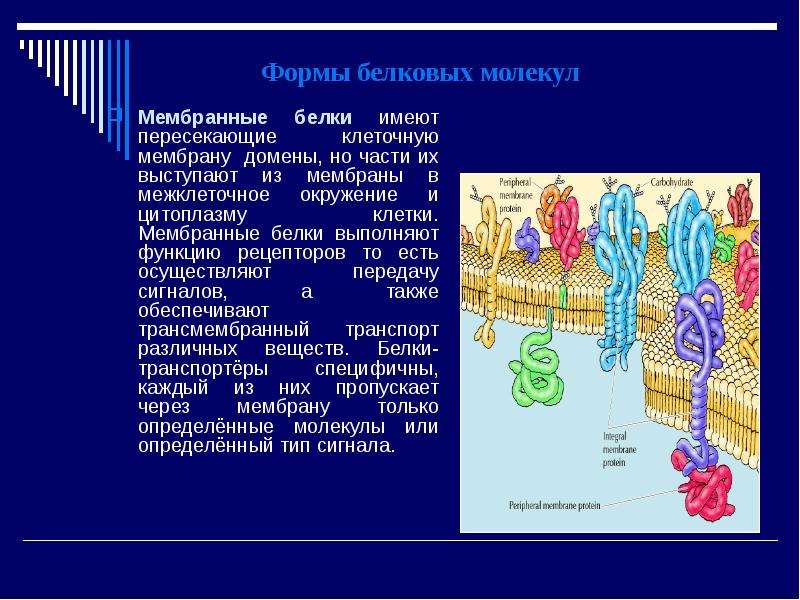
Благодаря белкам, в организме
могут откладываться про запас некоторые
вещества. К запасным белкам относятся белки яйца,
белки мозга, белки сои.
Белки являются одним из
источников энергии в клетке, они используются
тогда, когда другие источники израсходованы.
Одна из важнейших функций
белков. В состав клеток входит большое
количество веществ химически мало активных. Тем
не менее, все биохимические реакции протекают с
огромной скоростью, благодаря участию в них
биокатализаторов – ферментов, веществ белковой
природы. На скорость реакции влияет также
концентрация субстрата и концентрация фермента.
III. Практическая работа по обнаружению
каталитической функции каталазы и явления
денатурации.
Задания к практической работе:
- Прилейте по 2 мл пероксида водорода в пробирки с
кусочком сырого мяса, с сырым картофелем, вареным
картофелем. Объясните наблюдаемые вами явления
Объясните наблюдаемые вами явления
при действии Н2О2 на живые и мертвые
клетки (вареный картофель). - На предметное стекло в каплю воды положите лист
элодеи и рассмотрите под микроскопом на малом
увеличении место отрыва листа от стебля. - Нанесите на лист элодеи две капли пероксида
водорода, накройте покрывным стеклом и под
микроскопом рассмотрите место отрыва листа от
стебля. Объясните бурное выделение пузырьков О2
из поврежденных клеток элодеи. - Сделать общий вывод из проделанной
практической работы и записать в тетрадь.
Итоги урока: Учитель подводит итоги урока,
выставляет отметки учащимся, выясняет, что
узнали нового, что было трудно в новой теме, как
найти ответы на вопросы – параграф 27.
Домашнее задание: – параграф 27,
– закончить вывод по практической работе.
Приложение
Функции белков | Параграф 1.5.
«Введение в общую биологию и экологию. 9 класс». А.А. Каменский (гдз)
Вопрос 1. Чем объясняется многообразие функций белков?
Уникальные свойства белков заложены в колоссальном разнообразии пространственного строения их молекул. Это разнообразие белков определяется огромным числом возможных сочетаний аминокислотных остатков в длинных, состоящих, как правило, из нескольких сотен остатков, полипептидных цепях белков. Как известно, в состав белков может входить 20 видов аминокислот. Белки образуют различные соединения с различными веществами. Кроме того, белки могут иметь пространственную структуру молекулы. Установлено, что белки могут иметь различные размеры и форму. Многие белки содержат в своём составе такие металлы, как железо, цинк, медь и др. Все это способствует тому, что белки выполняют множество функций.
Вопрос 2. Какие функции белков вам известны?
1. Строительная (пластическая) функция. Белки являются непременным компонентом всех биологических мембран, составляют основу цитоскелета, входят в состав соединительных тканей, волосяного покрова, т.е. обеспечивают «строительную» функцию.
2. Ферментативная функция. Обладая, прежде всего, ярко выраженной каталитической способностью, они в качестве ферментов детерминируют интенсивность всех метаболических процессов в клетке и организме в целом. Белки служат ферментами, т. е. биологическими катализаторами. Примером может служить амилаза, расщепляющая крахмал до моносахаридов; пепсин, расщепляющий белки на пептиды.
3. Сократительная (двигательная) функция. Все виды движения, начиная с движений жгутиков бактерий и кончая движениями пальцев пианиста, обеспечиваются работой «белковых моторов» (сократительные белки). Сократительные свойства белков актина и миозина лежат в основе работы мышц.
4. Транспортная функция. Белки участвуют в транспорте молекул и ионов в пределах организма (гемоглобин переносит кислород из легких к органам и тканям, альбумин сыворотки крови участвует в транспорте жирных кислот).
5. Защитная функция. Она заключается в предохранении организма от повреждений и вторжения чужеродных белков и бактерий. Белки-антитела, вырабатываемые лимфоцитами, создают защиту организма от чужеродной инфекции, тромбин и фибрин участвуют в образовании тромба, тем самым, помогая организму избежать больших потерь крови.
6. Регуляторная функция. Белки-гормоны участвуют в регуляции активности клетки и всех жизненных процессов организма. Так, инсулин регулирует уровень сахара в крови и поддерживает его на определенном уровне.
7. Сигнальная функция. Белки формируют ионные каналы и осуществляют восприятие, трансформацию и передачу разнообразных внешних сигналов (белки-рецепторы).
8. Энергетическая функция. Она реализуется белками крайне редко. При полном расщеплении 1г белка способно выделиться 17,6кДж энергии. Однако белки для организма — очень ценное соединение. Поэтому расщепление белка происходит обычно до аминокислот, из которых строятся новые полипептидные цепочки. Они же осуществляют иммунологическую защиту от чужеродных соединений и патогенных микроорганизмов (защитные белки-иммуноглобулины).
Она реализуется белками крайне редко. При полном расщеплении 1г белка способно выделиться 17,6кДж энергии. Однако белки для организма — очень ценное соединение. Поэтому расщепление белка происходит обычно до аминокислот, из которых строятся новые полипептидные цепочки. Они же осуществляют иммунологическую защиту от чужеродных соединений и патогенных микроорганизмов (защитные белки-иммуноглобулины).
Вопрос 3. Какую роль играют белки-гормоны?
Белки-гормоны контролирует физиологическую активность тканей и органов и всех жизненных процессов всего организма. Так, в организме человека соматотропин участвует в регуляции роста тела, инсулин поддерживает на постоянном уровне содержание глюкозы в крови.
Вопрос 4. Какую функцию выполняют белки-ферменты?
Белки-ферменты играют роль катализаторов, т. е. ускоряют химические реакции в сотни миллионов раз. Ферменты обладают строгой специфичностью по отношению к веществу, вступающему в реакцию. Каждая реакция катализируется своим ферментом.
Каждая реакция катализируется своим ферментом.
Вопрос 5. Почему белки редко используются в качестве источника энергии?
Мономеры белков — аминокислоты — ценное сырье для построения новых белковых молекул. Поэтому полное расщепление полипептидов до неорганических веществ происходит редко. Следовательно, энергетическая функция, заключающаяся в выделении энергии при полном расщеплении, выполняется белками только в исключительных случаях, когда организм испытывает недостаток жиров или углеводов.
Краткий словарь генетических терминов
Краткий словарь основных понятий и терминов, использующихся в генетике
Для понимания того, с чем работает наша компания и зачем эта работа нужна, какие результаты мы получаем и что они вам расскажут, можно прийти на консультацию к специалистам ЦГРМ «ГЕНЕТИКО». А для того, чтобы Вы не забыли, о чем был разговор, и не утонули в море новой информации, мы составили для Вас небольшой словарик основных понятий и терминов, использующихся в генетике.
Основным положением биологической науки является то, что клетка – это самое маленькое из возможных проявление жизни и что новая клетка может появиться только от уже существующей и никак не может возникнуть сама по себе. Конечно, это приводит к большому количеству вопросов о том, как зародилась жизнь и каким образом могла сформироваться самая первая клетка. Но для удобства будем считать обозначенные положения верными в современной реальности планеты Земля, где мы живем. Несмотря на невообразимо огромное разнообразие живых существ, все они состоят из клеток. И у всех клеток есть схожие черты, которые обусловлены самыми простыми жизненными необходимостями. Во-первых, клетка должна как-то отделяться от внешнего пространства – для этого есть специальная оболочка.
Во-вторых, клетка должна питаться – для этого есть разные системы, способные преобразовать энергию света или химических связей в необходимые для жизни вещества и удобную для использования энергию. И еще клетка умеет размножаться. Для выполнения всех этих функций необходимы механизмы, основу которых составляют белки и РНК. А вот инструкция, как эти молекулы должны выглядеть и работать, хранится в специальном отсеке клетки – ядре – в виде ДНК. Ошибки в этой инструкции, которая разрабатывалась миллионы лет, приводят к смерти клетки. А в многоклеточном организме, таком, как у человека, например, клетки взаимодействуют друг с другом, поэтому нарушение в работе одной или нескольких клеток может привести не к смерти всего организма, а к нарушениям его работы – заболеваниям. Также необходимо помнить, что человеческий организм огромная система, ансамбль миллионов разнообразных маленьких организмов, которые выросли из одной единственной клетки – зиготы – результата слияния яйцеклетки и сперматозоида.
Для выполнения всех этих функций необходимы механизмы, основу которых составляют белки и РНК. А вот инструкция, как эти молекулы должны выглядеть и работать, хранится в специальном отсеке клетки – ядре – в виде ДНК. Ошибки в этой инструкции, которая разрабатывалась миллионы лет, приводят к смерти клетки. А в многоклеточном организме, таком, как у человека, например, клетки взаимодействуют друг с другом, поэтому нарушение в работе одной или нескольких клеток может привести не к смерти всего организма, а к нарушениям его работы – заболеваниям. Также необходимо помнить, что человеческий организм огромная система, ансамбль миллионов разнообразных маленьких организмов, которые выросли из одной единственной клетки – зиготы – результата слияния яйцеклетки и сперматозоида.
ДНК – ДезоксиРибонуклиновая Кислота – полимер, то есть молекула с большим количеством последовательно повторяющихся структурных элементов, который несет всю информацию о генах и белках, необходимых для жизни всего организма. ДНК является картотекой, библиотекой и матрицей, с которой считывается информация в определенной последовательности и определенных условиях, разъяснения о которых записаны как в самой ДНК, так и с помощью различных дополнительных модификаций этой молекулы. Каждой хромосоме соответствует 1 молекула ДНК. Структурными блоками этого полимера являются дезоксирибонуклеотиды (=нуклеотиды), которые бывают 4х видов (А, Т, Г, Ц).
ДНК является картотекой, библиотекой и матрицей, с которой считывается информация в определенной последовательности и определенных условиях, разъяснения о которых записаны как в самой ДНК, так и с помощью различных дополнительных модификаций этой молекулы. Каждой хромосоме соответствует 1 молекула ДНК. Структурными блоками этого полимера являются дезоксирибонуклеотиды (=нуклеотиды), которые бывают 4х видов (А, Т, Г, Ц).
Последовательность ДНК – это то, в каком порядке в молекуле ДНК идут ее структурные элементы – нуклеотиды. Таким образом, генетической информацией является именно последовательность ДНК, а молекула ДНК является ее физическим носителем.
Хромосома – это молекула ДНК, специальным образом обернутая различными белками, которые помогают управляться с такой длинной молекулой, чтобы она не порвалась, не перепуталась с другими ДНК-молекулами и была физически доступна для белков, осуществляющих работу всего генетического аппарата.
РНК –РибоНуклиновая Кислота – полимер, который выполняет функциональную роль переносчика информации, то есть копии, которая делается с ДНК и используется для создания функциональных молекул: специальных РНК или белков. Специальные молекулы РНК могут не являться матрицами, на базе которых синтезируется белок, а сами выполняют структурные, ферментативные или транспортные функции. Главное, что последовательность структурных блоков в молекуле РНК всегда определена последовательностью ДНК соответствующего участка.
Специальные молекулы РНК могут не являться матрицами, на базе которых синтезируется белок, а сами выполняют структурные, ферментативные или транспортные функции. Главное, что последовательность структурных блоков в молекуле РНК всегда определена последовательностью ДНК соответствующего участка.
Белок – основная функциональная единица живой клетки с самым широчайшим спектром функций и возможностей. Как ДНК и РНК, является полимером, однако имеет химически иные структурные блоки – аминокислоты. Их последовательность, с одной стороны, напрямую зависит от соответствующей последовательности ДНК и может изменяться только в ограниченных и предусмотренных в ДНК инструкций, с другой стороны является основой структуры, в том числе пространственной, возможностей и функции белков разных типов.
Ген – определение гена включает два аспекта: теоретический и физический. Теоретически, то есть умозрительно, геном называют последовательность ДНК (слово, записанное на языке генетики), обладающее определенными свойствами. Как и слово в языке, ген является основой наследственной информации, в то время как различные другие структуры можно отнести к знакам препинания или вспомогательным элементам. Ген является подробной инструкцией для синтеза белка или специфической РНК, которую он кодирует. Причем эта инструкция описывает не только последовательность молекул, но и то в каких условиях и как они должны работать и выполнять свои функции. С физической, то есть материальной, точки зрения, ген – это часть молекулы ДНК с определенными структурными элементами. Как внутри слова есть приставка, корень, суффикс и окончание, позволяющие слову адаптироваться для каждой конкретной фразы, так и у гена есть промотор, экзоны и интроны. Первый обозначает начало гена, экзоны – это ключевая информация о последовательности РНК или белка, а интроны необходимы для регуляции и тонкой настройки работы гена в условиях разных тканей, органов и изменяющейся окружающей среды.
Как и слово в языке, ген является основой наследственной информации, в то время как различные другие структуры можно отнести к знакам препинания или вспомогательным элементам. Ген является подробной инструкцией для синтеза белка или специфической РНК, которую он кодирует. Причем эта инструкция описывает не только последовательность молекул, но и то в каких условиях и как они должны работать и выполнять свои функции. С физической, то есть материальной, точки зрения, ген – это часть молекулы ДНК с определенными структурными элементами. Как внутри слова есть приставка, корень, суффикс и окончание, позволяющие слову адаптироваться для каждой конкретной фразы, так и у гена есть промотор, экзоны и интроны. Первый обозначает начало гена, экзоны – это ключевая информация о последовательности РНК или белка, а интроны необходимы для регуляции и тонкой настройки работы гена в условиях разных тканей, органов и изменяющейся окружающей среды.
Экспрессия гена – это эффективность работы гена, так как для его функционирования недостаточно его наличия в геноме – с него должна считываться информация. Именно то, как часто и в каком объеме считывается информация с гена, выражают термином экспрессия.
Именно то, как часто и в каком объеме считывается информация с гена, выражают термином экспрессия.
Локус – участок молекулы ДНК, содержащий различный структурные элементы, в том числе один или несколько генов.
Геном– это последовательность всех молекул ДНК организма. Важно помнить, что в каждой клетке одного организма в норме содержатся одинаковые по количеству и последовательностям молекулы ДНК, а различается экспрессия конкретных генов.
Экзом – это последовательности ДНК экзомных участков генов, то есть так называемая основная кодирующая составляющая. Это то, с чем работает организм, в то время как остальная часть генома объясняет, как работать и в каких условиях как применять и настраивать кодирующую часть генома.
Мутация – изменение последовательности ДНК по сравнению другими клетками организма или другими представителями вида. Мутации могут возникать как из-за воздействия внешних неблагоприятных условий, так и из-за того, что наши ферменты работают пусть с редкими, но ошибками.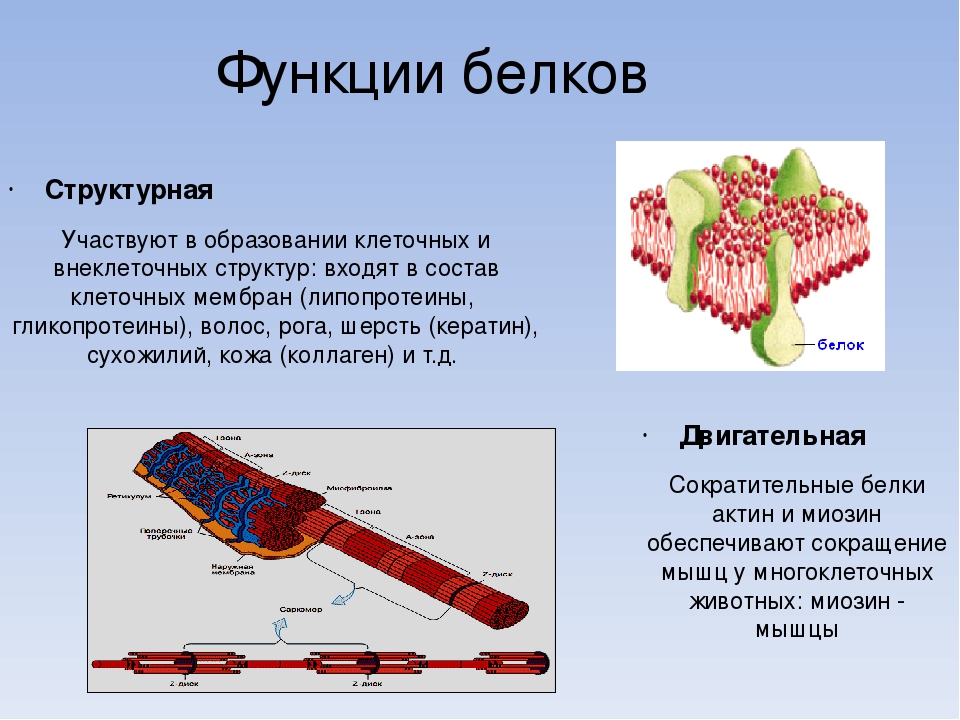 Так как происходит физическое изменение в носителе информации – ДНК, такое изменение может передаваться из поколения в поколение.
Так как происходит физическое изменение в носителе информации – ДНК, такое изменение может передаваться из поколения в поколение.
Частота мутаций — относительное значение, показывающее у какой доли людей в геноме есть конкретная мутация. Частоту мутации можно рассчитать, как среднюю для всех людей, так и отдельно по расовым или национальным, или любы другим группам. В медицинской генетике под мутацией подразумевают изменение ДНК, которое может быть связано с каким-то заболеванием, и противопоставляют ее полиморфизму. Хотя по общей логике полиморфизм – это частный случай мутации.
Полиморфизм – нейтральная, а точнее безвредная, мутация, которая сравнительно часто встречается у какой-то группы организмов одного вида. Некоторые мутации встречаются часто у всех людей, некоторые – только среди представителей определенных рас или народностей.
Аллель – вариант последовательности гена в разном виде: от различия в одной букве последовательности до отсутствия целого куска последовательности или вставке лишнего. Эти различия возникают из-за мутации, которая могла произойти у далекого предка и передаться потомству через поколения. Таким образом, каждый ген у отдельного человека может быть представлен конкретным вариантом – аллелем. Для понимания аллелизма необходимо объяснить, что, например, различия в цвете глаз, волос, росте, чувствительности к алкоголю объясняются именно разными аллельными состояниями соответствующих генов.
Эти различия возникают из-за мутации, которая могла произойти у далекого предка и передаться потомству через поколения. Таким образом, каждый ген у отдельного человека может быть представлен конкретным вариантом – аллелем. Для понимания аллелизма необходимо объяснить, что, например, различия в цвете глаз, волос, росте, чувствительности к алкоголю объясняются именно разными аллельными состояниями соответствующих генов.
Генотип – это все гены конкретной особи с указанием аллельного состояния каждого гена и наличия/отсутствия мутаций в межгенных участках ДНК.
Доминантный аллель. В геноме человека содержится по 2 копии каждой хромосомы. Это означает, что в каждом геноме есть две очень похожие по длине и последовательности генов молекулы ДНК, которые отличаются аллельными состояниями генов и мутациями/полиморфизмами в межгенных участках этих молекул ДНК. Из этого следует, что и каждый ген представлен в геноме 2 копиями, каждая из которых может быть определенным вариантом (аллелем) этого гена. Доминантным аллелем называется тот, одной копии которого достаточно для проявления его особенностей. То есть если хотя бы на одной из хромосом ген находится в состоянии доминантного аллеля, то ген будет работать по тому варианту, который описывается именно этим аллелем. Важно, что так как у одного гена может быть более двух вариантов (аллелей), то и доминантность аллеля определяется по отношению к каждому из вариантов, хотя есть и те, которые доминантны по сравнению со всеми другими. Встречаются варианты с одинаковой предпочтительностью для работы, тогда проявляется совместное влияние этих вариантов.
Доминантным аллелем называется тот, одной копии которого достаточно для проявления его особенностей. То есть если хотя бы на одной из хромосом ген находится в состоянии доминантного аллеля, то ген будет работать по тому варианту, который описывается именно этим аллелем. Важно, что так как у одного гена может быть более двух вариантов (аллелей), то и доминантность аллеля определяется по отношению к каждому из вариантов, хотя есть и те, которые доминантны по сравнению со всеми другими. Встречаются варианты с одинаковой предпочтительностью для работы, тогда проявляется совместное влияние этих вариантов.
Рецессивный аллель – по аналогии с доминантным аллелем, это такое состояние гена, которое наименее предпочтительно для проявления. Поэтому если в геноме есть другая копия гена, доминантная, то задавать темп работы гена будет именно она, но если и вторая копия гена представлена рецессивным аллелем, то будет работать этот, хотя менее предпочтительный, но в такой ситуации единственно имеющийся вариант.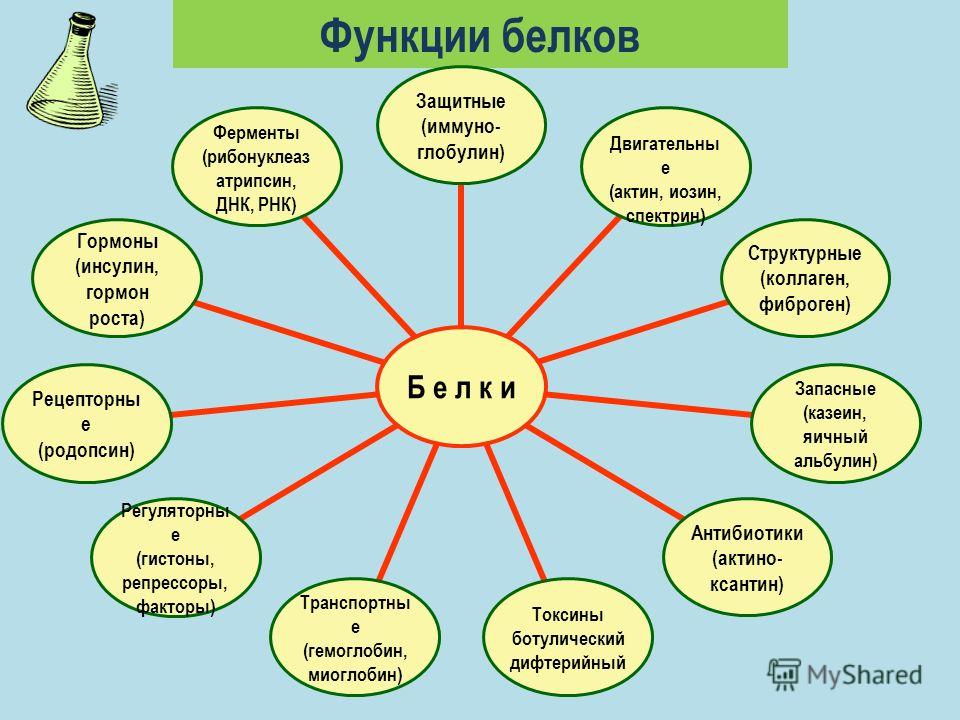 Хотя в большинстве случаев связанные с возникновением заболевания аллели рецессивны, это вредность/полезность не является единственным определяющим фактором рецессивности/доминантности аллеля.
Хотя в большинстве случаев связанные с возникновением заболевания аллели рецессивны, это вредность/полезность не является единственным определяющим фактором рецессивности/доминантности аллеля.
Гомозигота. Гомозиготой по определенной мутации/полиморфизму/аллелю называют такую клетку или организм, в генотипе которой/которого обе копии гена на двух хромосомах представлены одним вариантом, то есть не отличаются по этой мутации/полиморфизму/аллелю.
Гетерозигота. Гетерозиготой по определенной мутации/полиморфизму/аллелю называют такую клетку или организм, в генотипе которой/которого две копии гена на двух хромосомах представлены разными вариантами, то есть отличаются по этой мутации/полиморфизму/аллелю.
Секвенирование – это группа методов, позволяющая узнать последовательность нуклеотидов в молекуле ДНК. Этот метод обладает некоторыми особенностями. Во-первых, пока что ни один способ секвенирования не позволяет прочитать всю последовательность одной хромосомы, чтение идет сравнительно небольшими отрезка от 50 до несколько тысяч нуклеотидов. Во-вторых, почти все методы устроены так, что из кусочка ДНК делается много одинаковых и читаются они все. Эта особенность проявляется в таком параметре секвенирования, как глубина секвенирования, обозначаемая 10Х, 20Х, 50Х. Чем больше это значение, тем больше раз прочитан один и тот же кусок молекулы, тем точнее можно выявить ошибки секвенирования и особенности участка, например, его гетерозиготность по какой-либо мутации/полиморфизму.
Во-вторых, почти все методы устроены так, что из кусочка ДНК делается много одинаковых и читаются они все. Эта особенность проявляется в таком параметре секвенирования, как глубина секвенирования, обозначаемая 10Х, 20Х, 50Х. Чем больше это значение, тем больше раз прочитан один и тот же кусок молекулы, тем точнее можно выявить ошибки секвенирования и особенности участка, например, его гетерозиготность по какой-либо мутации/полиморфизму.
Гаплотип — совокупность состояний/вариантов определенных локусов, которые расположены на одной хромосоме, и вследствие структурных особенностей эти состояния всегда наследуются вместе. То есть, например, если в одном локусе (1) гаплотипа имеется мутация (1А), а в другом (2) имеется уже другая мутация (2M), то именно в таком составе они будут наследоваться (1А2М), а смешанных вариантов (1B2M или 1A2N) не бывает или они относятся к другому гаплотипу.
Гаплогруппа — совокупность особей, имеющих сходный гаплотип по определенным локусам, которые задаются в соответствии с тем, какую задачу нужно решить, определяя гаплогруппу
Митохондриальная ДНК. Если разбираться подробнее и глубже, то генетическая информация одного человека находится не только в 46 хромосомах, располагающихся в специальном отсеке клетки – ядре, но и в клеточных органах митохондриях. У митохондрий в клетке своя задача – преобразовывать энергию, заключенную в химической связи определенных атомов, в более удобную для клетки, то есть они готовят эффективные питательные запасы из разного сырья. Митохондрии довольно сложны, их оболочка хитро устроена, чтобы опасные побочные продукты готовки не могли попасть в остальную часть клетки, поэтому все время таскать туда нужные для их работы белки не слишком продуктивно. Таким образом, у них есть своя ДНК, которая несет информацию о разных особенных белках и РНК, которые нужны именно для работы митохондрии. Такую ДНК называют митохондриальной и она является неотъемлемой и обязательной частью нашего генотипа. Передается она только от мамы, так как сперматозоид для возможности быстро перемещаться и долго оставаться живым несет самый минимум необходимой генетической информации – 23 хромосомы.
Если разбираться подробнее и глубже, то генетическая информация одного человека находится не только в 46 хромосомах, располагающихся в специальном отсеке клетки – ядре, но и в клеточных органах митохондриях. У митохондрий в клетке своя задача – преобразовывать энергию, заключенную в химической связи определенных атомов, в более удобную для клетки, то есть они готовят эффективные питательные запасы из разного сырья. Митохондрии довольно сложны, их оболочка хитро устроена, чтобы опасные побочные продукты готовки не могли попасть в остальную часть клетки, поэтому все время таскать туда нужные для их работы белки не слишком продуктивно. Таким образом, у них есть своя ДНК, которая несет информацию о разных особенных белках и РНК, которые нужны именно для работы митохондрии. Такую ДНК называют митохондриальной и она является неотъемлемой и обязательной частью нашего генотипа. Передается она только от мамы, так как сперматозоид для возможности быстро перемещаться и долго оставаться живым несет самый минимум необходимой генетической информации – 23 хромосомы. А вот яйцеклетка, которой для выполнения основной функции не нужно находится в агрессивной окружающей среде, может позволить себе бОльшую массу и дополнительные запасы в виде готовых к работе станций приготовления питания – митохондрий и заранее синтезированных белков и РНК.
А вот яйцеклетка, которой для выполнения основной функции не нужно находится в агрессивной окружающей среде, может позволить себе бОльшую массу и дополнительные запасы в виде готовых к работе станций приготовления питания – митохондрий и заранее синтезированных белков и РНК.
Гены половой дифференцировки – группа генов, играющая ведущую роль в определении будет эмбрион развиваться как девочка или как мальчик. В геноме человека основой проявления мужских или женских половых признаков является наличие/отсутствие половой хромосомы Y, а именно особо локуса этой хромосомы – SRY (Sex-determining Region on the Y chromosome). Важно отметить, что нарушения в этом локусе могут приводить не к внешним проявлениям, а к сниженной репродуктивной способности мужчины или ее полному отсутствию. Процесс дифференцировки пола у человека можно представить тремя стадиями: 1) какой набор хромосом получается при слиянии яйцеклетки (всегда несет хромосому X) и сперматозоида (с хромосомой X или Y), 2) формирование женских или мужских половых органов в зависимости от работы генов локуса SRY, 3) развитие вторичных половых органов в соответствии с типом половых органов.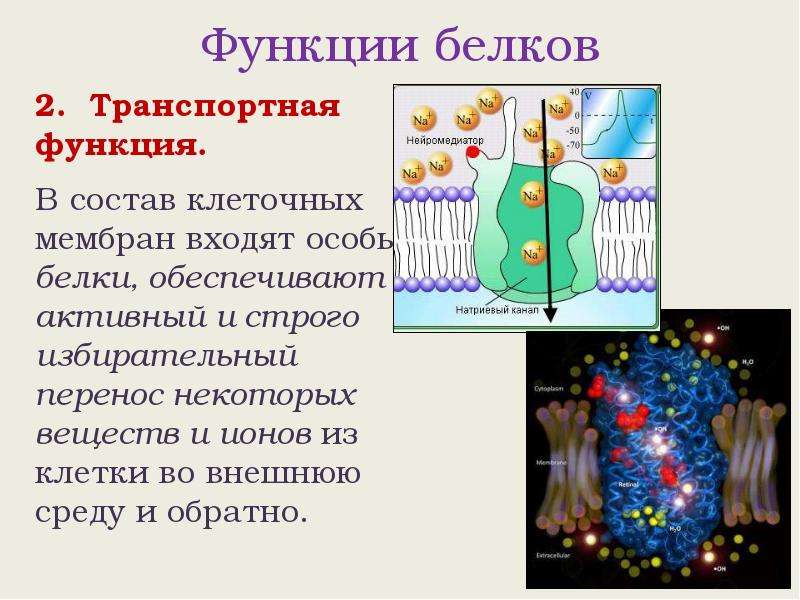 Нарушения на разных этапах приводят к разным проявлениям и разным заболеваниям.
Нарушения на разных этапах приводят к разным проявлениям и разным заболеваниям.
Локус AZF – это участок Y-хромосомы, на котором располагаются так называемые факторы азооспермии (AZF — AZoospermia Factors). Это особые участки, которые названы так, потому что если какой-то из них отсутствует из-за мутации, то развивается азооспермия (отсутствие сперматозоидов) или олигозооспермия (малое количество сперматозоидов). Всего обнаружено три таких фактора AZFa, AZFb и AZFc. В норме наличие всех трех является минимальным необходимым условием нормального формирования сперматозоидов. Если в геноме отсутствует один из AZFa и AZFb или оба, то нарушается созревание сперматозоидов и, как следствие, полностью отсутствует репродуктивная функция. При отсутствии локуса AZFc нарушения могут быть не столь сильными, поэтому деторождение остается возможным в некоторых случаях.
Хромосомные аномалии – это крупные мутации, которые связаны с изменением последовательности ДНК не в рамках отдельного гена или нескольких, а в масштабе хромосомы или генома. Например, отсутствие (делеция) большой части или всей хромосомы, лишняя хромосома, или часть одной хромосомы соединена с частью другой хромосомы и т.д.
Например, отсутствие (делеция) большой части или всей хромосомы, лишняя хромосома, или часть одной хромосомы соединена с частью другой хромосомы и т.д.
Наследственное заболевание – это заболевание, вызванное нарушениями в геноме, то есть мутациями, которые либо мешают формированию нормального белка (так как ген – инструкция по его построению – поврежден), либо изменяют регуляцию, то есть условия, когда, в каком месте или с кем такой белок или ген должен работать.
Моногенное заболевание – это наследственное заболевание, вызванное мутацией в одном только в одном гене. Несмотря на то, что все остальные почти 30000 генов могут быть в порядке, изменение последовательности ДНК в этом гене вызывает нарушения функционирования всего организма.
Хромосомное заболевание – наследственное заболевание, вызванное хромосомными аномалиями.
Носительство мутации – это состояние гетерозиготы по аллелю, обладающему какими-то негативными клиническими проявлениями, если он находится в геноме в виде гомозиготы.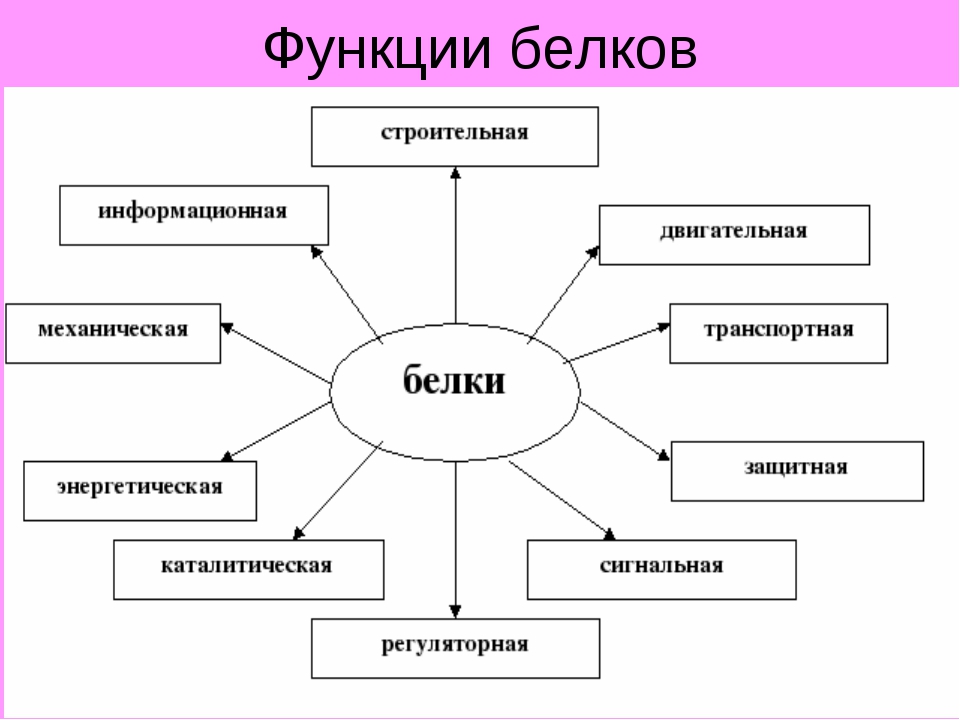
Пробанд – человек, с которого начинается составление генеалогического дерева (родословной). Обычно пробанд – это носитель или пациент с наследственным заболеванием, проявление которого и вызвало необходимость генеалогического анализа.
Сиблинг – в генетике таким термином обозначают потомков одних родителей, то есть братьев и сестер, но не близнецов.
Автор: Жикривецкая Светлана
Биолог-исследователь
Ученым удалось заставить рибосому работать «на заказ»
Потенциальное лекарство от рака, вирусов и бактерий смогли создать ученые, модифицировав рибосому и получив такую структуру, которая способна синтезировать белки «по заказу» исследователей. Отдел науки «Газеты.Ru» разбирался в том, что представляет собой эта рибосома и для чего она нужна. Авторы разработки рассказали, чем их изобретение напоминает сиамских близнецов и как оно поможет в борьбе с самыми различными болезнями.
Рибосома — это важнейшая специализированная структура в клетках живых организмов. Основной ее функцией является производство белков из аминокислот на основе генетической информации, предоставляемой матричной рибонуклеиновой кислотой (мРНК).
Основной ее функцией является производство белков из аминокислот на основе генетической информации, предоставляемой матричной рибонуклеиновой кислотой (мРНК).
По сути, рибосома представляет собой «фабрику» по производству белков, которые затем используются для поддержания жизнедеятельности самой клетки, то есть для ее роста, развития и обновления.
Основными составляющими рибосомы являются две структуры, называемые субчастицами, которые постоянно меняют своих «партнеров». Малая субчастица находит мРНК (а затем расшифровывает содержащуюся в ней генетическую информацию), после чего к ней присоединяется большая субчастица, которая выполняет следующий этап синтеза — обеспечивает формирование связей между растущей аминокислотной цепочкой будущего белка и каждой последующей аминокислотой. После того как синтез завершен, обе частицы расходятся.
Идея о том, чтобы научиться синтезировать пептиды (составляющие части белков) — то есть, по сути, научиться выполнять работу рибосом, — занимает умы исследователей в течение долгого времени. Общий метод, позволивший синтезировать пептиды в лабораторных условиях, был разработан еще в 1905 году лауреатом Нобелевской премии по химии 1902 года Эмилем Германом Фишером. Спустя полвека в лаборатории был создан окситоцин — гормон, состоящий из длинных пептидных цепочек. А в 1963 году Роберт Брюс Меррифилд разработал методику твердофазного пептидного синтеза, за что удостоился Нобелевской премии по химии 1984 года. На основе его разработок были созданы автоматические синтезаторы пептидов.
Твердофазный синтез пептидов продолжает использоваться и до сих пор, причем на производство одной пептидной связи обычно уходит от 10 до 15 минут. В 2013 году журнал Science опубликовал статью группы исследователей из Манчестера и Эдинбурга под руководством Дэвида Лея, в которой ученые описывали созданный ими искусственный аналог рибосомы — правда, весьма примитивный.
Структура представляла собой «машину» для синтеза пептидов заданного состава, сделанную из ротаксанов — соединений, состоящих из молекулы гантелевидной формы и циклической молекулы, «надетой» на нее. Принципиальные отличия от «настоящей» рибосомы заключались в том, что состав пептидов был уже задан, и «машине» оставалось только расставить предоставленные ей аминокислоты в нужном порядке, причем на присоединение одного аминокислотного остатка у нее уходило до 12 часов.
Клеточные рибосомы же самостоятельно определяют, в каком порядке должны располагаться аминокислоты, а соединяют они их со скоростью 15–20 штук в секунду.
Группа исследователей под руководством Александра Манькина (Иллинойский университет в Чикаго) и Майкла Джуветта (Северо-Западный университет) совершила настоящий прорыв в науке, сумев создать искусственную рибосому, которая выполняет те же функции, что и естественная. Кроме того, в ходе работы ученые существенным образом изменили структуру рибосомы, «запретив» ее субчастицам разделяться после синтеза белка. Подробнее ознакомиться с результатами работы исследователей можно в журнале Nature.
Один из ведущих авторов исследования Александр Манькин рассказал отделу науки, в чем заключается суть достижения.
— Александр, скажите, можно ли утверждать, что вы создали искусственную рибосому?
— Нет. Однако нам удалось существенным образом переиначить природную рибосому, которая является результатом всего каких-то трех миллиардов лет эволюции. Мы решили связать малую и большую субчастицы вечным союзом, фактически соединив их наручниками: основу большой субчастицы мы переделали таким образом, чтобы ее можно было «подшить» к малой субчастице.
close
100%
Большая и малая субчастицы, соединенные между собой («связка» обозначена зеленым цветом)
Александр Манькин
В результате это выглядит как нормальная рибосома, но вместо двух скелетов (РНК малой субчастицы и РНК большой субчастицы) эти скелеты соединены в один, прямо как у сиамских близнецов. А значит, теперь мы с этой парой сможем делать все, что захотим.
— Например?
— Например, учить ее синтезировать белки, в том числе и терапевтические, которые обычная рибосома или же совсем делать не умеет, или же делает их из рук вон плохо. Или же мы можем учить ее включать неприродные аминокислоты в белок с тем, чтобы сделать его лучше, устойчивее, более терапевтически полезным или вообще другим. Надо помнить, что природа предложила нам всего только 20 «нормальных» аминокислот, чтобы делать генетически программируемые полимеры, называемые белками.
Но теперь мы можем насинтезировать много разных новых аминокислот, или даже вовсе не аминокислот, а других соединений, которые можно было бы соединять в различные полезные для нас и, главное, программируемые полимеры.
— Получается, ваша модифицированная рибосома способна выполнять все функции рибосомы природной и даже больше?
— Да. Поэтому, к нашему огромному удивлению, клетка с такой рибосомой (но без «нормальных» рибосом) живет достаточно счастливо и растет всего в два раза медленнее, чем обычная клетка. Однако малая субчастица должна узнавать мРНК сама по себе. Неудивительно, что наша «сиамская» рибосома делает это несколько хуже. Мы сейчас пытаемся понять, можно ли нашей рибосоме помочь в этом деле, например, меняя структуру фрагментов РНК, которые связывают две субчастицы.
— Может ли помочь ваша работа пониманию того, как именно зародилась жизнь на Земле? Ведь предполагается, что первичными «кирпичиками» жизни, сформировавшимися в условиях молодой Земли, были именно РНК.
— Это замечательный вопрос. Ответ — сегодня, наверное, нет, а завтра — возможно. Ученые (в том числе и моя лаборатория) в течение многих лет пытались доказать, что РНК большой субчастицы может сама катализировать образование пептидной связи и соединять аминокислоты в белок. Доказательство этого факта было бы сильным аргументом в пользу того, что белковый синтез зародился в эпоху РНК, но пока, увы, все попытки сделать это были безуспешными. Наша рибосома, вероятно, позволит проводить новые эксперименты в этом направлении. В то же время тот факт, что клетка живет вполне счастливо с «сиамской» рибосомой, показывает, что двухсубъединичная структура рибосомы — это, скорее всего,
один из возможных эволюционных вариантов синтеза белка, а вовсе не необходимость, диктуемая механикой белкового синтеза.
— Можно ли использовать «сиамскую» рибосому в медицинских целях?
— Ну конечно! Все, что делается в биологических исследованиях — фундаментальных или прикладных, — рано или поздно, напрямую или косвенно оказывает влияние на медицину, сельское хозяйство… Как я уже говорил, нашу рибосому с «повязанными» субчастицами можно научить синтезировать терапевтические белки, которые будут более устойчивы в клетках, и, значит, их не надо будет давать пациенту слишком часто. Или же можно эти терапевтические белки (например, моноклональные антитела) сделать лучше, подшивая к ним всевозможные «боеголовки» для атак на наших врагов — раковые клетки, патогенные бактерии и вирусы.
Какое значение, роль и функции белков в клетке. Какую функцию в клетке выполняют белки?
Белки – это важнейшие органические вещества, количество которых преобладает над всеми другими макромолекулами, которые присутствуют в живой клетке. Они составляют больше половины веса сухого вещества как растительных, так и животных организмов. Функции белков в клетке разнообразные, некоторые из них до сих пор остаются неизвестными науке. Но все же основные направления их «работы» хорошо изучены. Одни нужны для того, чтобы стимулировать процессы, протекающие в клетках и тканях. Другие переносят важные минеральные соединения через клеточную мембрану и по кровеносным сосудам от одного органа к другому. Некоторые защищают организм от чужеродных часто патогенных агентов. Ясно одно — без белков не протекает ни один процесс в нашем организме.
Основные функции белков
Функции белков в организме многообразны. Каждая группа имеет определенное химическое строение, совершает одну специализированную «работу». В некоторых случаях несколько типов белков взаимосвязаны друг с другом. Они отвечают за разные этапы одного процесса. Или же влияют сразу на несколько. Например, регуляторная функция белков осуществляется ферментами и гормонами. Это явление можно представить, вспомнив о гормоне адреналине. Он вырабатывается мозговым слоем надпочечников. Поступая в кровеносные сосуды, он повышает количество кислорода в крови. Поднимается и артериальное давление, увеличивается содержание сахара. Это стимулирует обменные процессы. Также адреналин является медиатором нервной системы у рыб, амфибий и пресмыкающихся.
Ферментативная функция
Многочисленные протекающие в клетках живых организмов биохимические реакции осуществляются при высоких температурах и с нейтральным значением рН. В таких условиях скорость их прохождения слишком мала, поэтому нужны специализированные катализаторы, называемые ферментами. Все их разнообразие объединено в 6 классов, которые различаются по специфичности действия. Ферменты синтезируются на рибосомах в клетках. Их изучением занимается наука энзимология.
Несомненно, без ферментов невозможна регуляторная функция белков. Они обладают высокой избирательностью действия. Их активность может регулироваться ингибиторами и активаторами. Кроме того, ферменты обычно проявляют специфичность по отношению к субстратам. Также ферментативная активность зависит от условий в организме и в клетках в частности. На их протекание влияет давление, кислая рН, температура, ионная сила раствора, то есть концентрация солей в цитоплазме.
Транспортная функция белков
В клетку должны постоянно поступать необходимые организму минеральные и органические вещества. Они нужны как строительные материалы и источники энергии в клетках. Но механизм их поступления достаточно сложен. Клеточные оболочки состоят не только из белков. Биологические мембраны строятся по принципу двойного слоя липидов. Между ними встроены различные белки. Очень важно, что гидрофильные участки находятся на поверхности мембраны, а гидрофобные — в ее толще. Таким образом, такая структура делает оболочку непроницаемой. Через нее не могут самостоятельно, без «помощи», пройти такие важные компоненты, как сахара, ионы метолов и аминокислоты. Через цитоплазматическую мембрану в цитоплазму их транспортируют специализированные белки, которые вмонтированы в слои липидов.
Транспорт веществ от одних органов к другим
Но транспортная функция белков осуществляется не только между межклеточным веществом и клеткой. Некоторые важные для физиологических процессов вещества приходится доставлять из одних органов в другие. Например, транспортный белок крови – сывороточный альбумин. Он наделен уникальной способностью сформировывать соединения с жирными кислотами, которые появляются при переваривании жиров, с лекарственными препаратами, а также со стероидными гормонами. Важными белками-переносчиками являются и гемоглобин (доставляющий молекулы кислорода), трансферрин (соединяющийся с ионами железа) и церуплазмин (формирующий комплексы с медью).
Сигнальная функция белков
Огромное значение в протекании физиологических процессов в многоклеточных сложных организмах имеют белки-рецепторы. Они вмонтированы в плазматическую мембрану. Служат они для восприятия и расшифровки различного рода сигналов, которые непрерывным потоком поступают в клетки не только от соседних тканей, но и из внешней среды. В настоящее время, пожалуй, самым исследованным белком-рецептором является ацетилхолин. Он находится в ряде межнейронных контактов на мембране клетки.
Но сигнальная функция белков осуществляется не только внутри клеток. Многие гормоны связываются со специфическими рецепторами на их поверхности. Такое сформировавшееся соединение и является сигналом, который активирует физиологические процессы в клетках. Примером таких белков является инсулин, действующий в аденилатциклазной системе.
Защитная функция
Функции белков в клетке различны. Некоторые из них участвуют в иммунных ответах. Это защищает организм от инфекций. Иммунная система способна отвечать на выявленные чужеродные агенты синтезом огромного количества лимфоцитов. Эти вещества способны выборочно повреждать эти агенты, они могут быть чужеродными для организма, например бактерии, надмолекулярные частицы, или это могут быть раковые клетки.
Одна из групп — «бета»-лимфоциты — вырабатывает белки, которые попадают в русло крови. Они имеют очень интересную функцию. Эти белки должны распознавать чужеродные клетки и макромолекулы. Затем они соединяются с ними, формируя комплекс, который подлежит уничтожению. Белки эти называются иммуноглобулинами. Сами чужеродные компоненты – это антигены. А иммуноглобулины, которые им соответствуют – антитела.
Структурная функция
В организме, помимо высокоспециализированных, существуют еще и структурные белки. Они необходимы, чтобы обеспечивать механическую прочность. Эти функции белков в клетке важны для поддержания формы и сохранения молодости организма. Самым известным является коллаген. Это основной белок внеклеточного матрикса соединительных тканей. У высших млекопитающих он составляет до 1/4 общей массы белков. Синтезируется коллаген в фибробластах, которые являются основными клеточками соединительных тканей.
Такие функции белков в клетке имеют огромное значение. Помимо коллагена, известен еще один структурный белок – эластин. Он также является составляющей внеклеточного матрикса. Эластин способен наделять ткани возможностью растягиваться в определенных пределах и легко возвращаться в исходную форму. Еще один пример структурного белка – фиброин, который обнаружен у гусениц шелкопрядов. Это основной компонент шелковых нитей.
Двигательные белки
Роль белков в клетке переоценить невозможно. Они принимают участие и в работе мышц. Мышечное сокращение является важным физиологическим процессом. В результате происходит превращение запасенного в виде макромолекул АТФ в химическую энергию. Непосредственными участниками процесса являются два белка – актин и миозин.
Эти двигательные белки представляют собой нитевидные молекулы, которые функционируют в сократительной системе скелетных мышц. Также они обнаруживаются в немышечных тканях у эукариотических клеток. Еще один пример двигательных белков – тубулин. Из него построены микротрубочки, являющиеся важным элементом жгутиков и ресничек. Также микротрубочки, содержащие тубулин, обнаруживают в клетках нервной ткани животных.
Антибиотики
Огромна защитная роль белков в клетке. Частично ее возлагают на группу, которую принято называть антибиотиками. Это вещества природного происхождения, которые синтезируются, как правило, в бактериях, микроскопических грибах и прочих микроорганизмах. Они нацелены на подавление физиологических процессов других конкурирующих организмов. Открыты антибиотики белкового происхождения были в 40-х годах. Они произвели революцию в медицине, дав ей мощный толчок к развитию.
По своей химической природе антибиотики — весьма разнообразная группа. Они различаются и по механизму действия. Одни препятствуют синтезу белка внутри клеток, вторые блокируют выработку важных ферментов, третьи подавляют рост, четвертые — размножение. Например, хорошо известный стрептомицин взаимодействуют с рибосомами бактериальных клеток. Таким образом, в них резко замедляется синтез белков. При этом данные антибиотики не взаимодействуют с эукариотическими рибосомами организма человека. Это значит, что для высших млекопитающих данные вещества не токсичны.
Это далеко не все функции белков в клетке. Таблица антибиотических веществ позволяет определить и другие узкоспециализированные действия, которые эти специфические природные соединения способны оказывать на бактерии и не только. В настоящее время ведутся изучения антибиотиков белкового происхождения, которые при взаимодействии с ДНК нарушают процессы, связанные с воплощением наследственной информации. Но пока такие вещества используют только при химиотерапии онкологических заболеваний. Примером такого антибиотического вещества является дактиномицин, синтезируемый актиномицетами.
Токсины
Белки в клетке выполняют функцию весьма специфическую и даже неординарную. У ряда живых организмов вырабатываются ядовитые вещества – токсины. По своей природе это белки и сложные низкомолекулярные органические соединения. В качестве примера можно привести ядовитую мякоть гриба бледная поганка.
Запасные и пищевые белки
Некоторые белки выполняют функцию по обеспечению питанием зародышей животных и растений. Таких примеров много. Значение белка в клетке семян злаковых заключено именно в этом. Они будут питать формирующийся зачаток растения на первых стадиях его развития. У животных пищевыми белками являются яичный альбумин и молочный казеин.
Неизученные свойства белков
Приведенные выше примеры — лишь та часть, что уже достаточно изучена. Но в природе остается много загадок. Белки в клетке многих биологических видов уникальны, и в настоящее время даже классифицировать их затруднительно. Например, монеллин — белок, обнаруженный и выделенный из африканского растения. На вкус он сладкий, но при этом не вызывает ожирения и не токсичен. В будущем это может быть превосходная замена сахару. Еще один пример — белок, обнаруженный у некоторых арктических рыб, он препятствует замерзанию крови, действуя как антифриз в буквальном смысле этого сравнения. У ряда насекомых в соединениях крыльев выявлен белок резилин, обладающий уникальной, практически идеальной эластичностью. И это далеко не все примеры веществ, которые только предстоит изучить и классифицировать.
3.3A: Типы и функции белков
Белки выполняют многие важные физиологические функции, в том числе катализируют биохимические реакции.
Цели обучения
- Различать типы и функции белков
Ключевые моменты
- Белки необходимы для основных физиологических процессов жизни и выполняют функции во всех системах человеческого тела.
- Форма белка определяет его функцию.
- Белки состоят из аминокислотных субъединиц, которые образуют полипептидные цепи.
- Ферменты катализируют биохимические реакции, ускоряя химические реакции, и могут либо разрушать свой субстрат, либо строить более крупные молекулы из субстрата.
- Форма активного центра фермента соответствует форме субстрата.
- Гормоны — это тип белков, используемых для передачи сигналов и коммуникации клеток.
Ключевые термины
- аминокислота : Любая из 20 встречающихся в природе α-аминокислот (имеющих амино- и карбоксильные группы на одном атоме углерода) и различных боковых цепей, которые объединяются через пептидные связи с образованием белков.
- полипептид : любой полимер (одинаковых или разных) аминокислот, соединенных пептидными связями.
- катализатор : для ускорения процесса.
Типы и функции белков
Белки выполняют важные функции во всех системах человеческого тела. Эти длинные цепи аминокислот критически важны для:
- катализирующие химические реакции
- синтез и восстановление ДНК
- транспортировка материалов по камере
- прием и отправка химических сигналов
- отвечает на раздражители
- обеспечивает структурную поддержку
Белки (полимеры) представляют собой макромолекулы, состоящие из аминокислотных субъединиц (мономеров).Эти аминокислоты ковалентно связаны друг с другом с образованием длинных линейных цепей, называемых полипептидами, которые затем складываются в определенную трехмерную форму. Иногда эти свернутые полипептидные цепи функционируют сами по себе. В других случаях они объединяются с дополнительными полипептидными цепями, чтобы сформировать окончательную структуру белка. Иногда в конечном белке также требуются неполипептидные группы. Например, гемогобин белка крови состоит из четырех полипептидных цепей, каждая из которых также содержит молекулу гема, имеющую кольцевую структуру с атомом железа в центре.
Белки имеют разную форму и молекулярную массу в зависимости от аминокислотной последовательности. Например, гемоглобин представляет собой глобулярный белок, что означает, что он сворачивается в компактную шарообразную структуру, но коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок, что означает, что он складывается в длинную вытянутую волоконно-подобную цепь. Вы, вероятно, похожи на членов своей семьи, потому что у вас одинаковые белки, но вы отличны от посторонних, потому что белки в ваших глазах, волосах и остальном теле разные.
Рисунок \ (\ PageIndex {1} \): Гемоглобин человека : Структура гемоглобина человека. Α- и β-субъединицы белков выделены красным и синим цветом, а железосодержащие гемовые группы — зеленым. Из базы данных по белкам.
Поскольку форма определяет функцию, любое незначительное изменение формы белка может привести к нарушению функции белка. Небольшие изменения в аминокислотной последовательности белка могут вызвать разрушительные генетические заболевания, такие как болезнь Хантингтона или серповидно-клеточная анемия.
Ферменты
Ферменты — это белки, которые катализируют биохимические реакции, которые в противном случае не имели бы места.Эти ферменты необходимы для химических процессов, таких как пищеварение и клеточный метаболизм. Без ферментов большинство физиологических процессов протекало бы так медленно (или не протекало бы совсем), что жизнь не могла бы существовать.
Поскольку форма определяет функцию, каждый фермент специфичен для своих субстратов. Субстраты — это реагенты, которые подвергаются химической реакции, катализируемой ферментом. Место, где субстраты связываются с ферментом или взаимодействуют с ним, известно как активный сайт, потому что это место, где происходит химия.Когда субстрат связывается со своим активным центром на ферменте, фермент может способствовать его распаду, перегруппировке или синтезу. Помещая субстрату определенную форму и микроокружение в активном центре, фермент стимулирует протекание химической реакции. Существует два основных класса ферментов:
Рисунок \ (\ PageIndex {1} \): Ферментная реакция : Катаболическая ферментативная реакция, показывающая, что субстрат точно соответствует форме активного центра.
- Катаболические ферменты: ферменты, расщепляющие субстрат
- Анаболические ферменты: ферменты, которые создают более сложные молекулы из своих субстратов
Ферменты необходимы для пищеварения: процесс расщепления более крупных молекул пищи на субъединицы, достаточно мелкие, чтобы диффундировать через клеточную мембрану и использоваться клеткой.Эти ферменты включают амилазу, которая катализирует переваривание углеводов во рту и тонком кишечнике; пепсин, катализирующий переваривание белков в желудке; липаза, катализирующая реакции, необходимые для эмульгирования жиров в тонком кишечнике; и трипсин, который катализирует дальнейшее переваривание белков в тонком кишечнике.
Ферменты также необходимы для биосинтеза: процесса создания новых сложных молекул из более мелких субъединиц, которые поставляются или генерируются клеткой.Эти биосинтетические ферменты включают ДНК-полимеразу, которая катализирует синтез новых цепей генетического материала перед делением клетки; синтетаза жирных кислот, которая синтезирует новые жирные кислоты для образования жиров или мембранных липидов; и компоненты рибосомы, которая катализирует образование новых полипептидов из мономеров аминокислот.
Гормоны
Некоторые белки действуют как химические сигнальные молекулы, называемые гормонами. Эти белки секретируются эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение.Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови. Другие белки действуют как рецепторы, чтобы определять концентрации химических веществ и посылать сигналы для ответа. Некоторые типы гормонов, такие как эстроген и тестостерон, являются липидными стероидами, а не белками.
Другие функции белков
Белки выполняют важные функции во всех системах человеческого тела. В дыхательной системе гемоглобин (состоящий из четырех белковых субъединиц) транспортирует кислород для использования в клеточном метаболизме.Дополнительные белки в плазме крови и лимфе переносят питательные вещества и продукты обмена веществ по всему телу. Белки актин и тубулин образуют клеточные структуры, а кератин формирует структурную опору для мертвых клеток, которые становятся ногтями и волосами. Антитела, также называемые иммуноглобинами, помогают распознавать и уничтожать чужеродные патогены в иммунной системе. Актин и миозин позволяют мышцам сокращаться, а альбумин питает раннее развитие эмбриона или проростка.
Рисунок \ (\ PageIndex {1} \): Тубулин : структурный белок тубулин, окрашенный в красный цвет в клетках мыши.
5 ролей белка | Здоровое питание
Стефани Брукшер Обновлено 12 декабря 2018 г.
Белок можно найти в животных источниках, таких как мясо и молочные продукты, или в растительных источниках, таких как бобы, орехи и семена. По данным Министерства сельского хозяйства США, от 10 до 35 процентов потребляемых калорий должно поступать из белков. Каждая клетка вашего тела содержит белок, поэтому удовлетворение потребности в белке имеет важное значение для вашего здоровья.
Строительные ткани и мышцы
Белок необходим для построения и восстановления тканей организма.Если вы не получаете достаточного количества белка с пищей, это может привести к истощению мышц и другим симптомам. Такие упражнения, как силовые тренировки, вызывают микротрещины в мышцах, и когда ваше тело восстанавливает эти разрывы, они заставляют мышцы увеличиваться. Белок необходим для иммунного ответа, который помогает залечить крошечные мышечные разрывы. Однако потребление дополнительного белка не поможет вашему телу нарастить дополнительные мышцы.
Производство гормонов
Гормоны — это химические вещества, вырабатываемые железами в одной части тела, которые помогают координировать деятельность и общаться с другими областями.Белковые гормоны связываются с рецепторами на клеточной мембране вместо того, чтобы напрямую проникать в клетку. Гормональные белки, такие как инсулин и окситоцин, играют жизненно важную роль, например, контролируют концентрацию сахара в крови и стимулируют схватки во время родов. Гормоны также могут активировать рост мышц, увеличивая синтез белка или уменьшая его распад.
Ферменты
Ферменты — это белки, которые связываются с молекулами для ускорения химических реакций. Они играют роль во многих действиях, таких как сокращение и расслабление мышц, а также передача нервных импульсов.Амилаза и липаза — это ферменты, которые помогают переваривать углеводы и жиры. Фермент АТФаза экспортирует клеточные токсины и необходим для расщепления аденозинтрифосфата или АТФ, который высвобождает энергию.
Иммунная функция
Антитела — это специализированные белковые конфигурации, которые обеспечивают специфическую иммунную защиту от захватчиков. Они вырабатываются организмом после воздействия на него определенных антигенов, таких как бактерии, вирусы и грибки. Белки комплемента поддерживают иммунную систему как вторую линию защиты.Они могут создавать отверстия в стенках бактерий, способствовать воспалению, которое воздействует на макрофаги, которые уничтожают вторгшиеся организмы, и прикрепляются к чужеродным веществам.
Energy
Белок расщепляется на аминокислоты во время пищеварения и обеспечивает четыре калории на грамм. Включая протеин в пищу, вы чувствуете себя более насыщенным и дольше сохраняете сытость. Хотя белок можно использовать в качестве источника энергии, основным источником энергии для организма являются углеводы. Диета с нежирными белками, такими как бобы и рыба, сложными углеводами, такими как цельнозерновые и овощи, и полезными жирами, такими как оливковое масло и авокадо, — лучший способ снабдить ваше тело энергией.
Роль мембранных белков в физиологии
Мембранные белки — это белки, которые являются частью клеточных мембран или взаимодействуют с ними, и они несут ответственность за выполнение большинства функций этих мембран. Мембранные белки составляют примерно одну треть белков человека и отвечают за регулирование процессов, которые помогают биологическим клеткам выжить.
Изображение предоставлено: sciencepics / Shutterstock.com
Мембранные белки имеют ряд различных структур и также расположены в разных областях мембраны.Они выполняют широкий спектр функций, и количество белков и типы белков, присутствующих на конкретной мембране, могут варьироваться.
Структура мембранного белка
Клеточные мембраны состоят из двух фосфолипидных бислоев, которые называются листочками. Эти листочки присутствуют на всех клетках, образуя барьер, окружающий каждую клетку. Мембранные белки находятся на этих бислоев фосфолипидов или они взаимодействуют с этими бислоями фосфолипидов.
Внутри липидного бислоя находятся неполярные мембранные белки, которые являются гидрофобными (водоотталкивающими), и полярные мембранные белки, которые являются гидрофильными (способны смешиваться с водой).Они напрямую связаны с липидными бислоями, которые создают барьер вокруг каждой клетки.
Интегральные мембранные белки прочно закреплены на мембране.
Белки периферической мембраны не являются постоянной частью мембраны и могут иметь гидрофобные, электростатические и другие нековалентные взаимодействия с мембраной или интегральными белками.
Интегральные белки бывают разных типов, например монотопные, битопические, политопные, липидно-заякоренные белки или трансмембранные белки.
Монотопные интегральные белки прикреплены только к одному из двух листочков клетки.
Интегральные белки Bitopic — это трансмембранные белки, которые могут однажды покрывать липидные бислои. Политопные белки также являются трансмембранными белками, которые охватывают липидные бислои более одного раза.
Заякоренный липидом белок имеет ковалентную связь с липидами, которые встроены в фосфолипидный бислой.
Функции мембранного белка
Существует множество функций, которые выполняют мембранные белки.К ним относятся:
- Соединения: соединение двух ячеек вместе
Ферментативные функции
Все ферменты представляют собой белок. В результате мембранный белок, внедренный в мембрану, иногда может быть ферментом, активный сайт которого может быть обращен к веществам за пределами липидного бислоя.
Эти типы ферментативных мембранных белков могут работать в группах для выполнения определенных этапов метаболического пути, например, расщепления лактозы на углеводы, а затем на моносахариды.
Транспорт
Мембранные белки могут позволить гидрофильным молекулам проходить через клеточную мембрану. Белки транспортной мембраны бывают разных форм, и некоторым требуется энергия для изменения формы и активного перемещения молекул и других веществ через клеточную мембрану. Они делают это, высвобождая АТФ для использования в качестве источника энергии.
- Крепление: становятся точками прикрепления цитоскелета и внеклеточного матрикса
Преобразование сигнала
Некоторые мембранные белки могут иметь сайт связывания.Эти сайты связывания имеют особую форму, которая соответствует форме химического посредника. Например, эти химические посланники могут быть гормонами.
Когда гормон встречается с клеточной стенкой, он соединяется с рецепторным мембранным белком, встроенным в клеточную стенку. Гормон может изменить рецепторный белок и вызвать определенную реакцию, в зависимости от типа гормона или другого вещества, которая будет иметь место внутри клетки.
Распознавание клеток
Другая важная функция мембранных белков — идентификация и распознавание между клетками.Эта конкретная функция полезна для иммунной системы, поскольку она помогает организму распознавать чужеродные клетки, например, которые могут вызывать инфекцию. Гликопротеины — это один из типов мембранных белков, которые могут распознавать клетки.
Межклеточное соединение
Соседние клетки могут иметь мембранные белки, которые соединяются в различных соединениях. Щелевые и плотные соединения.
Эта функция помогает клеткам общаться друг с другом и передавать материалы между собой.
Приложение
Мембранные белки важны для цитоскелета, системы нитей и волокон в цитоплазме клетки и внеклеточного матрикса (ECM), который представляет собой сеть макромолекул, находящихся вне клеток, таких как коллаген, ферменты и гликопротеины. к мембранным белкам.
Прикрепление нитей или волокон в цитоплазме по всей клетке может помочь клетке сохранять свою особую форму. Он также сохраняет стабильное расположение мембранных белков.
Присоединение мембранных белков к внеклеточному матриксу может помочь ЕСМ опосредовать изменения, происходящие во внеклеточной и внутриклеточной среде.
Мембранные белки при болезнях
Некоторые заболевания связаны с мутациями мембранных белков. Одним из примеров является мутация под названием V509A, обнаруженная в рецепторе тиреотропина, причем тиреотропин является гормоном, секретируемым гипофизом, который регулирует выработку гормонов щитовидной железы.
Эта мутация увеличивает активность рецептора тиреотропина и приводит к врожденному гипертиреозу, состоянию, которое может вызывать изменения настроения, проблемы со сном и проблемы с желудком.
Другие заболевания, связанные с мутациями в мембранных белках, включают наследственную глухоту, болезнь Шарко-Мари-Тута, которая повреждает периферические нервы за пределами центральной нервной системы, и синдром Дежерина-Соттаса, который влияет на способность человека двигаться.
Изображение предоставлено: Explode / Shutterstock.com
Сводка
Мембранные белки выполняют ряд важных функций, которые помогают клеткам общаться, поддерживать свою форму, выполнять изменения, вызванные химическими посредниками, а также транспортировать и обмениваться материалами.
Мембранные белки также могут играть роль в прогрессировании заболевания, поскольку иммунная система может использовать мембранные белки для идентификации потенциально вредных чужеродных молекул в организме.
мембранных белков | BioNinja
Понимание:
• Мембранные белки разнообразны с точки зрения структуры, положения в мембране и функции
Фосфолипидные бислои залиты белками, которые могут быть постоянно или временно прикреплены к мембране
- Интегральные белки постоянно прикреплены к мембране и обычно являются трансмембранными (они охватывают бислой)
- Периферийные белки временно присоединяются посредством нековалентных взаимодействий и связываются с одной поверхностью мембраны
Структура мембранных белков
Аминокислоты мембранного белка локализованы в соответствии с полярностью:
- Неполярные (гидрофобные ) аминокислоты непосредственно связаны с липидным бислоем
- Полярные (гидрофильные) аминокислоты расположены внутри и обращены к водным растворам
Трансмембранные белки обычно имеют одну из двух третичных структур:
- Одинарные спирали / спиральные пучки
- Бета-баррели ( общий в Channel Pro teins)
Мембранные белковые структуры
Функции мембранных белков
Мембранные белки могут выполнять множество ключевых функций:
- J Unctions — Служат для соединения и соединения двух клеток вместе
- E nzymes — Крепление к мембраны локализуют метаболические пути
- T ransport — отвечает за облегчение диффузии и активного транспорта
- R ecognition — может функционировать как маркеры для клеточной идентификации
- A nchorage — точки прикрепления цитоскелета и внеклеточный матрикс
- T трансдукция — Функция как рецепторы для пептидных гормонов
Мнемоника: Jet Rat
Функции мембранного белка
Специализированная клеточная структура и функции: синтез белка
Синтез белка
Создание различных типов белка является одним из наиболее важных событий для клетки, поскольку белок не только формирует структурные компоненты клетки, но и составляет ферменты, которые катализировать производство оставшихся органических биомолекул, необходимых для жизни.В общем, генотип, кодируемый в ДНК, выражается как фенотип с помощью белка и других продуктов, катализируемых ферментами.
ДНК, размещенная в ядре, слишком велика, чтобы проходить через ядерную мембрану, поэтому она должна копироваться более мелкой однонитевой РНК (транскрипция), которая перемещается из ядра в рибосомы, расположенные в цитоплазме и грубой эндоплазме. ретикулум, чтобы направить сборку белка (трансляцию). Гены на самом деле не производят белок, но они обеспечивают план в виде РНК, которая направляет синтез белка.
Транскрипция
Транскрипция происходит в ядре клетки и представляет собой перенос генетического кода от ДНК к комплементарной РНК. Ферментная РНК-полимераза?
- Присоединяется к молекуле ДНК и расстегивает ее, превращая ее в две отдельные нити.
- Связывается с промотором сегментов ДНК, которые указывают начало копируемой одиночной цепи ДНК.
- Перемещается по ДНК и сопоставляет нуклеотиды ДНК с комплементарным нуклеотидом РНК для создания новой молекулы РНК, которая повторяет структуру ДНК.
Копирование ДНК продолжается до тех пор, пока РНК-полимераза не достигнет сигнала терминации , который представляет собой определенный набор нуклеотидов, который отмечает конец копируемого гена, а также сигнализирует об отключении ДНК от вновь созданной РНК. .
Три типа РНК?
- мРНК (информационная РНК) транскрибируется с ДНК и несет генетическую информацию от ДНК, которая должна быть переведена в аминокислоты.
- тРНК (транспортная РНК)? Интерпретирует? трехбуквенные кодоны нуклеиновых кислот к однобуквенному аминокислотному слову
- рРНК (рибосомная РНК) является наиболее распространенным типом РНК, и вместе с ассоциированными белками составляют рибосомы.
Когда РНК-полимераза заканчивает копирование определенного сегмента ДНК, ДНК реконфигурируется в исходную структуру двойной спирали. Вновь созданная мРНК выходит из ядра в цитоплазму.
Трансляция
Трансляция — это преобразование информации, содержащейся в последовательности нуклеотидов мРНК, в последовательность аминокислот, которые соединяются вместе, образуя белок. МРНК перемещается к рибосомам и «читается». с помощью тРНК, которая анализирует участки трех соседних нуклеотидных последовательностей, называемых кодонами , на мРНК и переносит соответствующую аминокислоту для сборки в растущую полипептидную цепь.Три нуклеотида в кодоне специфичны для конкретной аминокислоты. Следовательно, каждый кодон сигнализирует о включении определенной аминокислоты, которая объединяется в правильной последовательности для создания определенного белка, кодируемого ДНК.
Сборка полипептида начинается, когда рибосома прикрепляется к старт-кодону , расположенному на мРНК. Затем тРНК переносит аминокислоту к рибосомам, которые состоят из рРНК и белка и имеют три сайта связывания, способствующие синтезу.Первый сайт ориентирует мРНК таким образом, чтобы кодоны были доступны для тРНК, которые занимают оставшиеся два сайта, когда откладывают свои аминокислоты, а затем высвобождаются из мРНК для поиска большего количества аминокислот. Трансляция продолжается до тех пор, пока рибосома не распознает кодон, который сигнализирует о конце аминокислотной последовательности. Полипептид, когда он завершен, находится в своей первичной структуре. Затем он высвобождается из рибосомы, чтобы начать изгибаться, чтобы принять окончательную форму и начать свою функцию.
Bionote
Каждый кодон мРНК определяет конкретную аминокислоту, которая распознается антикодоном комплементарной тРНК.Есть 20 различных аминокислот; есть также 20 различных молекул тРНК.
После того, как белки изготовлены, они упаковываются и транспортируются к месту их конечного назначения по интересному пути, который можно описать в три этапа с участием трех органелл:
- Везикулы транспортируют белки из рибосом в аппарат Гольджи , иначе комплекс Гольджи, где они упакованы в новые пузырьки.
- Везикулы мигрируют к мембране и высвобождают свой белок за пределы клетки.
- Лизосомы переваривают и перерабатывают отходы для повторного использования клеткой.
Ферменты в аппарате Гольджи модифицируют белки и заключают их в новую везикулу, которая отрастает от поверхности аппарата Гольджи. Аппарат Гольджи часто рассматривается как центр упаковки и распределения ячейки.
Везикулы — это небольшие мембранные оболочки, которые обычно образуются в эндоплазматическом ретикулуме или аппарате Гольджи и используются для транспортировки веществ через клетку.
Лизосомы — это особый тип везикулы, который содержит пищеварительные ферменты клетки и полезен для расщепления оставшихся продуктов жизнедеятельности белков, липидов, углеводов и нуклеиновых кислот на их составные части для повторной сборки и повторного использования клеткой.
Выдержка из The Complete Idiot’s Guide to Biology 2004 Глен Э. Моултон, редактор Д. Все права защищены, включая право на воспроизведение полностью или частично в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу напрямую у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476. Вы также можете приобрести эту книгу на Amazon.com и Barnes & Noble.
Различные функции белков в биологической системе
Изображение: «Структура белка NOTCh3». пользователя Emw. Лицензия: CC BY-SA 3.0
.
Антитела
Антитела — это гликопротеины, которые однозначно связываются с белком или другими молекулами. Они принадлежат к семейству глобулярных белков, называемых иммуноглобулинами.Это антиген-реактивные белки, которые присутствуют в иммунной сыворотке и называются антисывороткой. Они образуются после того, как позвоночное животное-хозяин подвергается действию данного антигена, называемого иммуногеном.
«Антитела. Белки иммунной системы »Изображение создано Lecturio
Основная функция антитела — связываться с чужеродными молекулами. Большинство антител структурно схожи из-за их Y-образных молекул; однако каждое антитело уникально, потому что оно имеет разные аминокислотные последовательности.Структурные свойства антител позволяют им проявлять универсальность связывания, специфичность связывания и биологическую активность. Человек может производить сотни тысяч антител.
Это позволяет ему обнаруживать присутствие чужеродных или чужеродных молекул внутри него. Y-образное плечо антитела определяет, с какими молекулами они будут взаимодействовать. Он также определяет, какой ответ будет делать ячейка. Возможные ответы включают лизис, опосредованный комплементом, усиленный фагоцитоз и / или возникновение аллергических реакций.Эти ответы возникают, когда антитела связываются с антигенами. Люди способны экспрессировать пять типов антител или классов иммуноглобулинов.
Пять классов:
Эти пять классов могут различаться по своим физико-химическим свойствам, включая заряд, растворимость и размер. Эта вариабельность вызвана различиями в аминокислотных последовательностях, которые они имеют. Они также могут различаться по своим серологическим свойствам или по способу реакции с антигенами. Важнейшим фактором, разделяющим антитела на пять классов, является их различие в их поведении в качестве антигенов.
IgG — это антитело, индуцируемое белковыми антигенами, и составляет 80% антител в сыворотке. С другой стороны, человеческий IgA является преобладающим классом антител во внесосудистых секрециях. Он состоит из 13% антител в сыворотке крови человека. Человеческий IgM — это антитело, индуцированное полисахаридными антигенами. Это первое антитело, которое появляется при иммунном ответе. Он также является первым, который развивается у плода. IgD — это антитела, которые остаются связанными с мембраной. Это один из основных рецепторов зрелых В-клеток.
Регулирует активацию клетки. Человеческий IgE — это антитело, которое связывается через свою Fc-часть тучных клеток или базофилов. Когда тучные клетки и базофилы подвергаются воздействию одних и тех же антигенов, это вызывает аллергические реакции.
Экспрессия гена
Экспрессия гена — это процесс обработки генетических инструкций для получения определенных генных продуктов. Обычные продукты включают белки, которые необходимы для различных видов биологической активности. Сюда входят ферменты, гормоны и рецепторы.Чтобы предотвратить перепроизводство определенных генных продуктов, в клетках устанавливаются различные механизмы контроля. Регуляторы транскрипции — это белки, распознающие определенные области ДНК.
Когда эти регуляторы транскрипции связываются с ДНК, она действует как переключатель, который регулирует транскрипцию отдельного набора генов. Переключатели транскрипции также позволяют клеткам реагировать на изменения в окружающей среде. Переключатели транскрипции могут действовать как репрессоры или активаторы. Репрессоры — это белки, которые отключают гены.С другой стороны, активаторы — это белки, которые стимулируют или активируют гены.
«Экспрессия генов. Контроль экспрессии клеточных белков »Изображение, созданное Lecturio
Катализ
Другая важная функция белков — катализировать ряд реакций. Большинство метаболических реакций в биологических системах связано с использованием ферментов. Фактически, эти реакции не будут происходить, если у человека нет фермента, катализирующего реакцию. Ферменты очень специфичны, они обычно катализируют одну реакцию или очень мало родственных.
| Фермент | Число оборотов (в секунду) |
| Карбоангидраза | 699,000 |
| 3-кетоэстероид-изомераза | 280,000 |
| Ацетилхолинэстераза | 25,500 |
| Пенициллиназа | 2,000 |
| Лактатдегидрогеназа | 1.000 |
| Химотрипсин | 100 |
| ДНК-полимераза I | 15 |
| Триптофансинтетаза | 2 |
| лизоцим | 0.5 |
Различия в структуре активных центров фермента определяют его специфичность к конкретным субстратам или реагентам. Ферменты позволяют снизить энергию активации биологических реакций. Во время реакции ферменты претерпевают структурные изменения, чтобы не приспосабливаться к другим молекулам субстрата. После реакции они вернутся в исходное состояние и будут готовы к взаимодействию с новой молекулой субстрата.
Для описания действия ферментов во время катализа использовались разные модели.Наиболее распространенными моделями являются модель замка и ключа и модель индуцированной подгонки. В модели замка и ключа Эмиль Фишер постулировал, что ферменты и субстраты подобны замкам и ключам. Они идеально подходят друг другу. Это объясняет высокую специфичность ферментов к своему субстрату, потому что это означает, что фермент будет взаимодействовать только с определенным субстратом, который подходит к его активному сайту. Если субстрат и фермент не подходят, то никакой реакции не произойдет.
«Катализ. Взаимодействие с ферментным субстратом »Изображение создано Lecturio
В модели индуцированной подгонки фермент и субстрат взаимодействуют, образуя слабую ковалентную связь.Затем фермент претерпевает некоторые конформационные изменения, которые еще больше усиливают связывание. Затем реакция происходит до тех пор, пока не образуется продукт. Изменения в подтверждении ферментов снова произойдут, чтобы облегчить выпуск продуктов. Затем ферменты возвращаются в исходное состояние. Эта модель ферментного катализа может объяснить действие ингибиторов. Помимо активного центра фермента, существуют другие аллостерические сайты, к которым могут присоединяться другие молекулы. Ингибиторы могут действовать на эти аллостерические сайты, и, когда происходит изменение конформации, вход субстрата в активный сайт будет подавлен.
Транспортные белки
«Транспортные белки. Клеточные и органические »Изображение, созданное Lecturio
Другая важная функция белков — это транспортная среда для некоторых биомолекул. Транспортные белки — это белковые молекулы, которые служат для перемещения материалов в организме. Примерами транспортных белков являются липопротеины низкой и высокой плотности, гемоглобин и сывороточный альбумин. Липопротеины — это транспортные белки, отвечающие за перенос гидрофобных липидов.
Гемоглобин — это транспортный белок, отвечающий за транспортировку кислорода от легких к остальным частям тела. Альбумины являются белками-переносчиками стероидов, жирных кислот и гормона щитовидной железы. Другой тип транспортных белков — это мембранные транспортные белки. Они несут ответственность за движение ионов, небольших молекул или других макромолекул через биологическую мембрану. Они помогают в транспортировке за счет активного транспорта или облегченного распространения.
Транспорт кислорода
Два основных белка отвечают за транспорт молекул кислорода; это миоглобин и гемоглобин.Молекулы кислорода имеют разное сродство к этим двум типам белков. Миоглобин имеет более высокое сродство к O 2 даже при низкой концентрации O 2 . С другой стороны, гемоглобин имеет различную степень сродства O 2 в зависимости от концентрации O 2 .
«Транспорт кислорода. Гемоглобин и миоглобин »Изображение создано Lecturio
Между миоглобином и гемоглобином существует ряд структурных сходств; оба белка содержат атом Fe, где молекула O 2 может действовать как лиганд.Их главное отличие состоит в том, что миоглобин может вмещать только одну молекулу кислорода, в то время как гемоглобин может переносить до 4 молекул кислорода. Объяснение этому состоит в том, что гемоглобин переносит кислород из легких в мышцы, где находятся молекулы миоглобина. Когда они взаимодействуют, кислород будет передаваться молекулам миоглобина, которые будут передавать эту молекулу кислорода мышечным клеткам.
Na
+ / K + АТФаза
Na + / K + АТФаза — это фермент, образованный из двух мембраносвязанных полипептидов, которые служат насосом растворенных веществ для транспортировки ионов натрия из клеток при перекачивании ионов калия в клетки.Транспорт ионов происходит за счет градиента концентрации. Основной механизм действия этого транспортного белка включает связывание АТФ с помпой до того, как с ним также свяжутся 3 внутриклеточных иона Na + .
Затем
АТФ гидролизуется, что приводит к фосфорилированию и, в конечном итоге, высвобождению АДФ. Конформационные изменения приводят к открытию насоса наружу клеток, позволяя высвобождать ионы. Затем два внеклеточных иона K + связываются с помпой, вызывая дефосфорилирование помпы.Насос возвращается к своей исходной конфигурации и транспортирует K + внутрь клетки. Процесс повторяется для регулирования ионных условий внутри и снаружи клетки.
«Na / K АТФаза. Трансмембранный ионный транспорт »Изображение создано Lecturio
Протеом органелл — Атлас белков человека
Пространственное разделение биологических процессов — это фундаментальное явление для жизни, которое позволяет нескольким процессам происходить параллельно без нежелательного вмешательства.Органелла — это субъединица эукариотической клетки со специальной функцией. Название «органелла» происходит от аналогии между различными ролями органелл в клетках и различными ролями органов в организме человека в целом. Часто различают органеллы, связанные с мембраной, и органеллы, не связанные с мембраной. Связанные с мембраной органеллы, такие как ядро и аппарат Гольджи, имеют четко определенную физическую границу, которая разделяет внутри- и внеорганическое пространство. Напротив, органеллы, не связанные с мембраной, такие как цитоскелет и ядрышки, представляют собой пространственно различные сборки белков, а иногда и РНК внутри клетки.Мембранно или нет, это разделение создает особую среду в месте расположения органеллы, где концентрация различных молекул может быть адаптирована в соответствии с назначением органеллы, и предоставляет важную возможность для регуляции клеточных процессов. Поскольку точное определение органелл варьируется, более инклюзивные термины субклеточной структуры.
Основная функция белков — катализировать, проводить и контролировать клеточные процессы во времени и пространстве. Поскольку разные органеллы и субклеточные структуры предлагают разные среды, с различными физиологическими условиями и партнерами по взаимодействию, субклеточная локализация белка является важной частью функции белка.Следовательно, неправильная локализация белков часто была связана с клеточной дисфункцией и различными заболеваниями человека (Kau TR et al. (2004); Laurila K et al. (2009); Park S. et al. (2011)). Знание пространственного распределения белка на субклеточном уровне важно для понимания функции белка, взаимодействий и клеточных механизмов, а изучение того, как клетки генерируют и поддерживают свою пространственную организацию, является центральным для понимания механизмов живых клеток.
В клеточном атласе субклеточная локализация 12813 белков была сопоставлена на одноклеточном уровне с 35 субклеточными структурами, что позволило определить 13 основных протеомов органелл.Анализ показывает, что примерно половина белков локализуется в нескольких компартментах, и идентифицирует многие белки с одноклеточными вариациями с точки зрения обилия белка или пространственного распределения. Паттерн экспрессии и пространственное распределение белков человека во всех основных клеточных органеллах можно изучить в этих интерактивных разделах знаний, которые включают многочисленные каталоги белков со специфическими и схожими паттернами экспрессии, а также примеры изображений, иллюстрирующие различные паттерны внутриклеточного пространственного распределения.
Субклеточная локализация белков
Описано несколько подходов к систематическому анализу локализации белков. Количественные масс-спектрометрические данные позволяют идентифицировать белки со сходными профилями распределения по градиентам фракционирования (Park S et al. (2011); Christoforou A et al. (2016); Itzhak DN et al. (2016)) или ферментно-опосредованную близость. меченые белки в клетках (Itzhak DN et al. (2016); Roux KJ et al. (2012); Lee SY et al. (2016)). Напротив, подходы, основанные на визуализации, позволяют исследовать субклеточное распределение белков in situ в отдельных клетках и имеют преимущество в том, что они эффективно идентифицируют изменчивость отдельных клеток и локализацию в нескольких органеллах.Подходы на основе визуализации могут быть выполнены с использованием меченых белков (Huh WK et al. (2003); Simpson JC et al. (2000); Stadler C et al. (2013)) или аффинных реагентов.
В Cell Atlas мы используем подход, основанный на иммунофлуоресценции (IF), в сочетании с конфокальной микроскопией, чтобы обеспечить исследование пространственного распределения белков с высоким разрешением (Thul PJ et al. (2017); Stadler C et al. (2013); Барбе Л. и др. (2008); Штадлер С. и др. (2010); Фагерберг Л. и др. (2011)). С ограниченным дифракцией разрешением около 200 нм иммунофлуоресцентное изображение из Cell Atlas дает подробное представление о клеточной организации.Пространственное распределение белка исследуют с использованием непрямого IF в клеточной линии U-2 OS и до двух дополнительных клеточных линий, выбранных на основе экспрессии мРНК соответствующего гена, с использованием панели из 35 клеточных линий. Интересующий белок отображается зеленым цветом, а контрольные маркеры для микротрубочек (красный), эндоплазматического ретикулума (желтый) и ядра (синий) используются для обозначения клетки. От маленьких точек, таких как ядерные тельца, до более крупных структур, таких как нуклеоплазма, различные узоры на изображениях вместе с контрольными маркерами позволяют точно определить пространственное распределение белка в клетке.Локализация каждого белка назначается одной или нескольким из 35 субклеточных структур и субструктур, которые в настоящее время аннотированы в Cell Atlas, как показано на рисунке 1.
Нуклеоплазма
Ядерные крапинки
Ядерные тела
Ядрышки
Фибриллярный центр ядрышек
Ободок ядрышек
Митотическая хромосома
Кинетохора
Ядерная мембрана
Цитозоль
Цитоплазматические тела
Жезлы и Кольца
Агрессивный
Митохондрии
Центросома
Центриолярные спутники
Микротрубочки
Концы микротрубочек
Митотическое веретено
Цитокинетический мост
Midbody
Кольцо Midbody
Борозда спайности
Промежуточные волокна
Актиновые нити
Места очагового спайки
Эндоплазматическая сеть
аппарат Гольджи
Везикулы
Эндосомы
Лизосомы
Липидные капли
Пероксисомы
Плазматическая мембрана
Клеточные соединения
Рисунок 1.Пример конфокальных иммунофлуоресцентных изображений различных белков (зеленый цвет), локализованных в каждой из субклеточных органелл и субструктур, аннотированных в настоящее время в Атласе клеток в репрезентативном наборе клеточных линий. Микротрубочки помечаются антителами против тубулина (красный), а ядро окрашивается DAPI (синий). Сторона изображения составляет 64 мкм. Для получения дополнительных примеров изображений и деталей, описывающих все 35 шаблонов, аннотированных в Cell Atlas, см. Cell Dictionary.
Распределение белков в клетке человека
Рисунок 2 показывает распределение органелл всех аннотаций для белков 12813, локализованных по крайней мере в одной структуре или субструктуре.Участок отсортирован по мета-компартментам: цитоплазма, ядро и секреторный аппарат соответственно. Большинство белков находится в ядре, за ними следуют цитозоль и везикулы, которые состоят из транспортных пузырьков, а также небольших мембраносвязанных органелл, таких как эндосомы или пероксисомы. 55% (n = 7 · 106) белков были обнаружены более чем в одном месте (мультилокализирующие белки), а 25% (n = 3141) показали одноклеточную вариацию уровня экспрессии или пространственного распределения.
Рисунок 2.Гистограмма, показывающая распределение белков, обнаруженных в каждой органелле, структуре и субструктуре, аннотированных в Атласе клеток.
Проверка антител и данных о местоположении для Cell Atlas
Качество и использование антител в исследованиях часто обсуждаются (Baker M & period; (2015)). Поскольку связывание антитела с мишенью может привести к ложноположительным результатам, Cell Atlas пытается вручную подсчитать все результаты относительно надежности окрашивания. В Атласе клеток представлена оценка надежности для каждого аннотированного местоположения по четырехбалльной шкале: улучшенная, поддерживаемая, одобренная и неопределенная, как подробно описано в разделе «Анализ и аннотации».Улучшенные местоположения получены посредством валидации антител в соответствии с одним из «столпов» валидации, предложенных международной рабочей группой (Uhlen M et al. (2016): (i) генетические методы с использованием сайленсинга siRNA (Stadler C et al. (2012) ) или нокаут CRISPR / Cas9, (ii) экспрессия флуоресцентного белка, меченного белком, на эндогенных уровнях (Skogs M et al. (2017)) или (iii) независимые антитела, нацеленные на разные эпитопы (Stadler C et al. (2010) Поддерживаемое местоположение соответствует внешним экспериментальным данным (база данных UniProt), в то время как оценка утвержденного местоположения указывает на отсутствие внешней экспериментальной информации для подтверждения наблюдаемого местоположения.Неопределенное местоположение противоречит дополнительной информации, такой как данные литературы или транскриптомики, и показано, если нельзя исключить, что данные верны, и необходимы дальнейшие эксперименты для установления надежности окрашивания антител. Распределение оценок надежности для локализованных белков показано на рисунке 3. Приблизительно 43% (n = 5502) предоставленных локализаций белков улучшены или поддерживаются. В таблице 1 подробно описано распределение всех локализованных белков в органеллах и распределение оценок надежности на основе отдельных органелл.
Рис. 3. Круговая диаграмма, показывающая уровень надежности локализованных белков, где каждая часть представляет собой количество белков с одним типом оценки из четырех оценок надежности: Повышенная, Поддерживаемая, Одобренная и Неопределенная.
Таблица 1. Таблица, показывающая количество белков, локализованных в каждой органелле, структуре и субструктуре в Атласе клеток, а также распределение оценок надежности.
Соответствующие ссылки и публикации
Парих К. и др., Разнообразие эпителиальных клеток толстой кишки при здоровье и воспалительном заболевании кишечника и периоде; Природа и период; (2019)
PubMed: 30814735 DOI: 10.1038 / s41586-019-0992-y
Menon M et al., Одноклеточный транскриптомный атлас сетчатки глаза человека определяет типы клеток, связанные с возрастной дегенерацией желтого пятна & period; Nat Commun & period; (2019)
PubMed: 31653841 DOI: 10.1038 / s41467-019-12780-8
Wang L et al., Одноклеточная реконструкция сердца взрослого человека во время сердечной недостаточности и восстановления выявляет клеточный ландшафт, лежащий в основе сердечной функции и периода; Nat Cell Biol & period; (2020)
PubMed: 313 DOI: 10.1038 / s41556-019-0446-7
Wang Y et al., Анализ одноклеточного транскриптома показывает различные функции абсорбции питательных веществ в кишечнике человека & period; J Exp Med & period; (2020)
PubMed: 31753849 DOI: 10.1084 / jem.201
Liao J et al., Секвенирование одноклеточной РНК почек человека & период; Научные данные и период; (2020)
PubMed: 31896769 DOI: 10.1038 / s41597-019-0351-8
MacParland SA et al., Секвенирование одноклеточной РНК печени человека выявляет различные внутрипеченочные популяции макрофагов & period; Nat Commun & period; (2018)
PubMed: 30348985 DOI: 10.1038 / s41467-018-06318-7
Vieira Braga FA et al., Перепись клеток легких человека выявляет новые состояния клеток при здоровье и астме и периоде; Nat Med & period; (2019)
PubMed: 31209336 DOI: 10.1038 / s41591-019-0468-5
Vento-Tormo R et al., Одноклеточная реконструкция раннего взаимодействия матери и плода у людей и период; Природа и период; (2018)
PubMed: 30429548 DOI: 10.1038 / s41586-018-0698-6
Qadir MMF et al., Анализ одноклеточного разрешения ниши клеток-предшественников протоков поджелудочной железы человека & период; Proc Natl Acad Sci U S A & period; (2020)
PubMed: 32354994 DOI: 10.1073 / pnas.14117
Solé-Boldo L et al., Одноклеточные транскриптомы кожи человека показывают возрастную потерю прайминга фибробластов & период; Commun Biol & period; (2020)
PubMed: 32327715 DOI: 10.1038 / s42003-020-0922-4
Henry GH et al., A Клеточная анатомия простаты и уретры простаты взрослого человека & period; Cell Rep & period; (2018)
PubMed: 30566875 DOI: 10.1016 / j.celrep.2018.11.086
Chen J et al., Фиксация и обработка PBMC для секвенирования одноклеточной РНК хрома & период; J Transl Med & period; (2018)
PubMed: 30016977 DOI: 10.1186 / s12967-018-1578-4
Guo J et al., Атлас транскрипционных клеток семенников взрослого человека. Cell Res. (2018)
PubMed: 30315278 DOI: 10.1038 / s41422-018-0099-2
Uhlen M. et al., Предложение по валидации антител. Нат. Методы. (2016)
PubMed: 27595404 DOI: 10.1038 / nmeth.3995
Stadler C et al., Систематическая проверка связывания антител и субклеточной локализации белков с использованием миРНК и конфокальной микроскопии. Дж. Протеомика. (2012)
PubMed: 22361696 DOI: 10.1016 / j.jprot.2012.01.030
Poser I et al., BAC TransgeneOmics & Colon; высокопроизводительный метод исследования функции белков у млекопитающих и периода; Nat Методы и период; (2008)
PubMed: 183 DOI: 10.1038 / nmeth.1199
Skogs M et al., Валидация антител в приложениях биоимиджинга на основе эндогенной экспрессии меченых белков. J Proteome Res. (2017)
PubMed: 27723985 DOI: 10.1021 / acs.jproteome.6b00821
Takahashi H et al., 5 ‘центрированное по концам профилирование экспрессии с использованием экспрессии генов cap-анализа и секвенирования следующего поколения & period; Nat Protoc & period; (2012)
PubMed: 22362160 DOI: 10.1038 / nprot.2012.005
Lein ES et al., Полногеномный атлас экспрессии генов в мозге взрослой мыши & period; Природа и период; (2007)
PubMed: 17151600 DOI: 10.1038 / nature05453
Kircher M et al., Двойное индексирование устраняет неточности в мультиплексном секвенировании на платформе Illumina и период; Nucleic Acids Res & period; (2012)
PubMed: 22021376 DOI: 10.1093 / nar / gkr771
Pollard TD et al., Actin & comma; центральный игрок в форме клетки, движении и периоде; Наука и период; (2009)
PubMed: 19965462 DOI: 10.1126 / science.1175862
Mitchison TJ et al., Подвижность клеток на основе актина и перемещение клеток и период; Ячейка и период; (1996)
PubMed: 8608590
Pollard TD et al., Молекулярный механизм цитокинеза & период; Annu Rev Biochem & period; (2019)
PubMed: 30649923 DOI: 10.1146 / annurev-biochem-062917-012530
dos Remedios CG et al., Актин-связывающие белки и толстая кишка; регуляция цитоскелетных микрофиламентов и периода; Physiol Rev & period; (2003)
PubMed: 12663865 DOI: 10.1152 / Physrev.00026.2002
Campellone KG et al., Гонка вооружений нуклеаторов и двоеточие; клеточный контроль сборки актина и периода; Nat Rev Mol Cell Biol & period; (2010)
PubMed: 20237478 DOI: 10.1038 / nrm2867
Rottner K et al., Краткий обзор механизмов сборки актина и период; J Cell Sci & period; (2017)
PubMed: 257 DOI: 10.1242 / jcs.206433
Bird RP & period ;, Наблюдение и количественная оценка аберрантных крипт в толстой кишке мыши, обработанной канцерогеном толстой кишки & col; предварительные выводы и период; Рак Lett & period; (1987)
PubMed: 3677050 DOI: 10.1016 / 0304-3835 (87)
-1
HUXLEY AF et al., Структурные изменения в мышцах во время сокращения & semi; интерференционная микроскопия живых мышечных волокон и периода; Природа и период; (1954)
PubMed: 13165697
HUXLEY H et al., Изменения поперечных полос мышц во время сокращения и растяжения и их структурная интерпретация и период; Природа и период; (1954)
PubMed: 13165698
Svitkina T & period ;, Актиновый цитоскелет и подвижность на основе актина & период; Cold Spring Harb Perspect Biol & period; (2018)
PubMed: 29295889 DOI: 10.1101 / cshperspect.a018267
Kelpsch DJ et al., Nuclear Actin & Colon; От открытия до функции и периода; Анат Рек & lpar; Хобокен & rpar; & period; (2018)
PubMed: 30312531 DOI: 10.1002 / ar.23959
Malumbres M et al., Клеточный цикл и запятая; CDK и рак и толстая кишка; меняющаяся парадигма и период; Nat Rev Рак и период; (2009)
PubMed: 19238148 DOI: 10.1038 / nrc2602
Massagué J & period ;, G1 контроль клеточного цикла и рак & период; Природа и период; (2004)
PubMed: 15549091 DOI: 10.1038 / nature03094
Hartwell LH et al., Контроль клеточного цикла и рак & период; Наука и период; (1994)
PubMed: 7997877 DOI: 10.1126 / science.7997877
Barnum KJ et al., Регулирование клеточного цикла с помощью контрольных точек и периода; Методы Mol Biol & period; (2014)
PubMed: 247 DOI: 10.1007 / 978-1-4939-0888-2_2
Weinberg RA & period ;, Белок ретинобластомы и контроль клеточного цикла & период; Ячейка и период; (1995)
PubMed: 7736585 DOI: 10.1016 / 0092-8674 (95)
-2
Morgan DO & period;, Принципы регулирования CDK и период; Природа и период; (1995)
PubMed: 7877684 DOI: 10.1038 / 374131a0
Teixeira LK et al., Убиквитин-лигазы и контроль клеточного цикла & период; Annu Rev Biochem & period; (2013)
PubMed: 23495935 DOI: 10.1146 / annurev-biochem-060410-105307
King RW et al., Как протеолиз управляет клеточным циклом и периодом; Наука и период; (1996)
PubMed: 8939846 DOI: 10.1126 / science.274.5293.1652
Cho RJ et al., Регуляция транскрипции и функция во время клеточного цикла человека & период; Нат Генет и период; (2001)
PubMed: 11137997 DOI: 10.1038 / 83751
Whitfield ML et al., Идентификация генов, периодически экспрессируемых в клеточном цикле человека, и их экспрессия в опухолях & период; Mol Biol Cell & period; (2002)
PubMed: 12058064 DOI: 10.1091 / mbc.02-02-0030.
Boström J et al., Сравнительная транскриптомика клеточного цикла выявляет синхронизацию сетей онтогенетических факторов транскрипции в раковых клетках. PLoS One. (2017)
PubMed: 29228002 DOI: 10.1371 / journal.pone.0188772
Lane KR et al., Изменения содержания белка, регулируемого клеточным циклом, в синхронно пролиферирующих клетках HeLa включают регуляцию белков сплайсинга пре-мРНК & period; PLoS One & period; (2013)
PubMed: 23520512 DOI: 10.1371 / journal.pone.0058456
Ohta S et al., Белковый состав митотических хромосом, определенный с использованием мультиклассификатора комбинаторной протеомики и периода; Ячейка и период; (2010)
PubMed: 20813266 DOI: 10.1016 / j.cell.2010.07.047
Ly T et al., Протеомная хронология экспрессии генов через клеточный цикл в клетках миелоидного лейкоза человека & период; Элиф и период; (2014)
PubMed: 24596151 DOI: 10.7554 / eLife.01630
Pagliuca FW et al., Количественная протеомика раскрывает основу биохимической специфичности механизма клеточного цикла и периода; Mol Cell & period; (2011)
PubMed: 21816347 DOI: 10.1016 / j.molcel.2011.05.031
Ly T et al., Протеомный анализ ответа на остановку клеточного цикла в клетках миелоидного лейкоза человека & период; Элиф и период; (2015)
PubMed: 25555159 DOI: 10.7554 / eLife.04534
Dueck H et al., Вариация — это функция & двоеточие; Функционально ли важны различия отдельных клеток & quest; & col; Проверка гипотезы о том, что для агрегированной функции & period; Биологические исследования и период; (2016)
PubMed: 26625861 DOI: 10.1002 / bies.201500124
Snijder B et al., Происхождение регулируемой межклеточной изменчивости & период; Nat Rev Mol Cell Biol & period; (2011)
PubMed: 21224886 DOI: 10.1038 / nrm3044
Thul PJ et al., Субклеточная карта протеома человека. Наука. (2017)
PubMed: 28495876 DOI: 10.1126 / science.aal3321
Cooper S et al., Анализ содержания циклинов A & comma с мембранной элюцией; B1 & запятая; и E во время невозмущенного клеточного цикла & period; Ячейка Div & период; (2007)
PubMed: 17892542 DOI: 10.1186 / 1747-1028-2-28
Davis PK et al., Биологические методы синхронизации клеточного цикла клеток млекопитающих & период; Биотехнологии и период; (2001)
PubMed: 11414226 DOI: 10.2144 / 01306rv01
Domenighetti G et al., Влияние информационной кампании в СМИ на частоту и период гистерэктомии; Ланцет и точка; (1988)
PubMed: 21 DOI: 10.1016 / s0140-6736 (88) -9
Scialdone A et al., Вычислительное отнесение стадии клеточного цикла к данным транскриптома одиночной клетки & период; Методы и период; (2015)
PubMed: 26142758 DOI: 10.1016 / j.ymeth.2015.06.021
Sakaue-Sawano A et al., Визуализация пространственно-временной динамики развития многоклеточного клеточного цикла и периода; Ячейка и период; (2008)
PubMed: 18267078 DOI: 10.1016 / j.cell.2007.12.033
Grant GD et al., Идентификация генов, регулируемых клеточным циклом, периодически экспрессируемых в клетках U2OS, и их регуляция факторами транскрипции FOXM1 и E2F & period; Mol Biol Cell & period; (2013)
PubMed: 24109597 DOI: 10.1091 / mbc.E13-05-0264
Semple JW et al., Существенная роль Orc6 в репликации ДНК посредством поддержания пререпликативных комплексов & период; EMBO J & период; (2006)
PubMed: 17053779 DOI: 10.1038 / sj.emboj.7601391
Kilfoil ML et al., Стохастическая вариация и двоеточие; от одиночных клеток до суперорганизмов & период; HFSP J & период; (2009)
PubMed: 20514130 DOI: 10.2976 / 1.3223356
Ansel J et al., Стохастическая изменчивость экспрессии генов от клетки к клетке является сложным генетическим признаком & период; PLoS Genet & period; (2008)
PubMed: 18404214 DOI: 10.1371 / journal.pgen.1000049
Colman-Lerner A et al., Регулируемая межклеточная изменчивость в системе решения клеточной судьбы & период; Природа и период; (2005)
PubMed: 16170311 DOI: 10.1038 / nature03998
Liberali P et al., Одноклеточные и многомерные подходы к скринингу генетических возмущений & период; Nat Rev Genet & period; (2015)
PubMed: 25446316 DOI: 10.1038 / nrg3768
Elowitz MB et al., Стохастическая экспрессия гена в одной клетке & период; Наука и период; (2002)
PubMed: 12183631 DOI: 10.1126 / science.1070919
Kaern M et al., Стохастичность в экспрессии генов и толстой кишки; от теорий к фенотипам и периоду; Nat Rev Genet & period; (2005)
PubMed: 15883588 DOI: 10.1038 / nrg1615
Bianconi E et al., Оценка количества клеток в организме человека & период; Ann Hum Biol & period; (2013)
PubMed: 23829164 DOI: 10.3109 / 03014460.2013.807878
Malumbres M & period;, Циклинзависимые киназы & период; Биология генома & период; (2014)
PubMed: 25180339
Collins K et al., Клеточный цикл и рак & период; Proc Natl Acad Sci U S A & period; (1997)
PubMed:
91
Животовский Б. и др., Клеточный цикл и гибель клеток при заболевании и толстой кишке; прошедшее & запятая; настоящее и будущее и период; J Intern Med & period; (2010)
PubMed: 20964732 DOI: 10.1111 / j.1365-2796.2010.02282.x
Cho RJ et al., Полногеномный транскрипционный анализ митотического клеточного цикла и периода; Mol Cell & period; (1998)
PubMed: 9702192
Spellman PT et al., Всесторонняя идентификация регулируемых клеточным циклом генов дрожжей Saccharomyces cerevisiae с помощью гибридизации на микрочипах и период; Mol Biol Cell & period; (1998)
PubMed: 9843569
Orlando DA et al., Глобальный контроль транскрипции клеточного цикла с помощью связанных генераторов CDK и сети & period; Природа и период; (2008)
PubMed: 18463633 DOI: 10.1038 / nature06955
Rustici G et al., Программа периодической экспрессии генов клеточного цикла делящихся дрожжей и период; Нат Генет и период; (2004)
PubMed: 15195092 DOI: 10.1038 / ng1377
Uhlén M. et al., Тканевая карта протеома человека. Наука (2015)
PubMed: 25613900 DOI: 10.1126 / science.1260419
Nigg EA et al., Цикл центросомы и толстая кишка; Биогенез центриолей & запятая; дублирование и врожденная асимметрия и период; Nat Cell Biol & period; (2011)
PubMed: 21968988 DOI: 10.1038 / ncb2345
Doxsey S & period ;, Повторная оценка функции и периода центросомы; Nat Rev Mol Cell Biol & period; (2001)
PubMed: 11533726 DOI: 10.1038 / 35089575
Bornens M & period;, Состав центросом и механизмы закрепления микротрубочек и период; Curr Opin Cell Biol & period; (2002)
PubMed: 11792541
Conduit PT et al., Функция и сборка центросом в клетках животных & период; Nat Rev Mol Cell Biol & period; (2015)
PubMed: 26373263 DOI: 10.1038 / nrm4062
Tollenaere MA et al., Центриолярные спутники и толстая кишка; ключевые медиаторы функций и периода центросом; Cell Mol Life Sci & period; (2015)
PubMed: 25173771 DOI: 10.1007 / s00018-014-1711-3
Prosser SL et al., Центриолярный сателлитный биогенез и функция в клетках позвоночных и период; J Cell Sci & period; (2020)
PubMed: 31896603 DOI: 10.1242 / jcs.239566
Rieder CL et al., Центросома позвоночных и толстой кишки; больше, чем центр организации микротрубочек и период; Trends Cell Biol & period; (2001)
PubMed: 11567874
Badano JL et al., Центросома в генетических заболеваниях человека & период; Nat Rev Genet & period; (2005)
PubMed: 15738963 DOI: 10.1038 / nrg1557
Clegg JS & period ;, Свойства и метаболизм водной цитоплазмы и ее границы & период; Am J Physiol & period; (1984)
PubMed: 6364846
Luby-Phelps K & period ;, Физическая химия цитоплазмы и ее влияние на функцию клеток & толстой кишки; обновление & период; Mol Biol Cell & period; (2013)
PubMed: 23989722 DOI: 10.1091 / mbc.E12-08-0617
Luby-Phelps K & period;, Цитоархитектура и физические свойства цитоплазмы и толстой кишки; объем и запятая; вязкость и запятая; диффузия и запятая; площадь и период внутриклеточной поверхности; Int Rev Cytol & period; (2000)
PubMed: 10553280
Ellis RJ & period;, Макромолекулярная скученность и толстая кишка; очевидный, но недооцененный & период; Trends Biochem Sci & period; (2001)
PubMed: 115
Bright GR et al., Флуоресцентная микроскопия изображения отношения & двоеточия; временные и пространственные измерения цитоплазматического pH и периода; J Cell Biol & period; (1987)
PubMed: 3558476
Kopito RR & period;, Aggresomes & comma; тельца включения и агрегация белков и период; Trends Cell Biol & period; (2000)
PubMed: 11121744
Aizer A et al., Внутриклеточное перемещение и динамика P-телец и период; Прион и период; (2008)
PubMed: 19242093
Carcamo WC et al., Молекулярная клеточная биология и иммунобиология стержневых и кольцевых структур и периода млекопитающих; Int Rev Cell Mol Biol & period; (2014)
PubMed: 24411169 DOI: 10.1016 / B978-0-12-800097-7.00002-6
Lang F & period ;, Механизмы и значение регулирования объема клеток & период; J Am Coll Nutr & period; (2007)
PubMed: 17921474
Schwarz DS et al., Эндоплазматический ретикулум и толстая кишка; структура и запятая; функция и ответ на сотовую сигнализацию & период; Cell Mol Life Sci & period; (2016)
PubMed: 26433683 DOI: 10.1007 / s00018-015-2052-6
Friedman JR et al., ER в 3D и двоеточие; многофункциональная динамическая мембранная сеть & период; Trends Cell Biol & period; (2011)
PubMed: 21
9 DOI: 10.1016 / j.tcb.2011.07.004
Travers KJ et al., Функциональный и геномный анализ выявляет существенную координацию между развернутым белковым ответом и ER-ассоциированной деградацией & период; Ячейка и период; (2000)
PubMed: 10847680
Roussel BD et al., Дисфункция эндоплазматического ретикулума при неврологических заболеваниях и периоде; Ланцет Neurol & период; (2013)
PubMed: 23237905 DOI: 10.1016 / S1474-4422 (12) 70238-7
Neve EP et al., Белки цитохрома P450 и толстая кишка; удержание и распространение из эндоплазматической сети и периода; Curr Opin Drug Discov Devel & period; (2010)
PubMed: 20047148
Kulkarni-Gosavi P et al., Форма и функция аппарата Гольджи и толстой кишки; строительные леса и запятая; цитоскелет и передача сигналов и период; FEBS Lett & period; (2019)
PubMed: 31378930 DOI: 10.1002 / 1873-3468.13567
Short B et al., Аппарат Гольджи и период; Curr Biol & period; (2000)
PubMed: 10985372 DOI: 10.1016 / s0960-9822 (00) 00644-8
Wei JH et al., Распутывая ленту Гольджи и период; Трафик и период; (2010)
PubMed: 21040294 DOI: 10.1111 / j.1600-0854.2010.01114.x
Wilson C et al., Аппарат Гольджи и толстая кишка; органелла с множеством сложных функций & период; Biochem J & period; (2011)
PubMed: 21158737 DOI: 10.1042 / BJ20101058
Farquhar MG et al., Аппарат Гольджи и толстая кишка; 100 лет прогресса, противоречий и периода; Trends Cell Biol & period; (1998)
PubMed: 9695800
Brandizzi F et al., Организация интерфейса ER-Golgi для мембранного управления трафиком & период; Nat Rev Mol Cell Biol & period; (2013)
PubMed: 23698585 DOI: 10.1038 / nrm3588
Potelle S et al., Посттрансляционные модификации Гольджи и связанные с ними заболевания & период; J Наследовать Metab Dis & period; (2015)
PubMed: 25967285 DOI: 10.1007 / s10545-015-9851-7
Leduc C et al., Промежуточные филаменты в миграции и инвазии клеток & толстой кишки; необычные подозреваемые и период; Curr Opin Cell Biol & period; (2015)
PubMed: 25660489 DOI: 10.1016 / j.ceb.2015.01.005
Лоури Дж. И др., Промежуточные волокна играют ключевую роль в регулировании архитектуры и функции клеток & период; J Biol Chem & period; (2015)
PubMed: 25957409 DOI: 10.1074 / jbc.R115.640359
Роберт А. и др., Динамика промежуточных волокон и толстой кишки; Что мы видим сейчас и почему это важно & period; Биологические исследования и период; (2016)
PubMed: 26763143 DOI: 10.1002 / bies.201500142
Fuchs E et al., Промежуточные волокна и толстая кишка; структура и запятая; динамика и запятая; функция & запятая; и болезнь и период; Annu Rev Biochem & period; (1994)
PubMed: 7979242 DOI: 10.1146 / annurev.bi.63.070194.002021
Janmey PA et al., Вязкоупругие свойства виментина по сравнению с другими нитевидными биополимерными сетками & период; J Cell Biol & period; (1991)
PubMed: 2007620
Köster S et al., Механика промежуточных волокон in vitro и в клетке и толстой кишке; от спиральных катушек до нитей и запятой; волокна и сети и период; Curr Opin Cell Biol & period; (2015)
PubMed: 25621895 DOI: 10.1016 / j.ceb.2015.01.001
Herrmann H et al., Промежуточные волокна и толстая кишка; от клеточной архитектуры до наномеханики и периода; Nat Rev Mol Cell Biol & period; (2007)
PubMed: 17551517 DOI: 10.1038 / nrm2197
Gauster M et al., Кератины в трофобласте человека и период; Histol Histopathol & period; (2013)
PubMed: 23450430 DOI: 10.14670 / HH-28.817
Janke C & period ;, Код тубулина и двоеточие; молекулярные компоненты и запятая; механизмы считывания и запятая; и функции & период; J Cell Biol & period; (2014)
PubMed: 25135932 DOI: 10.1083 / jcb.201406055
Goodson HV et al., Микротрубочки и ассоциированные с микротрубочками белки & period; Cold Spring Harb Perspect Biol & period; (2018)
PubMed: 29858272 DOI: 10.1101 / cshperspect.a022608
Wade RH & period ;, На и вокруг микротрубочек и толстой кишки; обзор и период; Mol Biotechnol & period; (2009)
PubMed: 19565362 DOI: 10.1007 / s12033-009-9193-5
Desai A et al., Динамика и период полимеризации микротрубочек; Annu Rev Cell Dev Biol & period; (1997)
PubMed: 9442869 DOI: 10.1146 / annurev.cellbio.13.1.83
Conde C et al., Сборка микротрубочек и запятая; организация и динамика в аксонах и дендритах и периоде; Nat Rev Neurosci & period; (2009)
PubMed: 19377501 DOI: 10.1038 / nrn2631
Wloga D et al., Посттрансляционные модификации микротрубочек & период; J Cell Sci & period; (2010)
PubMed: 20930140 DOI: 10.1242 / jcs.063727
Schmoranzer J et al., Роль микротрубочек в слиянии пост-везикул Гольджи с плазматической мембраной & period; Mol Biol Cell & period; (2003)
PubMed: 12686609 DOI: 10.1091 / mbc.E02-08-0500
Skop AR et al., Диссекция протеома среднего тела млекопитающего выявляет механизмы и период консервативного цитокинеза; Наука и период; (2004)
PubMed: 15166316 DOI: 10.1126 / science.1097931
Waters AM et al., Цилиопатии и толстая кишка; расширяющийся спектр болезней и период; Педиатр Нефрол и период; (2011)
PubMed: 21210154 DOI: 10.1007 / s00467-010-1731-7
Matamoros AJ et al., Микротрубочки в здоровье и дегенеративных заболеваниях нервной системы & период; Brain Res Bull & period; (2016)
PubMed: 27365230 DOI: 10.1016 / j.brainresbull.2016.06.016
Jordan MA et al., Микротрубочки как мишень для противоопухолевых препаратов & период; Nat Rev Рак и период; (2004)
PubMed: 15057285 DOI: 10.1038 / nrc1317
Nunnari J et al., Митохондрии и толстая кишка; в болезни и в здоровье и периоде; Ячейка и период; (2012)
PubMed: 22424226 DOI: 10.1016 / j.cell.2012.02.035
Friedman JR et al., Форма и функция и период митохондрий; Природа и период; (2014)
PubMed: 24429632 DOI: 10.1038 / nature12985
Calvo SE et al., Митохондриальный протеом и болезнь человека и период; Annu Rev Genomics Hum Genet & period; (2010)
PubMed: 206 DOI: 10.1146 / annurev-genom-082509-141720
McBride HM et al., Митохондрии и толстая кишка; больше, чем просто электростанция и период; Curr Biol & period; (2006)
PubMed: 16860735 DOI: 10.1016 / j.cub.2006.06.054
Schaefer AM et al., Эпидемиология митохондриальных нарушений — прошлое & запятая; настоящее и будущее и период; Biochim Biophys Acta & period; (2004)
PubMed: 15576042 DOI: 10.1016 / j.bbabio.2004.09.005
Lange A et al., Классические сигналы ядерной локализации & двоеточие; определение & запятая; функция & запятая; и взаимодействие с importin alpha & period; J Biol Chem & period; (2007)
PubMed: 17170104 DOI: 10.1074 / jbc.R600026200
Ашмарина Л.И. и др., 3-гидрокси-3-метилглутарил-кофермент А лиаза & толстая кишка; нацеливание и процессинг в пероксисомах и митохондриях & период; J Lipid Res & period; (1999)
PubMed: 9869651
Wang SC et al., Ядерная транслокация рецепторов тирозинкиназы мембранных рецепторов эпидермального фактора роста & период; Clin Cancer Res & period; (2009)
PubMed: 19861462 DOI: 10.1158 / 1078-0432.CCR-08-2813
Jeffery CJ & period ;, Moonlighting Protein & period; Trends Biochem Sci & period; (1999)
PubMed: 10087914
Jeffery CJ & period ;, Зачем изучать подрабатывающие белки и поиски; Front Genet & period; (2015)
PubMed: 26150826 DOI: 10.3389 / fgene.2015.00211
Pancholi V & period ;, Многофункциональная альфа-енолаза & толстая кишка; его роль в болезнях и периоде; Cell Mol Life Sci & period; (2001)
PubMed: 11497239 DOI: 10.1007 / pl00000910
Chapple CE et al., Экстремальные многофункциональные белки, идентифицированные из сети взаимодействия белков человека & период; Nat Commun & period; (2015)
PubMed: 26054620 DOI: 10.1038 / ncomms8412
Dechat T. et al., Ядерные ламины и толстая кишка; основные факторы структурной организации и функции ядра и хроматина & период; Genes Dev & period; (2008)
PubMed: 18381888 DOI: 10.1101 / gad.1652708
Gruenbaum Y et al., Ядерная пластинка достигает возраста и периода; Nat Rev Mol Cell Biol & period; (2005)
PubMed: 15688064 DOI: 10.1038 / nrm1550
Stuurman N. et al., Ядерные ламины и толстая кишка; их структура и запятая; сборка и запятая; и взаимодействия & период; J Struct Biol & period; (1998)
PubMed: 9724605 DOI: 10.1006 / jsbi.1998.3987
Paine PL et al., Проницаемость ядерной оболочки и период; Природа и период; (1975)
PubMed: 1117994
Reichelt R et al., Корреляция между структурой и массовым распределением ядерного порового комплекса и отдельных компонентов порового комплекса & период; J Cell Biol & period; (1990)
PubMed: 2324201
CALLAN HG et al., Экспериментальные исследования ядер и периодов ооцитов амфибий; Я & период; Исследование структуры ядерной мембраны с помощью электронного микроскопа & period; Proc R Soc Lond B Biol Sci & period; (1950)
PubMed: 14786306
WATSON ML & period ;, Ядерная оболочка & semi; его структура и отношение к цитоплазматическим мембранам & период; J Biophys Biochem Cytol & period; (1955)
PubMed: 13242591
BAHR GF et al., Тонкая структура ядерной мембраны личиночной слюнной железы и средней кишки Chironomus & period; Exp Cell Res & period; (1954)
PubMed: 13173504
Terasaki M et al., Новая модель разрушения ядерной оболочки и периода; Mol Biol Cell & period; (2001)
PubMed: 11179431
Dultz E et al., Систематический кинетический анализ митотической разборки и повторной сборки ядерной поры в живых клетках & период; J Cell Biol & period; (2008)
PubMed: 18316408 DOI: 10.1083 / jcb.200707026
Salina D et al., Цитоплазматический динеин как посредник разрушения ядерной оболочки и периода; Ячейка и период; (2002)
PubMed: 11792324
Beaudouin J et al., Разрушение ядерной оболочки происходит в результате вызванного микротрубочками разрыва пластинки & период; Ячейка и период; (2002)
PubMed: 11792323
Gerace L et al., Пластинка ядерной оболочки обратимо деполимеризуется во время митоза & период; Ячейка и период; (1980)
PubMed: 7357605
Ellenberg J et al., Динамика ядерной мембраны и повторная сборка в живых клетках & толстой кишке; нацеливание на белок внутренней ядерной мембраны в интерфазе и митозе & периоде; J Cell Biol & period; (1997)
PubMed: 9298976
Yang L et al., Интегральные мембранные белки ядерной оболочки рассредоточены по эндоплазматическому ретикулуму во время митоза & период; J Cell Biol & period; (1997)
PubMed: 56
Bione S et al., Идентификация нового Х-сцепленного гена, ответственного за мышечную дистрофию Эмери-Дрейфуса и период; Нат Генет и период; (1994)
PubMed: 7894480 DOI: 10.1038 / ng1294-323
Boisvert FM et al., Многофункциональное ядрышко и период; Nat Rev Mol Cell Biol & period; (2007)
PubMed: 17519961 DOI: 10.1038 / nrm2184
Scheer U et al., Структура и функция ядрышка и период; Curr Opin Cell Biol & period; (1999)
PubMed: 10395554 DOI: 10.1016 / S0955-0674 (99) 80054-4
Németh A et al., Организация генома в ядрышке и вокруг него & период; Тенденции Genet & period; (2011)
PubMed: 21295884 DOI: 10.1016 / j.tig.2011.01.002
Cuylen S et al., Ki-67 действует как биологическое поверхностно-активное вещество для диспергирования митотических хромосом и периода; Природа и период; (2016)
PubMed: 27362226 DOI: 10.1038 / nature18610
Stenström L et al., Картирование протеома ядрышка выявляет пространственно-временную организацию, связанную с внутренним нарушением белков. Mol Syst Biol. (2020)
PubMed: 32744794 DOI: 10.15252 / msb.20209469
Derenzini M et al., Размер ядра указывает на скорость пролиферации клеток в раковых тканях & период; J Pathol & period; (2000)
PubMed: 10861579 DOI: 10.1002 / (SICI) 1096-9896 (200006) 191: 2 <181 :: AID-PATH607> 3.0.CO; 2-V
Visintin R et al., Ядрышко и толстая кишка ; шляпа фокусника для фокусов клеточного цикла и периода; Curr Opin Cell Biol & period; (2000)
PubMed: 10801456
Marciniak RA et al., Ядрышковая локализация белка синдрома Вернера в клетках человека & period; Proc Natl Acad Sci U S A & period; (1998)
PubMed: 9618508
Tamanini F et al., Хрупкие X-родственные белки FXR1P и FXR2P содержат функциональный сигнал нацеливания на ядрышки, эквивалентный регуляторным белкам ВИЧ-1 & period; Hum Mol Genet & period; (2000)
PubMed: 10888599
Willemsen R et al., Ассоциация FMRP с частицами-предшественниками рибосом в ядрышке & период; Biochem Biophys Res Commun & period; (1996)
PubMed: 8769090 DOI: 10.1006 / bbrc.1996.1126
Isaac C et al., Характеристика продукта ядрышкового гена & запятая; патока и запятая; в синдроме Тричера Коллинза и периоде; Mol Biol Cell & period; (2000)
PubMed: 10982400
Drygin D et al., Механизм транскрипции РНК-полимеразы I & двоеточие; новая цель для лечения рака и периода; Annu Rev Pharmacol Toxicol & period; (2010)
PubMed: 20055700 DOI: 10.1146 / annurev.pharmtox.010909.105844
Spector DL & period;, Макромолекулярные домены в ядре клетки & period; Annu Rev Cell Biol & period; (1993)
PubMed: 8280462 DOI: 10.1146 / annurev.cb.09.110193.001405
Ламонд А.И. и др., Структура и функция ядра и период; Наука и период; (1998)
PubMed: 9554838
SWIFT H & period;, Исследования ядерной тонкой структуры и периода; Brookhaven Symp Biol & period; (1959)
PubMed: 13836127
Ламонд А.И. и др., Ядерные точки и толстая кишка; модель ядерных органелл и период; Nat Rev Mol Cell Biol & period; (2003)
PubMed: 12923522 DOI: 10.1038 / nrm1172
Thiry M & period ;, Межхроматиновые гранулы & период; Histol Histopathol & period; (1995)
PubMed: 8573995
Sleeman JE et al., Вновь собранные snRNP ассоциируются со свернутыми телами до пятен и запятой; предполагая ядерный путь созревания snRNP & период; Curr Biol & period; (1999)
PubMed: 10531003
Darzacq X et al., малые ядерные РНК, специфичные для тельца Кахаля, & ободочная кишка; новый класс направляющих РНК 2′-O-метилирования и псевдоуридилирования & период; EMBO J & период; (2002)
PubMed: 12032087 DOI: 10.1093 / emboj / 21.11.2746
Jády BE et al., Модификация малых ядерных РНК Sm происходит в нуклеоплазматическом теле Кахаля после импорта из цитоплазмы & period; EMBO J & период; (2003)
PubMed: 12682020 DOI: 10.1093 / emboj / cdg187
Liu Q et al., Новая ядерная структура, содержащая белок & период выживания моторных нейронов; EMBO J & период; (1996)
PubMed: 8670859
Lefebvre S et al., Идентификация и характеристика гена, определяющего спинальную мышечную атрофию & период; Ячейка и период; (1995)
PubMed: 7813012
Fischer U et al., Комплекс SMN-SIP1 играет важную роль в биогенезе сплайсосомных snRNP & period; Ячейка и период; (1997)
PubMed: 9323130
Lallemand-Breitenbach V et al., PML ядерные тела и период; Cold Spring Harb Perspect Biol & period; (2010)
PubMed: 20452955 DOI: 10.1101 / cshperspect.a000661
Booth DG et al., Ki-67 и компартмент периферии хромосомы при митозе и периоде; Trends Cell Biol & period; (2017)
PubMed: 28838621 DOI: 10.1016 / j.tcb.2017.08.001
Ljungberg O et al., Составная фолликулярно-парафолликулярная клеточная карцинома щитовидной железы и толстой кишки; новая опухоль и квест; Рак и период; (1983)
PubMed: 6136320 DOI: 10.1002 / 1097-0142 (19830915) 52: 6 <1053 :: aid-cncr2820520621> 3.0.co; 2-q
Melcák I et al., Ядерная компартментализация пре-мРНК и толстая кишка; трафик выпущенных транскриптов в резервуары и периоды факторов сплайсинга; Mol Biol Cell & period; (2000)
PubMed: 10679009
Spector DL et al., Связи между отдельными компонентами сплайсинга пре-мРНК и ядром клетки & period; EMBO J & период; (1991)
PubMed: 1833187
Misteli T et al., Фосфорилирование белка и ядерная организация сплайсинга пре-мРНК & period; Trends Cell Biol & period; (1997)
PubMed: 17708924 DOI: 10.1016 / S0962-8924 (96) 20043-1
Cmarko D et al., Ультраструктурный анализ транскрипции и сплайсинга в ядре клетки после микроинъекции бром-UTP & period; Mol Biol Cell & period; (1999)
PubMed: 9880337
Van Hooser AA et al., Перихромосомный слой и период; Хромосома и период; (2005)
PubMed: 16136320 DOI: 10.1007 / s00412-005-0021-9
Booth DG et al., Ki-67 представляет собой белок, взаимодействующий с PP1, который организует периферию митотической хромосомы & period; Элиф и период; (2014)
PubMed: 24867636 DOI: 10.7554 / eLife.01641
Kau TR et al., Ядерный транспорт и рак и толстая кишка; от механизма к вмешательству и периоду; Nat Rev Рак и период; (2004)
PubMed: 14732865 DOI: 10.1038 / nrc1274
Laurila K et al., Прогнозирование связанных с заболеванием мутаций, влияющих на локализацию и период белка; BMC Genomics & period; (2009)
PubMed: 19309509 DOI: 10.1186 / 1471-2164-10-122
Park S. et al., Локализация белка как основной признак этиологии и коморбидности генетических заболеваний & период; Mol Syst Biol & period; (2011)
PubMed: 21613983 DOI: 10.1038 / msb.2011.29
Christoforou A et al., Черновик карты пространственного протеома и периода плюрипотентных стволовых клеток мыши; Nat Commun & period; (2016)
PubMed: 26754106 DOI: 10.1038 / ncomms9992
Itzhak DN et al., Global & comma; количественное и динамическое картирование субклеточной локализации и периода белка; Элиф и период; (2016)
PubMed: 27278775 DOI: 10.7554 / eLife.16950
Roux KJ et al., Беспорядочный гибридный белок с биотин-лигазой идентифицирует проксимальные и взаимодействующие белки в клетках млекопитающих & period; J Cell Biol & period; (2012)
PubMed: 22412018 DOI: 10.1083 / jcb.201112098
Lee SY et al., APEX Fingerprinting выявляет субклеточную локализацию интересующих белков & period; Cell Rep & period; (2016)
PubMed: 27184847 DOI: 10.1016 / j.celrep.2016.04.064
Huh WK et al., Глобальный анализ локализации белка у почкующихся дрожжей и период; Природа и период; (2003)
PubMed: 14562095 DOI: 10.1038 / nature02026
Simpson JC et al., Систематическая субклеточная локализация новых белков, идентифицированных с помощью крупномасштабного секвенирования кДНК & период; EMBO Rep & period; (2000)
PubMed: 11256614 DOI: 10.1093 / embo-reports / kvd058
Stadler C et al., Иммунофлуоресценция и мечение флуоресцентным белком показывают высокую корреляцию для локализации белка в клетках млекопитающих. Нат. Методы. 2013 Apr; 10 (4): 315-23 (2013)
PubMed: 23435261 DOI: 10.1038 / nmeth.2377
Barbe L. et al., К конфокальному субклеточному атласу протеома человека. Протеомика клеток Mol. (2008)
PubMed: 18029348 DOI: 10.1074 / mcp.M700325-MCP200
Stadler C et al., Единый протокол фиксации для исследований локализации иммунофлуоресценции в масштабе протеома. Дж. Протеомика. (2010)
PubMed: 19896565 DOI: 10.1016 / j.jprot.2009.10.012
Fagerberg L et al., Картирование субклеточного распределения белка в трех линиях клеток человека. J Proteome Res. (2011)
PubMed: 21675716 DOI: 10.1021 / pr200379a
Baker M & period ;, Кризис воспроизводимости и двоеточие; Во всем виноваты антитела и период; Природа и период; (2015)
PubMed: 25993940 DOI: 10.