Химический состав клетки — Энциклопедия по биологии
Сходство элементарного химического состава клеток всех организмов доказывает единство живой природы. Вместе с тем нет ни одного химического элемента, содержащегося в живых организмах, который не был бы найден в телах неживой природы. В этом находит свое выражение общность живой и неживой природы. Ниже дан перечень основных химических элементов, входящих в состав клетки (в % на сырую массу):
| Кислород — 65 — 75 Углерод — 15 — 28 Водород — 8 — 10 Азот — 1,5 — 3,0 |
Магний — 0,02 — 0,03 Натрий — 0,02 — 0,03 Кальций — 0,04 — 2,00 Железо — 0,01 — 0,015 Калий — 0,15 — 0,40 Сера — 0,15 — 0,20 Фосфор — 0,20 — 1,00 Хлор — 0,05 — 0,10 |
Цинк — 0,0003 Медь — 0,0002 Йод — 0,0001 Фтор — 0,0001 |
Этот перечень, естественно, распадается на 3 группы. Кислород, углерод, водород и азот — группа элементов, которыми живые существа богаче всего. В клетке они составляют до 98% ее сырой массы. Вторая группа объединяет следующие 8 элементов, которые представлены десятыми и сотыми долями процента в веществе живой клетки; их общая сумма — около 1,9% общей массы клетки. В третью группу входят такие микроэлементы, которых в живой клетке очень мало, но они совершенно необходимы для ее нормального функционирования.
Кислород, углерод, водород и азот — группа элементов, которыми живые существа богаче всего. В клетке они составляют до 98% ее сырой массы. Вторая группа объединяет следующие 8 элементов, которые представлены десятыми и сотыми долями процента в веществе живой клетки; их общая сумма — около 1,9% общей массы клетки. В третью группу входят такие микроэлементы, которых в живой клетке очень мало, но они совершенно необходимы для ее нормального функционирования.
Несмотря на единство элементарного состава живой и неживой природы, клетки живых существ построены из таких специфических химических соединений этих элементов, которые получили специальное название — органические вещества. В настоящее время органические вещества в природе могут образовываться на нашей планете только в теле живых организмов. Это, конечно, не исключает возможности их искусственного синтеза, осуществляемого в лабораториях.
В состав клеток входят и неорганические соединения. Но за исключением воды они составляют незначительную долю по сравнению с содержанием органических веществ.
Процентное соотношение в клетке воды, различных органических и неорганических веществ следующее (в расчете на сырую массу):
Вода — 70—85
Белки — 10—20
Жиры — 1—5
АТФ и другие низкомолекулярные органические вещества — 0,1—0,5
Углеводы — 0,2—2,0
Неорганические вещества (кроме воды) — 1—1,5
Значение воды в теле живой клетки огромно. Вода составляет основу тех коллоидных систем, из которых состоит клетка. Она является растворителем, а все обменные процессы в клетке могут протекать лишь в растворах. Вода играет важную роль во многих реакциях, происходящих в организме. К их числу относятся, например, реакции гидролиза, при которых высокомолекулярные органические вещества (белки, жиры, углеводы) расщепляются за счет присоединения к ним воды. Наконец, вода служит основой для жидкостей, передвижение которых в теле многоклеточных организмов обеспечивает перенос необходимых веществ от одной части организма к другой. Поэтому чем выше биохимическая активность той или иной клетки или ткани, тем выше содержание в ней воды. Велика роль воды и в теплорегуляции клетки и организма в целом.
Велика роль воды и в теплорегуляции клетки и организма в целом.
Неорганические вещества (кроме воды) находятся в организмах в виде анионов и катионов в растворах и в виде соединений с органическими веществами. Важное функциональное значение для нормальной жизнедеятельности клетки имеют катионы К+, Nа+, Са2+ и Mg2+ и анионы НРО24, Н2РО4— ,НСО3-, Сl-В соединении с органическими веществами особое значение имеют сера, входящая в состав многих белков; фосфор как обязательный компонент веществ хромосом; железо, входящее в состав белка крови гемоглобина, и магний, находящийся в молекуле хлорофилла. Кроме того, фосфор в форме нерастворимого фосфорнокислого кальция составляет твердую основу костного скелета позвоночных и раковин моллюсков.
Ведущими органическими веществами, входящими в состав клетки, являются белки, углеводы, жиры, нуклеиновые кислоты (ДНК и РНК) и аденозинтрифосфорная кислота (АТФ).
Белки — основная составная часть любой живой клетки. На их долю приходится половина сухого вещества клетки (после удаления из нее волы). Белки выполняют в ней чрезвычайно разнообразные функции, из которых самая важная — каталитическая функция. Любая химическая реакция в клетке протекает при участии особых биологических катализаторов — ферментов. А любой фермент — белок. Следовательно, без белков-ферментов клетка не смогла бы осуществить ни одной химической реакции, а значит не смогла бы ни расти, ни размножаться, ни функционировать. Где нет белка, там нет жизни. Именно это и заставило Ф. Энгельса определить жизнь как форму cуществования белковых тел — такую форму, которая реализуется через постоянный обмен веществ.
Помимо каталитической, очень важна структурная функции белков. Белки входят в состав всех мембран, окружающих и пронизывающих клетку. В соединении с ДНК белок составляет тело хромосом, а в соединении с РНК — тело рибосом. Растворы низкомолекулярных белков входят в состав жидких фракций клетки. Наконец, именно с белками связано осуществление таких функций, как перенос кислорода в теле организма (его осуществляет белок крови — гемоглобин), сокращение мускулатуры, передача раздражения по нервам и целый ряд других.
Наконец, именно с белками связано осуществление таких функций, как перенос кислорода в теле организма (его осуществляет белок крови — гемоглобин), сокращение мускулатуры, передача раздражения по нервам и целый ряд других.
Химический состав белков чрезвычайно разнообразен, и в то же время все они построены по одному принципу — по принципу полимера: молекула одного белка состоит из многих не вполне одинаковых мономеров — молекул аминокислот. Всего известно 20 различных аминокислот, входящих в состав белков. Каждая из них имеет карбоксильную группу (СООН), аминную группу (NH2) и третью химическую составную часть (радикал — R), которой одна аминокислота отличается от другой. В молекуле, белка аминокислоты химически соединены пептидной связью: карбоксильная группа одной кислоты соединяется с аминной группой другой; при каждом таком соединении выделяется молекула воды:
В молекуле того или иного белка одни аминокислоты могут многократно повторяться, а другие совсем отсутствуют. Общее число аминокислот, составляющих одну молекулу белка, иногда достигает нескольких сот тысяч. В результате молекула белка представляет собой макромолекулу, т. е. молекулу с очень большой молекулярной массой: от нескольких десятков тысяч до многих сотен тысяч.
Общее число аминокислот, составляющих одну молекулу белка, иногда достигает нескольких сот тысяч. В результате молекула белка представляет собой макромолекулу, т. е. молекулу с очень большой молекулярной массой: от нескольких десятков тысяч до многих сотен тысяч.
Химические и физиологические свойства белков определяются не только тем, какие аминокислоты входят в их состав, но и тем, какое место в длинной цепочке белковой молекулы занимает каждая из аминокислот. Так достигается огромное разнообразие первичной структуры белковой молекулы. В живой клетке белки имеют еще и вторичную и третичную структуру, с чем также связаны их специфические функциональные свойства. Вторичная структура белковой молекулы достигается ее спирализацией: длинная цепочка соединенных между собой аминокислот закручивается, а витки спирали плотно прилегают друг к другу. Третичная структура определяется тем, что слирализованная молекула белка еще многократно и закономерно сворачивается, образуя компактную глобулу (шарик). Именно такое состояние белковой молекулы соответствует активному состоянию белка-фермента. Если же под действием различных факторов (нагревание, обработка химическими веществами) происходит разворачивание белковой молекулы и потеря вторичной и третичной структуры белка, то он при этом теряет и свои ферментативные свойства.. Такое изменение может оказаться обратимым (белок восстановит свою вторичную и третичную структуру), если воздействие не было слишком сильным. Необратимые изменения структуры белков в клетке ведут к ее гибели.
Именно такое состояние белковой молекулы соответствует активному состоянию белка-фермента. Если же под действием различных факторов (нагревание, обработка химическими веществами) происходит разворачивание белковой молекулы и потеря вторичной и третичной структуры белка, то он при этом теряет и свои ферментативные свойства.. Такое изменение может оказаться обратимым (белок восстановит свою вторичную и третичную структуру), если воздействие не было слишком сильным. Необратимые изменения структуры белков в клетке ведут к ее гибели.
Углеводы — столь же необходимая составная часть любой клетки, как и белок. В растительных клетках их значительно больше, чем в животных. Углеводы — своеобразное «топливо» для живой клетки: окисляясь, они высвобождают химическую энергию, которая расходуется клеткой на все процессы жизнедеятельности. У растений углеводы выполняют и важные строительные функции: из них образуются оболочки как живых клеток, так и мертвых (древесина).
По химическому составу углеводы делятся на две большие группы: простые и сложные углеводы. В наиболее широкоизвестных простых углеводах содержится 5 (пентозы) или 6 (гексозы) атомов углерода и столько же молекул воды. Примерами простых углеводов могут служить глюкоза и фруктоза, находящиеся во многих плодах растений.
В наиболее широкоизвестных простых углеводах содержится 5 (пентозы) или 6 (гексозы) атомов углерода и столько же молекул воды. Примерами простых углеводов могут служить глюкоза и фруктоза, находящиеся во многих плодах растений.
Сложные углеводы — это соединение нескольких молекул простых углеводов в одну. Пищевой сахар (сахароза), например, состоит из одной молекулы глюкозы и одной молекулы фруктозы. Значительно большее количество молекул простых углеводов входит в такие сложные углеводы, как крахмал, клетчатка (целлюлоза), гликоген. В молекуле клетчатки, например, до 100—150 молекул глюкозы.
Жиры и липоиды — также обязательная составная часть любой клетки. Как и углеводы, жиры используются клеткой как источник энергии: при расщеплении жиров освобождается энергия. Подкожный жир играет важную теплоизоляционную роль у многих животных (водные млекопитающие). У животных, впадающих зимой в спячку, жиры обеспечивают организм необходимой энергией, так как питательные вещества извне в это время не поступают. Жиры составляют запас питательных веществ и в семенах многих растений.
У животных, впадающих зимой в спячку, жиры обеспечивают организм необходимой энергией, так как питательные вещества извне в это время не поступают. Жиры составляют запас питательных веществ и в семенах многих растений.
По химическому составу жиры представляют собой соединение глицерина с различными жирными кислотами. Именно этим высокомолекулярным кислотам жиры и липоиды обязаны своим важным биологическим свойством: они не растворяются в воде. Поэтому жироподобные вещества — липоиды входят в состав всех мембран клетки и ее структурных элементов. Средний, липондный, слой таких мембран препятствует свободному перемещению воды из клетки в клетку.
Нуклеиновые кислоты впервые были обнаружены в ядрах клеток. Существует два типа нуклеиновых кислот: дезоксирибонуклеиновые (сокращенно ДНК) и рибонуклеиновые (сокращенно РНК). ДНК содержится преимущественно в ядре клетки, РНК — в цитоплазме и в ядре. Значение нуклеиновых кислот состоит в том, что они обеспечивают синтез в клетке специфических для нее белков. Благодаря функции ДНК, связанной с синтезом белков-ферментов, осуществляется и ее генетическая роль: ДНК является носителем наследственной информации.
Благодаря функции ДНК, связанной с синтезом белков-ферментов, осуществляется и ее генетическая роль: ДНК является носителем наследственной информации.
Рис. 5. Схема строения нуклеотида
Молекулярная структура ДНК отражает ее особое химическое свойство — способность к саморепродукции (репликации) и ее основную функцию — обеспечение синтеза специфических белков. Это очень длинная двойная цепочка. Длина ее во многие сотни раз превышает длину цепочки белковой молекулы. Как и молекуле белка, молекуле ДНК присуща спиральная структура: двойная цепочка спирально закручена вокруг своей продольной оси. Каждая одинарная цепочка представляет собой полимер и состоит из отдельных, соединенных между собой мономеров — нуклеотидов. В состав любого нуклеотида входят два постоянных химических компонента (фосфорная кислота и углевод дезоксирибоза) и один переменный, который может быть представлен одним из четырех азотистых оснований: аденином, гуанином, тимином или цитозином (рис. 5). Поэтому в молекулах ДНК всего 4 разных нуклеотида. Разнообразие же молекул ДИК огромно и достигается благодаря различной последовательности нуклеотидов в цепочке ДНК. Таким образом, и ДНК и белки построены по одному и тому же химическому принципу: специфичность ДНК обусловливается порядком нуклеотидов в ее молекуле, специфичность белка — порядком аминокислот в его молекуле. Как будет видно из дальнейшего, это совпадение имеет первостепенное значение при синтезе белков.
5). Поэтому в молекулах ДНК всего 4 разных нуклеотида. Разнообразие же молекул ДИК огромно и достигается благодаря различной последовательности нуклеотидов в цепочке ДНК. Таким образом, и ДНК и белки построены по одному и тому же химическому принципу: специфичность ДНК обусловливается порядком нуклеотидов в ее молекуле, специфичность белка — порядком аминокислот в его молекуле. Как будет видно из дальнейшего, это совпадение имеет первостепенное значение при синтезе белков.
Рис. 6. Схема строения молекулы дезоксирибонуклеиновой кислоты (ДНК): две цепочки нуклеотидов, закрученные спирально, соединены азотистыми основаниями: а — аденин, Т— тимин, Г — гуанин, Ц — цитозин
Две одинарные цепи ДНК соединены в одну двойную через нуклеотиды. При этом возможны лишь такие химические соединения: аденина с тимином и гуанина с цитозином. Поэтому последовательность нуклеотидов в одной цепочке жестко определяет и последовательность их в другой цепочке. Строгое соответствие нуклеотидов друг другу в парных цепочках молекулы ДНК получило название комплементарности (рис. 6). Эта особенность химического строения молекулы ДНК создается в процессе синтеза ДНК в живой клетке, который называется репликацией. Схематически этот процесс изображен на рис. 7. Сводится он к тому, что исходная двойная цепочка молекулы ДНК под действием специального фермента постепенно распадается на две одинарные — и тут же к каждой из них по принципу химического сродства (аденин к тимину, гуанин к цитозину) присоединяются свободные нуклеотиды. Тем самым вновь восстанавливается двойная структура ДНК. Но теперь уже таких двойных молекул получается две вместо одной. Поэтому синтез ДНК и получил название саморепродукции, или репликации: каждая молекула ДНК как бы сама себя удваивает.
6). Эта особенность химического строения молекулы ДНК создается в процессе синтеза ДНК в живой клетке, который называется репликацией. Схематически этот процесс изображен на рис. 7. Сводится он к тому, что исходная двойная цепочка молекулы ДНК под действием специального фермента постепенно распадается на две одинарные — и тут же к каждой из них по принципу химического сродства (аденин к тимину, гуанин к цитозину) присоединяются свободные нуклеотиды. Тем самым вновь восстанавливается двойная структура ДНК. Но теперь уже таких двойных молекул получается две вместо одной. Поэтому синтез ДНК и получил название саморепродукции, или репликации: каждая молекула ДНК как бы сама себя удваивает.
Молекулярная структура РНК близка к таковой ДНК. Но есть и существенные различия. Молекула РНК представляет собой не двойную, а одинарную цепочку из нуклеотидов. Поэтому РНК не способна к саморепродукции. В состав молекул РНК также входят 4 нуклеотида, но один из них иной, чем в ДНК: вместо тимина в РНК содержится другое азотистое соединение — урацил. Кроме того, в состав всех нуклеотидов молекулы РНК входит не дезоксирибоза, а рибоза. Молекулы РНК не столь велики, как молекулы ДНК. О двух формах РНК будет сказано дальше.
Кроме того, в состав всех нуклеотидов молекулы РНК входит не дезоксирибоза, а рибоза. Молекулы РНК не столь велики, как молекулы ДНК. О двух формах РНК будет сказано дальше.
Аденозинтрифосфорная кислота (АТФ). Это органическое вещество входит в состав любой клетки, где выполняет одну из важнейших функций. Химически АТФ представляет собой нуклеотид, в состав которого входят азотистое основание аденин, углевод рибоза и фосфорная кислота. Но в отличие от нуклеотида, входящего в состав РНК, в молекуле АТФ содержатся три молекулы фосфорной кислоты. Это обстоятельство и определяет биохимические особенности и функцию АТФ. Неустойчивые химические связи, которыми соединены молекулы фосфорной кислоты в АТФ, очень богаты энергией: при разрыве этих связей энергия высвобождается и используется в живой клетке на процессы жизнедеятельности и синтез. Такой разрыв осуществляется через реакцию присоединения воды молекулой АТФ и отщеплением от нее одной молекулы фосфорной кислоты.
Рис. 7. Схема репликация (самоудвоения) молекулы ДНК. А — исходная молекула ДНК перед репликацией; Б — репликация молекулы ДНК: цепи расходятся и к каждой из них подстраивается новая цепь из свободных нуклеотидов по принципу комплементарпости; В — две молекулы ДНК. образовавшиеся в результате репликации
В результате молекула АТФ превращается в АДФ (аденозин-дифосфорная кислота):
АТФ + Н2О → АДФ + Н3РO4 + свободная энергия.
Обратный процесс превращения АДФ в АТФ происходит путем присоединения молекулы фосфорной кислоты к АДФ с выделением воды и поглощением большого количества энергии. Таким образом, система обеспечивает в живой клетке постоянный обмен энергии.
|
1. 
|
Химические элементы клетки
|
2 |
|
2. |
Гидрофильные и гидрофобные вещества
|
2 |
|
3. 
|
Структура молекулы белка
|
2 |
|
4. |
Ускорители процессов в клетке
|
3 |
|
5. 
|
Углеводы и липиды
|
3 |
|
6. |
Роль воды в клетке
|
3 |
|
7. 
|
Нуклеиновые кислоты
|
1 |
|
8. |
Нуклеотиды
|
3 |
|
9. 
|
Роль минеральных веществ в клетке
|
3 |
|
10. |
Мономеры органических веществ
|
3 |
Синтез белков в клетке
Биосинтез белков идет в каждой живой клетке. Наиболее активен он в молодых растущих клетках, где синтезируются белки на построение их органоидов, а также в секреторных клетках, где синтезируются белки-ферменты и белки-гормоны.
Наиболее активен он в молодых растущих клетках, где синтезируются белки на построение их органоидов, а также в секреторных клетках, где синтезируются белки-ферменты и белки-гормоны.
Основная роль в определении структуры белков принадлежит ДНК. Отрезок ДНК, содержащий информацию о структуре одного белка, называют геном. Молекула ДНК содержит несколько сотен генов. В молекуле ДНК записан код о последовательности аминокислот в белке в виде определенно сочетающихся нуклеотидов. Код ДНК удалось расшифровать почти полностью. Сущность его состоит в следующем. Каждой аминокислоте соответствует участок цепи ДНК из трех рядом стоящих нуклеотидов.
Например, участок Т—Т—Т соответствует аминокислоте лизину, отрезок А—Ц—А — цистину, Ц—А—А — валину н т. д. Разных аминокислот — 20, число возможных сочетаний из 4 нуклеотидов по 3 равно 64. Следовательно, триплетов с избытком хватает для кодирования всех аминокислот.
Синтез белка — сложный многоступенчатый процесс, представляющий цепь синтетических реакций, протекающих по принципу матричного синтеза.
Поскольку ДНК находится в ядре клетки, а синтез белка происходит в цитоплазме, существует посредник, передающий информацию с ДНК на рибосомы. Таким посредником является и-РНК. :
В биосинтезе белка определяют следующие этапы, идущие в разных частях клетки:
- Первый этап — синтез и-РНК происходит в ядре, в процессе которого информация, содержащаяся в гене ДНК, переписывается на и-РНК. Этот процесс называется транскрипцией (от лат. «транскриптик» — переписывание).
- На втором этапе происходит соединение аминокислот с молекулами т-РНК, которые последовательно состоят из трех нуклеотидов — антикодонов, с помощью которых определяется свой триплет-кодон.
- Третий этап — это процесс непосредственного синтеза полипептидных связей, называемый трансляцией. Он происходит в рибосомах.
- На четвертом этапе происходит образование вторич ной и третичной структуры белка, то есть формирование окончательной структуры белка.
Таким образом, в процессе биосинтеза белка образуются новые молекулы белка в соответствии с точной информацией, заложенной в ДНК. Этот процесс обеспечивает обновление белков, процессы обмена веществ, рост и развитие клеток, то есть все процессы жизнедеятельности клетки.
Этот процесс обеспечивает обновление белков, процессы обмена веществ, рост и развитие клеток, то есть все процессы жизнедеятельности клетки.
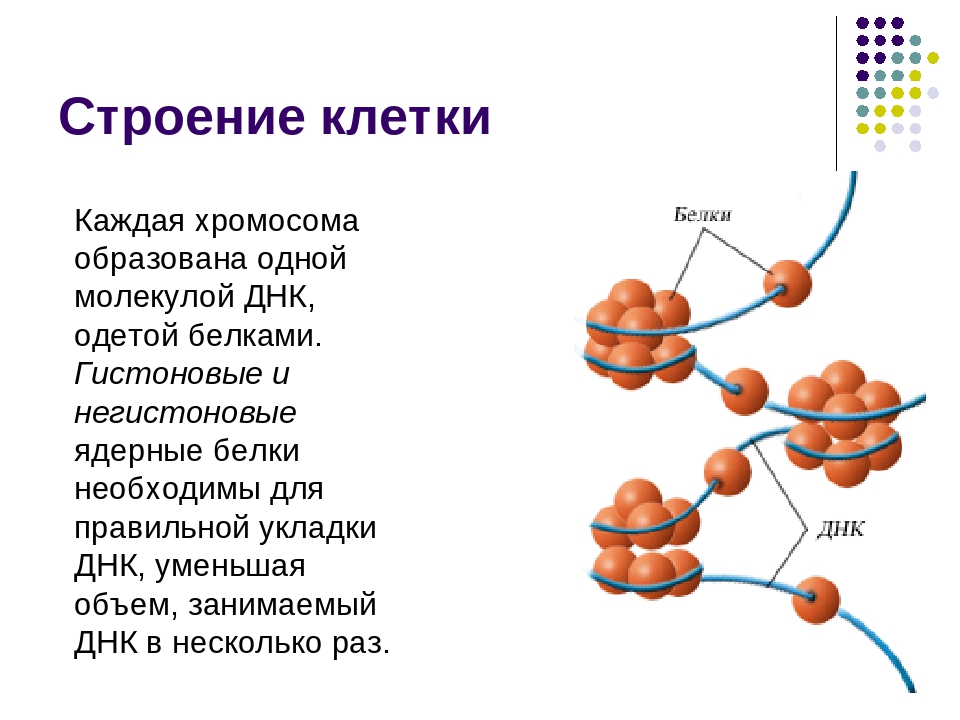
Хромосомы (от греч. «хрома» — цвет, «сома» — тело) — очень важные структуры ядра клетки. Играют главную роль в процессе клеточного деления, обеспечивая передачу наследственной информации от одного поколения к другому. Они представляют собой тонкие нити ДНК, связанные с белками. Нити называются хроматидами, состоящими из ДНК, основных белков (гистонов) и кислых белков.
В неделящейся клетке хромосомы заполняют весь объем ядра и не видны под микроскопом. Перед началом деления происходит спирализация ДНК и каждая хромосома становится различимой под микроскопом. Во время спирализации хромосомы сокращаются в десятки тысяч раз. В таком состоянии хромосомы выглядят как две лежащие рядом одинаковые нити (хроматиды), соединенные общим участком — центромерой.
Для каждого организма характерно постоянное количество и структура хромосом. В соматических клетках хромосомы всегда парные, то есть в ядре есть две одинаковые хромосомы, составляющие одну пару. Такие хромосомы называют гомологичными, а парные наборы хромосом в соматических клетках называют диплоидными.
В соматических клетках хромосомы всегда парные, то есть в ядре есть две одинаковые хромосомы, составляющие одну пару. Такие хромосомы называют гомологичными, а парные наборы хромосом в соматических клетках называют диплоидными.
Так, диплоидный набор хромосом у человека состоит из 46 хромосом, образуя 23 пары. Каждая пара состоит из двух одинаковых (гомологичных) хромосом.
Особенности строения хромосом позволяют выделить их 7 групп, которые обозначаются латинскими буквами А, В, С, D, Е, F, G. Все пары хромосом имеют порядковые номера.
У мужчин и женщин есть 22 пары одинаковых хромосом. Их называют аутосомы. Мужчина и женщина отличаются одной парой хромосом, которые называют половыми. Они обозначаются буквами — большая X (группа С) и маленькая Y (группа С,). В женском организме 22 пары аутосом и одна пара (XX) половых хромосом. У мужчин — 22 пары аутосом н одна пара (XY) половых хромосом.
В отличие от соматических клеток, половые клетки содержат половинный набор хромосом, то есть содержат по одной хромосоме каждой пары! Такой набор называют гаплоидным.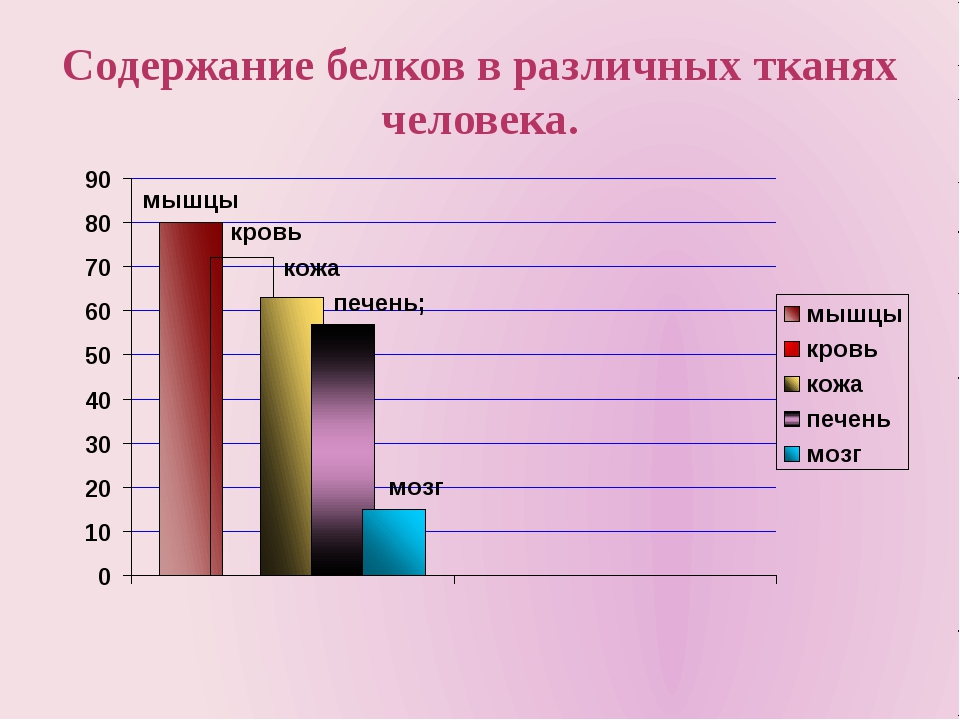 Гаплоидный набор хромосом возникает в процессе созревания клеток.
Гаплоидный набор хромосом возникает в процессе созревания клеток.
Ученые предложили способы регуляции уровня онкогенных белков в клетке
Белки семейства Bcl-2 играют важную роль в регуляции апоптоза — одного из типов программируемой клеточной гибели. Некоторые из этих белков (проапоптотические) принимают участие в процессe «самоуничтожения» потенциально злокачественных клеток, тогда как другие (антиапоптотические) противодействуют апоптозу, таким образом уравновешивая гибель и выживание клеток. Нарушения этого баланса могут привести к возникновению и развитию раковых заболеваний. Один из механизмов устойчивости опухолевых клеток к гибели — повышение в них уровня антиапоптотических белков, к числу которых относится Mcl-1. Его отличительная особенность — короткое время жизни, что делает его очень чувствительным к изменениям в процессах синтеза или деградации.
Молодые сотрудники лаборатории исследования механизмов апоптоза факультета фундаментальной медицины МГУ имени М. В. Ломоносова Вячеслав Сеничкин, Алена Стрелецкая, Анна Горбунова и руководитель проекта Гелина Копеина провели детальный анализ всех имеющихся на сегодняшний день данных, которые касаются функционирования антиапоптотического белка Mcl-1 в опухолях. Ученые исследовали способы регуляции его содержания в клетке на разных этапах, от синтеза до разрушения.
В. Ломоносова Вячеслав Сеничкин, Алена Стрелецкая, Анна Горбунова и руководитель проекта Гелина Копеина провели детальный анализ всех имеющихся на сегодняшний день данных, которые касаются функционирования антиапоптотического белка Mcl-1 в опухолях. Ученые исследовали способы регуляции его содержания в клетке на разных этапах, от синтеза до разрушения.
«Для того, чтобы целенаправленно воздействовать на клеточные процессы, позволяющие выживать злокачественным клеткам, необходимо понять, как именно возникает устойчивость к апоптозу. Mcl-1 — один из важных белков, защищающих опухоли от терапевтического воздействия. Его уровень определяется целым рядом регуляторных механизмов, и нарушение в работе любого из них может привести к повышению содержания Mcl-1, злокачественному перерождению клеток и их устойчивости к терапии», — рассказал кандидат биологических наук Вячеслав Сеничкин.
В рамках работы ученые проанализировали более 150 литературных источников, содержащих информацию о Mcl-1, включая данные, полученные ранее в лаборатории МГУ. Ученые предложили снижать уровень белка в опухолевых клетках с помощью «непрямого воздействия».
Ученые предложили снижать уровень белка в опухолевых клетках с помощью «непрямого воздействия».
Картинка: схема «прямого» и «непрямого» ингибирования белка Mcl-1 в нормальной и опухолевой клетках. Подход, предложенный исследователями, заключается в воздействии на процессы синтеза и деградации, а не на сам белок. Источник: Борис Животовский
«Гипотеза основана на том, что на содержание Mcl-1 в клетке могут существенно влиять нарушения в работе некоторых регуляторных механизмов – например, отвечающих за быструю деградацию. Мы предлагаем одновременное воздействие на различные механизмы регуляции этого белка — так называемое “непрямое” ингибирование, или подавление. С нашей точки зрения такой подход будет более безопасной стратегией в сравнении с прямым подавлением его работы. Воздействуя таким образом на процессы, которые нарушаются при развитии опухоли, можно добиться снижения уровня Mcl-1 только в злокачественных клетках.Ингибирование же белка напрямую, напротив, будет затрагивать его содержание и в опухолевых, и в нормальных клетках. Однако, чтобы точно сказать, какая из двух стратегий является более предпочтительной, необходимы дальнейшие исследования», — объяснил заведующий лабораторией профессор Борис Животовский.
Если ученым удастся добиться специфического снижения уровня Mcl-1 в опухолевых клетках, влияя на механизмы его синтеза и распада, и гипотеза о большей эффективности «непрямого воздействия» на исследуемый белок подтвердится, то данный подход можно будет успешно использовать в качестве одного из важных методов противоопухолевой терапии.
Белки, их строение и роль в клетке.
Белки, их строение и роль в клетке.
Белки — основная структурная единица клеток. Это полимеры, мономерами которых являются аминокислоты. В состав белков входит 20 типов аминокислот. В каждой из аминокислот содержится аминогруппа (-NH), карбоксильная группа (-СООН) и радикал (R). Строение радикалов отличается у различных аминокислот. Соединение аминокислот в молекуле белка происходит благодаря образованию пептидной связи: аминогруппа одной аминокислоты соединяется с карбоксильной группой другой аминокислоты.
В каждой из аминокислот содержится аминогруппа (-NH), карбоксильная группа (-СООН) и радикал (R). Строение радикалов отличается у различных аминокислот. Соединение аминокислот в молекуле белка происходит благодаря образованию пептидной связи: аминогруппа одной аминокислоты соединяется с карбоксильной группой другой аминокислоты.
Соединение, состоящее из нескольких аминокислот, называют пептидом. Выделяют первичную, вторичную, третичную и четвертичную структуры белков. Первичная структура белка определяется последовательностью аминокислот в полипептидной цепи. Именно порядок чередования аминокислот в данной белковой молекуле определяет её особые физико-химические и биологические свойства.
Вторичная структура представляет собой белковую нить, закрученную в виде спирали. Между карбоксильными группами на одном витке спирали и аминогруппами на другом витке возникают водородные связи, которые слабее ковалентных, но при их большом числе обеспечивают образование прочной структуры.
Третичная структура — это клубок, или глобула, в который свертывается спираль. Он образуется в результате взаимодействия различных остатков аминокислот. Для каждого белка характерна своя форма.
Некоторые белки имеют четвертичную структуру. Она характерна для сложных белков. Несколько глобул объединены вместе и удерживаются вместе благодаря ионным, водородным и другим нековалентным связям. Например, белок гемоглобин — состоит из четырех глобул, каждая из которых соединена с железосодержащим гемом.
Под влиянием внешних факторов (изменение температуры, солевого состава среды, pH, под действием радиации и т.п. факторов) слабые химические связи, поддерживающие молекулу белка (вторичную, третичную, четвертичную структуры), разрываются, изменяются структура и свойства белка. Этот процесс называется денатурацией.
Роль белков:
- Строительная функция. Белки входят в состав клеточных структур, являются структурными компонентами биологических мембран и многих внутриклеточных органоидов, главным компонентом опорных структур организма.

- Ферментативная функция. Многие белки служат биокатализаторами, ускоряют протекание различных химических реакций в организме.
- Регуляторная функция. Часть гормонов — белки. Они участвуют в регуляции активности клетки и организма. Например, инсулин регулирует обмен глюкозы.
- Защитная функция. Антитела, образуемые лимфоцитами, нейтрализуют чужеродных для организма возбудите лей заболеваний. Белки, участвующие в процессе свертывания крови (фибриноген и тромбин), предохраняют организм от кровопотери.
- Транспортная функция. Белки могут присоединять к себе различные молекулы и ионы и переносить их из одной части организма к другой. Например, гемоглобин переносит кислород и углекислый газ.
- Энергетическая функция. Белки могут служить источ ником энергии для клетки. При недостатке в организме yглеводов или жиров окисляются молекулы аминокислот. При расщеплении 1 г белков высвобождается 17,6 кДж энергии.
Белки, их строение и роль в клетке.
3.7 (73.33%) 114 votes
На этой странице искали :
- роль белков в клетке
- Белки и их роль в клетке
- строение и роль белков в клетке
- роль белков в клетке доклат
- белки их строение и роль в клетке
Сохрани к себе на стену!
46 — норма? Считаем хромосомы: сколько человеку для счастья нужно
Прожиточный оптимум
Сначала договоримся о терминологии. Окончательно человеческие хромосомы посчитали чуть больше полувека назад — в 1956 году. С тех пор мы знаем, что в соматических, то есть не половых клетках, их обычно 46 штук — 23 пары.
Хромосомы в паре (одна получена от отца, другая — от матери) называют гомологичными. На них расположены гены, выполняющие одинаковые функции, однако нередко различающиеся по строению. Исключение составляют половые хромосомы — Х и Y, генный состав которых совпадает не полностью. Все остальные хромосомы, кроме половых, называют аутосомами.
Все остальные хромосомы, кроме половых, называют аутосомами.
Количество наборов гомологичных хромосом — плоидность — в половых клетках равно одному, а в соматических, как правило, двум.
Интересно, что не у всех видов млекопитающих число хромосом постоянно. Например, у некоторых представителей грызунов, собак и оленей обнаружили так называемые В-хромосомы. Это небольшие дополнительные хромосомы, в которых практически нет участков, кодирующих белки, а делятся и наследуются они вместе с основным набором и, как правило, не влияют на работу организма. Полагают, что В-хромосомы — это просто удвоенные фрагменты ДНК, «паразитирующие» на основном геноме.
У человека до сих пор В-хромосомы обнаружены не были. Зато иногда в клетках возникает дополнительный набор хромосом — тогда говорят о полиплоидии, а если их число не кратно 23 — об анеуплоидии. Полиплоидия встречается у отдельных типов клеток и способствует их усиленной работе, в то время как анеуплоидия обычно свидетельствует о нарушениях в работе клетки и нередко приводит к ее гибели.
Делиться надо честно
Чаще всего неправильное количество хромосом является следствием неудачного деления клеток. В соматических клетках после удвоения ДНК материнская хромосома и ее копия оказываются сцеплены вместе белками когезинами. Потом на их центральные части садятся белковые комплексы кинетохоры, к которым позже прикрепляются микротрубочки. При делении по микротрубочкам кинетохоры разъезжаются к разным полюсам клетки и тянут за собой хромосомы. Если сшивки между копиями хромосомы разрушатся раньше времени, то к ним могут прикрепиться микротрубочки от одного и того же полюса, и тогда одна из дочерних клеток получит лишнюю хромосому, а вторая останется обделенной.
Деление при образовании половых клеток (мейоз) устроено более сложно. После удвоения ДНК каждая хромосома и ее копия, как обычно, сшиты когезинами. Затем гомологичные хромосомы (полученные от отца и матери), а точнее их пары, тоже сцепляются друг с другом, и получается так называемая тетрада, или четверка. А дальше клетке предстоит поделиться два раза. В ходе первого деления расходятся гомологичные хромосомы, то есть дочерние клетки содержат пары одинаковых хромосом. А во втором делении эти пары расходятся, и в результате половые клетки несут одинарный набор хромосом.
А дальше клетке предстоит поделиться два раза. В ходе первого деления расходятся гомологичные хромосомы, то есть дочерние клетки содержат пары одинаковых хромосом. А во втором делении эти пары расходятся, и в результате половые клетки несут одинарный набор хромосом.
Мейоз тоже нередко проходит с ошибками. Проблема в том, что конструкция из сцепленных двух пар гомологичных хромосом может перекручиваться в пространстве или разделяться в неположенных местах. Результатом снова будет неравномерное распределение хромосом. Иногда половой клетке удается это отследить, чтобы не передавать дефект по наследству. Лишние хромосомы часто неправильно уложены или разорваны, что запускает программу гибели. Например, среди сперматозоидов действует такой отбор по качеству. А вот яйцеклеткам повезло меньше. Все они у человека образуются еще до рождения, готовятся к делению, а потом замирают. Хромосомы уже удвоены, тетрады образованы, а деление отложено. В таком виде они живут до репродуктивного периода. Дальше яйцеклетки по очереди созревают, делятся первый раз и снова замирают. Второе деление происходит уже сразу после оплодотворения. И на этом этапе проконтролировать качество деления уже сложно. А риски больше, ведь четыре хромосомы в яйцеклетке остаются сшитыми в течение десятков лет. За это время в когезинах накапливаются поломки, и хромосомы могут спонтанно разделяться. Поэтому чем старше женщина, тем больше вероятность неправильного расхождения хромосом в яйцеклетке.
Дальше яйцеклетки по очереди созревают, делятся первый раз и снова замирают. Второе деление происходит уже сразу после оплодотворения. И на этом этапе проконтролировать качество деления уже сложно. А риски больше, ведь четыре хромосомы в яйцеклетке остаются сшитыми в течение десятков лет. За это время в когезинах накапливаются поломки, и хромосомы могут спонтанно разделяться. Поэтому чем старше женщина, тем больше вероятность неправильного расхождения хромосом в яйцеклетке.
Анеуплоидия в половых клетках неизбежно ведет к анеуплоидии зародыша. При оплодотворении здоровой яйцеклетки с 23 хромосомами сперматозоидом с лишней или недостающей хромосомами (или наоборот) число хромосом у зиготы, очевидно, будет отлично от 46. Но даже если половые клетки здоровы, это не дает гарантий здорового развития. В первые дни после оплодотворения клетки зародыша активно делятся, чтобы быстро набрать клеточную массу. Судя по всему, в ходе быстрых делений нет времени проверять корректность расхождения хромосом, поэтому могут возникнуть анеуплоидные клетки. И если произойдет ошибка, то дальнейшая судьба зародыша зависит от того, в каком делении это случилось. Если равновесие нарушено уже в первом делении зиготы, то весь организм вырастет анеуплоидным. Если же проблема возникла позже, то исход определяется соотношением здоровых и аномальных клеток.
И если произойдет ошибка, то дальнейшая судьба зародыша зависит от того, в каком делении это случилось. Если равновесие нарушено уже в первом делении зиготы, то весь организм вырастет анеуплоидным. Если же проблема возникла позже, то исход определяется соотношением здоровых и аномальных клеток.
Часть последних может дальше погибнуть, и мы никогда не узнаем об их существовании. А может принять участие в развитии организма, и тогда он получится мозаичным — разные клетки будут нести разный генетический материал. Мозаицизм доставляет немало хлопот пренатальным диагностам. Например, при риске рождения ребенка с синдромом Дауна иногда извлекают одну или несколько клеток зародыша (на той стадии, когда это не должно представлять опасности) и считают в них хромосомы. Но если зародыш мозаичен, то такой метод становится не особенно эффективным.
Третий лишний
Все случаи анеуплоидии логично делятся на две группы: недостаток и избыток хромосом. Проблемы, возникающие при недостатке, вполне ожидаемы: минус одна хромосома означает минус сотни генов.
Расположение хромосом в ядре клетки человека (хромосомные территории). Изображение: Bolzer et al., 2005 / Wikimedia Commons / CC BY 2.5
Если гомологичная хромосома работает нормально, то клетка может отделаться только недостаточным количеством закодированных там белков. Но если среди оставшихся на гомологичной хромосоме генов какие-то не работают, то соответствующих белков в клетке не появится совсем.
В случае избытка хромосом все не так очевидно. Генов становится больше, но здесь — увы — больше не значит лучше.
Во-первых, лишний генетический материал увеличивает нагрузку на ядро: дополнительную нить ДНК нужно разместить в ядре и обслужить системами считывания информации.
Ученые обнаружили, что у людей с синдромом Дауна, чьи клетки несут дополнительную 21-ю хромосому, в основном нарушается работа генов, находящихся на других хромосомах. Видимо, избыток ДНК в ядре приводит к тому, что белков, поддерживающих работу хромосом, не хватает на всех.
Во-вторых, нарушается баланс в количестве клеточных белков. Например, если за какой-то процесс в клетке отвечают белки-активаторы и белки-ингибиторы и их соотношение обычно зависит от внешних сигналов, то дополнительная доза одних или других приведет к тому, что клетка перестанет адекватно реагировать на внешний сигнал. И наконец, у анеуплоидной клетки растут шансы погибнуть. При удвоении ДНК перед делением неизбежно возникают ошибки, и клеточные белки системы репарации их распознают, чинят и запускают удвоение снова. Если хромосом слишком много, то белков не хватает, ошибки накапливаются и запускается апоптоз — программируемая гибель клетки. Но даже если клетка не погибает и делится, то результатом такого деления тоже, скорее всего, станут анеуплоиды.
Жить будете
Если даже в пределах одной клетки анеуплоидия чревата нарушениями работы и гибелью, то неудивительно, что целому анеуплоидному организму выжить непросто. На данный момент известно только три аутосомы — 13, 18 и 21-я, трисомия по которым (то есть лишняя, третья хромосома в клетках) как-то совместима с жизнью. Вероятно, это связано с тем, что они самые маленькие и несут меньше всего генов. При этом дети с трисомией по 13-й (синдром Патау) и 18-й (синдром Эдвардса) хромосомам доживают в лучшем случае до 10 лет, а чаще живут меньше года. И только трисомия по самой маленькой в геноме, 21-й хромосоме, известная как синдром Дауна, позволяет жить до 60 лет.
Вероятно, это связано с тем, что они самые маленькие и несут меньше всего генов. При этом дети с трисомией по 13-й (синдром Патау) и 18-й (синдром Эдвардса) хромосомам доживают в лучшем случае до 10 лет, а чаще живут меньше года. И только трисомия по самой маленькой в геноме, 21-й хромосоме, известная как синдром Дауна, позволяет жить до 60 лет.
Совсем редко встречаются люди с общей полиплоидией. В норме полиплоидные клетки (несущие не две, а от четырех до 128 наборов хромосом) можно обнаружить в организме человека, например в печени или красном костном мозге. Это, как правило, большие клетки с усиленным синтезом белка, которым не требуется активное деление.
Дополнительный набор хромосом усложняет задачу их распределения по дочерним клеткам, поэтому полиплоидные зародыши, как правило, не выживают. Тем не менее описано около 10 случаев, когда дети с 92 хромосомами (тетраплоиды) появлялись на свет и жили от нескольких часов до нескольких лет. Впрочем, как и в случае других хромосомных аномалий, они отставали в развитии, в том числе и умственном. Однако многим людям с генетическими аномалиями приходит на помощь мозаицизм. Если аномалия развилась уже в ходе дробления зародыша, то некоторое количество клеток могут остаться здоровыми. В таких случаях тяжесть симптомов снижается, а продолжительность жизни растет.
Однако многим людям с генетическими аномалиями приходит на помощь мозаицизм. Если аномалия развилась уже в ходе дробления зародыша, то некоторое количество клеток могут остаться здоровыми. В таких случаях тяжесть симптомов снижается, а продолжительность жизни растет.
Гендерные несправедливости
Однако есть и такие хромосомы, увеличение числа которых совместимо с жизнью человека или даже проходит незаметно. И это, как ни удивительно, половые хромосомы. Причиной тому — гендерная несправедливость: примерно у половины людей в нашей популяции (девочек) Х-хромосом в два раза больше, чем у других (мальчиков). При этом Х-хромосомы служат не только для определения пола, но и несут более 800 генов (то есть в два раза больше, чем лишняя 21-я хромосома, доставляющая немало хлопот организму). Но девочкам приходит на помощь естественный механизм устранения неравенства: одна из Х-хромосом инактивируется, скручивается и превращается в тельце Барра. В большинстве случаев выбор происходит случайно, и в ряде клеток в результате активна материнская Х-хромосома, а в других — отцовская. Таким образом, все девочки оказываются мозаичными, потому что в разных клетках работают разные копии генов. Классическим примером такой мозаичности являются черепаховые кошки: на их Х-хромосоме находится ген, отвечающий за меланин (пигмент, определяющий, среди прочего, цвет шерсти). В разных клетках работают разные копии, поэтому окраска получается пятнистой и не передается по наследству, так как инактивация происходит случайным образом.
Таким образом, все девочки оказываются мозаичными, потому что в разных клетках работают разные копии генов. Классическим примером такой мозаичности являются черепаховые кошки: на их Х-хромосоме находится ген, отвечающий за меланин (пигмент, определяющий, среди прочего, цвет шерсти). В разных клетках работают разные копии, поэтому окраска получается пятнистой и не передается по наследству, так как инактивация происходит случайным образом.
Кошка черепахового окраса. Фото: Lisa Ann Yount / Flickr / Public domain
В результате инактивации в клетках человека всегда работает только одна Х-хромосома. Этот механизм позволяет избежать серьезных неприятностей при Х-трисомии (девочки ХХХ) и синдромах Шерешевского — Тернера (девочки ХО) или Клайнфельтера (мальчики ХХY). Таким рождается примерно один из 400 детей, но жизненные функции в этих случаях обычно не нарушены существенно, и даже бесплодие возникает не всегда. Сложнее бывает тем, у кого хромосом больше трех. Обычно это значит, что хромосомы не разошлись дважды при образовании половых клеток. Случаи тетрасомии (ХХХХ, ХХYY, ХХХY, XYYY) и пентасомии (XXXXX, XXXXY, XXXYY, XXYYY, XYYYY) встречаются редко, некоторые из них описаны всего несколько раз за всю историю медицины. Все эти варианты совместимы с жизнью, и люди часто доживают до преклонных лет, при этом отклонения проявляются в аномальном развитии скелета, дефектах половых органов и снижении умственных способностей. Что характерно, дополнительная Y-хромосома сама по себе влияет на работу организма несильно. Многие мужчины c генотипом XYY даже не узнают о своей особенности. Это связано с тем, что Y-хромосома сильно меньше Х и почти не несет генов, влияющих на жизнеспособность.
Обычно это значит, что хромосомы не разошлись дважды при образовании половых клеток. Случаи тетрасомии (ХХХХ, ХХYY, ХХХY, XYYY) и пентасомии (XXXXX, XXXXY, XXXYY, XXYYY, XYYYY) встречаются редко, некоторые из них описаны всего несколько раз за всю историю медицины. Все эти варианты совместимы с жизнью, и люди часто доживают до преклонных лет, при этом отклонения проявляются в аномальном развитии скелета, дефектах половых органов и снижении умственных способностей. Что характерно, дополнительная Y-хромосома сама по себе влияет на работу организма несильно. Многие мужчины c генотипом XYY даже не узнают о своей особенности. Это связано с тем, что Y-хромосома сильно меньше Х и почти не несет генов, влияющих на жизнеспособность.
У половых хромосом есть и еще одна интересная особенность. Многие мутации генов, расположенных на аутосомах, приводят к отклонениям в работе многих тканей и органов. В то же время большинство мутаций генов на половых хромосомах проявляется только в нарушении умственной деятельности. Получается, что в существенной степени половые хромосомы контролируют развитие мозга. На основании этого некоторые ученые высказывают гипотезу, что именно на них лежит ответственность за различия (впрочем, не до конца подтвержденные) между умственными способностями мужчин и женщин.
Получается, что в существенной степени половые хромосомы контролируют развитие мозга. На основании этого некоторые ученые высказывают гипотезу, что именно на них лежит ответственность за различия (впрочем, не до конца подтвержденные) между умственными способностями мужчин и женщин.
Кому выгодно быть неправильным
Несмотря на то что медицина знакома с хромосомными аномалиями давно, в последнее время анеуплоидия продолжает привлекать внимание ученых. Оказалось, что более 80% клеток опухолей содержат необычное количество хромосом. С одной стороны, причиной этому может служить тот факт, что белки, контролирующие качество деления, способны его затормозить. В опухолевых клетках часто мутируют эти самые белки-контролеры, поэтому снимаются ограничения на деление и не работает проверка хромосом. С другой стороны, ученые полагают, что это может служить фактором отбора опухолей на выживаемость. Согласно такой модели, клетки опухоли сначала становятся полиплоидными, а дальше в результате ошибок деления теряют разные хромосомы или их части. Получается целая популяция клеток с большим разнообразием хромосомных аномалий. Большинство из них нежизнеспособны, но некоторые могут случайно оказаться успешными, например если случайно получат дополнительные копии генов, запускающих деление, или потеряют гены, его подавляющие. Однако если дополнительно стимулировать накопление ошибок при делении, то клетки выживать не будут. На этом принципе основано действие таксола — распространенного лекарства от рака: он вызывает системное нерасхождение хромосом в клетках опухоли, которое должно запускать их программируемую гибель.
Получается целая популяция клеток с большим разнообразием хромосомных аномалий. Большинство из них нежизнеспособны, но некоторые могут случайно оказаться успешными, например если случайно получат дополнительные копии генов, запускающих деление, или потеряют гены, его подавляющие. Однако если дополнительно стимулировать накопление ошибок при делении, то клетки выживать не будут. На этом принципе основано действие таксола — распространенного лекарства от рака: он вызывает системное нерасхождение хромосом в клетках опухоли, которое должно запускать их программируемую гибель.
Получается, что каждый из нас может оказаться носителем лишних хромосом, по крайней мере в отдельных клетках. Однако современная наука продолжает разрабатывать стратегии борьбы с этими нежеланными пассажирами. Одна из них предлагает использовать белки, отвечающие за Х-хромосому, и натравить, например, на лишнюю 21-ю хромосому людей с синдромом Дауна. Сообщается, что на клеточных культурах этот механизм удалось привести в действие.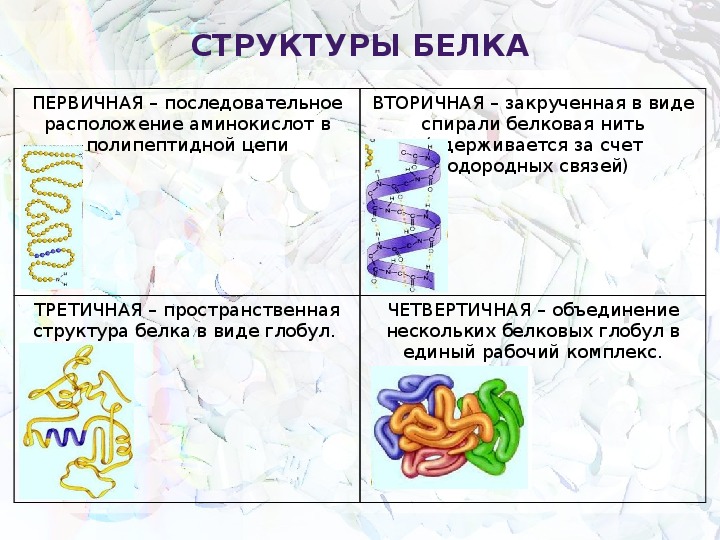 Так что, возможно, в обозримом будущем опасные лишние хромосомы окажутся укрощены и обезврежены.
Так что, возможно, в обозримом будущем опасные лишние хромосомы окажутся укрощены и обезврежены.
границ | Одноклеточный протеин — современное состояние, промышленный ландшафт и патенты 2001–2016 гг.
Введение
Люди и животные потребляют белок как источник азота и незаменимых аминокислот, из которых они строят новые структурные и функциональные (например, ферменты и гормоны) белки, которые позволяют им выжить. В экстремальных условиях белки также могут использоваться в качестве источника энергии. Пищевая ценность белка определяется аминокислотным составом; В диетическом белке обычно содержится 20 аминокислот, из которых несколько (т.е., фенилаланин, валин, треонин, триптофан, метионин, лейцин, изолейцин, лизин и гистидин, при этом аргинин, цистеин, глицин, глутамин, пролин и тирозин также полезны) не могут быть синтезированы людьми или животными и поэтому необходимы и должны поступать с пищей (обзор см. Wu, 2009).
Boland et al. (2013) исследовали, как растущий спрос на мясной и молочный белок потребует улучшений в животноводстве, а также открытости для новых источников белка, как в качестве корма для животных, так и для непосредственного потребления человеком. Производство продукции животноводства и молочных продуктов неуклонно растет в течение последних десятилетий и теоретически может продолжать расти, чтобы удовлетворить ожидаемый спрос, даже к 2050 году, когда спрос на мясо превысит 400 млн тонн, а спрос на молочные продукты — 800 млн тонн (Boland et al., 2013). Однако, поскольку растительный белок превращается в мясной белок довольно неэффективно (для производства 1 кг мясного белка требуется ~ 6 кг растительного белка), увеличение производства мяса для удовлетворения растущего спроса в конечном итоге не является устойчивым (ВОЗ, 2015).Западный мир также заинтересован в разработке более здоровой пищи с оптимальным аминокислотным составом и низким, но качественным содержанием жиров в сочетании с этически устойчивым производством. Как правило, это экологически безопасные процессы, не связанные с животными, но могут включать новые процессы, такие как производство «культивированного» мяса, при котором мясной белок более эффективно продуцируется in vitro , а не выращиванием целого животного (Kadim et al.
Производство продукции животноводства и молочных продуктов неуклонно растет в течение последних десятилетий и теоретически может продолжать расти, чтобы удовлетворить ожидаемый спрос, даже к 2050 году, когда спрос на мясо превысит 400 млн тонн, а спрос на молочные продукты — 800 млн тонн (Boland et al., 2013). Однако, поскольку растительный белок превращается в мясной белок довольно неэффективно (для производства 1 кг мясного белка требуется ~ 6 кг растительного белка), увеличение производства мяса для удовлетворения растущего спроса в конечном итоге не является устойчивым (ВОЗ, 2015).Западный мир также заинтересован в разработке более здоровой пищи с оптимальным аминокислотным составом и низким, но качественным содержанием жиров в сочетании с этически устойчивым производством. Как правило, это экологически безопасные процессы, не связанные с животными, но могут включать новые процессы, такие как производство «культивированного» мяса, при котором мясной белок более эффективно продуцируется in vitro , а не выращиванием целого животного (Kadim et al.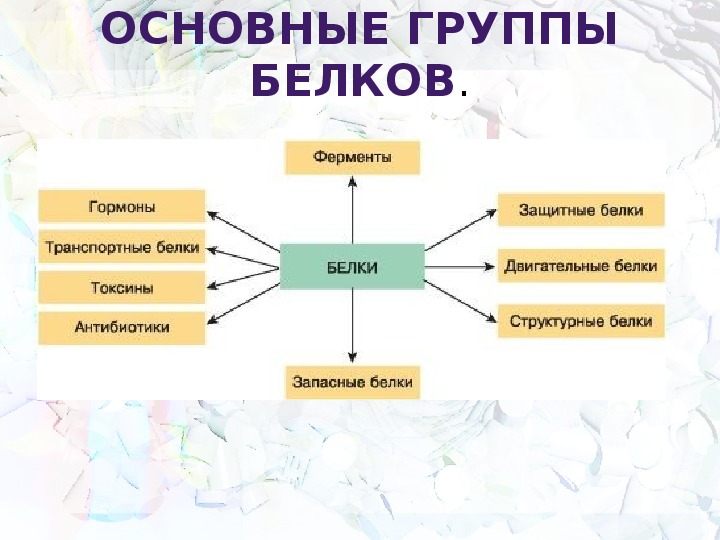 ., 2015). Источники протеина растительного происхождения, такие как бобы, являются ценными в питательном отношении источниками протеина, но для этого требуются пахотная земля и вода, которые станут ограничивающими, поскольку мы будем стремиться удовлетворить глобальный спрос на протеин.Содержание белка в мясе обычно составляет около 45%, в молоке — около 25%, а в соевых бобах — около 35% (Ghasemi et al., 2011).
., 2015). Источники протеина растительного происхождения, такие как бобы, являются ценными в питательном отношении источниками протеина, но для этого требуются пахотная земля и вода, которые станут ограничивающими, поскольку мы будем стремиться удовлетворить глобальный спрос на протеин.Содержание белка в мясе обычно составляет около 45%, в молоке — около 25%, а в соевых бобах — около 35% (Ghasemi et al., 2011).
Белок также может быть получен путем культивирования различных микробов и водорослей, предпочтительно тех, которые содержат более 30% белка в своей биомассе и которые могут обеспечить здоровый баланс незаменимых аминокислот. Микробный белок обычно называют одноклеточным белком (SCP), хотя некоторые из продуцирующих микробы, такие как нитчатые грибы или нитчатые водоросли, могут быть многоклеточными.Помимо прямого использования в качестве SCP, микробы вносят свой вклад в потребность в белке, когда они используются для повышения содержания белка или повышения качества ферментированных продуктов (Bourdichon et al. , 2012). Хотя микробный белок обеспечивает относительно небольшую часть современного питания человека, растущий глобальный спрос на белок, вероятно, сделает SCP все более важным (Boland et al., 2013). Высокие темпы роста или способность использовать уникальные субстраты, такие как CO 2 или метан, приводят к процессам, которые обеспечивают гораздо более высокую эффективность и / или устойчивость, чем это возможно при традиционном сельском хозяйстве.
, 2012). Хотя микробный белок обеспечивает относительно небольшую часть современного питания человека, растущий глобальный спрос на белок, вероятно, сделает SCP все более важным (Boland et al., 2013). Высокие темпы роста или способность использовать уникальные субстраты, такие как CO 2 или метан, приводят к процессам, которые обеспечивают гораздо более высокую эффективность и / или устойчивость, чем это возможно при традиционном сельском хозяйстве.
SCP в настоящее время производится из ограниченного числа видов микробов, особенно с учетом потребления человеком. Диапазон источников SCP, используемых в кормах для животных, шире, чем источники, одобренные для употребления в пищу людьми, и постоянно расширяется. Как рассматривается ниже, все продукты, полученные из водорослей, грибов (включая дрожжи) и бактерий, используются или находятся в стадии разработки. Этапы производства обычно включают (а) приготовление питательной среды, возможно, из отходов, (б) культивирование, включая ферментацию в твердом состоянии, (в) разделение и концентрацию SCP, в некоторых случаях сушку, и (г) окончательную переработку SCP в ингредиенты и продукты.
SCP для потребления человеком обычно производится из субстратов пищевого качества, но есть надежда, что будут разработаны процессы производства SCP из недорогих отходов пищевой промышленности и производства напитков, а также непосредственно из лесных и сельскохозяйственных источников (Anbuselvi et al. ., 2014). Всегда необходимо учитывать нормативные вопросы. С введением водорослей поставщикам микробного белка стало возможным производство CO 2 , в то время как парниковый газ метан стал новым источником углерода для SCP из бактерий.
В следующем обзоре дается введение в производство SCP и организмы, используемые в качестве SCP, с акцентом на коммерчески реализуемые разработки в этой области. Более подробные обзоры исследований конкретных организмов, рассматриваемых для производства SCP, предоставлены Анупама и Равиндра (2000), Угальде и Кастрилло (2002), Рудраварам и др. (2009), Ghasemi et al. (2011) и Nasseri et al. (2011). Здесь мы предоставляем обновленную информацию о последних достижениях в патентном ландшафте (2001–2016 гг. ) И текущих промышленных игроках на основе профилей компаний, найденных в Интернете, литературе и патентных базах данных.
) И текущих промышленных игроках на основе профилей компаний, найденных в Интернете, литературе и патентных базах данных.
Производственные системы SCP с различными субстратами и процессами
Водоросли, грибы (мицелиальные грибы и дрожжи) и бактерии могут быть использованы в качестве SCP (Анупама и Равиндра, 2000). В будущем диетический белок также может быть получен из белков, секретируемых сконструированными микробными клетками (например, белков молока или яичного белка), и производиться из культур клеток животных и растений, в которых клетки больше не являются микробами, но не являются животными или растениями, или. Таким образом, различие между SCP и другими белками становится нечетким.
SCP из водорослей
Микроводоросли, которые производятся для употребления в пищу людьми или животными, обычно имеют высокое содержание белка (например, 60–70%; Таблица 1). Они также содержат жиры (особый интерес представляют ω-3 жирные кислоты и каротиноиды), витамины A, B, C и E, минеральные соли и хлорофилл (Gouveia et al. , 2008). В них относительно низкое содержание нуклеиновых кислот (3–8%; Nasseri et al., 2011).
, 2008). В них относительно низкое содержание нуклеиновых кислот (3–8%; Nasseri et al., 2011).
Таблица 1 . Недавние сообщения о содержании белка в некоторых водорослях, представляющих интерес как SCP *.
В настоящее время микроводоросли используются в основном в форме добавок, доступных в таблетках, капсулах или жидкой форме, но они все чаще обрабатываются как ингредиенты, которые могут быть включены в пасту, выпечку, закуски и т. Д. (Gouveia et al., 2008; Зимберов, 2017). Наиболее доступные коммерческие продукты получены, главным образом, из Arthrospira platensis и Arthrospira maxima (продается как спирулина, продается, например, Hainan Simai Pharmacy Co., Earthrise Nutritionals, Cyanotech Corp., FEBICO и Mayanmar Spriulina Factory) , Chlorella (продается, например, Taiwan Chlorella Manufacturing Co., FEBICO и Roquette Klötze GmbH & Co), Dunaliella salina (продается, например, Qianqiu Biotechnology Co., Ltd. , в основном для β-каротина) и Aphanizomenon flos-aquae (продается, например, Blue Green Foods, Klamath Valley Botanicals LLC и E3Live; Gouveia et al., 2008). Euglena Co. Ltd. (Suzuki, 2017) и Algaeon (http://algaeon-inc.com/#products) продают продукты из Euglena , в основном из-за содержания β-глюкана, но включая цельноклеточные продукты.TerraVia не указывает водоросли, содержащиеся в их пищевом ингредиенте AlgaVia ® . Enzing et al. (2014) и Vigani et al. (2015) предоставляют полезные обзоры компаний и стран, занимающихся производством микроводорослей в качестве продуктов питания или кормов. Оба обзора посвящены Европейскому союзу, но при этом отмечается участие в этой отрасли множества компаний из Азии и Северной Америки.
, в основном для β-каротина) и Aphanizomenon flos-aquae (продается, например, Blue Green Foods, Klamath Valley Botanicals LLC и E3Live; Gouveia et al., 2008). Euglena Co. Ltd. (Suzuki, 2017) и Algaeon (http://algaeon-inc.com/#products) продают продукты из Euglena , в основном из-за содержания β-глюкана, но включая цельноклеточные продукты.TerraVia не указывает водоросли, содержащиеся в их пищевом ингредиенте AlgaVia ® . Enzing et al. (2014) и Vigani et al. (2015) предоставляют полезные обзоры компаний и стран, занимающихся производством микроводорослей в качестве продуктов питания или кормов. Оба обзора посвящены Европейскому союзу, но при этом отмечается участие в этой отрасли множества компаний из Азии и Северной Америки.
Водоросли обычно питаются CO 2 и светом, хотя некоторые продукты, такие как AlgaVia ® , производятся путем традиционной ферментации, а не путем фотосинтеза.Выращивание водорослей в открытых водоемах на открытом воздухе является обычным явлением, но подвержено загрязнению (не только биологическому, но и минеральному, влияющему на качество конечного продукта) и изменению погоды (Harun et al. , 2010). Внутренние фотобиореакторы также используются, чтобы гарантировать поставку свежих водорослей в качестве корма для аквакультуры (моллюски, креветки, рыба; Henrikson, 2013; Mahmoud et al., 2016). Водоросли в основном используются в аквакультуре как источник омега-жирных кислот и каротиноидных пигментов, но их белок также способствует питанию животных (Muller-Feuga, 2000).
, 2010). Внутренние фотобиореакторы также используются, чтобы гарантировать поставку свежих водорослей в качестве корма для аквакультуры (моллюски, креветки, рыба; Henrikson, 2013; Mahmoud et al., 2016). Водоросли в основном используются в аквакультуре как источник омега-жирных кислот и каротиноидных пигментов, но их белок также способствует питанию животных (Muller-Feuga, 2000).
SCP от грибов
Согласно обзору Anupama and Ravindra (2000), Rudravaram et al., Для использования в качестве SCP рассматривается широкий спектр грибов. (2009) и Nasseri et al. (2011). В таблице 2 перечислены некоторые виды, которые были исследованы в последние годы, с указанием содержания белка в условиях, в которых они были выращены. Продукты из Saccharomyces, Fusarium и Torulopsis коммерчески доступны.
Таблица 2 .Недавние сообщения о содержании грибкового белка, произведенного из определенных субстратов для видов, исследованных как потенциальные источники SCP.
Грибы, выращенные как SCP, обычно содержат 30–50% белка (Anupama and Ravindra, 2000; Nasseri et al., 2011). Аминокислотный состав выгодно отличается от руководящих принципов ФАО; Содержание треонина и лизина обычно высокое, а содержание метионина относительно низкое, хотя все еще соответствует рекомендациям ФАО / ВОЗ (Anderson et al., 1975). Содержание метионина в некоторых грибковых продуктах, таких как Marmite ® , еще ниже.Серусодержащие аминокислоты были обогащены SCP из K. fragilis путем культивирования на сыворотке (Willetts and Ugalde, 1987).
Ожидается, что SCP, полученный из грибов, помимо белка, будет обеспечивать витамины в основном из группы B-комплекса (тиамин, рибофлавин, биотин, ниацин, пантотеновая кислота, пиридоксин, холин, стрептогенин, глутатион, фолиевая кислота и п-аминобензойная кислота). кислота). Клеточные стенки грибов богаты глюканами, которые вносят клетчатку в рацион. Холестерин липопротеинов низкой плотности был снижен у добровольцев, которые потребляли микопротеин из Fusarium venenatum (Turnbull et al. , 1992) и уровни глюкозы в крови и инсулина также могут быть положительно затронуты (Lang et al., 1999). Ожидается, что в грибах будет умеренное содержание нуклеиновых кислот (7–10%; Nasseri et al., 2011), которое, однако, слишком велико для потребления человеком и требует обработки для его снижения (Edelman et al., 1983).
, 1992) и уровни глюкозы в крови и инсулина также могут быть положительно затронуты (Lang et al., 1999). Ожидается, что в грибах будет умеренное содержание нуклеиновых кислот (7–10%; Nasseri et al., 2011), которое, однако, слишком велико для потребления человеком и требует обработки для его снижения (Edelman et al., 1983).
Бренд Quorn ™ (http://www.quorn.com/) был запущен в 1985 году компанией Marlow Foods (Великобритания). Продукты Quorn ™ содержат микопротеин мицелиального гриба F. venenatum . Грибковая биомасса обеспечивает текстуру, напоминающую мясные продукты.Quorn ™ может быть единственным продуктом SCP, используемым исключительно для питания человека, и для этой цели широко используется бренд, продается и продается. Недавно (2015 г.) компания была приобретена филиппинским производителем лапши быстрого приготовления Monde Nissin Corp за 550 миллионов фунтов стерлингов (http://www.reuters.com/article/quorn-ma-idUSL5N1204C720151001).
Отработанные пивные дрожжи ( Saccharomyces cerevisiae ) более века продавались в виде дрожжевых экстрактов, таких как Marmite ® (Unilever и Sanitarium Health Food), Vegemite ® (Bega Cheese Ltd. ), Cenovis ® (Gustav Gerig AG) и Vitam-R ® (VITAM Hefe-Produkt GmbH). Дрожжевые экстракты являются хорошим источником пяти важных витаминов группы B, а также белка. Другой коммерчески доступный дрожжи, Torula ( Candida utilis , переименованный в Pichia jadinii ), широко используемый ароматизатор, также содержит большое количество белка. Torula использовался в Provesteen ® T, производимом Provesta Corporation в 1980-х годах, наряду с аналогичными продуктами с использованием дрожжей Pichia и Kluyveromyces (Hitzman, 1986).Торула богата аминокислотой глутаминовой кислотой, и по этой причине ее использовали для замены усилителя вкуса мононатрия глутамата (MSG).
), Cenovis ® (Gustav Gerig AG) и Vitam-R ® (VITAM Hefe-Produkt GmbH). Дрожжевые экстракты являются хорошим источником пяти важных витаминов группы B, а также белка. Другой коммерчески доступный дрожжи, Torula ( Candida utilis , переименованный в Pichia jadinii ), широко используемый ароматизатор, также содержит большое количество белка. Torula использовался в Provesteen ® T, производимом Provesta Corporation в 1980-х годах, наряду с аналогичными продуктами с использованием дрожжей Pichia и Kluyveromyces (Hitzman, 1986).Торула богата аминокислотой глутаминовой кислотой, и по этой причине ее использовали для замены усилителя вкуса мононатрия глутамата (MSG).
Процесс под названием «Пекило» был разработан в Финляндии для производства SCP для кормов для животных из сахаров, присутствующих в сульфитном растворе сточных вод бумажных фабрик (обзор в Ugalde and Castrillo, 2002). Нитчатый гриб Paecilomyces varioti выращивали на сахарах, включая пентозы, в щелоке сульфитных отходов или гидролизатах древесины. В течение 1982–1991 гг. В Финляндии действовали две фабрики в Мянття и Ямсянкоски, но после того, как целлюлозные фабрики прекратили свою деятельность, эти фабрики также были закрыты.Хотя продукт продавался как корм для животных, он также был исследован в качестве добавки к мясным продуктам, таким как колбасы и фрикадельки (Koivurinta et al., 1979). Штамм Pekilo process доступен из коллекции культур VTT Ltd. (www.culturecollection.vtt.fi/).
В течение 1982–1991 гг. В Финляндии действовали две фабрики в Мянття и Ямсянкоски, но после того, как целлюлозные фабрики прекратили свою деятельность, эти фабрики также были закрыты.Хотя продукт продавался как корм для животных, он также был исследован в качестве добавки к мясным продуктам, таким как колбасы и фрикадельки (Koivurinta et al., 1979). Штамм Pekilo process доступен из коллекции культур VTT Ltd. (www.culturecollection.vtt.fi/).
Quorn ™ и дрожжевые пасты, такие как Marmite ® , производятся из глюкозы, полученной из крахмала, в то время как в процессе Пекило использовались лигноцеллюлозные сахара. В дополнение к этим источникам углерода для производства SCP дрожжами и нитчатыми грибами использовались алканы и метанол.Метилотрофные дрожжи, например Komagataella pastoris (ранее Pichia pastoris ), производят биомассу и белок из метанола (Rashad et al., 1990). Производство в промышленных масштабах осуществляется, например, компанией Phillips Petroleum. Их дрожжи производили 130 г (DW) / л биомассы с продуктивностью более 10 г / л -1 ч -1 (Johnson, 2013).
Их дрожжи производили 130 г (DW) / л биомассы с продуктивностью более 10 г / л -1 ч -1 (Johnson, 2013).
Компания British Petroleum первой начала производство Yarrowia lipolytica SCP для корма для животных из парафиновых парафинов из парафинов на нефтеперерабатывающем заводе в 1970-х годах, построив пилотную установку мощностью до 100 тыс. Тонн в год (Groenewald et al., 2014). Хотя сам продукт считался безопасным, завод не получил необходимых разрешений на производство из-за экологических проблем (Bamberg, 2000). В сочетании с высокой ценой на субстрат, возникшей в результате нефтяного кризиса 1973 года, это заставило British Petroleum отказаться от интереса к SCP (Groenewald et al., 2014). Yarrowia SCP теперь доступен в меньшем масштабе как продукты Yarrowia Technology (продукты Yarrowia Equinox и Yarrowia GoodStart) от Skotan S.A. в Польше (http: // www.yarrowiatechnology.com/?lang=3). Хотя масла и каротиноиды являются наиболее распространенными продуктами Yarrowia для использования человеком (Groenewald et al. , 2014), американская компания Nucelis также предлагает богатую белком муку из тысячелистника обыкновенного (https://www.nucelis.com/products. php? product = масла # кружки).
, 2014), американская компания Nucelis также предлагает богатую белком муку из тысячелистника обыкновенного (https://www.nucelis.com/products. php? product = масла # кружки).
Исследования и разработки SCP с различными видами грибов активны и продолжаются и могут привести к созданию новых продуктов или производственных процессов. Например, Zhao et al. (2013) описали процесс, в котором антибактериальные пептиды будут продуцироваться и секретироваться Y.lipolytica , генерируя ценный продукт, тогда как отработанные дрожжи можно было использовать в качестве SCP, поскольку в них было высокое содержание белка. Большая часть текущих исследований сосредоточена на использовании отходов субстратов, таких как жмых сахарного тростника (например, Penicillium janthinellum с 46% белка, Rao et al., 2010), отработанное зерно пивоварни, гемицеллюлозный гидролизат (например, Debaryomyces hansenii , White et al., 2008; Kluyveromyces marxianus , Aggelopoulos et al., 2014), сыворотка (смешанные культуры дрожжей, Yadav et al. , 2014, 2016; K. marxianus , Aggelopoulos et al., 2014), а также смеси других обычных отходов пищевой промышленности, таких как апельсиновые и картофельные остатки, патока и солодовые корешки ( K. marxianus , Aggelopoulos et al., 2014). Aggelopoulos et al. (2014) использовали твердофазную ферментацию (SSF), а не погруженное культивирование, а также отметили, что более ценные продукты могут быть извлечены до использования обогащенных белком остатков в качестве корма для животных.
, 2014, 2016; K. marxianus , Aggelopoulos et al., 2014), а также смеси других обычных отходов пищевой промышленности, таких как апельсиновые и картофельные остатки, патока и солодовые корешки ( K. marxianus , Aggelopoulos et al., 2014). Aggelopoulos et al. (2014) использовали твердофазную ферментацию (SSF), а не погруженное культивирование, а также отметили, что более ценные продукты могут быть извлечены до использования обогащенных белком остатков в качестве корма для животных.
SCP из бактерий
Бактерии также давно используются в качестве SCP, особенно в кормах.Некоторые из наиболее часто изучаемых видов были рассмотрены Анупама и Равиндра (2000), Рудраварам и др. (2009) и Nasseri et al. (2011), а в таблице 3 представлен список недавних исследований бактериальных SCP.
Таблица 3 . Недавние сообщения о содержании бактериального белка на определенных субстратах для видов, исследованных как потенциальные источники SCP.
Бактериальный SCP обычно содержит 50–80% белка в пересчете на сухой вес (Anupama and Ravindra, 2000), и ожидается, что содержание незаменимых аминокислот будет сравнимо с рекомендациями ФАО или выше (Erdman et al., 1977). Сообщалось о содержании метионина до 3,0% (Schulz and Oslage, 1976), что выше, чем обычно получают в SCP водорослей или грибов. Аналогичный аминокислотный состав наблюдается у бактерий, выращенных на метаноле или метане (Øverland et al., 2010). Как и в случае с грибами, бактериальный SCP имеет высокое содержание нуклеиновых кислот (8–12%), особенно РНК, и поэтому требует обработки перед использованием в качестве пищи / корма (Kihlberg, 1972; Nasseri et al., 2011; Strong et al., 2015 ). В дополнение к белку и нуклеиновой кислоте бактериальный SCP обеспечивает некоторые липиды и витамины из группы B.
Компания
Imperial Chemical Industries разработала SCP (Pruteen) для кормов для животных из метанола с использованием бактерии Methylophilus methylotrophus . Прутин содержал до 70% белка и использовался в кормах для свиней (Johnson, 2013). Однако Pruteen не могла конкурировать с более дешевыми кормами для животных, которые были доступны в конце 1970-х годов, и производство было прекращено. Прутин производился из метанола, но сейчас интерес к метану в качестве субстрата для SCP. UniBio A / S (с использованием знаний, полученных Dansk BioProtein A / S) и Calysta Inc.оба разработали технологию ферментации для преобразования природного газа в кормовой белок для животных с использованием метанотрофных бактерий. UniBio A / S использует ферментер с U-образной петлей для достижения производительности 4 кг м -3 ч -1 , производя UniProtein ® с ~ 70% белка, который был одобрен для использования в кормах для животных ( http://www.unibio.dk/company/subpage-1/). Ферментер с U-образным контуром разработан для увеличения скорости массопереноса метана из газа в жидкую фазу, делая больше метана доступным для бактерий (Petersen et al., 2017). Calysta Inc. открыла производство для своего продукта FeedKind ® в Великобритании в 2016 году и в партнерстве с Cargill построит более крупное производственное предприятие в США (http://calysta.com/commercialization/). FeedKind ® , как и UniProtein ® , используется в кормах для животных. Метан представляет собой интересный субстрат, поскольку он является основным побочным продуктом животноводства и свиноводства (Philippe and Nicks, 2015), а также доступен при производстве биогаза (свалки, отходы).В настоящее время сжигается излишек метана. VTT Ltd. изучает конструкцию реактора и варианты сочетания производства метана на фермах с производством микробного масла и кормового белка (http://www.vttresearch.com/media/news/protein-feed-and-bioplastic-from-farm -biogas) из метанотрофных бактерий Methylococcus capsulatus (группа I), Methylosinus trichosporium (группа II) и Methylocystis parvus (группа II).
Как и в случае SCP из грибов, другие разработки в области производства бактериального SCP сосредоточены на улучшении различных субстратов для отходов или повышении ценности очистки сточных вод.Примеры включают обработку отходов переработки картофельного крахмала в двухступенчатом процессе с использованием Aspergillus niger для разложения волокон в остатках картофеля и Bacillus licheniformis для производства белка (Liu et al., 2014). Экономический анализ показал, что этот процесс может решить не только проблему загрязнения в крахмальной промышленности, но и проблему нехватки белка для кормов для животных в Китае (Liu et al., 2014). Другой пример одновременного управления сточными водами и производства SCP был описан Kornochalert et al.(2014) для заводских отходов резиновых листов. Они продемонстрировали, что химическая потребность в кислороде, взвешенных твердых частицах и общем количестве сульфидов в сточных водах была снижена пурпурной несерной бактерией, Rhodopseudomonas palustris , до уровней, соответствующих руководящим принципам для использования в качестве воды для орошения в Таиланде, и что произведенная биомасса была подходящей. для SCP (Kornochalert et al., 2014).
Скорлупа сои была ферментирована B. subtilis для повышения ее питательной ценности в качестве корма для животных с однокамерным желудком (Wongputtisin et al., 2014).
Kunasundari et al. (2013) описывают новый вторичный продукт, произведенный совместно с бактериальным SCP. Они культивировали Cupriavidus necator в больших масштабах для получения биомассы с высоким содержанием как белка, так и полигидроксиалканоата (PHA). Этой биомассой скармливали крыс. Корм был не только хорошо переносимым и безопасным для крыс, но крысы также производили фекальные гранулы, содержащие гранулы PHA, что позволяло очистить значительные количества PHA без использования сильных растворителей (Kunasundari et al., 2013).
Обработка SCP
В зависимости от материала субстрата и предполагаемого пищевого / кормового применения перед составлением конечного продукта SCP требуются различные этапы обработки. В следующем разделе мы рассмотрим наиболее важные потребности в обработке SCP.
Деградация клеточной стенки в белковых продуктах одиночной клетки
Некоторые SCP используются в виде цельноклеточных препаратов, в то время как у других клеточная стенка может быть разрушена, чтобы сделать белок более доступным.SCP, такие как Quorn ™, можно употреблять без разрушения клеточной стенки, и в этом случае хитин и глюкан из клеточных стенок грибов вносят клетчатку в рацион (Wiebe, 2004). SCP, полученный из Euglena , не требует усвоения, поскольку клетки имеют белковые пленки, а не клеточные стенки, что делает его более легко усваиваемым.
Для разрушения клеточной стенки использовались различные методы, в том числе механические силы (дробление, измельчение, измельчение, гомогенизация под давлением или ультразвуковая обработка), гидролитические ферменты (эндогенные или экзогенные), химическое разрушение с помощью детергентов или комбинации этих методов ( рассмотрено в Nasseri et al., 2011). Разрушение клеток может повлиять на качество и количество белка и других компонентов в SCP. Такие продукты, как Marmite ® и Vegemite ® , представляют собой клеточные экстракты, полученные путем нагревания клеток до 45–50 ° C, достаточного для того, чтобы внутриклеточные ферменты частично гидролизовали клеточную стенку; белки также восстанавливаются до более мелких пептидов (Trevelyan, 1976; Ugalde and Castrillo, 2002).
Удаление нуклеиновых кислот из белковых продуктов одиночных клеток
Хотя водоросли обычно имеют низкое содержание нуклеиновых кислот, быстро размножающиеся виды бактерий и грибов имеют высокое содержание нуклеиновых кислот (РНК).На содержание и деградацию РНК влияют условия роста, скорость роста и соотношение углерода и азота (Trevelyan, 1976). Когда SCP производят для потребления человеком, высокое содержание нуклеиновых кислот является проблемой, потому что прием пуриновых соединений, полученных в результате распада РНК, увеличивает концентрацию мочевой кислоты в плазме, что может вызвать подагру и камни в почках (Edelman et al., 1983). SCP с высоким содержанием нуклеиновых кислот, предназначенный в качестве корма для животных, рекомендуется только для кормления животных с короткой продолжительностью жизни (Strong et al., 2015). Гао и Сюй (2015) и Сюй (2015) недавно описали методы измерения содержания нуклеотидов в сложных продуктах SCP.
Были разработаны различные методы уменьшения содержания РНК в SCP (Sinskey and Tannenbaum, 1975), которые продолжают использоваться. Эндогенные ферменты, расщепляющие РНК (рибонуклеазы), могут быть использованы для деградации РНК после активации с помощью тепловой обработки (60–70 ° C), как это используется при производстве Quorn ™ (Anderson and Solomons, 1984). Рибонуклеазы также можно добавлять в процесс или использовать в качестве иммобилизованных ферментов (Martinez et al., 1990; Хамеш и Демир, 2015). Компоненты деградированной РНК диффундируют из клеток, но также происходит потеря биомассы (35–38%). Процесс был улучшен за счет использования более высоких температур (72–74 ° C) в течение 30–45 минут с меньшими потерями биомассы (потеря 30–33%; Ward, 1998). Повышение температуры требует ввода пара, что является фактором затрат, но тепло также необходимо для окончательной обработки биомассы при 90 ° C после активации РНКазы (Knight et al., 2001).
Также были изучены методы щелочного гидролиза и химической экстракции.Виикари и Линко (1977) использовали щелочную обработку для уменьшения РНК в биомассе P. varioti , используемой в процессе Пекило, до уровня менее 2%. Обработка при 65 ° C, pH 7,5–8,5 для активации эндогенной рибонуклеазы также снижала содержание РНК до <2%, в то время как содержание белка оставалось на уровне 50%.
Безопасность SCP
Как и любой продукт питания или корм, SCP должен быть безопасным для производства и использования. В большинстве регионов существуют правила, обеспечивающие безопасность пищевых продуктов или кормов для употребления (Bagchi, 2006).Обычно они различают не только пищу (для людей) и корм (для животных), но также и пищу (обеспечивающую питание и потенциально вкус и аромат) и пищевые добавки (консерванты, красители, модификаторы текстуры и т. Д.) Или корм и корм. добавки. Точные определения могут отличаться в зависимости от региона, но международные стандарты, регулируемые Объединенным комитетом экспертов ФАО / ВОЗ по пищевым добавкам, применяются к товарам, продаваемым на международном уровне (ВОЗ, 2017). Правила различаются в зависимости от предполагаемого назначения продукта, и хотя предполагается, что SCP будет либо пищевым продуктом, либо кормом (обеспечивающим питание), некоторые продукты могут поступать на рынок в качестве добавок (например,g., обеспечивающий цвет), а не как SCP, даже если в продукте присутствует белок, что ограничивает степень их добавления и их ценность как SCP. Coppens et al. (2006) обобщили европейские правила, касающиеся пищевых продуктов и пищевых добавок, сделав вывод, что «процесс подготовки« функциональных пищевых продуктов »к рынку, безусловно, является дорогостоящей и трудоемкой задачей», но также и что этот процесс может быть успешным.
Smedley (2013) дает полезные ссылки на конкретные правила, касающиеся кормов и кормовых добавок, в Бразилии, Канаде, Китае, Европейском союзе, Японии, Южной Африке и США, а также на различия между правилами в этих регионах.Следует отметить, что не все животные считаются одинаковыми во всех регионах, поэтому корм для домашних животных регулируется как корм в некоторых областях, но не в других. Перед продажей новых кормов или добавок требуется разрешение (Smedley, 2013).
Ключевыми проблемами являются содержание РНК, токсины, вырабатываемые микробами (производственными хозяевами или контаминантами), потенциальные симптомы аллергии и вредные вещества, полученные из исходного сырья, такие как тяжелые металлы. Были разработаны и используются в промышленности способы снижения содержания РНК до приемлемых уровней, как обсуждалось выше.
Проблема токсинов решается путем тщательного выбора производственного организма, условий процесса и рецептуры продукта. Некоторые грибы производят микотоксины, что делает их нежелательными источниками SCP (Анупама и Равиндра, 2000). Эффекты грибковых токсинов варьируются от аллергических реакций до канцерогенеза и смерти. Поражены как люди, так и животные, поэтому микотоксины недопустимы в SCP для употребления людьми или животными. Микопротеин Quorn ™ прошел обширное тестирование на наличие микотоксинов или других токсичных соединений, прежде чем был одобрен для употребления в пищу человеком (Wiebe, 2004).Конкретный штамм F. venenatum не продуцирует микотоксины в производственных условиях, но процесс все еще контролируется, чтобы гарантировать их отсутствие. Первоначальное тестирование безопасности микопротеина Quorn ™ длилось 16 лет, и еще много лет потребовалось для получения разрешения на продажу за пределами Великобритании (Solomons, 1986). Y. lipolytica — еще один гриб, безопасность которого была тщательно изучена, что свидетельствует о том, что его можно безопасно использовать в различных пищевых продуктах, в том числе в качестве SCP (Groenewald et al., 2014).
Бактерии также могут производить токсины, ограничивающие их использование в качестве SCP. Токсины могут быть внеклеточными (экзотоксины) или клеточно-связанными (эндотоксины). Например, обе Pseudomonas spp. и Methylomonas methanica продуцируют высокий уровень белка и были оценены для использования в качестве SCP. Оба также производят эндотоксины, вызывающие лихорадочные реакции (Rudravaram et al., 2009). Их можно разрушить при нагревании. Кроме того, исследование иммуногенности SCP из M. capsulatus показало, что бесклеточный препарат (т.е., клеточная стенка удалена) не вызывали иммунных ответов у мышей, хотя препараты цельных клеток вызывали (Steinmann et al., 1990).
Использование различных видов отходов в качестве сырья для производства SCP привлекательно с точки зрения стоимости и устойчивости, но может быть проблематичным с точки зрения безопасности, и необходимо тщательно рассмотреть происхождение сырья. Например, Quorn ™ производится в среде определенного химического состава из глюкозы (гидролизованный крахмал) с помощью четко определенного процесса, который соответствует стандартам GLP (Wiebe, 2002, 2004).Любой продукт для потребления человеком, который будет производиться из гидролизатов биомассы или потоков отходов, должен будет предоставить эквивалентную запись о безопасности, прежде чем будет одобрен в Европе или Северной Америке. В дополнение к требованиям безопасности, связанным с использованием субстратов, полученных из отходов, для УПП, общественное восприятие и принятие пищевых продуктов, полученных из отходов, будет ключевым элементом, который следует учитывать при внедрении SCP в рационы питания человека.
Генетически модифицированные организмы в производстве SCP — будущие возможности
Использование генетически модифицированных организмов (ГМО) в продуктах питания и кормах еще не нашло общественного признания в Европе, хотя в других странах мира оно более приемлемо.По мере накопления данных о потреблении ГМО они могут получить дальнейшее признание по мере того, как источники белка становятся все более дефицитными, особенно если развивается рынок здорового или индивидуального питания. ГМО дрожжи с заводов по производству биоэтанола уже могут использоваться в качестве корма для крупного рогатого скота в некоторых странах. Использование генетических элементов самого хозяина (самоклонирование) часто означает, что чужеродная ДНК не вводится.
Хотя Голдберг (1988) обсуждал перспективу использования генно-инженерных микробов в качестве SCP в 1980-х годах как средство улучшения экономики процесса за счет производства побочных продуктов (например,g., фермент, органическая кислота или антибиотик), эта концепция не получила развития и только в последние годы вызвала больший интерес и признание. Рассмотрен широкий спектр преимуществ продуктов SCP от генетической модификации. Например, компания DuPont с помощью генной инженерии создала дрожжи для производства длинноцепочечных жирных кислот омега-3, которые необходимы для здоровья человека (Xie et al., 2015). Секвенирование генома и генная инженерия также позволяют нарушить работу генов, участвующих в производстве токсинов, и, таким образом, повысить безопасность некоторых продуктов SCP.Нарушение работы генов может быть достигнуто с помощью традиционного мутагенеза и скрининга, но этот процесс может привести к нежелательным мутациям в продукте, тогда как генетическая модификация происходит быстрее и специфичнее. Этому будут способствовать новые технологии, такие как кластерные регулярные короткие палиндромные повторы (CRISPR), которые позволяют редактировать геном без введения новой ДНК. Штаммы, модифицированные с помощью CRISPR, не обязательно считаются ГМО. Методология CRISPR также может исключить введение в организм генов устойчивости к антибиотикам, избегая опасений по поводу распространения генов устойчивости к антибиотикам за счет использования ГМО.
Метаболизм источника углерода — еще одна цель для улучшения процессов производства SCP, поскольку источник углерода может быть основной статьей затрат при производстве SCP (Ugalde and Castrillo, 2002). Генная инженерия может расширить диапазон субстратов, используемых производственным организмом, или повысить эффективность их использования, позволяя использовать несколько источников сырья и обеспечивая использование всего потенциального углерода в сырье. Например, Ren et al. (2016) представили способность к ферментации ксилозы от Candida intermedia до S.cerevisiae путем расщепления генома, чтобы обеспечить производство этанола из глюкозы и производство SCP из ксилозы, тогда как Cui et al. (2011) представили инулазу Y. lipolytica . Точно так же экспрессия одного или нескольких гидролитических ферментов улучшила использование полимерных субстратов (Song et al., 2017). Целлюлоза, крахмал или сыворотка могут использоваться в консолидированных биопроцессах организмом, модифицированным для производства индивидуально подобранного ферментного коктейля, подходящего для конкретного сырья. Организмы также могут быть сконструированы так, чтобы иметь улучшенную устойчивость к кислотам, щелочам или другим соединениям, связанным с конкретными субстратами.
Генетические модификации могут также увеличить нутрицевтическую ценность биомассы либо за счет оптимизации аминокислотного состава, либо за счет увеличения содержания определенных витаминов (например, витамина D, витамина B, биотина), жирных кислот, глутатиона и т. Д. с белком. Существуют значительные возможности для создания SCP с индивидуально подобранным питательным составом.
Генная инженерия может также предоставить новые способы сбора белков для включения в пищу или корм.Например, модификация для улучшения флокуляции могла бы снизить затраты на сбор клеток, или клетки можно было бы модифицировать, чтобы они имели набор ферментов, разрушающих клеточную стенку, которые активировались бы специфическими внеклеточными стимулами для обеспечения белков без клеточных стенок. Точно так же рибонуклеазы могут быть сконструированы для активации в определенное время в условиях, в которых протеазы не активируются. Морфологические характеристики также могут быть изменены для обеспечения определенных органолептических свойств.
Экономические аспекты
Развитие процессов SCP всегда определялось потребностью в белке, и это продолжает оставаться важным фактором развития как старых, так и новых процессов. Повышение ценности легкодоступных потоков субстрата и отходов также было и остается сильным фактором. УПП часто рассматривается как потенциальный побочный продукт, который может усилить экономический потенциал в противном случае убыточного процесса биопереработки, а также как средство снижения затрат на последующую переработку, необходимую для удаления технологических отходов.Продажа остаточной биомассы в качестве корма предпочтительнее продажи в качестве удобрения. Это видно из многочисленных публикаций и патентов (не рассматриваемых в этом обзоре), в которых конкретные отходы превращаются в SCP и оцениваются как пища для конкретных животных. Тем не менее, экологические проблемы теперь также играют важную роль в разработке новых продуктов SCP. Это особенно заметно в процессах, в которых используются парниковые газы: SCP водорослей из CO 2 и бактериальный SCP из метана.Такие процессы вряд ли будут экономически жизнеспособными в краткосрочной перспективе, поскольку при крупномасштабном выращивании еще предстоит преодолеть множество проблем, но они могут выжить там, где они могут получить выгоду от зеленой надбавки. Кроме того, экологические проблемы, а также экономические проблемы помогают стимулировать разработку продуктов из потоков отходов.
Помимо преимуществ для окружающей среды, ключевыми элементами при оценке экономической жизнеспособности процесса производства SCP являются общая стоимость продукта, капитальные вложения и рентабельность.Угальде и Кастрилло (2002) подсчитали, что при производстве грибковых SCP 62% от общей стоимости продукта будет приходиться на сырье, а 19% — на производственный процесс. По данным Aggelopoulos et al. (2014), затраты на сырье варьируются от 35 до 55% производственных затрат, тогда как эксплуатационные расходы, включая рабочую силу, энергию и расходные материалы, составляют 45–55%. Использование побочных потоков и отходов биомассы иногда рассматривается как средство снижения стоимости субстрата в тех случаях, когда субстрат не ставит под угрозу удобство использования конечного продукта.
Масштаб также важен для экономической жизнеспособности производства SCP. Между стоимостью и масштабом производства существует эмпирическая зависимость. Было доказано, что непрерывные операции являются наиболее прибыльными, и большинство процессов SCP, которые были реализованы в промышленных масштабах, были адаптированы к непрерывному проектированию (Ugalde and Castrillo, 2002). С другой стороны, мелкомасштабное домашнее производство некоторых продуктов может стать возможным во многом так же, как производство домашнего йогурта или грибов, и как было предложено для питания растительных клеток без растений (Poutanen et al., 2017).
Обновленная информация о промышленном производстве SCP — Игроки и возможности
В таблице 4 перечислены компании, которые, как сообщается, производят УПП или проявляют к ней интерес, с указанием веб-сайта и патентной информации, если таковая имеется. Ниже приводится краткое описание некоторых действующих компаний.
Альгеон Инк . производит β-глюкан и цельноклеточные продукты из фотосинтетических протистов Euglena gracillis . Компания Algaeon была основана в 2011 году и базируется в США
.
BlueBioTech Int.GmbH , компания по биотехнологии микроводорослей, которая работает более 10 лет, производя большое количество спирулины и хлореллы .
Калиста Инк . была основана как частная компания в 2011 году. Она производит FeedKind ® из метана на пилотном предприятии в Великобритании и начала распространение коммерческих образцов в 2017 году. Она планирует открыть более крупный завод (производящий до 20 000 тонн в год) в США в 2019 году.
Cangzhou Tianyu Feed Additive Co., Ltd — производитель и торговая компания, расположенная в Хэбэе, Китай, с 2004 года. Их основными продуктами являются дрожжевой порошок, хлорид холина, бетаин и аллицин, имеющие рынки в Юго-Восточной Азии, Восточной Азии, Океании, Южной Азии и Южной Америке. В компании работает 50 человек, а их общий доход составляет 5–10 миллионов долларов США.
CBH Qingdao Co., Ltd была признанной компанией на протяжении десятилетий, поставляющей ряд ингредиентов и добавок для кормовой и пищевой промышленности. Они могут поставлять продукцию, соответствующую стандартам FAMI-QS, ISO, GMP, KOSHER и HALAL.
Cyanotech Corporation — один из ведущих мировых производителей Spirulina , который продается в США и 30 других странах. Их оборот в 2016 году составил почти 32 миллиона долларов США. FDA присвоило статус GRAS продукту Cyanotech Spirulina в качестве пищевого ингредиента.
Компания Proteus Corporation, прародительница Earthrise , была основана в 1976 году. Они производят Spirulina со статусом GRAS. Они сертифицированы по GMP и имеют сертификат системы безопасности пищевых продуктов (FSSC) 22000: 2011.
E.I.D Parry Ltd., подразделение Parry Nutraceuticals является частью группы Murugappa с оборотом 4,4 млрд долларов США. Они используют технологию микроводорослей для производства нутрицевтиков, таких как Spirulina и Chlorella . Их продукция продается более чем в 40 странах, а их основные рынки находятся в Северной Америке, Европе, Юго-Восточной Азии и на Дальнем Востоке.
Эвглена Ко. Лтд. . была основана в Японии в 2005 году. Среди других продуктов, полученных из Euglena gracillis , Euglena Co.Ltd. разрабатывает обезжиренную эвглену как источник богатого белком корма для животных.
KnipBio была основана в 2013 году в США с целью предоставления доступных кормов для аквакультуры. Они производят KnipBio Meal из метанола с использованием метилотрофных бактерий и планируют начать коммерческое производство в 2018 году.
Лаллеманд Инк . канадская компания, специализирующаяся на разработке, производстве и продаже дрожжей и бактерий. Компания состоит из двух основных групп: Yeast Group (Монреаль, Канада) и Specialties Group (Тулуза, Франция).Они производят SCP для потребления человеком (LBI, Lake States ® , Engevita ™) из дрожжей S. cerevisiae и Torula .
LeSaffre производит дрожжи ( S. cerevisiae ) и продукты на основе дрожжей, включая SCP, такие как Lynside ® Nutri, Lynside ® ProteYn и родственные продукты (продукты Lesaffre Human Care), а также вкусовые ингредиенты на основе дрожжей. (Продукция Biospringer). В компании работают 7 700 сотрудников и более 80 дочерних компаний в более чем 40 странах мира.Их продукты и услуги продаются более чем в 180 странах, а их оборот в 2013 году составил ~ 1,6 миллиарда евро.
Marlow Foods Ltd производит микопротеин Quorn ™. Проект развития Quorn начался еще в 1960-х годах, когда они начали искать источник микробного белка, который понравился бы людям. Куорн классифицируется как безопасный, хорошо переносимый продукт регулирующими органами по всему миру, включая FDA и Агентство по пищевым стандартам Великобритании (FSA). Компания была приобретена Monde Nissin Corporation на Филиппинах за 831 миллион долларов США в 2015 году.
Nucelis Inc . была основана в 2010 году в США, но стала дочерней компанией Cibus Global в 2014 году. Наряду со скваленом, витамином D и пищевыми маслами Nucelis Inc. разрабатывает муку с высоким содержанием белка из дрожжей Yarrowia .
Nutrinsic базируется в США и имеет дочерние компании в Китае. Nutrinsic фокусируется на использовании сточных вод пищевой промышленности, производства напитков и биотоплива для производства кормов и удобрений. Они продают SCP для корма для животных под названием ProFloc ™, который, по описанию, содержит около 60% белка.Они открыли свое первое производство в США в 2015 году, используя сточные воды местной пивоварни.
Tangshan Top Bio-Technology Co., Ltd — производитель и торговая компания, расположенная в Хэбэе, Китай (материк). Их основные продукты: пивные дрожжи, автолизированные дрожжи, клеточная стенка дрожжей и дрожжевой экстракт, включая 100% натуральный, без ГМО, чистый дрожжевой порошок в качестве добавки к корму для животных по цене 1100–1250 долларов США за тонну и производственная мощность 15000 тонн. в год на производственную линию.Компания была основана в 2009 году и насчитывает около 200 сотрудников. Их основные рынки находятся в Китае, Восточной Азии, Западной Европе, Юго-Восточной Азии и Среднем Востоке, при этом 40–50% их продукции экспортируется.
ТерраВиа Холдингс, Инк. . — публичная американская компания, специализирующаяся на поставках ингредиентов для продуктов питания и средств ухода из эукариотических водорослей. TerraVia появилась в 2016 году, но является производным от компании Solazyme Inc., основанной в 2003 году. TerraVia использует традиционные реакторы с мешалкой для выращивания своих водорослей.
UniBio A / S, Дания — это МСП, владеющее правами на уникальную технологию ферментации — технологию U-Loop, которая позволяет превращать природный газ в продукт с высоким содержанием белка — UniProtein ® . UniProtein ® имеет содержание белка ~ 71% и может использоваться в кормах для животных. UniBio A / S была основана в 2001 году.
Unilever производит дрожжевой экстракт Marmite ® из отработанного зерна пивоварни. Количество сотрудников составляет около 169 000 человек, а оборот компании составил 52 доллара США.7 миллиардов в 2016 году.
Vega Pharma Ltd находится в провинции Чжэцзян, Китай. Группа компаний Vega занимается разработкой, производством и продажей фармацевтических препаратов, пищевых ингредиентов, продуктов для здоровья животных и пробиотиков. Они предлагают SCP, содержащий до 65% белка и относительно высокий уровень треонина, в корм животным в качестве побочного продукта производства глутамата натрия.
Таблица 4 . Промышленные предприятия, занимающиеся производством SCP.
Последние патенты (2001–2016)
Последние патенты (2001–2016 гг.), Относящиеся к производству SCP с помощью водорослей, грибов, бактерий и смешанных микробных популяций, перечислены в таблицах 5–8.Некоторые патенты, принадлежащие промышленным операторам, также показаны в таблице 4. Количество патентов, связанных с использованием водорослей, бактерий, дрожжей или смешанных популяций, относительно равномерно разделено. Также было зарегистрировано множество патентов, в которых микробная биомасса образует компонент кормовой смеси, которая предназначена для обеспечения белком и другими питательными веществами рыб или сельскохозяйственных животных. Они не были включены в Таблицы 5–8, поскольку неясно, сколько протеина обеспечивается микробом, а какое — другими компонентами, такими как соя, фасоль или рыбная мука.
Таблица 5 . Патенты, связанные с получением SCP из водорослей в 2001–2016 гг. *.
Таблица 6 . Патенты, относящиеся к производству SCP из дрожжей или нитчатых грибов в 2001–2016 гг. *.
Таблица 7 . Патенты, относящиеся к производству SCP из бактерий в 2001–2016 гг. *.
Таблица 8 . Патенты, относящиеся к производству SCP из смешанных микробных популяций (бактерий и / или дрожжей и / или водорослей) или в которых микроорганизм не был указан в течение 2001–2016 годов *.
Отрасли промышленности и университеты в Китае были особенно активны в регистрации патентов, связанных с УПП, в последние годы, причем около 70% патентов, выданных с 2001 года, были зарегистрированы в Китае. В Китае большое внимание уделяется производству SCP путем ферментации сельскохозяйственных или пищевых остатков бактериями, дрожжами и смешанными популяциями. Таким образом, производство SCP часто сочетается с биоремедиацией и переработкой отходов.
Несколько важных патентов, связанных с использованием соединений C1, таких как метанол и метан, были зарегистрированы до 2001 г. и не были включены в этот обзор.Однако появилось два новых патента на производство SCP из метанола и шесть на производство SCP из метана (Таблица 7). SCP из водорослей также продолжает генерировать патенты, при этом внимание уделяется рецептурам продуктов, а также продолжаются разработки методов выращивания (таблица 5).
Заключительные замечания
Как видно из Таблицы 4, существует широкий спектр отраслей, вовлеченных в производство SCP, некоторые из которых производят SCP как побочный продукт других процессов, а другие сосредоточены в первую очередь на SCP.SCP из мицелиальных грибов и дрожжей продолжает доминировать на устоявшихся рынках, особенно если рассматривать SCP для потребления человеком. Дрожжевые SCP имеют долгую историю использования, что способствует их дальнейшему распространению на рынке. Однако SCP для человека из нитчатых грибов, вероятно, останется ограниченным F. venenatum (Quorn ™) и ферментацией в твердом состоянии с другими пищевыми грибами из-за риска микотоксинов и долгого пути к нормативному признанию. Дрожжи также давно используются в качестве добавок к кормовой промышленности.Большая часть грибковых SCP, содержащихся в кормах для животных, является побочным продуктом производства продуктов питания и напитков, а также биоперерабатывающих заводов, на которых гриб сначала действует как биокатализатор для создания основного продукта, а затем обеспечивает обогащенные белком остатки, которые продаются в качестве корма. Грибковые SCP обладают такими преимуществами, как знакомство, хорошо зарекомендовавшие себя подходы к обработке и доступность. Основным препятствием является внедрение УПП новых видов, которые вызывают академический и патентный интерес, но которые трудно вывести на рынок.
Водоросли также имеют хорошо налаженные рынки как для пищевых продуктов, так и для кормов, хотя они традиционно ориентированы не на водоросли как SCP, а на пищевые добавки, содержащие омега-3 жирные кислоты, каротиноиды и витамины, с белком в качестве дополнительного преимущества. Поскольку с продуктами обращаются как с добавками или красителями, нормативные требования отличаются от требований для непосредственного использования в пищевых продуктах или кормах, что способствует появлению новых видов для потенциальных продуктов. Продукты из водорослей обычно имеют аромат, который может ограничивать количество, которое человек хотел бы потреблять, уменьшая потребность в обширной переработке для уменьшения РНК, но также ограничивая количество белка, поступающего в рацион.Однако несколько молодых МСП, вышедших на рынок, разрабатывают процессы производства продуктов со слабым вкусом, которые могли бы увеличить вклад водорослевого белка в рацион человека. У водорослей SCP есть преимущества, заключающиеся в обеспечении здоровых липидов вместе с белком, при потенциальном потреблении CO 2 . Он считается экологически чистым и очень «зеленым». Основными препятствиями являются стоимость производства и необходимость в новой рецептуре, чтобы сделать ее приемлемой для человека.SCP из водорослей, вероятно, будет широко использоваться в кормовой промышленности, если удастся снизить производственные затраты.
Бактериальный SCP в первую очередь ограничивается кормовой промышленностью, если не включает цианобактериальные продукты с нефотосинтезирующими бактериями. Некоторые бактериальные SCP в настоящее время являются побочным продуктом других отраслей промышленности, таких как производство глутамата натрия, и ожидается, что этот тип кормового продукта будет увеличиваться с расширением биоперерабатывающих заводов, как и в случае с дрожжами. Однако наиболее интересные современные разработки бактериальных SCP связаны с использованием метана в качестве источника углерода.Хотя использование метана для производства бактериальной биомассы не ново, движущие силы развития перешли от метана как дешевого источника углерода к бактериям как средству сокращения выбросов парниковых газов и потенциальной интеграции производства кормов с животноводством. . Низкая растворимость метана в сочетании с низкой скоростью роста бактерий является серьезным препятствием на пути к успеху в этой области. Однако молодые малые и средние предприятия, такие как UniBio и Calysta Inc., считают, что препятствия можно преодолеть.Бактериальные SCP, отличные от метана, обладают преимуществами в виде высоких скоростей продуцирования, но им не хватает из-за низкой степени узнаваемости и высокого содержания нуклеиновых кислот, что увеличивает затраты на обработку.
Первоначально SCP приобрели значение в питании людей во время войны, когда традиционных источников белка стало не хватать. Он снова вызвал интерес во второй половине двадцатого века из-за озабоченности по поводу удовлетворения потребностей в белке постоянно растущего населения мира. Эти опасения были глобальными, но когда мы рассматриваем текущий интерес к УПП, мы видим, что страны, которые сейчас проводят исследования и разработки новых УПП, как правило, являются странами с большим населением (например,г., Китай и Индия) и проблемы с недоеданием. Самые последние патенты, связанные с SCP, были поданы в Китае, что указывает на важность SCP для будущего производства продуктов питания и кормов. Быстрый рост продуктов SCP можно ожидать в Китае и, возможно, во всей Азии. Развитие SCP водорослей составляет исключение из этого наблюдения — поскольку в последние годы во всем мире было создано множество компаний для разработки продуктов, которые могут использовать текущую избыточную доступность CO 2 . Таким образом, движущие силы развития SCP водорослей несколько отличаются от движущих сил развития SCP бактериальных и грибковых.Производство SCP из метана разделяет эту экологическую озабоченность и возможность с развитием водорослей.
Расширение процессов биопереработки, как часть расширения концепций биоэкономики и экономики замкнутого цикла, также выступает в качестве движущей силы для разработки SCP для использования в качестве корма для животных, поскольку преобразование отходов в корм для животных обеспечивает лучшую отдачу от инвестиции, чем сжигание остаточной микробной биомассы или ее использование в качестве удобрения. Нормативное разрешение по-прежнему необходимо для использования новых продуктов в кормах для животных, но оно отличается от разрешений, необходимых для употребления в пищу человеком, и более широкий диапазон субстратов считается приемлемым, если продукт предназначен для использования в животных.Таким образом, можно ожидать большего расширения доступных SCP для кормов для животных, чем для продуктов питания для людей. Тем не менее, растет понимание неэффективности преобразования биомассы растений в SCP, который скармливается животным, а не напрямую людям, что также подтолкнет разработку безопасных SCP в качестве пищи.
На западе интерес к здоровому питанию и новинкам в еде помогает пробудить новый интерес к SCP, а также размывает границы того, какие продукты могут быть включены в SCP. Культуры клеток как растений, так и животных могут внести свой вклад в обеспечение питания в будущем (Poutanen et al., 2017), но не соответствуют определению SCP как происходящего из микробных клеток. Кроме того, формы, в которых можно употреблять SCP, продолжают развиваться. SCP дрожжевых грибов употребляли в течение десятилетий в виде клеточного экстракта в форме паст, которые можно намазывать на хлеб, тогда как SCP грибов, который используется в Quorn ™, был намеренно разработан как продукт, который можно было бы разделить на кусочки и ломтики, которые больше очень напоминают мясо. Недавно разработанные продукты часто имеют форму сухих порошков или муки, которые предназначены для смешивания с другими ингредиентами для создания продуктов, в которых отдельные компоненты не воспринимаются.Такие продукты подходят для добавления в протеиновые батончики и напитки, такие как смузи, которые сейчас популярны. Кроме того, продолжают развиваться твердотельные ферментации, в которых используются микробы для улучшения качества белка и вкусовых качеств растительных продуктов или ингредиентов с низким содержанием питательных веществ. Строго говоря, это не SCP, поскольку и микроб, и исходный субстрат вносят свой вклад в конечный продукт, но они также будут вносить свой вклад в поставку белка в будущем. Наличие широкого ассортимента пищевых продуктов, содержащих SCP, должно стимулировать дальнейшее расширение рынка.
Авторские взносы
AR, SH и MT в равной степени внесли свой вклад в исследование и написание этой статьи. MW предоставил информацию о SCP водорослей и грибов, участвовал в написании статьи, а также просмотрел и отредактировал рукопись.
Финансирование
Авторы благодарят ООО «ВТТ» за финансовую поддержку.
Заявление о конфликте интересов
Авторы являются сотрудниками VTT Technical Research Center of Finland Ltd. и заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.MW получал финансовую поддержку от Marlow Foods в 1986–1989 годах и работал в проектах, поддерживаемых Marlow Foods с 1989 по 1994 год, но не имел постоянного сотрудничества с ними.
Другие авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят докторов наук. Йоханна Бухерт, Лаура Руохонен и Тийна Накари-Сетяля за запрос на обзор и поддержку его публикации.
Сокращения
DSP, нисходящая обработка; ГМО, генетически модифицированный организм; GRAS, признанный безопасным; SCP, одноклеточный белок; QPS, Квалифицированная презумпция безопасности микроорганизмов в пищевых продуктах и кормах.
Список литературы
Аггелопулос, Т., Кациерис, К., Бекатору, А., Панди, А., Банат, И. М., и Кутинас, А. А. (2014). Твердотельная ферментация смесей пищевых отходов для производства одноклеточного белка, летучих ароматических веществ и жира. Food Chem. 145, 710–716. DOI: 10.1016 / j.foodchem.2013.07.105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ахмади, А. Р., Горчиан, Х., Хаджихосаини, Р., и Ханифар, Дж. (2010). Определение количества белка и аминокислот, экстрагированных из микробного белка (SCP) лигноцеллюлозных отходов. Пакистан J. Biol. Sci . 13, 355–361. DOI: 10.3923 / pjbs.2010.355.361
CrossRef Полный текст
Анбуселви, А., Махаланобис, С., Джа, М. (2014). Оптимизация одноклеточного белка с использованием зеленой лузги и бенгальской лузги с использованием дрожжей. Внутр. J. Pharm. Sci. Ред. Рез. . 28, 188–190.
Андерсон, К., Соломонс, Г. Л. (1984). «Первичный метаболизм и производство биомассы из Fusarium», в The Applied Mycology of Fusarium , ред. М. О. Мосс и Дж. Э. Смит (Кембридж: издательство Кембриджского университета), 231–250.
Андерсон, К., Лонгтон, Дж., Мэддикс, К., Скаммелл, Г.У. и Соломонов Г. Л. (1975). «Рост микрогрибов на углеводах», в Single-Cell Protein II , ред. С. Р. Танненбаум и Д. И. К. Ван (Кембридж, Массачусетс: MIT Press), 314–329.
Google Scholar
Апанди, Н. М., Мохамед, Р. М. С. Р., Латиффи, Н. А. А., Розлан, Н. Ф. М., и Аль-Гити, А. А. С. (2017). Содержание белков и липидов в микроводорослях Scenedesmus sp. биомасса, выращенная в сточных водах влажного рынка. Веб-конференция MATEC. 103: 06011. DOI: 10.1051 / matecconf / 201710306011
CrossRef Полный текст | Google Scholar
Багчи, Д. (2006). Нормативы в отношении нутрицевтиков и функциональных пищевых продуктов в США и во всем мире. Токсикология 221, 1–3. DOI: 10.1016 / j.tox.2006.01.001
PubMed Аннотация | CrossRef Полный текст
Baldensperger, J., Le Mer, J., Hannibal, L., and Quinto, P.J. (1985). Твердотельное брожение банановых отходов. Biotechnol. Lett . 7, 743–748. DOI: 10.1007 / BF01032289
CrossRef Полный текст | Google Scholar
Бамберг, Дж. (2000). Бритиш петролеум и глобальная нефть 1950-1975: вызов национализму . Кембридж: Издательство Кембриджского университета.
Google Scholar
Бхалла, Т. К., и Джоши, М. (1994). Обогащение белком яблочного жмыха путем совместного культивирования целлюлолитических плесневых грибов и дрожжей. World J. Microbiol. Биотехнология . 10, 116–117. DOI: 10.1007 / BF00357577
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боланд, М.J., Rae, A.N., Vereijken, J.M., Meuwissen, M.P.M., Fischer, A.R.H., van Boekel, M.A.J.S. и др. (2013). Будущие поставки белка животного происхождения для потребления человеком. Trends Food Sci. Технол . 29, 62–73. DOI: 10.1016 / j.tifs.2012.07.002
CrossRef Полный текст | Google Scholar
Бурдишон, Ф., Касарегола, С., Фаррох, К., Фрисвад, Дж. К., Гердс, М. Л., Хаммес, В. П. и др. (2012). Пищевые ферментации: микроорганизмы с технологическим полезным использованием. Внутр. J. Food Microbiol . 154, 87–97. DOI: 10.1016 / j.ijfoodmicro.2011.12.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chiou, P. W. S., Chiu, S. W., and Chen, C. R. (2001). Стоимость продукта ферментации Aspergillus niger в качестве диетического ингредиента для цыплят-бройлеров. Наука о кормах для животных. Технол . 91, 171–182. DOI: 10.1016 / S0377-8401 (01) 00224-3
CrossRef Полный текст | Google Scholar
Коппенс, П., да Силва, М. Ф., и Петтман, С. (2006). Европейские правила в отношении нутрицевтиков, диетических добавок и функциональных пищевых продуктов: основа, основанная на безопасности. Токсикология 221, 59–74. DOI: 10.1016 / j.tox.2005.12.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуй, В., Ван, К., Чжан, Ф., Чжан, С.-С., Чи, З.-М., и Мадзак, К. (2011). Прямое преобразование инулина в одноклеточный белок с помощью сконструированного Yarrowia lipolytica , несущего ген инулиназы. Процесс Биохим . 46, 1442–1448. DOI: 10.1016 / j.procbio.2011.03.017
CrossRef Полный текст | Google Scholar
Де Грегорио А., Мандалари Г., Арена Н., Нусита Ф., Триподо М. М. и Ло Курто Р. Б. (2002). Производство SCP и сырой пектиназы путем ферментации мякоти лимона в суспензионном состоянии. Биоресурсы. Технол . 83, 89–94. DOI: 10.1016 / S0960-8524 (01) 00209-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Оливейра, М.А.С.Л., Монтейро, М.П.С., Роббс, П.Г., и Лейте, С.Г.Ф. (1999). Рост и химический состав биомассы Spirulina maxima и Spirulina platensis при различных температурах. Aquacult. Инт . 7, 261–275. DOI: 10.1023 / A: 1009233230706
CrossRef Полный текст | Google Scholar
Дуарте, Л. К., Карвалейро, Ф., Лопес, С., Невес, И., и Гириу, Ф. М. (2008). Производство дрожжевой биомассы в гемицеллюлозном гидролизате отработанного зерна пивоварни. заявл.Biochem. Биотехнология . 148, 119–129. DOI: 10.1007 / s12010-007-8046-6
CrossRef Полный текст | Google Scholar
Дуонг, В. Т., Ахмед, Ф., Томас-Холл, С. Р., Куигли, С., Новак, Э., и Шенк, П. М. (2015). Микроводоросли с высоким содержанием белка и высоким содержанием липидов из северной Австралии в качестве потенциального сырья для кормов для животных и биодизеля. Фронт. Bioeng. Biotechnol. 3:53. DOI: 10.3389 / fbioe.2015.00053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эдельман, Дж., Фьюэлл А. и Соломонс Г. Л. (1983). Микопротеин — новая пища. Nutr. Abstr. Преподобный Clin. Нутр . 53, 471–480.
Энцинг, К., Плоег, М., Барбоза, М., и Сийтсма, Л. (2014). Продукты на основе микроводорослей для сектора пищевых продуктов и кормов: прогноз для Европы . Научные и политические отчеты JRC (JRC85709), редакторы М. Вигани, К. Паризи и Э. Родригес-Сересо (Бюро публикаций Европейского Союза).
Google Scholar
Эрдман, М. Д., Берген, В.Г. и Редди К. А. (1977). Аминокислотные профили и предполагаемая оценка питания одноклеточного белка из некоторых лактобацилл. заявл. Environ. Микробиол . 33, 901–905.
PubMed Аннотация | Google Scholar
Гао, Х., Сюй, Дж. Г. (2015). Метод измерения общего количества нуклеотидов в белковых продуктах . Патент № CN104316621A. Государственное ведомство интеллектуальной собственности Китайской Народной Республики.
Гао, Ю., Ки, Д., и Лю, Ю. (2012).Производство одноклеточного белка из соевой патоки с использованием Candida tropicalis. Ann. Микробиол . 62, 1165–1172. DOI: 10.1007 / s13213-011-0356-9
CrossRef Полный текст | Google Scholar
Гасеми Ю., Расул-Амини С. и Моровват М. Х. (2011). «Водоросли для производства SCP», в направлениях биохимических исследований. Науки и технологии биопроцессов , изд. М.-Т. Liong (Нью-Йорк: Hauppage) 163–184.
Google Scholar
Гольдберг, И.(1988). Будущие перспективы генно-инженерного одноклеточного белка. Trends Biotechnol. 6, 32–34. DOI: 10.1016 / 0167-7799 (88)
-3
CrossRef Полный текст | Google Scholar
Гувейя Л., Батиста А. Б., Соуза И., Раймундо А. и Бандарра Н. М. (2008). «Микроводоросли в новых пищевых продуктах», в Food Chemistry Research Developments , ed. К. Пападопулос (Нью-Йорк, штат Нью-Йорк: издательство Nova Science), 75–111.
Google Scholar
Грюневальд, М., Бекхаут, Т., Невеглиз, К., Гайлардин, К., ван Дейк, П. В. М., и Висс, М. (2014). Yarrowia lipolytica : оценка безопасности маслянистых дрожжей с большим промышленным потенциалом. Crit. rev. Микробиол . 40, 187–206. DOI: 10.3109 / 1040841X.2013.770386
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хамеш Э. Э. и Демир Т. (2015). Микробные рибонуклеазы (РНКазы): производство и возможности применения. World J. Microbiol.Биотехнология . 31, 1853–1862. DOI: 10.1007 / s11274-015-1945-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харун Р., Сингх М., Форд Г. М. и Данкуа М. К. (2010). Биотехнология микроводорослей для производства разнообразных потребительских товаров. Обновить. Sust. Энергия Ред. . 14, 1037–1047. DOI: 10.1016 / j.rser.2009.11.004
CrossRef Полный текст | Google Scholar
Хашем, М., Хешам, А. Э.-Л., Аламри, С. А., и Альрамман, С.А. (2014). Производство одноклеточного белка из потерянных плодов фиников Hanseniaspora uvarum KKUY-0084 и Zygosaccharomyces rouxii KKUY-0157. Ann. Микробиол . 64, 1505–1511. DOI: 10.1007 / s13213-013-0793-8
CrossRef Полный текст | Google Scholar
Хицман, Д. О. (1986). «Процесс Provesteen — ферментация сверхвысокой плотности», в Microbial Biomass Proteins , eds. М. Му-Янг и К. Ф. Грегори (Лондон: Elsevier Applied Science), 27–32.
Google Scholar
Джаласутрам В., Катарам С., Ганду Б. и Ануподжу Г. Р. (2013). Производство одноклеточного белка из переваренного и непереваренного помета птицы с помощью Candida utilis : оптимизация параметров процесса с использованием методологии поверхности отклика. Clean Technol. Environ. Политика 15, 265–273. DOI: 10.1007 / s10098-012-0504-3
CrossRef Полный текст | Google Scholar
Кадим, И. Т., Махгуб, О., Бакир, С., Фэй, Б., и Закупс, Р.(2015). Мясо из мышечных стволовых клеток: обзор проблем и перспектив. J. Integr. Сельское хозяйство . 14, 222–233. DOI: 10.1016 / S2095-3119 (14) 60881-9
CrossRef Полный текст | Google Scholar
Кам, С., Абедиан Кенари, А., Юнеси, Х. (2012). Производство одноклеточного белка в клещевой воде Lactobacillus acidophilus и Aspergillus niger . J. Aquat. Food Prod. Технол . 21, 403–417. DOI: 10.1080 / 10498850.2011.605539
CrossRef Полный текст | Google Scholar
Рыцарь, Н., Робертс, Дж., И Шелтон, Д. (2001). Термостойкость изделий QuornTM. Внутр. J. Food Sci. Технол . 36, 47–52. DOI: 10.1046 / j.1365-2621.2001.00424.x
CrossRef Полный текст | Google Scholar
Койвуринта Дж., Куркела Р. и Койвистойнен П. (1979). Использование Пекило, биомассы микрогриба из Paecilomyces varioti в колбасе и фрикадельках. Внутр. J Food Sci. Технол . 14, 561–570.
Google Scholar
Корночалерт, Н., Кантачоте, Д., Чайпрапат, С., и Теккарнярук, С. (2014). Использование Rhodopseudomonas palustris P1 стимулировало рост ферментированным экстрактом ананаса для обработки сточных вод латексных резиновых листов с целью получения одноклеточного белка. Ann. Микробиол . 64, 1021–1032. DOI: 10.1007 / s13213-013-0739-1
CrossRef Полный текст | Google Scholar
Кунасундари, Б., Муругайя, В., Каур, Г., Маурер, Ф. Х. Дж., И Кумар, С. (2013). Возвращаясь к применению одноклеточного белка Cupriavidus necator h26 и одновременному извлечению гранул биопласта. PLoS ONE 8: e78528. DOI: 10.1371 / journal.pone.0078528
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Курбаноглу, Э. Б., и Алгур, О. Ф. (2002). Производство одноклеточного белка из гидролизата бараньего рога бактериями. Биоресурсы. Технол . 85, 125–129. DOI: 10.1016 / S0960-8524 (02) 00094-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ланг, В., Беллисл, Ф., Аламович, К., Краплет, К., Борнет, Ф. Р. Дж., Slama, G., et al. (1999). Варьирование источника белка в смешанном питании изменяет кинетику глюкозы, инсулина и глюкагона у здоровых мужчин, оказывает слабое влияние на субъективное чувство сытости и не влияет на потребление пищи. евро. J. Clin. Нутр . 53, 959–965. DOI: 10.1038 / sj.ejcn.1600881
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Дж. З., Логан, А., Терри, С., и Спир, Дж. Р. (2015). Микробный ответ на производство одноклеточного белка и очистку пивоваренных сточных вод. Микробиологическая биотехнология . 8, 65–76. DOI: 10.1111 / 1751-7915.12128
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, К., Ян, Х., Ли, Ю., Ченг, Л., Чжан, М., Чжан, Л. и др. (2013). Новые биоконверсии городских сточных вод и CO2 в богатую белком биомассу Chlorella vulgaris. Биоресурсы. Технол . 132, 171–177. DOI: 10.1016 / j.biortech.2012.12.017
CrossRef Полный текст | Google Scholar
Лю Б., Ли Ю., Сун Дж., Чжан, Л., Донг, Дж., И Ян, К. (2014). Производство одноклеточного белка с двухступенчатой ферментацией для обработки отходов переработки картофельного крахмала. Целлюлоза 21, 3637–3645. DOI: 10.1007 / s10570-014-0400-6
CrossRef Полный текст | Google Scholar
Лю Б., Сун Дж., Ли Ю., Ню Дж., Ван З. и Ян К. (2013). На пути к промышленно осуществимой переработке отходов переработки картофельного крахмала смешанными культурами. заявл. Biochem. Биотехнология . 171, 1001–1010.DOI: 10.1007 / s12010-013-0401-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махмуд Р., Ибрагим М. и Али Г. (2016). Закрытый фотобиореактор для производства биомассы микроводорослей в условиях выращивания в помещении. J. Биомасса водорослей Utln . 7, 86–92.
Google Scholar
Мартинес, М. К., Санчес-Монтеро, Дж. М., Синистерра, Дж. В., и Баллестерос, А. (1990). Новые нерастворимые производные рибонуклеазы и эндонуклеазы для удаления нуклеиновых кислот в концентратах одноклеточных белков. Biotechnol. Прил. Биохим . 12, 643–652.
PubMed Аннотация | Google Scholar
Мюллер-Феуга, А. (2000). Роль микроводорослей в аквакультуре: ситуация и тенденции. J. Appl. Phycol . 12, 527–534. DOI: 10.1023 / A: 1008106304417
CrossRef Полный текст | Google Scholar
Нассери А. Т., Расул-Амини С., Моровват М. Х. и Гасеми Ю. (2011). Одноклеточный белок: производство и процесс. г. J. Food Technol . 6, 103–116.DOI: 10.3923 / ajft.2011.103.116
CrossRef Полный текст | Google Scholar
Эверланд М., Таусон А. Х., Ширер К. и Скреде А. (2010). Оценка продуктов, содержащих метан-утилизирующие бактерии, в качестве кормовых ингредиентов для животных с однокамерным желудком. Arch. Anim. Нутр . 64, 171–189. DOI: 10.1080 / 174503
6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Параскевопулу, А., Атанасиадис, И., Канеллаки, М., Бекатуру, А., Блекас, Г., и Киоссеоглу, В.(2003). Функциональные свойства белка сигловых клеток, продуцируемого кефирной микрофлорой. Food Res. Инт . 36, 431–438. DOI: 10.1016 / S0963-9969 (02) 00176-X
CrossRef Полный текст | Google Scholar
Песоа А. младший, Мансила И. М. и Сато С. (1996). Выращивание Candida tropicalis в гемицеллюлозном гидролизате сахарного тростника для производства микробного белка. Дж. Биотехнология . 51, 83–88. DOI: 10.1016 / 0168-1656 (96) 01572-6
CrossRef Полный текст | Google Scholar
Петерсен, Л.А. Х., Вилладсен, Дж., Йоргенсен, С. Б., и Герней, К. В. (2017). Смешивание и массообмен в пилотном биореакторе с U-образной петлей. Biotechnol. Bioeng . 114, 344–354. DOI: 10.1002 / бит. 26084
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Филипп, Ф.-Х., и Никс, Б. (2015). Обзор выбросов парниковых газов от свинарников: производство диоксида углерода, метана и закиси азота животными и навозом. Сельское хозяйство. Экосист. Окружающая среда . 199, 10–25.DOI: 10.1016 / j.agee.2014.08.015
CrossRef Полный текст
Поутанен, К., Нордлунд, Э., Пааси, Дж., Вехмас, К., и Окерман, М. (2017). Продовольственная экономика 4.0: видение VTT эры умного производства продуктов питания, ориентированного на потребителя . Хельсинки: VTT Technical Research Center of Finland Ltd. Доступно на сайте: http://www.vtt.fi/inf/pdf/visions/2017/V10.pdf) VTT VISIONS 10
Рафикул И. М., Джалал К. К. А. и Алам М. З. (2005). Факторы окружающей среды для оптимизации биомассы спирулины в лабораторной культуре. Биотехнология 4, 19–22. DOI: 10.3923 / biotech.2005.19.22
CrossRef Полный текст
Рао, М., Варма, А. Дж., И Дешмук, С. С. (2010). Производство Penicillium janthinellum одноклеточного белка, незаменимых аминокислот и ксиланазы. BioResource 5, 2470–2477.
Google Scholar
Рашад, М. М., Мохариб, С. А., и Джванни, Э. У. (1990). Преобразование дрожжевыми отходами манго или метанола в одноклеточный белок и другие метаболиты. Biol. Отходы 32, 277–284. DOI: 10.1016 / 0269-7483 (90) -2
CrossRef Полный текст | Google Scholar
Равиндер Р., Венкатешвар Рао Л. и Равиндра П. (2003). Исследования мутантов Aspergillus oryzae для производства одноклеточных белков из обезжиренных рисовых отрубей. Food Technol. Биотехнология . 41, 243–246.
Google Scholar
Рен, X., Ван, Дж., Ю, Х., Пэн, К., Ху, Дж., Руан, З. и др. (2016). Анаэробное и последовательное аэробное производство этанола с высоким титром и одноклеточного белка из кукурузной соломы, предварительно обработанной NaOH, штаммом Saccharomyces cerevisiae , модифицированным перетасовкой генома. Биоресурсы. Технол . 218, 623–630. DOI: 10.1016 / j.biortech.2016.06.118
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ришипал Р. и Филип Р. (1998). Селекция морских дрожжей для производства одноклеточного белка из отходов панциря креветок. Биоресурс Технол . 65, 255–256. DOI: 10.1016 / S0960-8524 (97) 00179-X
CrossRef Полный текст | Google Scholar
Родригес, Дж., Ферраз, А., Ногейра, Р. Ф. П., Феррер, И., Эспозито, Э., и Дюран, Н. (1997). Биодеградация лигнина аскомицетом Chrysondia sitophila. заявл. Biochem. Биотехнология . 62, 233–242. DOI: 10.1007 / BF02787999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Родригес-Завала, Дж. С., Ортис-Крус, М. А., Мендоса-Эрнандес, Г., и Морено-Санчес, Р. (2010). Повышенный синтез a-токоферола, парамилона и тирозина Euglena gracilis в условиях высокой продукции биомассы. Дж.Прил. Микробиол . 109, 2160–2172. DOI: 10.1111 / j.1365-2672.2010.04848.x
CrossRef Полный текст | Google Scholar
Рудраварам, Р., Чандель, А. К., Рао, Л. В., Хуэй, Ю. З., и Равиндра, П. (2009). «Био (одноклеточный) белок: вопросы производства, токсины и статус коммерциализации», в сельскохозяйственных отходов , ред. Г. С. Эшворт и П. Азеведо (Нью-Йорк, штат Нью-Йорк: Хауппейдж), 129–153.
Google Scholar
Safafar, H., Nørregaard, P.U., Ljubic, A., Мёллер, П., Холдт, С. Л., и Якобсен, К. (2016). Повышение содержания белка и пигментов у двух видов хлореллы, выращиваемых на промышленной технологической воде. J. Mar. Sci. Eng . 4:84. DOI: 10.3390 / jmse4040084
CrossRef Полный текст | Google Scholar
Шульц Э. и Ослаге Х. Дж. (1976). Состав и пищевая ценность одноклеточного белка (SCP). Anim. Feed Sci. Технол . 1, 9–24. DOI: 10.1016 / 0377-8401 (76)
-1
CrossRef Полный текст | Google Scholar
Сински, А.Дж. И Танненбаум С. Р. (1975). «Удаление нуклеиновых кислот в SCP» в Single-Cell Protein II , ред. С. Р. Танненбаум и Д. И. К. Ван (Кембридж, Массачусетс, Массачусетс, США), 158–178.
Google Scholar
Сисман, Т., Озлем, Г., Доган, Н., Оздал, М., Алгур, Э. Ф. и Эргон Т. (2013). Одноклеточный белок как альтернативный корм для рыбок данио, Danio rerio : токсикологическая оценка. Toxicol. Ind. Health 29, 792–799. DOI: 10.1177 / 0748233712442711
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смедли, К.О. (2013). Сравнение нормативного регулирования разрешенных ингредиентов, процессов утверждения и процедур оценки рисков для кормовых ингредиентов . Охватываемая юрисдикция: Бразилия, Канада, Китай, Европейский Союз, Япония, Южная Африка и США. Международная федерация кормовой промышленности, 12 июля 2013 г.
Google Scholar
Соломонов Г. Л. (1986). «Микробные белки и регуляторный клиренс для микобелка RHM», в Microbial Biomass Proteins , под ред. М.Му-Янг и К. Ф. Грегори (Лондон: Elsevier Applied Science), 19–26.
Google Scholar
Сонг, Х. Т., Ян, Ю. М., Лю, Д. К., Сюй, X. Q., Сяо, В. Дж., Лю, З. Л. и др. (2017). Конструирование рекомбинантного Yarrowia lipolytica и его применение в биотрансформации лигноцеллюлозы. Биоинженерия 17, 1–6. DOI: 10.1080 / 21655979.2017.1293219
CrossRef Полный текст | Google Scholar
Steinmann, J., Wottge, H.U., и Müller-Ruchholtz, W.(1990). Тестирование иммуногенности пищевых белков: in vitro, и in vivo, испытаний на крысах. Внутр. Arch. Аллергия Иммунол . 91, 62–65. DOI: 10.1159 / 000235091
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Таран М., Асади Н. (2014). Новый подход к экологически безопасному производству одноклеточного белка из нефтехимических сточных вод с использованием галофильных микроорганизмов в различных условиях. Petroleum Sci. Технол .32, 625–630. DOI: 10.1080 / 10
6.2011.596888
CrossRef Полный текст | Google Scholar
Тревельян, В. Э. (1976). Химические методы снижения содержания пурина в пекарских дрожжах, форме одноклеточного белка. J. Sci. Продовольственное сельское хозяйство . 27, 225–230. DOI: 10.1002 / jsfa.2740270305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тернбулл У. Х., Лидс А. Р. и Эдвардс Г. Д. (1992). Микопротеин снижает уровень липидов в крови у свободноживущих людей. г. J. Clin. Nutr. 55, 415–419.
PubMed Аннотация | Google Scholar
Ugalde, U., и Castrillo, J. I. (2002). «Белки отдельных клеток дрожжей и грибов», в Прикладная микология и биотехнология, Том II «Сельское хозяйство и производство пищевых продуктов», 2002 г. , ред. Г. Г. Хачатурян и Д. К. Арора (Амстердам: Elsevier Science B.V.) 123–149.
Валентино, М. Дж. Г., Ганадо, Л. С., и Ундан, Дж. Р. (2016). Белковый потенциал отдельных клеток эндофитных грибов, связанных с бамбуком, с использованием рисовых отрубей в качестве субстрата. Adv. Прил. Sci. Res . 7, 68–72.
Вигани, М., Паризи, К., Родригес-Сересо, Э., Барбоса, М. Дж., Сийтсма, Л., Плоег, М., и Энцинг, К. (2015). Продукты питания и корма из микроводорослей: рыночные возможности и проблемы для ЕС. Trends Food Sci. Технол . 42, 81–92. DOI: 10.1016 / j.tifs.2014.12.004
CrossRef Полный текст | Google Scholar
Виикари, Л., и Линко, М. (1977). Снижение содержания нуклеиновых кислот в SCP. Процесс Биохим .12, 35.
Google Scholar
Вагмаре, А.Г., Сальве, М.К., ЛеБлан, Дж. Г., и Арья, С.С. (2016). Концентрация и характеристика белков микроводорослей из Chlorella pyrenoidosa . Биоресурсы. Биопроцесс . 3, 16. DOI: 10.1186 / s40643-016-0094-8
CrossRef Полный текст | Google Scholar
Ван, Дж. П., Ким, Дж. Д., Ким, Дж. Э. и Ким, И. Х. (2013). Аминокислотная перевариваемость одноклеточного белка из Corynebacterium Ammoniagenes у растущих свиней. Anim. Feed Sci. Технол . 180, 111–114. DOI: 10.1016 / j.anifeedsci.2012.12.006
CrossRef Полный текст | Google Scholar
Уорд П. Н. (1998). Производство продуктов питания. Патент США № 5739030. Вашингтон, округ Колумбия: Бюро по патентам и товарным знакам США.
Вибе, М. Г. (2002). Микопротеин из Fusarium venenatum : хорошо зарекомендовавший себя продукт для потребления человеком. заявл. Microbiol. Биотехнология . 58, 421–427. DOI: 10.1007 / s00253-002-0931-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вибе, М.Г. (2004). QuornTM Myco-protein — Обзор успешного грибкового продукта. Миколог 18, 17–20. DOI: 10.1017 / S0269915X04001089
CrossRef Полный текст | Google Scholar
Willetts, A., и Ugalde, U. (1987). Производство одноклеточного белка из сыворотки. Biotechnol. Lett . 9, 795–800. DOI: 10.1007 / BF01028286
CrossRef Полный текст | Google Scholar
Wongputtisin, P., Khanongnuch, C., Khongbantad, W., Niamsup, P., and Lumyong, S.(2012). Скрининг и селекция Bacillus spp. для производства ферментированного кортикального соевого шрота. J. Appl. Микобиол . 113, 798–806. DOI: 10.1111 / j.1365-2672.2012.05395.x
CrossRef Полный текст | Google Scholar
Wongputtisin, P., Khanongnuch, C., Kongbuntad, W., Niamsup, P., Lumyong, S., and Sarkar, P.K (2014). Использование изолятов Bacillus subtilis из Туа-нао для улучшения питательных свойств оболочки соевых бобов для однокомпонентного кормления. Lett. Прил. Микробиол . 59, 328–333. DOI: 10.1111 / lam.12279
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Се Д., Джексон Э. Н. и Чжу К. (2015). Устойчивый источник омега-3 эйкозапентаеновой кислоты из метаболически модифицированной Yarrowia lipolytica : от фундаментальных исследований до коммерческого производства. заявл. Microbiol. Биотехнология . 99, 1599–1610. DOI: 10.1007 / s00253-014-6318-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюй, Дж.Г. (2015). Метод оценки степени разрушения нуклеотидов Метод определения и технология производства гидролизата свободных нуклеиновых кислот в белковых продуктах . Патент № CN104515817A. Государственное ведомство интеллектуальной собственности Китайской Народной Республики.
Ядав, Дж. С. С., Безавада, Дж., Аджила, К. М., Ян, С., Тьяги, Р. Д. и Сурампалли, Р. Ю. (2014). Смешанная культура Kluyveromyces marxianus и Candida krusei для производства одноклеточного белка и удаления органической нагрузки из сыворотки. Биоресурсы. Технол . 164, 119–127. DOI: 10.1016 / j.biortech.2014.04.069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ядав, Дж. С. С., Ян, С., Аджила, К. М., Безавада, Дж., Тьяги, Р. Д., и Сурампалли, Р. Ю. (2016). Производство пищевых одноклеточных белков, определение характеристик и восстановление остаточных ферментированных сывороточных белков из сыворотки с помощью ультрафильтрации. Пищевой Биопрод. Процесс 99, 156–165. DOI: 10.1016 / j.fbp.2016.04.012
CrossRef Полный текст | Google Scholar
Яздян, Ф., Гаджизаде, С., Шоджаосадати, С.А., Халилзаде, Р., Джаханшахи, М., и Носрати, М. (2005). Производство одноклеточного белка из природного газа: оптимизация параметров и оценка РНК. Иранский J. Biotech . 3, 235–242.
Google Scholar
Зепка, Л.К., Якоб-Лопес, Э., Голдбек, Р., Соуза-Соарес, Л.А., и Кейруш, М.И. (2010). Пищевая ценность одноклеточного белка, продуцируемого Aphanothece microscopica Nägeli. Биоресурсы. Технол .101, 7107–7111. DOI: 10.1016 / j.biortech.2010.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, H. Y., Piao, X. S., Li, P., Yi, J. Q., Zhang, Q., Li, Q. Y., et al. (2013). Влияние одноклеточного белка, заменяющего рыбную муку в рационе, на показатели роста, усвояемость питательных веществ и морфологию кишечника у свиней-отъемышей. Asian Australas J. Anim. Sci . 26, 1320–1328. DOI: 10.5713 / ajas.2013.13200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, Г., Чжан В. и Чжан Г. (2010). Производство одноклеточного белка с использованием отработанного порошка стручкового перца, полученного при экстракции капсантина. Lett. Прил. Микробиол . 50, 187–191. DOI: 10.1111 / j.1472-765X.2009.02773.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, М.-Х., Чи, З., Чи, З.-М., и Мадзак, К. (2013). Одновременная продукция одноклеточного белка и рекомбинантного антибактериального пептида путем экспрессии гена антибактериального пептида в Yarrowia lipolytica . Процесс Биохим . 48, 212–217. DOI: 10.1016 / j.procbio.2013.01.003
CrossRef Полный текст | Google Scholar
Гомеостаз концентрации белка и мРНК в растущих клетках
Модель стохастической экспрессии генов
В моделях с постоянной скоростью скорость транскрипции на ген и скорость трансляции на мРНК постоянны 1,5,24 (рис. 1a). Модели с постоянной скоростью предсказывают постоянное количество мРНК, пропорциональное количеству копий гена и независимо от объема клетки.Однако экспериментальные наблюдения на клетках растений и млекопитающих выявили пропорциональность между количеством мРНК и объемом клеток для клеток с постоянным числом копий генома 18,19,20 . Более того, даже сравнивая клетки до и после репликации генома (S-фаза), коэффициент пропорциональности между мРНК и объемом клетки не показывает каких-либо очевидных изменений. Напротив, постоянная скорость транскрипции на ген может предсказывать удвоение скорости транскрипции после репликации всего генома, что приводит к более высокой концентрации мРНК.В одном классе моделей с постоянной скоростью 26,27,34 явно рассматривается детерминированный экспоненциальный рост объема клетки. Возникающее в результате возмущение концентраций из-за репликации генома подавляется в пределе длительного времени жизни, но все еще значимо для молекул с коротким временем жизни, например, мРНК (см. Рис. 1 в ссылке 27 ).
Рис. 1
Модель стохастической экспрессии генов растущей клетки в сравнении с моделями постоянной скорости. a В модели постоянной скорости скорость транскрипции пропорциональна количеству копий гена, а скорость трансляции пропорциональна количеству мРНК.Эти предположения подразумевают, что количество гена и количество мРНК являются ограничивающими факторами в экспрессии генов. b На этапе 1 модели растущих клеток мы вводим в качестве ограничивающих факторов РНК-полимеразы (РНКП) и рибосомы. Гены разного цвета транскрибируются с разной скоростью. Здесь k 0 — константа, а регуляция генов грубо выражена во фракции распределения генов \ (\ phi _i = g_i {\ mathrm {/}} \ mathop {\ sum} \ nolimits_j {\ kern 1pt} g_j \). г i — эффективное количество копий гена i (также учитывающее силу промотора). n — общее количество RNAP. Скорость трансляции мРНК зависит от количества активных рибосом ( f a r ), скорости трансляции k t и доли мРНК i в общем пуле мРНК. В следующем разделе (Единая фазовая диаграмма экспрессии генов и клеточного роста) мы ослабим наши предположения и рассмотрим ситуации, в которых ограничивающими факторами экспрессии генов становятся номер гена и номер мРНК
С учетом трансляции различные эксперименты показали что количество рибосом является ограничивающим фактором, а не количество мРНК.Наиболее прямым доказательством является закон роста: скорость роста клеток пропорциональна доле рибосомных белков в общем протеоме (с постоянным коэффициентом, зависящим от условий роста) 35 для бактериальных клеток 30,31,36 и почкующиеся дрожжевые клетки 32 . Это означает, что постоянная часть рибосом активно транслирует мРНК. Эти результаты предполагают, что в целом клетки находятся ниже предела насыщения, при котором существует слишком много рибосом, которые мРНК могут связывать.Поэтому мы предположим биологическую ситуацию, в которой мРНК в клетке конкурируют за ограничивающий ресурс активной трансляции рибосом, поэтому скорость трансляции одного типа мРНК пропорциональна количеству активных рибосом, умноженному на ее долю в общем пуле мРНК.
Что касается транскрипции, эксперименты показали, что мутанты делящихся дрожжей с измененным размером клетки регулируют глобальную транскрипцию, чтобы поддерживать одинаковые скорости транскрипции на объем клетки независимо от содержания клеточной ДНК.Изменения общей транскрипции коррелируют с согласованными изменениями в занятости генов РНК-полимеразами 37 . Эти результаты предполагают, что количество RNAPs может быть ограничивающим фактором транскрипции, а не количество генов, и аналогичные доказательства были показаны для бактериальных клеток 38 и клеток млекопитающих 39 . Однако в тех же экспериментах на делящихся дрожжах 37 было также обнаружено, что у мутантов с остановкой клеточного цикла общая скорость транскрипции перестала расти, когда объем клетки превышал определенное значение, что предполагало, что ДНК становится ограничивающей транскрипцию при низких значениях. Концентрация ДНК.Этот результат предполагает, что избыток RNAP может привести к тому, что количество генов станет ограничивающим фактором в определенных условиях. В этом разделе мы сосредоточимся на сценарии, при котором как РНКП, так и рибосома ограничивают экспрессию генов, которую мы обозначим как Фаза 1. На этой фазе мы покажем, что количество мРНК и количество белков пропорциональны объему клетки и растут в геометрической прогрессии. В следующем разделе (Единая фазовая диаграмма экспрессии генов и клеточного роста) мы рассмотрим более общую модель, в которой ограничивающая природа РНКП и рибосом может нарушаться, а динамика количества мРНК и белков отличается.
Чтобы решить проблему ограничивающего характера RNAP, мы определяем эффективное количество копий гена g i для каждого гена, чтобы учесть количество его копий и силу связывания его промотора, которая определяет его способность конкурировать за RNAP. . Скорость транскрипции для одного конкретного гена i пропорциональна доле RNAP, которые работают с его геном (ами), \ (\ phi _i = g_i {\ mathrm {/}} \ mathop {\ sum} \ nolimits_j { \ kern 1pt} g_j \), которую мы обозначаем как долю распределения генов.Генная регуляция, таким образом, является крупнозернистой во фракции распределения генов ϕ i . Скорость транскрипции не зависит от числа копий генома, поскольку изменение числа генома оставляет неизменной фракцию распределения одного гена, что согласуется с рядом экспериментальных результатов на различных организмах 18,19,20,37 .
Фактически, явная регуляция гена также может быть включена в нашу модель (методы) с зависящим от времени g i .В таких сценариях g i может быть функцией концентраций белка (например, действие факторов транскрипции изменяет скорость транскрипции). Такие модели приведут к более сложной динамике концентраций мРНК и белка. Однако, поскольку нас интересует глобальное поведение экспрессии генов и роста клеточного объема, мы не сосредотачиваемся на этих сложных правилах в этой рукописи. Наши выводы относительно экспоненциального роста количества мРНК и белков для конститутивно экспрессируемых генов и экспоненциального роста объема клеток на глобальном уровне не зависят от динамики экспрессии генов отдельных генов.
Далее m , p , r , n представляют собой количество мРНК, белков, рибосом и РНК-полимераз соответственно. Белки ( p ) также включают RNAP ( n ) и рибосомы ( r ) 30 . Мы рассматриваем деградацию мРНК со временем деградации τ для всех генов. Количество белков уменьшается только при делении клеток (хотя добавление конечной скорости разложения белков не влияет на наши результаты).{{k_t \ left ({m_i {\ mathrm {/}} \ mathop {\ sum} \ limits_j {\ kern 1pt} m_j} \ right) f_ar}} p_i + 1. $$
(3)
Здесь k 0 , k t — константы, характеризующие скорость транскрипции (трансляции) одиночной РНКП (рибосомы). f a — доля активных рибосом, которую мы предполагаем постоянной в данной питательной среде 30,32 .Мы отмечаем, что неспецифически связанные РНКП описаны у бактерий 40,41 . Мы обсудим их эффект позже. Для простоты предположим, что значения ϕ i не меняются во времени. Формально это можно представить как соответствующую мгновенной репликации генома. В действительности конечная продолжительность репликации ДНК и различное время инициации репликации для разных генов приводят к ϕ i , которые изменяются во время репликации ДНК.Позже мы проанализируем более полную версию модели, которая включает эти эффекты дозировки генов, но сначала мы рассмотрим упрощенный сценарий константы ϕ i , который отражает основные особенности проблемы.
Мы предполагаем, что объем клетки приблизительно пропорционален общей массе белка, т. Е. \ (V \ propto M = \ mathop {\ sum} \ nolimits_j {\ kern 1pt} p_j \), что является хорошим приближением для бактерий 42,43 и клетки млекопитающих 17 .Чтобы упростить следующие формулы, мы считаем, что каждый белок имеет одинаковую массу, и устанавливаем плотность клеток равной 1.
Из-за быстрой деградации мРНК по сравнению с продолжительностью клеточного цикла 44,45 , количество мРНК может быть хорошо приблизительно определено. как находящийся в устойчивом состоянии. Мы можем выразить усредненное по ансамблю количество мРНК гена i как
$$ \ left \ langle {m_i (t)} \ right \ rangle = k_0 \ phi _i \ left \ langle {n (t)} \ правый \ rangle \ tau. $$
(4)
Уравнение (3) затем приводит к временной зависимости среднего числа рибосом, \ (d \ left \ langle r \ right \ rangle {\ mathrm {/}} dt = k_tf_a \ phi _r \ left \ langle r \ right \ rangle \), воспроизводя автокаталитическую природу образования рибосом и скорость роста
$$ \ mu = k_tf_a \ phi _r, $$
(5)
определяется относительной численностью активных рибосом в протеоме 30,32 .
Точно так же количество белка i растет как \ (d \ left \ langle {p_i} \ right \ rangle {\ mathrm {/}} dt = k_tf_a \ phi _i \ left \ langle r \ right \ rangle \ ). По мере роста и деления клетки динамика становится нечувствительной к начальным условиям, поэтому количество белков также будет расти экспоненциально. 21 . Соотношение между средними значениями двух белков в установившемся состоянии определяется соотношением скорости их производства, поэтому \ (\ langle {p_i} \ rangle {\ mathrm {/}} \ langle {p_j} \ rangle = \ phi _i {\ mathrm {/}} \ phi _j \).Среднее количество мРНК отслеживает количество РНК-полимераз согласно формуле. (4), а значит, тоже растет экспоненциально. На протяжении клеточного цикла мы имеем
$$ \ left \ langle {m_i (t)} \ right \ rangle = m_b (i) {\ mathrm {exp}} \ left ({\ mu t} \ right), $$
(6а)
$$ \ left \ langle {p_i (t)} \ right \ rangle = p_b (i) {\ mathrm {exp}} \ left ({\ mu t} \ right), $$
(6b)
, где m b ( i ) ( p b ( i )) — количество мРНК (белка) гена i при рождении клетки.m_i} \ right \ rangle = k_0 \ tau \ phi _i \ phi _n \). Результаты не зависят от объема клетки и числа копий генома, что согласуется с экспериментальными данными для различных организмов 18,19,20,22 .
Мы явно принимаем во внимание деление клеток и для конкретности используем модель «сумматора» для деления клеток, рассматривая белок-инициатор I . Белок-инициатор накапливается с момента рождения клетки, запускает деление клетки по достижении порога деления I c и затем уничтожается (или «сбрасывается», например.g., после инициации репликации ДНК в бактериях, АТФ-связанная DnaA дефосфорилируется до АДФ-связанной формы) 46,47,48 . Во время события деления мы предполагаем, что белки и мРНК делятся между двумя дочерними клетками в соответствии с биномиальным распределением 49 . Белок-инициатор устанавливает шкалу абсолютного количества белков, и среднее количество белков, продуцируемых в одном клеточном цикле, равно Δ ( i ) = I c ϕ i / ϕ I 47 900 48.Поскольку количество белка увеличивается вдвое в течение одного клеточного цикла, среднее количество белка гена i при рождении клетки составляет p b ( i ) = I c ϕ i / ϕ I и соответствующее среднее количество мРНК при рождении клетки составляет m b ( i ) = k 0 I c c τϕ i ϕ n / ϕ I .Отметим, что точный молекулярный механизм деления клеток не влияет на наши результаты.
Мы подтверждаем приведенные выше аналитические расчеты численным моделированием. Они также будут фиксировать стохастические колебания уровней экспрессии генов, которые не были включены в предыдущий анализ. Из-за короткого времени жизни мРНК производство белков может быть приблизительно выражено мгновенными всплесками 24 . Мы вводим параметр размера пакета b 0 как среднее количество белков, производимых за один пакет, \ (b_0 \) = \ (k_tf_a \ langle {r (t)} \ rangle {\ mathrm {/}} \ langle {\ mathop {\ sum} \ nolimits_j {\ kern 1pt} m_j} \ rangle \ times \ tau \) ≈ \ (k_tf_a \ phi _r {\ mathrm {/}} \ left ({k_0 \ phi _n} \ right) \), независимо от объема ячейки. ϕ i для N = 200 белков равномерно отбираются в логарифмическом пространстве, при этом сумма, превышающая ϕ i (включая рибосомы и RNAP), должна быть равна единице. Мы выбираем параметры, которые являются биологически значимыми для бактерий: время удвоения T = ln (2) / μ = 150 мин, r b = 10 4 , n b = 10 3 , b 0 = 0.8, I c = 20, ϕ r = 0,2, f a = 0,7 и τ = 3,5 мин, другие числовые данные см. В разделе «Методы». Наши выводы не зависят от конкретного выбора параметров.
На рис. 2a мы показываем типичные траектории из нашего моделирования объема клетки, количества белка и количества мРНК для одного и того же гена в течение нескольких поколений. Чтобы проверить экспоненциальный рост белка и мРНК, мы усредняем количество белка и мРНК при фиксированной относительной фазе развития клеточного цикла, которая нормализуется по времени генерации и изменяется от 0 до 1.Усредненные значения количества белков и мРНК (кружки) хорошо предсказываются экспоненциальным ростом, уравнения. (6a) и (6b) (черные линии) без каких-либо подгоночных параметров, как показано на рис. 2b с 3 одиночными траекториями на заднем плане. Мы также моделируем регулируемый ген с помощью зависящего от времени числа копий гена и получаем качественно аналогичные результаты (методы, дополнительный рисунок 1).
Рис. 2
Экспоненциальный рост объема клетки, количества белков, количества мРНК; гомеостаз концентрации белка и мРНК на протяжении клеточного цикла. a Показаны численно смоделированные траектории объема клеток, количества белков и количества мРНК ( ϕ i = 0,018). b Усредненные значения количества белков и мРНК высокоэкспрессируемого гена ( ϕ i = 0,04) показаны (кружки) с тремя одиночными траекториями на заднем плане. Черные линии — это теоретические предсказания уравнений. (6а) и (6б). В среднем более 130 клеточных циклов. Цветная полоса представляет собой стандартное отклонение (то же самое для ( c )). c Показаны усредненные значения концентраций белка и мРНК того же гена, что и в ( b ) (кружки). Черные линии — это теоретические предсказания уравнений. (7а) и (7б). На заднем плане показаны три траектории. d Три траектории расходящихся концентраций в сценарии, когда количество белка и объем клеток растут независимо. См. Числовые данные в разделе «Методы». e График разброса количества белков при делении клетки ( P d ) v.с. количество белка при рождении клетки ( P b ). Кружки — это данные с разбивкой по ячейкам. Черная линия представляет собой линейную аппроксимацию разделенных данных с наклоном 1,03, что соответствует корреляциям сумматора
. Соответствующие траектории концентраций белка и мРНК показаны на рис. 2c с ограниченными колебаниями вокруг предсказанных усредненных значений (черные линии). Напротив, если количество белка и объем клеток растут экспоненциально, но независимо, соотношение между ними будет расходиться по мере накопления эффектов шума, демонстрируя поведение случайного блуждания (рис.2г). Учитывая зависимость количества мРНК от клеточного цикла и гомеостаза концентрации белка на протяжении всего клеточного цикла, экспериментальное наблюдение на Escherichia coli , показывающее незначительную корреляцию между количеством мРНК и концентрацией белка 50 , согласуется с нашей моделью и не противоречит сильная корреляция концентрации мРНК и концентрации белка 51 .
В рамках нашей модели мы можем также изучить динамику количества белков: как количество белков при делении клеток коррелирует с количеством белков при рождении клетки? Мы обнаруживаем, что корреляции следуют «сумматору» (т.е.е. количество добавленных новых белков не коррелирует с количеством при рождении), как показано на рис. 2e. Хотя это было количественно определено у различных организмов в отношении объема клеток 8,9,11,52,53,54 , проверке корреляций между содержанием белка при рождении и делении клеток уделялось значительно меньше внимания 55,56 . В связи с этим мы изучаем автокорреляционную функцию концентрации белка во времени. Мы обнаружили, что автокорреляционная функция является приблизительно экспоненциальной, а время корреляции ограничено снизу временем удвоения (дополнительный рис.2). Оба этих результата обеспечивают экспериментально проверяемые прогнозы.
Эффекты конечной продолжительности репликации гена
До сих пор мы рассматривали константу ϕ i на протяжении всего клеточного цикла, предполагая мгновенную репликацию генома. В этом разделе мы ослабим это условие и изучаем эффекты конечного времени репликации ДНК. Мы рассматриваем бактериальную модель репликации ДНК, а именно E. coli , для которой механизм репликации ДНК хорошо охарактеризован 57 .Продолжительность репликации ДНК постоянна и определяется как период –. Соответствующее деление клеток следует после приблизительно постоянной продолжительности, известной как период D . Подробная информация о модели репликации ДНК находится в разделе «Методы». На рис. 3а показаны временные траектории фракции распределения генов, концентрации мРНК и концентрации белка одного гена для времени удвоения T = 30 мин с C + D = 70 мин. Репликация ДНК вводит зависимую от клеточного цикла модуляцию ϕ i .Резкое увеличение на ϕ i соответствует репликации специфического гена i (рис. 3а) ϕ i → 2 ϕ i . Однако по мере репликации других генов относительная доля гена – в общем геноме уменьшается. Эта модуляция распространяется на концентрацию мРНК, которая по существу отслеживает динамику ϕ i из-за ее короткого времени жизни.Модуляция концентрации мРНК также влияет на концентрацию белка, но с гораздо меньшей амплитудой. Эти результаты можно проверить экспериментально, одновременно отслеживая процесс репликации ДНК и концентрацию мРНК.
Рис. 3
Эффекты конечной продолжительности репликации ДНК. a Временная траектория доли распределения генов (треугольники), концентрации мРНК (квадраты) и концентрации белка (кружки) белка с большим числом копий ( μ p ≈ 10 4 , см. ( b )).Время удвоения составляет T = 30 мин, и мы используем значения периодов C и D из исх. 57 , а именно C = 35 мин и D = 35 мин. В этой ситуации клетка подвергается репликации ДНК на протяжении всего клеточного цикла. Тем не менее, шум в ϕ i не распространяется на шум концентрации белка. Значение концентрации мРНК увеличено в 5 раз для наглядности. b Моделируется экспоненциально растущее население (см. Методы).Величина шума определяется как квадрат CV концентраций белка. Среднее количество белка ( μ p ) — это количество белка на средний объем клетки. Эффекты дозирования генов из-за репликации ДНК не создают значительного глобального внешнего шума. Рассматриваются два разных времени удвоения.
Шум в экспрессии генов можно классифицировать как внутренний и внешний шум 58 . В то время как собственный шум обусловлен стохастической природой химических реакций, участвующих в экспрессии генов, считается, что внешний шум возникает из-за колебаний внешних условий и является общим для подмножества белков.Эксперименты выявили глобальный внешний шум, который влияет на все концентрации белка в геноме 50,59,60 . Поскольку все гены подвергаются конечной продолжительности репликации ДНК, возникает соблазн приписать конечную продолжительность репликации ДНК как один из основных источников глобального внешнего шума 34 . В нашей модели из предыдущего раздела (постоянные ϕ i на протяжении клеточного цикла) нет глобального внешнего шума (дополнительный рис.3). Глобальный внешний шум может появиться после того, как мы введем зависящие от времени ϕ i из-за репликации ДНК. Однако мы обнаружили, что коэффициент вариации (CV, отношение между стандартным отклонением и средним значением) наиболее высоко экспрессируемых белков составляет всего около 0,02 в рамках модели растущих клеток (рис. 3b), что намного меньше, чем в экспериментах 50 , 59 . Отметим, что небольшой внешний шум из-за репликации генов также наблюдается в моделях с постоянной скоростью 26,27 .Более того, недавние эксперименты и моделирование показали, что значительная часть внешнего шума уровня экспрессии мРНК может быть отнесена к колебаниям числа копий RNAP 28 . В рамках нашей модели колебания уровня РНКП приведут к внешнему шуму в концентрациях мРНК.
Единая фазовая диаграмма экспрессии генов и клеточного роста
Экспериментальные наблюдения на E. coli 30 и почкующихся дрожжах 32 подтверждают наше предположение, что рибосомы ограничивают трансляцию.Экспериментальные наблюдения на клетках растений и млекопитающих 18,19,20 и делящихся дрожжах 37 также согласуются с нашим предположением, что РНК-полимераза ограничивает транскрипцию. Однако, как мы обсуждали в первом разделе, в тех же экспериментах на делящихся дрожжах 37 ДНК становилась лимитирующей для транскрипции при низкой концентрации ДНК. Следовательно, мы не можем исключить возможность того, что в некоторых случаях из-за слишком большого количества RNAP, ДНК становится ограничивающим ресурсом для транскрипции, а не количество RNAP.Точно так же, когда рибосомы слишком многочисленны по сравнению с числом транскриптов, ограничивающим фактором для трансляции становится номер транскрипта, а не число рибосом.
В этом разделе мы обобщаем нашу модель, предполагая, что каждый ген имеет верхнюю границу количества RNAP ( n s ), которые могут одновременно работать с ним. Возможным крайним случаем является то, что ген полностью загружен RNAP, для которых RNAP ограничены только стерическими препятствиями.Такое же предположение сделано для мРНК с верхней границей рибосом ( r s ), которые могут работать с ней одновременно. Отметим, что точный механизм насыщения ДНК и мРНК выходит за рамки нашей грубой модели. Если количество РНКП (рибосом) превышает верхнюю границу, скорость транскрипции (трансляции) ограничивается количеством гена (мРНК) аналогично моделям с постоянной скоростью.
Мы определяем отношение белка к ДНК (отношение PTD) как сумму количества белков, деленную на сумму эффективных номеров генов,
$$ \ gamma = \ mathop {\ sum} \ limits_i {\ kern 1pt} p_i {\ mathrm {/}} \ mathop {\ sum} \ limits_i {\ kern 1pt} g_i.$
(8)
По мере того, как соотношение PTD становится больше, например, из-за достаточно большого объема клетки с фиксированным количеством генов, количество RNAP (рибосом) будет превышать максимальную нагрузку, которую могут выдерживать общие гены (мРНК). Мы подробно обсудили Фазу 1 (ни ДНК, ни мРНК не насыщены) ранее, и мы резюмируем наши прогнозы относительно перехода от Фазы 1 к другим фазам ниже.
Фаза 2: В фазе 2 ограничивающим фактором транскрипции становится количество копий гена, а скорость транскрипции пропорциональна количеству копий гена (рис.4б). Пороговое значение PTD для перехода от фазы 1 к фазе 2 составляет (Методы),
$$ \ gamma _1 = \ frac {{n_s}} {{\ phi _n}}. $$
(9)
Здесь n s — это верхняя граница количества RNAP, которые могут работать с одним геном, а ϕ n — доля распределения генов RNAP. Поскольку мРНК не насыщена, количество белка и объем клетки растут экспоненциально с той же скоростью роста, что и в фазе 1, уравнение.(5), и гомеостаз концентрации белка остается в силе. Однако, поскольку скорость продукции мРНК теперь пропорциональна количеству копий гена, концентрация мРНК больше не является постоянной по мере роста объема клетки (методы). На этапе 2, даже если скорость транскрипции удваивается после репликации генома, скорость трансляции пропорциональна относительной доле мРНК в общем пуле мРНК и, следовательно, все еще не зависит от числа копий генома. Средняя концентрация белка равна доле распределения генов (\ (\ left \ langle {c_i} \ right \ rangle = \ phi _i \)).Недавно предложенные теоретические модели экспрессии генов согласуются с этой фазой 61 . Что касается транскрипции, наша модель в фазе 2 эквивалентна моделям с постоянной скоростью, и мы подтвердили, что как для бактерий, так и для клеток млекопитающих, типичное время жизни мРНК достаточно короткое по сравнению со временем удвоения, чтобы различать фазу 1 и фазу 2 (дополнительные Рис.4).
Рис. 4
Фазы экспрессии генов и роста объема клеток. a Теоретическая фазовая диаграмма экспрессии генов и клеточного роста в рамках нашей модели.Ось x — это отношение белка к ДНК ( γ ). Когда γ < γ 1 , ни ДНК, ни мРНК не являются насыщенными. Количество мРНК, количество белка и объем клетки растут экспоненциально со скоростью роста, заданной долей рибосомного гена в общем геноме ( ϕ r ). Когда γ 1 < γ < γ 2 , ДНК является насыщенной, а мРНК — нет. Количество белка и объем клетки по-прежнему растут экспоненциально, в то время как количество мРНК постоянно пропорционально количеству гена.Когда γ > γ 2 , и ДНК, и мРНК являются насыщенными. Количество белка и объем клеток растут линейно, а скорость роста объема клеток задается числом копий генома. b Динамика экспрессии гена в фазе 2. На этой фазе ДНК насыщается RNAP, поэтому скорость транскрипции пропорциональна эффективному количеству копий гена, g i . n s — это верхняя граница количества RNAP, которые могут работать с одним геном одновременно.Скорость трансляции такая же, как и в фазе 1. Для упрощения формулы мы предполагаем, что все рибосомы активны (чтобы учесть эффект неактивной фракции, r следует заменить на f a r ). c Динамика экспрессии гена в фазе 3, в которой и ДНК, и мРНК являются насыщенными. Скорость трансляции пропорциональна количеству мРНК. r s — это верхняя граница количества рибосом, которые могут работать с одной мРНК одновременно.
Фаза 3: по мере увеличения объема клетки мРНК также может насыщаться.Ограничивающим фактором для трансляции теперь является количество копий мРНК (рис. 4c). Пороговое значение PTD для перехода от фазы 2 к фазе 3 составляет (Методы)
$$ \ gamma _2 = \ frac {{k_0 \ tau r_sn_s}} {{\ phi _r}}. $$
(10)
Здесь r s — верхняя граница количества рибосом, которые могут работать на одной мРНК. На этой фазе скорость трансляции пропорциональна количеству мРНК, а количество белков линейно растет как \ (\ dot p_i = k_tk_0g_i \ tau n_sr_s \), с линейной скоростью роста, пропорциональной количеству гена.Следовательно, в предположении, что объем клетки определяется общим числом белков, объем клетки также линейно растет с линейной скоростью роста, пропорциональной общему количеству гена,
$$ \ mu _l = k_tk_0 \ tau n_sr_s \ mathop {\ sum} \ limits_i {\ kern 1pt} g_i, $$
(11)
и, следовательно, пропорционально количеству копий генома. Как и на этапе 2, концентрация мРНК уменьшается по мере увеличения объема клетки, однако концентрация белка по-прежнему остается постоянной, а средняя концентрация белка равна доле распределения генов (\ (\ left \ langle {c_i} \ right \ rangle = \ phi _i \), Методы).В фазе 3, даже несмотря на то, что объем клеток растет линейно, популяция все равно растет экспоненциально со скоростью роста популяции. Однако не существует общей связи между фракцией рибосом в протеоме и скоростью роста популяции, в отличие от закона роста в фазах 1 и 2. Мы суммируем предсказанную фазовую диаграмму клеточного роста на рис. 4a.
Чтобы получить некоторое представление о параметрах, связанных с предлагаемой фазовой диаграммой, мы оцениваем коэффициент PTD в E.coli . Принимая во внимание типичный объем клеток E. coli как 1 мкм 3 , плотность белка как 3 × 10 6 белков / мкм 3 и общее количество кодирующих белок генов в E. coli как 4000 62 , мы оцениваем отношение белка к ДНК для E. coli как γ ~ 1000. Оценки двух пороговых значений отношений PTD (см. Методы) предполагают, что γ 1 ~ 1500 и γ 2 ~ 20,000.
Эти оценки предполагают, что клетки E. coli дикого типа обнаружены в фазе 1, но близки к фазе 2. Мы отмечаем, что на фактические пороговые значения отношения PTD для переходов между различными фазами роста могут влиять другие факторы. , , например, ., Гетерогенный размер генов, но мы предполагаем, что общий сценарий перехода от фазы 1 к фазе 3 по мере увеличения отношения белка к ДНК должен быть в целом применимым. По мере увеличения отношения PTD мы прогнозируем переход от экспоненциального роста к линейному росту количества белков и объема клеток (дополнительный рис.5). Мы предлагаем будущие эксперименты по изучению потенциального перехода от экспоненциального к линейному росту объема клеток, например, с использованием нитчатой E. coli , где деление клеток и репликация генов подавлены. Подобные эксперименты также могут быть проведены для более крупных клеток, например, клеток млекопитающих, в которых легче достичь перехода от экспоненциального роста к линейному увеличению объема клетки. Предварительные результаты экспериментов по измерению роста клеточной массы клеток млекопитающих 63 и дрожжевых клеток 64 действительно показывают переход от экспоненциального роста к линейному росту, когда клеточная масса превышает пороговое значение, что согласуется с нашим предсказанием.
На бактериях было показано, что существуют избыточные РНКП, неспецифически связанные с ДНК 40,41 . В Методиках мы рассматриваем модифицированную модель, учитывающую разделение RNAP на свободные RNAP, удлиняющиеся RNAP, связанные с промотором RNAP и неспецифически связанные RNAP. Скорость транскрипции определяется концентрацией свободных РНКП с помощью кинетики Михаэлиса-Ментен 40,65 . Мы обнаружили, что наши выводы остаются неизменными с приблизительно постоянной долей активно транскрибирующих RNAP в общем количестве RNAP для фазы 1 (дополнительный рис.6). Таким образом, действие неспецифически связанных РНКП заключается в перенормировке константы транскрипции k 0 в Фазе 1 (уравнение (1)) на постоянный коэффициент. Переход от фазы 1 к фазе 2 качественно не затронут (дополнительный рисунок 7), а пороговое отношение PTD γ 1 (уравнение (9)) от фазы 1 к фазе 2 изменяется на постоянный коэффициент (методы) . Мы отмечаем, что альтернативные механизмы насыщения генов могут возникать при введении различных классов RNAP через насыщение свободных RNAP и кинетику Михаэлиса-Ментен (методы).
Новый инструмент для исследования контроля производства белка в клетках человека
Кредит: CC0 Public Domain
Исследователи SAHMRI разработали capCLIP, совершенно новый метод изучения того, как клетки контролируют время и направленность синтеза белка, процесс, который, когда он не работает, имеет решающее значение для развития серьезных заболеваний и расстройств.
Исследовательская группа SAHMRI по передаче сигналов и регуляции генов под руководством профессора Криса Прауда и старшего научного сотрудника д-раКирк Дженсен изучает eIF4E, небольшой белок, необходимый для рибосом, фабрик по производству белка в клетке. Группа обнаружила, что можно химически «пометить» eIF4E, чтобы присоединить его к молекулам мРНК-мессенджера, которые содержат информацию, используемую для создания всех белков в клетке.
Критический шаг в создании белка наступает, когда инструкции, содержащиеся в мРНК, считываются рибосомами. Затем рибосома производит белок из набора из 20 различных строительных блоков, называемых аминокислотами.
«Используя capCLIP, теперь мы можем идентифицировать набор мРНК, которые связаны с eIF4E, и, таким образом, мы можем точно установить, какие белки производятся клеткой в данный момент времени или при определенных условиях окружающей среды».
Синтез новых белков постоянно происходит почти во всех живых клетках и связывает гены и функции клетки, ответственные почти за все функции клетки.
«Таким образом, capCLIP предоставляет нам подробные» считывания «клеточных функций.Во-вторых, новый метод также позволяет нам напрямую изучить, как ключевой путь, вызывающий рак, влияет на функцию eIF4E, — сказал профессор Прауд.
Крайне важно, чтобы этот процесс синтеза белка строго контролировался, поскольку дефекты его контроля тесно связаны с раком, а изменения в активности eIF4E также играют ключевую роль в расстройствах аутистического спектра, восприятии боли и циркадных ритмах.
«Мы изучали eIF4E в течение многих лет, но наши исследования были сильно ограничены, потому что до сих пор мы не могли оценить, какие мРНК eIF4E были связаны в клетках в различных условиях», — сказал профессор Прауд.
«Новый метод может широко применяться в широком спектре исследований, в том числе на доклинических моделях таких заболеваний, как рак и неврологические расстройства».
Благодаря этой работе наука получила более подробное представление о контроле производства белка в клетках и сделала важный шаг к лучшему пониманию причин возникновения серьезных заболеваний, таких как рак, и расстройств, таких как расстройство аутистического спектра.
Исследование было опубликовано в журнале Nucleic Acids Research .
Хранить жир или сжигать его? Нацеленность на один белок меняет положение
Дополнительная информация:
Кирк Б. Дженсен и др., CapCLIP: новый инструмент для исследования контроля трансляции в клетках человека посредством захвата и идентификации взаимодействия eIF4E-мРНК, Nucleic Acids Research (2021).DOI: 10.1093 / nar / gkab604
Предоставлено
Южно-Австралийский институт здравоохранения и медицинских исследований (SAHMRI)
Цитата :
Новый инструмент для исследования контроля производства белка в клетках человека (2021 г., 6 сентября)
получено 12 ноября 2021 г.
с https: // физ.org / news / 2021-09-tool-probe-protein-production-human.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Влияние обработки сои на пористость клеточной стенки и усвояемость белка
Помимо наличия факторов, препятствующих питанию, усвояемость соевых белков ограничена в интактных клетках проницаемостью клеточной стенки для протеолитических ферментов.Обработка пищевых продуктов может регулировать проницаемость клеточной стенки и, следовательно, доступность ферментов протеазы для внутриклеточных белков. В этом исследовании соевые бобы обрабатывались различными способами, например, приготовление применяли отдельно или с процессами прорастания или ферментации, и изменение проницаемости клеточной стенки исследовали с помощью конфокальной микроскопии для визуализации проникновения зондов FITC-декстрана в изолированные клетки / кластеры клеток. Также контролировали диффузию флуоресцентно меченного трипсина в клетки и кластеры клеток.Наблюдения под микроскопом показали, что ферментация и прорастание, а также протеолитические ферменты увеличивают проницаемость вареных клеток семядолей сои. Диффузия трипсина во все изолированные клетки наблюдалась на ранней стадии смоделированного переваривания in vitro , тогда как диффузия в кластеры клеток была отложена из-за большего размера и ограниченной проницаемости кластеров клеток. Небольшое, хотя и значительное увеличение перевариваемости белка наблюдалось, когда кипячение сочеталось с ферментацией или прорастанием, вероятно, из-за предварительного переваривания запасных белков и инактивации ингибиторов трипсина.Это исследование подчеркивает положительную роль ферментации и прорастания в улучшении перевариваемости белка в соевых бобах, но в целом предполагает, что проницаемость клеточной стенки для трипсина играет незначительную роль в степени переваривания белка интактными клетками сои.
Эта статья в открытом доступе
Подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуйте снова?
белков и клеток | Дом
Protein & Cell публикует оригинальные исследовательские статьи, обзоры и комментарии, касающиеся последних достижений в междисциплинарных областях биологии и биомедицины, с акцентом на исследования белков и клеток.
Предметные области включают биохимию / биофизику, клеточную биологию, биологию развития, генетику, иммунологию, микробиологию, молекулярную биологию, нейробиологию, онкологию, науку о белках, структурную биологию и трансляционную медицину. Кроме того, Protein & Cell освещает основные моменты исследований, новости и мнения, а также комментарии, охватывающие политику исследований и тенденции финансирования в Китае, и предоставляет форум для содействия академическому обмену между исследователями из различных областей наук о жизни.
Protein & Cell — это рецензируемый журнал с открытым доступом, публикуемый ежемесячно. Плата за открытый доступ (плата за обработку статей) для этого журнала любезно спонсируется издательством «Высшее образование», Пекинским институтом наук о жизни, Китайской академией наук и Биофизическим обществом Китая. Авторы могут публиковать статьи в журнале без дополнительной оплаты.
Зачем публиковать у нас
- Мы предоставляем форум для содействия академическому обмену между исследователями из различных областей наук о жизни.
- Мы публикуем основные моменты исследований, новости, обзоры и комментарии, охватывающие последние разработки в междисциплинарных областях биологии и биомедицины, уделяя особое внимание исследованиям белков и клеток.
- Публикация с открытым доступом гарантирует, что вашу статью можно будет легко найти, получить к ней доступ, использовать и поделиться, что максимизирует ваше влияние и станет трамплином для дальнейшего изучения.
- Мы обеспечиваем высокий уровень удовлетворенности авторов, из которых 94% из наших опубликованных авторов сообщают, что они определенно или вероятно опубликуют снова у нас.
Соединения, разрушающие белок, нацелены на молекулы болезней вне клеток | Наука
Стратегия горячих лекарств заставляет клетки избавляться от болезнетворных белков вместе с их мусором. Но эта концепция, которая включает в себя пометку нарушителей спокойствия молекулой, которая направляет их в уплотнитель клеточного мусора, сработала только с нежелательными белками внутри клеток. Теперь исследователи разработали три тесно связанных техники, чтобы пометить повреждающие внеклеточные белки, чтобы они попадали внутрь и таким же образом удалялись.Этот поворот может привести к новым методам лечения различных состояний, от аутоиммунных заболеваний до бактериальных инфекций. И компании выстраиваются в очередь, чтобы заняться утилизацией белка извне.
Распад белка «действительно захватил сердца и умы людей, работающих в биофармацевтике», — говорит Кэролайн Бертоцци, химик из Стэнфордского университета. Ее группа разработала один из новых подходов, и она является основателем Lycia Therapeutics, стартапа, разрабатывающего препараты, использующие эту стратегию. Последние достижения, добавляет она, «открывают новые возможности для нацеливания на различные соединения.”
Первые двери для внутриклеточных белков открылись в 2001 году. Исследователи под руководством Крейга Круза, биохимика Йельского университета, сообщили о создании двухкомпонентных молекул, называемых химерами, с одним концом, который фиксируется на внутриклеточном раковом белке под названием METAP2. Другой конец вызывает белок, называемый убиквитинлигазой E3, который добавляет химическую метку к METAP2, помечая его для разрушения протеасомой, первичным рециклером белка клетки. Метод Крюса, известный как химеры, нацеленные на протеолиз, или PROTAC, вместе с ответвлениями приобрел огромную популярность, поскольку фармацевтические компании вложили миллиарды долларов в инвестиции, надеясь разрушить внутриклеточные белки, вызывающие широкий спектр заболеваний.Согласно апрельскому анализу, опубликованному в отчете Nature Reviews Drug Discovery , восемнадцать таких белков-деструкторов проходят или близятся к клиническим испытаниям. Оказалось, что несколько уже одобренных препаратов, например талидомид, работают таким же образом.
В отличие от обычных лекарств, которые склеивают активный сайт болезнетворного белка, объясняет Алессио Чиулли, биохимик из Университета Данди, препараты PROTAC полностью удаляют белки. Это может дать деструкторам более продолжительное воздействие и потенциально позволить им отключать «неподдающиеся взаимодействию» белки путем связывания в любом месте молекулы, вместо того, чтобы нацеливаться на активный сайт.
Тем не менее, у PROTAC есть ограничения. Важно отметить, что, по словам Бертоцци, около 40% белков в организме работают вне клеток — на их поверхности, в кровотоке или во внеклеточном матриксе. Благодаря новым методам эти белки также становятся жизнеспособными мишенями для деградеров. В августе 2020 года в Nature Бертоцци и ее коллеги сообщили о LYTAC, или химерах, нацеленных на лизосомы. Эти молекулы связываются с внеклеточным белком-мишенью и рецептором на поверхности клетки, который втягивает белок в клетку и доставляет его в лизосому, уплотнитель мусора, ответственный за разрушение внеклеточных белков.
Но LYTAC, как и PROTAC, действуют во всех тканях, а не в специфических тканях, что повышает риск побочных эффектов. Новые усовершенствования позволяют ограничить их активность печенью, главным органом тела по расщеплению белков. Летом 2020 года, в течение нескольких недель, группы под руководством Бертоцци, химика-синтетика Дэвида Шпигеля из Йельского университета и Вейпинга Танга, медицинского химика из Университета Висконсина в Мэдисоне, опубликовали препринты о разрушителях внеклеточного белка, нацеленных на печень. «Не случайно несколько лабораторий пришли к единому мнению, — говорит Бертоцци.
Этой весной появилось
рецензируемых статей Бертоцци и Танга. В марте в ACS Central Science Тан сообщил о разработке химер, которые связываются с рецептором фактора роста на клеточной поверхности, который обычно мутирует и сверхэкспрессируется в опухолях. Химера переправляет эти белки второму партнеру по связыванию, рецептору асиалогликопротеина (ASGPR), которого много в клетках печени. Захваченные рецепторы перемещаются в клетку и отправляются в лизосомы.
Двухголовая молекула
Молекулярная химера помогает направить связанный с болезнью белок к рецептору, который направляет пучок в клетку печени, где белок пережевывается.
D. CAIANIELLO et al. , NATURE CHEMICAL BIOLOGY , 17, HTTPS://DOI.ORG/10.1038/S41589_021_00851_1 (2021), АДАПТИРОВАНО К. БИКЕЛ / SCIENCE
25 марта Nature Chemical Biology online her, Bertozzi опубликовал почти идентичную стратегию. Химеры, разработанные обеими группами, основаны на высокоспецифичных антителах для захвата белков-мишеней. Группа Бертоцци также нацелена на внеклеточные белки с помощью белковых фрагментов, называемых пептидами.Другая часть химеры состоит из трех молекул сахара, которые связывают ASGPR.
Антитела — это большие молекулы, производство которых обычно дорого, и их необходимо вводить внутривенно. Пептиды также необходимо вводить внутривенно, а ферменты в организме могут быстро их разрушить. Группа Шпигеля изобрела химеры, которые решают эти проблемы. 19 августа в онлайн-режиме Nature Chemical Biology команда сообщила о захвате целевого белка с использованием гораздо меньших, похожих на лекарства молекул, при использовании сахарной группы для связывания рецептора ASGPR.Затем исследователи показали, как на клетках, так и на мышах, что такие химеры могут избирательно разрушать антитела или цитокины, внеклеточные белки, которые, как известно, вызывают нежелательное воспаление.
Чиулли говорит, что деградация внеклеточного белка идеально подходит для лечения аутоиммунных заболеваний и амилоидных заболеваний, таких как болезнь Альцгеймера, когда белки-изгоями собираются вместе вне клеток. Он добавляет, что статья Шпигеля — «хорошее дополнение к новому подходу».
Внеклеточная деградация набирает обороты, как это делали до этого PROTAC.В июне Lycia собрала 50 миллионов долларов для борьбы с белками внеклеточных заболеваний, а на прошлой неделе она подписала сделку с Eli Lilly and Company на сумму 35 миллионов долларов авансом с обещанием выплатить еще 1,6 миллиарда долларов в виде лицензионных платежей, если препараты будут соответствовать ключевым этапам. Spiegel передал лицензию на свою технологию Biohaven Pharmaceuticals. И Тан говорит, что он вел переговоры с биотехнологическими и фармацевтическими компаниями о лицензировании своей технологии. Избавление от клеточного мусора может принести большую пользу во многих отношениях.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.