Полезное от клиники «Геном» в Калининграде
Тестостерон – ключевой андроген, который несет ответственность за формирование мужского организма и влияет на репродуктивную функцию — принимает участие в процессе сперматогенеза.
Оволосение согласно мужскому типу, грубый тембр голоса тоже «заслуга» тестостерона. Кроме того, он увеличивает плотность костных тканей, обладает жиросжигающим эффектом и увеличивает объемы мышечной массы за счет ускорения процессов синтеза белка.Тестостерон усиливает половое влечение мужчин и может становиться причиной высокой агрессивности. Наиболее активный андроген — свободный тестостерон, вырабатывается клетками семенников, является продуктом периферического метаболизма. Небольшой биосинтез данного гормона возможен корой надпочечников.
При завышенных показателях тестостерона нередко наблюдаются следующие проявления:
— внезапные и сильные приступы гнева;
— избыточное оволосение тела;
— угревые гнойные высыпания.
Если тестостерона недостаточно, то существует риск формирования остеопороза, снижение либидо, ухудшение интеллектуальной деятельности, возникновение эректильных дисфункций и мужского бесплодия.
Чтобы получить достоверную картину о мужском гормональном статусе при подозрении на бесплодие, необходимо проверить не только уровень андрогенов, но и целого ряда других гормонов.
Определение гормонального статуса обязательно включает выявление уровня концентрации следующих гормонов:
— ФСГ;
— тестостерон;
— ЛГ.
Пройти исследование гормонального фона мужчины могут в клинике «Геном-Калининград», а по результатам обследования — проконсультироваться с урологом-андрологом. Состояние гормонального статуса мужчины важно оценить при бесплодии пары.
К сведению. В яичках у мужчин есть два вида клеток: клетки Сертоли и клетки Лейдига. В клетках Лейдига происходит синтез мужских половых гормонов, в клетках Сертоли – сперматозоидов. Эти процессы регулируются гормонами гипофиза, расположенного в головном мозге — фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ).
Эти процессы регулируются гормонами гипофиза, расположенного в головном мозге — фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ).
ФСГ – это основной регулятор сперматогенеза, его уровень в крови показывает, способны ли яички производить нормальные сперматозоиды.
ЛГ – это основной и единственный стимулятор производства и секреции тестостерона в клетках Лейдига яичек. Гормон гипофиза пролактин воздействует вместе с ЛГ на клетки Лейдига и участвует в процессе сперматогенеза. При повышении его уровня в крови – так называемом синдроме гиперпролактинемии – происходит подавление выработки тестостерона и, соответственно, сперматогенеза.
Другой гормон гипофиза – тиреотропный гормон ТТГ – в норме активатор синтеза пролактина. При некоторых заболеваниях щитовидной железы может повышаться уровень пролактина, и как следствие, снижаться уровень общего тестостерона.
Пролактин отвечает за то, чтобы яички успешно выполняли свою сперматогенную функцию. При нормальном уровне гормона они продуцируют достаточное количество сперматозоидов с правильным строением и подвижностью, достаточной для проникновения в женскую яйцеклетку и ее оплодотворения.
При нормальном уровне гормона они продуцируют достаточное количество сперматозоидов с правильным строением и подвижностью, достаточной для проникновения в женскую яйцеклетку и ее оплодотворения.
Гормон эстрадиол, который синтезируется в яичках и в жировой ткани, участвует в регуляции синтеза ФСГ и ЛГ, и в норме также необходим для нормального созревания сперматозоидов. Повышение уровня эстрадиола в крови – гиперэстрогенемия, приводит к снижению синтеза ФСГ и ЛГ. Гиперэстрогенемия возможна при заболеваниях яичек и при ожирении.
ГсПГ – это белок глобулин, который образуется в печени, и при некоторых заболеваниях и состояниях, сопровождающихся поражением печени, может происходить снижение уровня ГсПГ, и, соответственно, уровня общего тестостерона. Происходит это также при сахарном диабете второго типа и при ожирении.
Кроме того при ожирении происходит снижение чувствительности клеток к тестостерону, а также снижается синтез ЛГ в гипофизе. В жировой ткани содержится фермент ароматаза, за счет которой тестостерон превращается в эстрадиол, и, как следствие уровень общего тестостерона снижается.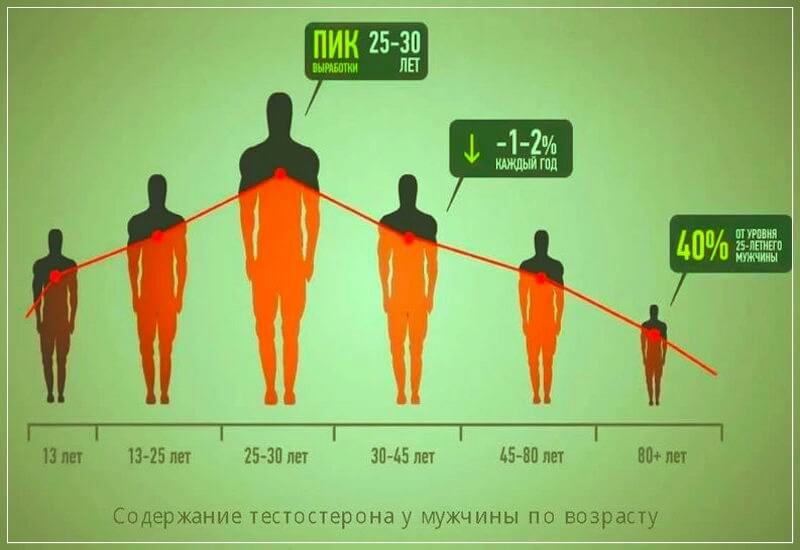
Тестостерон у женщин: почему он растёт, падает и что с этим делать
Тестостерон считается чисто мужским гормоном. И напрасно. Слабому полу этот андроген (так называются мужские гормоны) необходим не менее, чем сильному. Но есть нюансы.
Зачем женщинам тестостерон
Это слово у многих ассоциируется с чем-то эмоциональным — мужественностью, агрессивностью, напором. Однако весь этот тестостероновый мачизм всего лишь побочка, а то и вовсе миф . У гормона полно куда более важных задач, нежели превращение мужчины в мачо. И эти функции — общие для обоих полов.
Тестостерон играет ключевую роль в десятках процессов внутри организма. Он (в компании с другими веществами, естественно) обеспечивает прочность костям, участвует в производстве красных кровяных телец, влияет на переработку жиров, укрепляет мышцы, воздействует на настроение и когнитивные возможности мозга, усиливает или ослабляет сексуальное желание в разные периоды жизни… В общем, функций не перечесть, и женское тело без тестостерона столь же немыслимо, как и мужское.
Есть и ещё один фактор, который делает тестостерон необходимым для женщин. Мужской гормон — это незаменимый предшественник женских половых гормонов. То есть из тестостерона вырабатываются эстрогены. Те самые, что во многом делают женщину женщиной: запускают половое созревание, заставляют расти грудь, «включают» менструацию и позволяют забеременеть и выносить плод.
Из этого, кстати, следует парадоксальный факт: чем меньше у женщины «мужского» гормона, тем она менее женственна, ведь эстрогены у неё тоже в дефиците. Впрочем, и повышенное количество тестостерона тоже ни к чему хорошему не ведёт.
Как распознать, что уровень тестостерона у женщины отличается от нормального
Опытные терапевты могут сделать это даже на глаз. Вот несколько косвенных, но наглядных симптомов , сочетание которых говорит о том, что с важным гормоном происходит что-то не то.
Признаки повышенного тестостерона у женщин
- Плохое состояние кожи. Она слишком жирная, на ней много прыщей.
- Оволосение. У женщины появляются усики над верхней губой и волосы по мужскому типу на других частях тела. При этом у некоторых дам одновременно развивается лобное облысение.
- Заметное снижение тембра голоса.
- Увеличение мышечной массы.
- Увеличенный клитор.
- Тучность. Фигура превращается в «яблоко»: сильно полнеют талия, живот, грудь, плечи, при этом ноги остаются стройными.
- Нарушения менструального цикла.
Признаки пониженного тестостерона у женщин
- Лишний вес. Недостаток гормона влияет на фигуру так же, как и избыток.
- Мышечная слабость, вялость. Тело выглядит рыхлым и беспомощным.
- Постоянная усталость, подавленное настроение.
- Пониженное либидо: женщине совсем не хочется секса.
- Проблемы с памятью и целеустремлённостью.
Конечно, все эти признаки — косвенные. Они позволяют лишь заподозрить ненормальный уровень тестостерона. Чтобы подтвердить или опровергнуть предположение, надо сделать анализ крови на общий уровень этого гормона.
Какой должна быть норма тестостерона у женщин
Сдав анализ, можете сами сравнить его результаты со стандартом — нормами тестостерона для женщин разного возраста. Уровень гормона измеряется в нанограммах на децилитр (нг/дл). Если в бланке с результатами анализов вы видите другие единицы измерения, конвертируйте их в нг/дл здесь.
- 12–16 лет: <7–75 нг/дл;
- 17–18 лет: 20–75 нг/дл;
- 19 лет и старше: 8–60 нг/дл.
Причины скачков тестостерона могут быть самыми разными, от вполне естественных до опасных.
Почему тестостерон у женщин может быть понижен
Как правило, выделяют три основные причины :
- Естественное снижение уровня гормона, связанное со старением и менопаузой. С возрастом яичники функционируют менее активно, в том числе вырабатывают меньше тестостерона.
- Приём гормональных препаратов — тех же противозачаточных таблеток или пилюль для уменьшения побочных эффектов климакса. В них содержится эстроген, который заставляет наше тело вырабатывать меньше тестостерона.

- Заболевания яичников, гипофиза или надпочечников — основных поставщиков андрогена в организм.
Почему тестостерон у женщин может быть повышен
За увеличение количества тестостерона чаще всего в ответе :
- Гирсутизм. Так называется генетическое заболевание, которое приводит к усиленной выработке тестостерона. Внешне гирсутизм проявляет себя обильным ростом волос на лице, груди, руках и ногах.
- Синдром поликистозных яичников. Это заболевание эндокринной системы, побочкой которого является увеличенная выработка половых гормонов.
- Врождённая гиперплазия надпочечников. У людей с этим заболеванием отсутствует один из ферментов, контролирующих выработку половых гормонов.
Что делать, если уровень тестостерона выше или ниже, чем надо
Если результаты ваших анализов показали, что уровень андрогена за пределами нормы, обязательно проконсультируйтесь с терапевтом.
С гормонами шутки плохи, поэтому корректировать любое отклонение тестостерона от нормы надо в тесном контакте с врачом — терапевтом, гинекологом или эндокринологом. Только специалист поможет вам не спутать гормональный дисбаланс с другими заболеваниями, которые имеют схожие симптомы. Кроме того, медик установит наиболее вероятную причину сбоя, а значит, подберёт эффективное лечение.
Только специалист поможет вам не спутать гормональный дисбаланс с другими заболеваниями, которые имеют схожие симптомы. Кроме того, медик установит наиболее вероятную причину сбоя, а значит, подберёт эффективное лечение.
При серьёзных отклонениях от нормы, как правило, назначают гормональные препараты. Если же дисбаланс невелик, врач может порекомендовать внести изменения в образ жизни:
- Нормализовать вес. Жировая ткань влияет на гормональный фон, в том числе на выработку тестостерона. При этом важно учитывать следующее: если у мужчин лишний вес понижает уровень андрогена, то у женщин, напротив, повышает .
- Скорректировать питание. Как показывают исследования, жиры и холестерин в рационе повышают тестостерон, а вот диета с пониженным содержанием жира приводит к уменьшению количества мужского гормона.
- Высыпаться. Это особенно важно, если уровень тестостерона ниже нормы: львиная доля его синтезируется во сне.
- Чаще заниматься сексом или хотя бы влюбиться .
 Оба варианта повышают количество тестостерона.
Оба варианта повышают количество тестостерона.
Читайте также 🧐
Тестостерон свободный
Тестостерон — главный половой гормон мужчин. Он вырабатывается также и у женщин, но в очень низких концентрациях.
У мужчин тестостерон вырабатывается в семенниках и в небольшом количестве в коре надпочечников, у женщин — в яичниках и коре надпочечников.Тестостерон отвечает за развитие вторичных половых признаков и нормальное функционирование половой системы, синтез белка и настроение, а также за рост костей и мышц (в подростковом возрасте), стимуляцию сперматогенеза, рост волос на кожных.
Секреция гормона меняется с возрастом – нарастает до 30 лет, а после 50 начинает снижаться. Отмечены и суточные колебания тестостерона: максимальная концентрация в 4 -8 часов утра и минимальная вечером в 16- 20 часов.
В крови тестостерон присутствует в свободном и связанном с белками состоянии. Лишь около 2% приходится на свободный тестостерон. Именно он является биологически активным. Свободный и связанный тестостерон находятся в равновесии, поэтому когда свободный гормон связывается с органом-мишенью, часть связанного высвобождается от белков, связывающих половые гормоны.
При избыточном образовании андрогенов у женщин возникает вирилизация (вторичные половые признаки, характерные для мужчин), гирсутизм (чрезмерное оволосение по мужскому типу), огрубение голоса, гипертрофия клитора. Так как тестостерон стимулирует функцию сальных желез, его повышение часто связывают с развитием угревой сыпи.
Сниженный синтез тестостерона у мужчин ведет к гипогонадизму (недоразвитию половых желез), оволосению по женскому типу, слабому развитию скелетной мускулатуры, недоразвитию наружных половых органов, бесплодию, увеличению молочных желез, ожирению. Недостаточная продукция данного андрогена у пожилых мужчин увеличивает риск остеопороза.
Недостаточная продукция данного андрогена у пожилых мужчин увеличивает риск остеопороза.
Состояния, при которых наблюдается повышение концентрации связывающих белков (беременность, гипертиреоз, лечение противоэпилептическими препараты) или понижение (гипотиреоидизм, избыток андрогенов, метаболический синдром), приводят к изменению уровня связанного тестостерона. В таком случае измерение свободного тестостерона более целесообразно, чем измерение общего тестостерона. В пожилом возрасте у мужчин происходит снижение свободного тестостерона в плазме.
Показания к исследованию:
-
выявление причин раннего полового созревания или задержки полового развития у мальчиков; -
выявление причин импотенции и бесплодия у мужчин; -
диагностика тестостеронпродуцирующих опухолей половых желез; -
выявление поликистоза яичников и других причин вирилизации у женщин; -
контроль за лечением рака простаты аналогами гонадолиберинов и антиандрогенами; -
выявление причин угревой сыпи; -
диагностика гипоталамо-гипофизарных нарушений, оценка функции эндокринной системы организма; -
уточнение пола новорождённых с неоднозначными половыми признаками; -
ожирение; -
заболевания щитовидной железы; -
импотенция; -
терапия антидепрессантами.
Референсные значения: <0.93 нг/мл
Необходимо воздержаться от приема пищи в течение 2-3 часов. Накануне исключить физические нагрузки, накануне исключить курение
!ВАЖНО для установления соответствующих норм указывать постменопаузу (при наличии).
Повышение значений:
— гирсутизм;
— вирилизирующая опухоль надпочечников;
— синдром поликистозных яичников;
— резистентность к андрогенам;
— прием анаболических препаратов.
Понижение значений:
— пожилой возраст мужчин;
— гипогонадизм;
— импотенция, травма яичек;
— болезнь Альцгеймера;
— терапия антидепрессантами;
— дефицит фермента Р450.
ПМС и гормональные сбои | Kotex®
Несмотря на то, что единой устоявшейся точки зрения ни о ПМС, ни о причинах, его вызывающих, у учёных нет, его симптомы вполне реальны.
Для порядка 5% женщин симптомы ПМС становится проблемой настолько серьезной, что они ежемесячно мешают повседневной жизни.
ПМС связан с менструальным циклом, который, в свою очередь, управляется гормонами.
Менструальный цикл—это результат сложных циклических изменений в уровнях гормонов, выделяемых яичниками и гипофизом в мозге.
Вероятнее всего, симптомы ПМС связаны с гормональным дисбалансом, дисбалансом гормонов стресса и нейротрансмиттеров.
Важно знать признаки гормональных сбоев, которые могут проявлять себя в том числе и как симптомы, которые характерны для ПМС.
1. Проблемы со сном
Если вы подолгу не можете заснуть или не высыпаетесь, несмотря на то, что, казалось бы, спите достаточное количество часов, то возможная причина связана с гормональным сбоем.
Прогестерон—это гормон, выделяемый яичниками, который играет важную роль для засыпания и крепкого сна.
Если же вы страдаете от ночной потливости и от приливов, то возможная причина—низкий уровень эстрогена.
Если вы заметили такие симптомы, то необходимо обязательно обратиться ко врачу.
2. Акне
Многие женщины сталкиваются с высыпаниями перед и во время месячных, но постоянное акне это уже другой вопрос, и такое состояние может быть вызвано избытком андрогенов, то есть мужских гормонов, таких, как тестостерон. Тестостерон вырабатывается как женским, так и мужским организмов, но избыток его выработки у женщин может вызывать избыточную выработку сала сальными железами, а также влиять на волосяные фолликулы. Такие изменения в выработке кожного сала и в клетках кожи может вызывать микровоспаления и «забиванию». Если у вас постоянное акне, то нужно обратиться ко врачу, чтобы уточнить, все ли в порядке у вас с гормонами. Это особенно важно в том числе потому, что избыток андрогенов в женском организме может привести к поликистозу яичников, а он, в свою очередь, может стать причиной бесплодия. Стоит также помнить, что высокий уровень инсулина может провоцировать повышенную выработку мужских гормонов и может быть связан с диабетом.
Это особенно важно в том числе потому, что избыток андрогенов в женском организме может привести к поликистозу яичников, а он, в свою очередь, может стать причиной бесплодия. Стоит также помнить, что высокий уровень инсулина может провоцировать повышенную выработку мужских гормонов и может быть связан с диабетом.
3. Проблемы с животом
Клетки, выстилающие желудочно-кишечный тракт, чувствительны к воздействию прогестерона и эстрогена, уровни которых меняются в течение менструального цикла, а значит влияют на работу желудка и кишечника.
Многие женщины во время и перед месячными сталкиваются с диареей, запорами, вздутием живота, тошнотой и рвотой. Помните, что данные симптомы могут быть связаны со множеством других состояний здоровья. Если же они происходят ежемесячно в одно и то же время и сопровождаются перепадами настроения и усталостью, то скорее всего они связаны с изменениями уровня гормонов.
4. Усталость
Усталость—один из самых распространенных симптомов огромного количества состояний здоровья, что значит, что у неё может быть огромное количество причин.
Слишком высокий уровень прогестерона может вызывать повышенную утомляемость, но это может быть связано и с низким уровнем гормонов щитовидной железы. Такие нарушения легко проверить при помощи анализа крови.
В любом случае, какова бы ни была причина, важно поддерживать гигиену сна, а это значит ложиться спать и просыпаться в одно и то же время, даже по выходным, а также стараться избегать прием алкоголя, кофе и активные занятия спортом после обеда.
Заведите привычку перед сном выделять время на расслабляющие занятия
Например, выпейте стакан теплого молока или принимайте расслабляющую ванну, чтобы ваш организм привык к такому знаку, что наступает время сна.
5. Перепады настроения
Перепады эмоционального состояния, пониженное настроение и повышенная чувствительность—частый симптом ПМС, от которого страдают некоторые женщины.
Обычно они мягко проявляются, но порядка 5% женщин испытывают настолько серьезные психологические проблемы в этот период, что такое состояние уже квалифицируется как предсменстуральный дисфорический синдром (ПДС). Эстроген может влиять на такие нейротрансмиттеры, как серотонин, норэпинефрин и допамин.
Если вы чувствуете, что перед месячными вы чувствуете себя необычно, то имеет смысл себе напомнить, что это временное состояние и попробовать помочь себе с ним справиться с наименьшими потерями: держитесь подальше от алкоголя, кофеина и сигарет, старайтесь сохранять физическую активность и спать достаточное количество времени каждую ночь.
Помните, что то, что даже если у вас и есть такой симптом, то это еще не значит, что то, что вас это расстроило—смешно или неправильно. Старайтесь напоминать себе, что если у вас есть такая особенность, а сильные эмоциональные реакции временны.
6. Аппетит и вес
Падение уровня эстрогена во время менструального цикла может вызывать изменения на аппетит, так как влияет на гормон лептин, который вызывает чувство голода.
Многие женщины также могут предпочитать жирную, сладкую и соленую еду в такие периоды, чтобы поднять себе настроение, но, к сожалению, такая еда оказывает обратный эффект.
7. Пониженное либидо
Пониженный уровень тестостерона может оказывать подавляющее влияние на женское либидо.
8. Изменение структуры груди
Слишком высокий или слишком низкий уровень эстрогена может вызывать изменения структуры груди.
Высокий уровень эстрогена может вызывать комковатую или плотную структуру ткани и даже кисты, а пониженный может сделать структуру ткани менее плотной.
Если Вы заметили какие-либо изменения в вашей груди, необходимо обратиться ко врачу за консультацией, потому что они могут быть вызваны серьезными нарушениями работы гормональной системы и даже раком.
Рак предстательной железы.
 Что должен знать каждый мужчина
Что должен знать каждый мужчина
Предстательная железа – это половая железа у мужчин. Она располагается у выхода из мочевого пузыря и охватывает часть уретры (мочеиспускательного канала). Основная роль предстательной железы – секреция жидкости, входящей в состав спермы. Эта жидкость необходима для нормальной жизнедеятельности сперматозоидов.
Как часто встречается рак предстательной железы?
В Республике Беларусь ежегодно выявляется более 1000 мужчин, заболевших раком предстательной железы. Рост этого заболевания отмечается во всем мире. Так, например, в США у 50% мужчин, умерших после 60 лет находят рак предстательной железы. Риск заболевания раком предстательной железы возрастает с возрастом, и, как правило, эта болезнь чаще начинается у мужчин после 50 лет. Этот факт говорит о том, что всем мужчинам после 50 лет должно быть рекомендовано ежегодное обследование у уролога, включающее ректальное пальцевое исследование. Раннее выявление опухоли помогает врачу вовремя начать лечение с хорошим последующим эффектом.
Какие симптомы рака предстательной железы?
Симптомы рака предстательной железы часто схожи с доброкачественной гиперплазией предстательной железы. Оба заболевания встречаются преимущественно у пожилых мужчин, и в обоих случаях у больных может появляться учащенное мочеиспускание. Это связано с увеличением размеров предстательной железы и сдавлением уретры. Доброкачественная гиперплазия предстательной железы не является злокачественной опухолью, но только врач сможет определить различия между доброкачественной гиперплазией и раком предстательной железы.
Специфических симптомов рака предстательной железы не существует. Длительное время болезнь может вообще себя никак не проявлять. При увеличении опухоли может сдавливаться уретра, и это будет затруднять мочеиспускание. Иногда затрудненное мочеиспускание (даже безболезненное) может быть первым симптомом проявления болезни.
При раке предстательной железы может появляться кровь в моче, в сперме. Может быть, боль во время семяизвержения. Но очень важно запомнить, что рак предстательной железы, а особенно в ранней стадии, может не проявляться никакими симптомами. Поэтому мы вновь обращаем внимание на регулярное медицинское обследование.
Но очень важно запомнить, что рак предстательной железы, а особенно в ранней стадии, может не проявляться никакими симптомами. Поэтому мы вновь обращаем внимание на регулярное медицинское обследование.
При распространенном раке предстательной железы могут поражаться лимфатические узлы, кости и другие органы. Многие пациенты предъявляют жалобы на боли в костях, суставах, а особенно в пояснице и костях таза.
Чем обусловлен рост злокачественной опухоли предстательной железы?
Рост и функция нормальной предстательной железы зависит от мужского полового гормона — тестостерона. Тестостерон вырабатывается яичками, и небольшое его количество вырабатывается надпочечниками. Было выяснено, что этот гормон стимулирует рост рака предстательной железы. Сколько в организме будет вырабатываться тестостерон, столько рак предстательной железы будет расти и распространяться.
Как можно выявить рак предстательной железы?
В арсенале врача есть множество методов, позволяющих выявить злокачественное поражение предстательной железы. Наиболее простой и распространенный способ – исследование предстательной железы через прямую кишку. Врач надевает резиновую перчатку, и, смочив палец смазкой, осторожно вводит его в прямую кишку. При этом можно определить плотность и размеры предстательной железы. Процедура занимает очень мало времени и не приносит неудобств пациенту.
Наиболее простой и распространенный способ – исследование предстательной железы через прямую кишку. Врач надевает резиновую перчатку, и, смочив палец смазкой, осторожно вводит его в прямую кишку. При этом можно определить плотность и размеры предстательной железы. Процедура занимает очень мало времени и не приносит неудобств пациенту.
Следующее исследование – это определение в крови простатспецифического антигена (ПСА). ПСА – это протеин, повышенный уровень которого может говорить о наличии у пациента рака предстательной железы; определение ПСА является одним из важных инструментов мониторинга рака предстательной железы.
Другим путем выявления рака предстательной железы является ультразвуковое исследование. При этой процедуре врач помещает небольшой прибор в прямую кишку; прибор излучает безболезненные ультразвуковые волны, отражающиеся от ткани предстательной железы. Отраженные волны преобразуются в изображение на мониторе. Если в результате заподозрен рак предстательной железы, то врач может взять небольшой участок ткани простаты путем биопсии специальной иглой. Образец ткани исследуется под микроскопом на предмет обнаружения раковых клеток. Только таким путем можно подтвердить диагноз рака предстательной железы.
Образец ткани исследуется под микроскопом на предмет обнаружения раковых клеток. Только таким путем можно подтвердить диагноз рака предстательной железы.
Какие бывают стадии и пути лечения рака предстательной железы?
Пути и способы лечения рака предстательной железы зависят от степени его распространения, поэтому для врача очень важно определить стадию для получения наилучшего результата. При определении тактики лечения, как для пациента, так и для врача важны преимущества и недостатки каждого вида лечения. Ниже приведены детальные описания четырех стадий рака предстательной железы и путей лечения при них.
Стадия 1: Опухоль ограничена предстательной железой и слишком мала, чтобы определяться при помощи пальцевого ректального исследования, однако выявляется другими методами. Эта стадия не проявляется клинически, и правильное лечение может привести к «полному» излечению. Методами лечения рака простаты стадии 1 являются хирургическое и лучевое лечение.
Хирургическое удаление предстательной железы называется простатэктомией и может быть произведена на ранних стадиях болезни для предотвращения распространения опухоли. При этом часто проводится удаление тазовых лимфатических узлов, потому как они расположены около предстательной железы и, прежде всего, могут поражаться опухолью. Как и при многих хирургических манипуляциях могут встречаться послеоперационные осложнения, требующие пристального внимания – это, как правило, импотенция и недержание мочи. Ранее недержание мочи встречалось в значительном проценте случаев, однако, новая хирургическая техника минимизирует этот риск.
При лучевой терапии используются лучи высоких энергий, убивающие раковые клетки. Возможно хирургическое внедрение в предстательную железу пациента специальных радиоактивных капсул, как альтернативный метод. Эта форма лечения хороша для пациентов, желающих избежать операции и недержания мочи. Побочные эффекты лучевой терапии могут быть следующие: повышенная утомляемость, кожные реакции в области полей облучения, частое и болезненное мочеиспускание, расстройство желудка, понос, раздражение прямой кишки или кровотечение из прямой кишки. Большинство этих побочных явлений прекращаются вместе с прекращением лучевого лечения.
Стадия 2: Опухоль пока локализована в предстательной железе, но определяется пальцевым ректальным исследованием. На этой стадии чаще всего отсутствуют симптомы, связанные с опухолью; рак предстательной железы стадии 2 может считаться «излечимым», путями лечения, как правило, являются простатэктомия и лучевая терапия (подробнее см. лечение стадии 1).
Стадия 3: На этой стадии опухоль распространяется на предстательную железу и прилежащие к ней области. На этой стадии основными симптомами являются расстройства мочеиспускания. Некоторые врачи выбирают в качестве путей лечения хирургическое удаление предстательной железы, лучевую терапию или их сочетание (смотри — стадия 1). Задача лечения при стадии 3 – уменьшить распространение рака предстательной железы и облегчить его проявления, такие как боли и расстройства мочеиспускания. Другим путем лечения стадии 3 является гормонотерапия. Цель гормонотерапии – снижение продукции тестостерона яичками, так как тестостерон усиливает рост клеток рака предстательной железы. Гормонотерапия не излечивает рак предстательной железы, но может замедлить его рост, уменьшить размеры опухоли и облегчить симптомы, вызванные опухолью. Существует несколько способов снижения продукции организмом тестостерона:
Цель гормонотерапии – снижение продукции тестостерона яичками, так как тестостерон усиливает рост клеток рака предстательной железы. Гормонотерапия не излечивает рак предстательной железы, но может замедлить его рост, уменьшить размеры опухоли и облегчить симптомы, вызванные опухолью. Существует несколько способов снижения продукции организмом тестостерона:
Традиционное лечение распространенного рака предстательной железы включает хирургическое удаление яичек. Медицинский термин этого вида операции – орхиэктомия. Орхиэктомия может быть выполнена как амбулаторная манипуляция, но, как правило, требует госпитализации и общего обезболивания. Удаление яичек эффективно снижает продукцию тестостерона и облегчает боль, расстройства мочеиспускания и другие симптомы, связанные с раком предстательной железы. Побочные эффекты этого вида лечения включают импотенцию и приливы жара (мужской климакс).
Аналоги природного рилизинг- фактора лютеинизирующего гормона (LHRH) являются более новыми препаратами. При ежемесячном приеме аналогов LHRH происходит прекращение выработки тестостерона яичками. Соответственно, эффективно облегчается боль, расстройства мочеиспускания и другие симптомы, связанные с раком предстательной железы. Как правило, ежемесячные инъекции производятся в условиях поликлиники, хотя в настоящее время возможно и самолечение под врачебным наблюдением. Побочные эффекты этого вида лечения аналогичны таковым после орхиэктомии и включают импотенцию и приливы жара, но в течение первых нескольких недель лечения возможно временное ухудшение симптоматики.
При ежемесячном приеме аналогов LHRH происходит прекращение выработки тестостерона яичками. Соответственно, эффективно облегчается боль, расстройства мочеиспускания и другие симптомы, связанные с раком предстательной железы. Как правило, ежемесячные инъекции производятся в условиях поликлиники, хотя в настоящее время возможно и самолечение под врачебным наблюдением. Побочные эффекты этого вида лечения аналогичны таковым после орхиэктомии и включают импотенцию и приливы жара, но в течение первых нескольких недель лечения возможно временное ухудшение симптоматики.
Для лечения распространенного рака предстательной железы также используются гормоноблокирующие лекарства, так называемые антиандрогены. Эти препараты могут принимаются ежедневно внутрь и блокируют действие тестостерона, в небольшом количестве выделяемом надпочечниками, тогда как продукция тестостерона яичками прекращается после кастрации или приема налогов LHRH. Побочные эффекты комбинированной гормонотерапии включают упомянутые выше импотенцию и приливы жара, возможны также тошнота, рвота, и диарея (понос).
Стадия 4: На этой стадии опухоль распространяется на другие органы, чаще всего, на кости скелета и лимфатические узлы. Частыми симптомами на этой стадии являются расстройства мочеиспускания, боли в костях, похудание и повышенная утомляемость. На этой стадии рак предстательной железы лечится гормональным методом (подробнее – смотри стадия 3). При неэффективности этого метода лечения может использоваться химиотерапия. Целью вышеуказанных методов лечения является облегчение боли, улучшение мочеиспускания.
Химиотерапия использует противораковые лекарства; эти препараты, циркулируя в кровяном русле, убивают быстрорастущие клетки, как раковые, так и некоторые здоровые, нормальные клетки. Для уменьшения повреждения здоровых тканей ведется тщательный контроль над дозами и частотой введения химиопрепаратов. Для лечения рака предстательной железы используется несколько химиопрепаратов, которые часто применяются сочетано. Химеотерапия применяется главным образом для облегчения симптомов, связанных с раком предстательной железы. Такое лечение имеет достаточно много побочных эффектов.
Кто занимается лечением рака предстательной железы?
В случае если у пациента появились проблемы с предстательной железой, врач общей лечебной сети должен направить его к врачу урологу, который при подозрении на рак предстательной железы направляет мужчину к онкологу.
Тестостерон и его значение в жизни мужчины | Он-Лайн Клиник
Уверенный в себе мужчина правит миром! Залог мужской уверенности, решительности, интереса к жизни – гормон тестостерон. Объем и активность данного гормона с возрастом меняется. Еще пятнадцать лет назад норматив 50 нмоль/л считался нормой. Сейчас нормальный показатель тестостерона в крови – 30 нмоль/л. Почему тестостерон важен в жизни мужчины? К чему приводит его снижение? Чем может помочь «правило пяти С»?
На эти и другие вопросы ответил врач-уролог медицинского центра Online Clinic Денис Абросов.
КОМПЛЕКСНОЕ ОБСЛЕДОВАНИЕ ВРАЧА УРОЛОГА:
Существует целый перечень заболеваний, оказывающих разрушительное влияние на органы мужской мочеполовой системы. И при отсутствии полноценного лечения велика вероятность развития таких осложнений, как бесплодие, импотенция, недержание мочи, вплоть до рака предстательной железы.
И при отсутствии полноценного лечения велика вероятность развития таких осложнений, как бесплодие, импотенция, недержание мочи, вплоть до рака предстательной железы.
Что влияет на количество тестостерона в организме?
Сбалансированный гормональный фон гарантирует человеку полноценную жизнь, и избавляет от риска приобретения различных недугов. Когда вырабатывается достаточное количество тестостерона, и его функция выполняется, то здоровье и подтянутый вид мужчины поддерживается в течение долгих лет. В среднем начиная с тридцатилетнего возраста выработка тестостерона снижается до 1,5% в год. Одна из важнейших причин снижения тестостерона – стресс, ожирение, алкоголь. Ипотека, кредиты, рост ответственности, нестабильное психо-эмоциональное состояние – суровые реалии нашей жизни. Результат – повышенная выработка гормонов стресса, в том числе, пролактина, а показатели важнейшего мужского гормона в крови снижаются. Что же делать? Гормон тестостерон вырабатывается преимущественно во сне и во время физических тренировок. Казалось бы, все просто: займись спортом и высыпайся. Но этого недостаточно. Тестостерон вырабатывается только во время интенсивных силовых, даже экстремальных тренировок, занятия в кардио зоне в этом случае дают слабый эффект. Что касается сна — он должен быть полноценным, с прохождением всех важных фаз сна, а пробуждение – плавным, так как при резком пробуждении, например, по звонку будильника, организм испытывает стресс, и выработка тестостерона не происходит. Отслеживать фазы сна и бодрствования, режим тренировок и отдыха помогают популярные сейчас фитнес браслеты. Но грамотное решение вероятных проблем – консультация с врачом и контроль показателя тестостерона в крови.
Казалось бы, все просто: займись спортом и высыпайся. Но этого недостаточно. Тестостерон вырабатывается только во время интенсивных силовых, даже экстремальных тренировок, занятия в кардио зоне в этом случае дают слабый эффект. Что касается сна — он должен быть полноценным, с прохождением всех важных фаз сна, а пробуждение – плавным, так как при резком пробуждении, например, по звонку будильника, организм испытывает стресс, и выработка тестостерона не происходит. Отслеживать фазы сна и бодрствования, режим тренировок и отдыха помогают популярные сейчас фитнес браслеты. Но грамотное решение вероятных проблем – консультация с врачом и контроль показателя тестостерона в крови.
Какие факторы указывают на снижение уровня тестостерона?
Первое – отсутствие утренней эрекции. Второе – отказ от увлечений, доставляющих удовольствие и приносящих здоровую усталость в пользу пива, дивана и покоя. Если человек пытается похудеть, ходит для этого в спортзал и при этом питается более или менее правильно, а результата нет, то это также указывает на низкий уровень тестостерона. Глаза должны гореть, человек должен стремиться к чему-то. Вспомните себя в детстве, когда просыпаешься с радостью, желанием познавать мир и творить! Если у мужчины гормоны в норме, то он выглядит и чувствует себя именно так. Самостоятельно тестостерон может повышаться до возраста полового созревания. Считается, что в этот период он достигает своего пика. И здесь огромное значение имеет образ жизни: был ли мальчик активным, занимался ли спортом, был ли склонен к полноте, как питался, во сколько лет начал половую жизнь. Сейчас у возрастных пациентов, приходящих на прием, уровень тестостерона в крови бывает выше, чем у молодых и это больщая проблема сегодняшнего поколения! Вседозволенность, отсутствие общей культуры, нравственных принципов и трепетного отношения к женщине — пагубно влияют на мужское здоровье. И дело не только в возможных инфекциях. Мы перестали добиваться женщин. Рыцарство, подвиг, преодоление себя, мобилизация всех внутренних ресурсов для достижения цели – то, в чем заключается мужественность – отошли на второй план.
 Как итог – утрата мужского достоинства как важной составляющей формирующегося веками образа мужчины. Кроме того, мужчины разучились отдыхать. Они стали заложниками всевозможных гаджетов, компьютерных занятий, после которых не чувствуют себя отдохнувшими и полными сил. Как результат – перегрузка нервной системы. Мужчина зажат, лишен внутренней свободы. Главный совет читателям мужчинам – займитесь тем, что вам действительно интересно и добивайтесь результатов, не жалея сил, духовных и физических, в достижении новых вершин.
Как итог – утрата мужского достоинства как важной составляющей формирующегося веками образа мужчины. Кроме того, мужчины разучились отдыхать. Они стали заложниками всевозможных гаджетов, компьютерных занятий, после которых не чувствуют себя отдохнувшими и полными сил. Как результат – перегрузка нервной системы. Мужчина зажат, лишен внутренней свободы. Главный совет читателям мужчинам – займитесь тем, что вам действительно интересно и добивайтесь результатов, не жалея сил, духовных и физических, в достижении новых вершин.
Питание имеет значение?
Да, имеет. Мужчинам, следящим за своим здоровьем, стоит внимательно выбирать источник животного белка. Основа белкового рациона у многих сегодня – курица, яйцо куриное и свинина. Первые два — продукты с высоким содержанием гормонов. А жирное мясо негативно влияет на выработку тестостерона. Исключение мяса из рациона — тоже не выход. Когда человек с детства предпочитает вегетарианскую пищу, то это не плохо. Однако полный отказ от мяса приводит к резкой нехватке белка – аминокислот, который крайне необходим, особенно для молодого организма. Поэтому все диеты должны быть разработаны врачом. Мясоедам, на мой взгляд, стоит отдать предпочтение блюдам из оленины, перепелиных яиц и рыбы, а также разнообразить перекусы грецким орехом и сельдереем. Кстати, не стоит забывать, что чисто белковые диеты вредят почкам и печени. Полный отказ от пива (напитка, содержащего гормоны) только положительно скажется на мужском здоровье.
Поэтому все диеты должны быть разработаны врачом. Мясоедам, на мой взгляд, стоит отдать предпочтение блюдам из оленины, перепелиных яиц и рыбы, а также разнообразить перекусы грецким орехом и сельдереем. Кстати, не стоит забывать, что чисто белковые диеты вредят почкам и печени. Полный отказ от пива (напитка, содержащего гормоны) только положительно скажется на мужском здоровье.
Какие внешние факторы влияют на мужское здоровье?
На мужское здоровье влияют: плохая экология, явные и скрытые инфекции, передающиеся половым путем, стресс, экстремальные погодные условия –перегревание или переохлаждение. Все это в совокупности пагубно влияет на простату — «второе сердце» мужчины, и может привести к бесплодию и появлению как простатита, так и аденомы предстательной железы. Ещё недавно аденома предстательной железы в молодом возрасте практически не встречалась. Сегодня данные проблемы у мужчин возникают намного раньше. В России, например, риск заболевания простатитом и аденомой в процентном соотношении приравнивается к паспортному возрасту мужчины. А именно от работы этого внутреннего органа зависит выработка тестостерона и мужское здоровье. Поэтому, если мужчина теряет интерес к противоположному полу, то это тревожный звоночек, и игнорировать его нельзя.
А именно от работы этого внутреннего органа зависит выработка тестостерона и мужское здоровье. Поэтому, если мужчина теряет интерес к противоположному полу, то это тревожный звоночек, и игнорировать его нельзя.
Что нужно делать, чтобы восстановить и сохранить мужское здоровье?
Рекомендаций много. Но они должны проводиться только под наблюдением врача. Контроль гормонов крови и ПСА, излечение всех хронических инфекций с применением современных методик. Особенно хотел бы отметить незаменимость физиотерапевтических процедур – магнитотерапии и ультразвука. Позволить себе это может каждый. Клиники сейчас стараются подстроиться под график пациента, запись ведут круглосуточно, работают вечером, в выходные дни и предлагают максимально широкий перечень услуг, в том числе и дневной стационар. Нет смысла тратить драгоценное время и заниматься самолечением! Игнорировать проблему, пускать все на самотек нельзя — можно дотянуть до операции. Следите за своим здоровьем. Здоровье мужчины важно не только для него. Поэтому профилактика обязательна!
Поэтому профилактика обязательна!
Есть ли медикаментозные способы лечения?
Медикаментозные способы, безусловно, есть. Медицина не стоит на месте. Появилось много средств для восстановления уровня тестостерона на основе трав, которые не вредят организму. Задача квалифицированного врача — правильно подобрать эти препараты. При этом нужно помнить, что лучше всего работает комплекс мер, и на одни лекарства полагаться не стоит. Особое внимание нужно уделить образу жизни. Как только восстанавливается предстательная железа и гормональный фон, все становится на свои места. Совет женщинам: если у мужчины что-то не получается, не нужно обвинять его в этом. Необходимо поддерживать, и записать к специалисту.
Что делать для стабилизации уровня тестостерона?
Есть правило пяти «С»: спорт, сон, регулярный секс, принцип «съешь» и отсутствие стресса. При соблюдении этого правила уровень тестостерона не снижается. Он при этом не растет, просто сохраняется. Только уверенный в себе мужчина правит миром! Это ложное счастье, когда у успешного человека есть и спортивная нагрузка, и хобби, и деньги, но при этом нет желания что-либо делать, а причина – низкий уровень тестостерона. Сейчас часто бывает, что успешный бизнесмен имеет все атрибуты успеха, кроме самого важного — у него отсутствует либидо и в отношении секса, и в отношении жизни. Если вы испытываете постоянное напряжение при принятии ключевых решений, над вами довлеет ответственность за других людей, прессинг со стороны конкурентов и проверяющих инстанций – присмотритесь к себе внимательно, возможно вам нужен контроль гормонов. Если при этом появилась раздражительность, возраст приближается к 45-ти годам, и много времени проводите за рулем автомобиля — вам необходимо раз в полгода делать УЗИ предстательной железы, сдавать кровь на свободный и общий тестостерон и ПСА (Простатический атипический антиген – онкомаркер рака предстательной железы). Если вы хотите быть успешным мужчиной – подумайте о своем тестостероне! Обратитесь за консультацией к компетентному врачу, которому вы будете доверять.
Тестостерон общий со скидкой до 50%
Интерпретация результатов исследования
«Тестостерон общий»
Интерпретация результатов анализов носит информационный характер, не является диагнозом и не
заменяет консультации врача. Референсные значения могут отличаться от указанных в
зависимости от используемого оборудования, актуальные значения будут указаны на бланке
результатов.
Единица измерения: мкг/л
Референсные значения:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Повышение:
- Вирилизирующая лютеома.
- Опухоли коры надпочечников.
- Экстрагонадные опухоли у мужчин.
- Мужчины с кариотипом XYY.
- Адреногенитальный синдром (женщины).
- Синдром Штейна-Левенталя.
- Преждевременное половое созревание мальчиков.
- Идиопатический гирсутизм.
- Синдром поликистозных яичников (СПКЯ).
Снижение:
- Первичный и вторичный гипогонадизм.
- Крипторхизм.
- Синдром Клайнфельтера.
- Синдром Каллмана.
- Уремия.
- Миотоническая дистрофия.
- Печеночная дистрофия.
Тестостерон — обзор | Темы ScienceDirect
Патофизиология
Самым важным андрогеном человека является тестостерон. Тестостерон — стероидный гормон, состоящий из 19 атомов углерода (рис. 64.1). Другим известным андрогеном является дегидроэпиандростерон (DHEA), который принадлежит к группе прогормонов, вместе называемых 17-кетостероидами. У взрослых мужчин семенники производят примерно 7 мг тестостерона в день. 1 У женщин суточная скорость выработки тестостерона составляет примерно 0.25–0,3 мг. 2 У мужчин в надпочечниках вырабатывается дополнительно 0,25 мг тестостерона в день, но количество может варьироваться в зависимости от пациента. 3 У женщин надпочечники обеспечивают примерно 25% суточной выработки тестостерона или примерно 50–75 мкг / день, вклад яичников составляет 25%, а оставшиеся 50% суточной выработки тестостерона обусловлены периферическим превращением. 2 Остальная часть обсуждения будет посвящена дефициту тестостерона (ДТ) у мужчин и механизмам контроля, связанным с мужской физиологией.
Уровень тестостерона регулируется лютеинизирующим гормоном (ЛГ) передней доли гипофиза. ЛГ стимулирует высвобождение тестостерона из клеток Лейдига в яичках. Производство спермы находится под влиянием фолликулостимулирующего гормона (ФСГ), также выделяемого передней долей гипофиза. Тестостерон подавляет секрецию ЛГ по отрицательной обратной связи. 1 Уровни тестостерона в плазме соответствуют циркадному ритму, с самым высоким пиком ранним утром около 7:00 a.м. и еще один, меньший пик днем около 16:00. 4 Однако пик и низший уровень тестостерона не так драматичны, как у кортизола.
Тестостерон обычно находится в организме связанным с белками, особенно с глобулином, связывающим половые гормоны (SHBG). Тестостерон, связанный с SHBG, измеряется как общий тестостерон (TT). Производство SHBG в печени контролируется рядом гормонов. Заболевания печени, эстроген и гормоны щитовидной железы увеличивают ГСПГ. ГСПГ снижается в ответ на андрогены, инсулинорезистентность и диабет, а также при гипотиреозе. 5 Уровни SHBG в плазме имеют тенденцию к увеличению с возрастом. Доля тестостерона, связанного с ГСПГ в сыворотке, пропорциональна уровню ГСПГ. 5 Это помогает объяснить более высокую скорость снижения свободного тестостерона (свободный T) по сравнению с TT (снижение на 2–3% в год по сравнению с 1–2%, соответственно) после 40 лет.
Диабет, метаболический синдром / инсулинорезистентность, ожирение и гипотиреоз могут привести к ложно низкому уровню TT, несмотря на нормальные уровни свободного тестостерона.Проверка свободного T является более точным тестом для этих людей.
Тестостерон может превращаться в эстрадиол с помощью ароматазы, особенно в жировой ткани, и в дигидротестостерон (ДГТ) с помощью 5-альфа-редуктазы в специализированных тканях, таких как сальные железы, волосяные фолликулы и ткани простаты (рис. 64.2). Тестостерон регулирует развитие вторичных половых признаков у мужчин. Достаточное количество тестостерона необходимо для нормального либидо, фертильности и потенции у мужчин. Он также может влиять на эритропоэз.Тестостерон оказывает анаболическое действие на мускулатуру и может влиять на поведение и агрессивность. Тестостерон метаболизируется в печени и в основном выводится с мочой. 1
Существует множество клинических проявлений TD, что затрудняет диагностику. Физические симптомы включают снижение минеральной плотности костей, снижение мышечной массы и силы, увеличение жировых отложений или индекса массы тела (ИМТ), гинекомастию, анемию, облысение в подмышечных и генитальных областях и утомляемость. Психологические симптомы могут включать подавленное настроение, снижение энергии / чувства бодрости или благополучия, снижение уверенности в себе и нарушение познания / памяти.Однако много раз мужчины предъявляют основную жалобу на сексуальную дисфункцию. Сексуальные симптомы включают снижение либидо, эректильную дисфункцию, трудности с достижением оргазма, снижение утренней эрекции и снижение сексуальной активности 6 (вставка 64.1).
В то время как ведутся споры о том, какой уровень ТТ представляет собой дефицит, большинство экспертов сходятся во мнении, что здоровый диапазон ТТ составляет 300–1050 нг / дл при рассмотрении заместительной терапии тестостероном. 7,8 Данные показывают, что уровни <440 нг / дл связаны с повышенным 10-летним сердечно-сосудистым риском у мужчин среднего и пожилого возраста. 8a Существует общее мнение, что свободный T или биодоступный T (свободный T плюс связанный с альбумином T) обеспечит лучшую оценку статуса T; тем не менее, существует озабоченность по поводу надежности этих анализов и общего отсутствия исследований с использованием этих показателей. Имеются данные об отличной корреляции между уровнями тестостерона в слюне и уровнями свободного тестостерона, полученными одновременно. 9 Это может оказаться надежной альтернативой тестированию сыворотки; однако некоторые из тех же проблем, о которых упоминалось ранее, остаются.Следует повторить однократный низкий уровень тестостерона AM для подтверждения диагноза TD.
Большая часть наших текущих данных о нормальных изменениях уровня тестостерона у взрослых, связанных со старением, взяты из Массачусетского исследования старения мужчин (MMAS). В этом исследовании участвовали мужчины на протяжении более 3 десятилетий. В начале исследования в 1987 году насчитывалось 1667 участников, а к концу исследования в 2004 году оставалось 584 участника. Лонгитюдные данные выявили в среднем снижение уровня TT на 1-2% в год, с более быстрым снижением свободного T из-за увеличения SHBG с возрастом, как обсуждалось ранее. 5,10 Интересно, что скорость снижения варьировалась: у некоторых испытуемых уровни TT не снижались с течением времени, а у некоторых участников наблюдалось повышение с возрастом. Средний уровень TT в 45 лет составлял примерно 540 нг / дл, а к 70 годам он упал примерно до 440 нг / дл. 5 Распространенность TD оценивается примерно в 6–12% среди населения первичной медико-санитарной помощи. 11 Еще одной интересной тенденцией MMAS было независимое от возраста снижение уровня тестостерона за последние 3 десятилетия.Анализ показывает снижение TT на 1% в год. 5 Другими словами, средний уровень TT 60-летнего мужчины в 1988 г. составлял 500 нг / дл по сравнению с примерно 440 нг / дл в 2003 г. Это, по-видимому, согласуется с другими наблюдениями снижения количества сперматозоидов в популяции. подсчитывает и другие репродуктивные расстройства у мужчин. 12,13
|
Где производится гормон |
Выделяемый гормон (ы) |
Гормональная функция |
|---|---|---|
|
Надпочечники |
Альдостерон |
Регулирует солевой, водный баланс и кровяное давление |
|
Надпочечники |
Кортикостероид |
Управляет ключевыми функциями в корпусе; действует как противовоспалительное средство; поддерживает уровень сахара в крови, артериальное давление и мышечную силу; регулирует солевой и водный баланс |
|
Гипофиз |
Антидиуретический гормон (вазопрессин) |
Влияет на задержку воды в почках; контролирует артериальное давление |
|
Гипофиз |
Адренокортикотропный гормон (АКТГ) |
Контролирует выработку половых гормонов (эстрогена у женщин и тестостерона у мужчин), а также яйцеклеток у женщин и спермы у мужчин. |
|
Гипофиз |
Гормон роста (GH) |
влияет на рост и развитие; стимулирует выработку белка; влияет на распределение жира |
|
Гипофиз |
Лютеинизирующий гормон (ЛГ) и фолликулостимулирующий гормон (ФСГ) |
Контролирует выработку половых гормонов (эстрогена у женщин и тестостерона у мужчин), а также яйцеклеток у женщин и спермы у мужчин |
|
Гипофиз |
Окситоцин |
Стимулирует сокращение матки и молочных протоков в груди |
|
Гипофиз |
Пролактин |
Инициирует и поддерживает производство молока в груди; влияет на уровень половых гормонов |
|
Гипофиз |
Тиреотропный гормон (ТТГ) |
Стимулирует выработку и секрецию гормонов щитовидной железы |
|
Почки |
Ренин и ангиотензин |
Контролирует артериальное давление, как напрямую, так и путем регулирования выработки альдостерона надпочечниками |
|
Почки |
Эритропоэтин |
Влияет на выработку эритроцитов (эритроцитов) |
|
Поджелудочная железа |
Глюкагон |
Повышает уровень сахара в крови |
|
Поджелудочная железа |
Инсулин |
Понижает уровень сахара в крови; стимулирует метаболизм глюкозы, белков и жиров |
|
Яичники |
Эстроген |
Влияет на развитие женских половых признаков и репродуктивное развитие, важно для функционирования матки и груди; также защищает здоровье костей |
|
Яичники |
Прогестерон |
Стимулирует слизистую оболочку матки для оплодотворения; подготавливает грудь к производству молока |
|
Паращитовидные железы |
Гормон паращитовидной железы (ПТГ) |
Самый важный регулятор уровня кальция в крови |
|
Щитовидная железа |
Гормон щитовидной железы |
Контролирует обмен веществ; также влияет на рост, созревание, активность нервной системы и обмен веществ |
|
Надпочечники |
Адреналин |
Повышает частоту сердечных сокращений, потребление кислорода и кровоток |
|
Надпочечники |
норэпинефрин |
Поддерживает артериальное давление |
|
Семенники (яички) |
Тестостерон |
Развивать и поддерживать мужские половые признаки и созревание |
|
Шишковидная железа |
Мелатонин |
Высвобождает мелатонин в ночное время, чтобы улучшить сон |
|
Гипоталамус |
Гормон высвобождения гормона роста (GHRH) |
Регулирует высвобождение гормона роста в гипофизе |
|
Гипоталамус |
Тиротропин-рилизинг-гормон (TRH) |
Регулирует высвобождение тиреотропного гормона в гипофизе |
|
Гипоталамус |
Гонадотропин-рилизинг-гормон (ГнРГ) |
Регулирует выработку ЛГ / ФСГ в гипофизе |
|
Гипоталамус |
Кортикотропин-рилизинг-гормон (CRH) |
Регулирует выброс адренокортикотропина в гипофизе |
|
Тимус |
Гуморальные факторы |
Способствует развитию лимфоидной системы |
Мужская репродуктивная система: структура и функции
Обзор
Анатомия мужской репродуктивной системы
Что такое мужская репродуктивная система?
Мужская репродуктивная система включает группу органов, составляющих репродуктивную и мочевыделительную системы мужчины.Эти органы выполняют в вашем теле следующие функции:
- Они производят, поддерживают и транспортируют сперму (мужские репродуктивные клетки) и сперму (защитную жидкость вокруг спермы).
- Они выделяют сперму в женские половые пути.
- Они производят и выделяют мужские половые гормоны.
Мужская репродуктивная система состоит из внутренней (внутри вашего тела) и внешней (вне вашего тела) частей. Вместе эти органы помогают вам мочиться (избавлять ваше тело от жидких отходов), вступать в половую связь и зачать детей.
Функция
Как функционирует мужская репродуктивная система?
Вся мужская репродуктивная система зависит от гормонов. Это химические вещества, которые стимулируют или регулируют деятельность ваших клеток или органов. Основными гормонами, участвующими в функционировании мужской репродуктивной системы, являются фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ) и тестостерон.
ФСГ и ЛГ вырабатываются гипофизом. Он расположен в основании вашего мозга и отвечает за многие функции вашего тела.ФСГ необходим для производства спермы (сперматогенеза). ЛГ стимулирует выработку тестостерона, который необходим для продолжения процесса сперматогенеза. Тестостерон также важен для развития мужских качеств, включая мышечную массу и силу, распределение жира, костную массу и половое влечение.
Анатомия
Каковы внешние мужские репродуктивные структуры?
Большая часть мужской репродуктивной системы расположена за пределами брюшной полости или таза.Внешние части мужской репродуктивной системы включают половой член, мошонку и яички.
Пенис
Пенис — мужской орган для полового акта. Он состоит из трех частей:
- Корень : это часть полового члена, которая прикрепляется к стенке вашего живота.
- Тело или стержень : тело полового члена имеет форму трубки или цилиндра и состоит из трех внутренних камер. Внутри этих камер находится особая губчатая эректильная ткань, содержащая тысячи больших пространств, которые заполняются кровью при сексуальном возбуждении.По мере того, как половой член наполняется кровью, он становится жестким и эрегированным, что позволяет проникать внутрь во время секса. Кожа полового члена рыхлая и эластичная, что позволяет изменять размер полового члена во время эрекции.
- Головка полового члена : это конусообразный конец полового члена. Головка полового члена, которую также называют головкой полового члена, покрыта рыхлым слоем кожи, называемым крайней плотью. Эта кожа иногда удаляется во время процедуры, называемой обрезанием.
Отверстие уретры — трубки, по которой сперма и моча выводятся из организма — находится на кончике головки полового члена.Пенис также содержит множество чувствительных нервных окончаний.
Сперма, содержащая сперму, выходит (эякулирует) через конец полового члена, когда мужчина достигает оргазма. Когда половой член находится в эрегированном состоянии, поток мочи из уретры блокируется, что позволяет эякулировать только сперму при оргазме.
Мошонка
Мошонка — это свободный мешочек из кожи, свисающий за пенисом. Он удерживает яички (также называемые семенниками), а также многие нервы и кровеносные сосуды.Мошонка защищает ваши яички, а также обеспечивает своего рода систему климат-контроля. Для нормального развития сперматозоидов температура яичек должна быть немного ниже температуры тела. Специальные мышцы в стенке мошонки позволяют ей сокращаться (напрягаться) и расслабляться, перемещая яички ближе к телу для тепла и защиты или подальше от тела, чтобы охладить температуру.
Яички (семенники)
Яички — это овальные органы размером с очень большие оливки, которые лежат в мошонке и закреплены с обоих концов структурой, называемой семенным канатиком.У большинства мужчин два яичка. Яички отвечают за выработку тестостерона, основного мужского полового гормона, а также за производство спермы. Внутри семенников находятся спиральные массы трубок, которые называются семенными канальцами. Эти канальцы отвечают за производство сперматозоидов в процессе, называемом сперматогенезом.
Эпидидимис
Эпидидимис представляет собой длинную спиралевидную трубку, которая опирается на тыльную сторону каждого яичка. Он несет и хранит сперматозоиды, которые создаются в яичках.Это также задача придатка яичка — довести сперматозоиды до зрелости — сперматозоиды, выходящие из яичек, являются незрелыми и неспособны к оплодотворению. Во время сексуального возбуждения сокращения заставляют сперму попасть в семявыносящий проток.
Какие внутренние мужские репродуктивные органы?
У вас есть несколько внутренних органов, также называемых дополнительными органами, которые играют большую роль в мужской репродуктивной системе. Эти органы включают:
- Семявыносящий проток : Семявыносящий проток — это длинная мышечная трубка, которая идет от придатка яичка в полость таза и сразу за мочевым пузырем.Семявыносящий проток транспортирует зрелую сперму в уретру для подготовки к эякуляции.
- Эякуляторные протоки : Эти протоки образованы слиянием семявыносящего протока и семенных пузырьков. Эякуляторные протоки выходят в уретру.
- Уретра : Уретра — это трубка, по которой моча выводится из мочевого пузыря за пределы вашего тела. У мужчин он выполняет дополнительную функцию изгнания (эякуляции) спермы при достижении оргазма. Когда половой член находится в эрегированном состоянии во время секса, поток мочи из уретры блокируется, что позволяет эякулировать только сперму при оргазме.
- Семенные пузырьки : Семенные пузырьки представляют собой мешковидные мешочки, которые прикрепляются к семявыносящему протоку у основания мочевого пузыря. Семенные пузырьки создают богатую сахаром жидкость (фруктозу), которая обеспечивает сперматозоиды источником энергии и помогает сперматозоидам двигаться (подвижность). Жидкость семенных пузырьков составляет большую часть объема эякуляционной жидкости или эякулята.
- Предстательная железа : предстательная железа представляет собой структуру размером с грецкий орех, которая расположена ниже мочевого пузыря перед прямой кишкой.Предстательная железа вносит дополнительную жидкость в эякулят. Жидкости простаты также помогают питать сперму. Уретра, по которой выводится эякулят во время оргазма, проходит через центр предстательной железы.
- Бульбоуретральные железы : Бульбоуретральные железы, или железы Купера, представляют собой структуры размером с горошину, расположенные по бокам уретры, чуть ниже предстательной железы. Эти железы производят прозрачную скользкую жидкость, которая вытекает прямо в уретру.Эта жидкость служит для смазки уретры и нейтрализации кислотности, которая может присутствовать из-за остаточных капель мочи в уретре.
Состояния и расстройства
Может ли мужчина пережить менопаузу?
Менопауза — это термин, используемый для описания окончания нормальной менструальной функции женщины. У женщин это отмечается изменением выработки гормонов. Одно из самых больших изменений для женщины после менопаузы — то, что она больше не может иметь детей. Яички, в отличие от яичников, не теряют способности вырабатывать гормоны.Если мужчина здоров, он может производить сперму в свои 80 лет или дольше.
С другой стороны, незначительные изменения в функции яичек могут произойти уже в возрасте от 45 до 50 лет и более резко после 70 лет. Для многих мужчин выработка гормонов может оставаться нормальной до старости, в то время как у других возможно, раньше у вас снизилась выработка гормонов. Иногда это может быть результатом болезни, например диабета.
Неясно, способствует ли снижение функции яичек появлению таких симптомов, как усталость, слабость, депрессия или импотенция.
Забота
Можно ли вылечить «мужской климакс»?
Если у вас низкий уровень тестостерона, заместительная гормональная терапия может помочь облегчить такие симптомы, как потеря интереса к сексу, депрессия и усталость. Однако замена мужских гормонов может усугубить рак простаты, а также может усугубить атеросклероз (затвердение артерий).
Перед началом заместительной гормональной терапии вы должны пройти полное медицинское обследование и провести лабораторные анализы.Есть еще много безответных вопросов о том, скольким мужчинам среднего возраста может помочь заместительная гормональная терапия. Поговорите со своим врачом обо всех плюсах и минусах этого лечения и о том, какой вариант лучше всего подходит для вас.
факт или вымысел? »Сексуальная медицина» BUMC
Недостаточность тестостерона у женщин: факт или вымысел?
Андре Гуай и Сьюзан Р. Дэвис
Выдержка из Всемирного журнала урологии 2002. 20: 106-110
Стало очевидно, что андрогены играют важную роль в здоровье женщин.Уровень андрогенов в крови женщины выше ожидаемого вызывает явные симптомы избытка андрогенов; менее очевидны последствия дефицита андрогенов у женщин. Симптомы неуловимы, влияют на сексуальное желание, удовлетворение и настроение женщины и обычно ошибочно принимаются за признаки глубокой депрессии, требующей направления на консультацию и психотерапию, когда измерения гормонов были бы более уместными и более плодотворными. Дефицит андрогенов у женщин — это проблема, которую медицинское сообщество не решает.Частично это связано с тем, что наиболее частым симптомом является снижение либидо, очень частая неспецифическая жалоба, которая долгое время ассоциировалась с психологическими проблемами стресса и депрессии. Один из самых ранних отчетов, показывающих связь между снижением сексуального влечения и снижением тестостерона у женщин, был опубликован в 1959 году, но принятие этой связи было медленным. Однако теперь больше данных показывает, что многие женщины в пременопаузе и постменопаузе действительно страдают от дефицита андрогенов.Поскольку симптомы такого дефицита напоминают симптомы депрессии, неправильный диагноз и отсутствие лечения являются обычным явлением. Необходимо повысить осведомленность о симптомах, диагностических процедурах и подходящих доступных методах лечения, чтобы избежать ошибочного диагноза и ненужного или неподходящего лечения.
Симптомы андрогенной недостаточности
Симптомы андрогенной недостаточности у женщин могут очень сильно напоминать другие состояния. Основная жалоба женщин с дефицитом андрогенов — снижение полового влечения, которое часто характеризуется уменьшением сексуальных мыслей и фантазий, а также действий.Еще одна частая жалоба — мышечная слабость, особенно у спортсменов. Похоже, что на генитальное возбуждение и оргазмическую реакцию также может отрицательно повлиять, а вагинальная смазка может уменьшиться даже у женщин, у которых регулярные менструации. Есть некоторые свидетельства того, что тестостерон, помимо эстрогена, может иметь прямое влияние на генитальное возбуждение и физиологию оргазма.
Метаболизм андрогенов у женщин
У женщин тестостерон вырабатывается в различных местах. Четверть гормона вырабатывается в яичниках, четверть — в надпочечниках, а половина — в периферических тканях из различных предшественников, вырабатываемых в яичниках и надпочечниках.Между стероидными гормонами также существует много взаимопревращений. Основным предшественником в яичнике является андростендион, который превращается в основном в эстрон, но который также может превращаться в андрогены. Основными предшественниками в надпочечниках являются DHEA и DHEA-S. Следовательно, разумно ожидать появления симптомов дефицита тестостерона после менопаузы, поскольку почти половина тестостерона вырабатывается яичниками, хотя яичники в постменопаузе по-прежнему вырабатывают некоторые стероидные гормоны. Недавнее открытие снижения выработки тестостерона и ДГЭА-С у женщин в пре- и постменопаузе указывает на возможность дефекта ферментов, вызывающего снижение выработки ДГЭА.DHEA образуется из 17-гидроксипрегненолона под действием фермента 17, 20-лиазы. Если этого фермента недостаточно, уровень ДГЭА будет низким.
Эпидемиология снижения либидо
В 1999 г. сообщалось, что в США доля женщин в возрасте от 18 до 59 лет с сексуальной дисфункцией составляла 43%. Однако из-за того, что женской сексуальной дисфункции публично уделяется мало внимания, эта область по-прежнему игнорируется, и только теперь есть понимание таких расстройств у женщин.Процент женщин, распределенных по возрасту, образованию и этническому происхождению, которые жаловались на снижение сексуального влечения в различных категориях, колеблется от 22% до 44%, в среднем 32%. Это привело бы к тому, что только в этой стране число женщин с пониженным либидо исчислялось десятками миллионов. Неизвестно, у скольких из этих женщин снизился уровень андрогенов, но, по оценкам, их число составляет от 10 до 15 миллионов.
На кого это может повлиять?
Большая часть текущего клинического опыта с андрогенами и дефицитом андрогенов приходится на женщин в постменопаузе, которые жалуются на снижение полового влечения после прекращения менструации, и которым не помогает только заместительная терапия эстрогенами.У женщин в пременопаузе вопрос об андрогенной недостаточности в основном игнорируется. Уровни тестостерона обычно измерялись в этой популяции только при поиске избыточной выработки у женщин, жалующихся на растительность на лице, потерю волос на коже головы, бесплодие или угри. Недавняя презентация на заседании Форума женских сексуальных функций 2000 года в Бостоне показала, что 36 женщин в пременопаузе и 38 женщин в постменопаузе, жалующихся на снижение либидо, также имели снижение общего и свободного тестостерона в плазме, а также снижение уровня DHEA-S.
Руководство по оценке андрогенного дефицита
Анализы общего тестостерона в плазме доступны уже более 40 лет, и показано, что его уровни снижаются с возрастом у женщин, как и у мужчин. Относительно новый анализ свободного тестостерона используется уже десять лет, и, будь то с помощью равновесного диализа или с помощью прямого радиоиммуноанализа, он считается более точным, поскольку он измеряет количество тестостерона, доступное для активности в тканях.
Однако имеется очень мало данных о нормальных диапазонах для этих анализов.Даже известные данные, использующие общий тестостерон, страдают от общего недостатка, заключающегося в том, что ни одна из женщин, использовавших для нормального диапазона, не подвергалась скринингу на какие-либо сексуальные проблемы, включая снижение полового влечения. Пока не появятся более достоверные данные, уровень общего тестостерона в плазме <25 нг / дл у женщин в возрасте до 50 лет и <20 нг / дл у женщин в возрасте 50 лет и старше указывает на дефицит андрогенов. Для определения свободного тестостерона с помощью прямого радиоиммуноанализа используется руководство для женщин в возрасте до 50 лет, уровень <1.5 пг / мл, а у женщин старше 50 лет уровень <1,0 пг / мл указывает на дефицит андрогенов. Если значения даже немного превышают указанные уровни, это следует считать пограничным, и клиническое испытание андрогена может быть целесообразным, если симптомы наводят на мысль. Доступны более точные и последовательные данные для измерения DHEA-S. Этот гормон также уменьшается с возрастом. Недавний анализ предложил две возрастные кривые: одну для худых, а другую - для полных женщин. Согласно опыту клиники, у женщин в возрасте до 50 лет с уровнем DHEA-S <150 нг / дл уместен диагноз снижения выработки DHEA надпочечниками.Точно так же диагноз продукции DHEA надпочечниками следует рассматривать у женщин в возрасте 50 лет и старше, у которых уровни DHEA-S <100 нг / дл.
Нет четких рекомендаций по оценке женщин, у которых может быть андрогенный дефицит. Лишь недавно была признана необходимость в четких рекомендациях по измерению пониженного уровня андрогенов. На самом деле, у женщин могут развиться симптомы дефицита андрогенов в любом возрасте, начиная с подросткового возраста и заканчивая поздним взрослением. Главный симптом часто — снижение сексуального интереса, что не всегда признается.Еще один распространенный симптом — это утомляемость, симптом, связанный со многими клиническими состояниями и, следовательно, вряд ли увеличивающий ваши подозрения на дефицит андрогенов. Спросите пациенток об уменьшении сексуального влечения и сексуальных фантазий, поскольку многие неохотно упоминают об этих проблемах. Во многих случаях врачи быстро связывали сексуальные проблемы с тревогой, депрессией, предменструальным синдромом или недостатком сна, особенно в годы воспитания детей. Женщины в перименопаузе могут жаловаться на снижение полового влечения в начале изменения их жизненного цикла, приписывая это этим изменениям.Возможно, сейчас самое время провести тест на дефицит андрогенов. Кроме того, у женщины в постменопаузе проверьте уровень тестостерона, если снижение полового влечения не улучшается после 6 месяцев заместительной терапии эстрогенами или если она отказывается от такой терапии.
Андрогенная терапия
Как только диагноз андрогенной недостаточности подтвержден или сильно заподозрен по пограничному уровню тестостерона, встает вопрос о лечении. В доступной медицинской литературе обсуждаются различные варианты лечения андрогенами у женщин в постменопаузе, но о пременопаузе известно немного.Единственное средство, показанное для использования женщинам, — это комбинация эстрогена и метилтестостерона в форме эстратеста, который в этой стране прописывался женщинам в постменопаузе в течение нескольких десятилетий. Однако он не всегда эффективен, вероятно, потому, что это метилированное производное тестостерона, а не естественный гормон. В Европе гранулы тестостерона имплантируются под кожу — вариант лечения, требующий хирургической процедуры, которая предрасполагает пациента к инфекции или выпадению гранул.Было обнаружено, что в целом он эффективен в Англии и Австралии. Это лечение доступно в этой стране для мужчин. Внутримышечные инъекции эфиров тестостерона применялись у мужчин на протяжении десятилетий, а женщины применялись в очень малых дозах. Уровень тестостерона в крови повышается в течение нескольких дней после инъекции, и многие женщины достигают уровня, достаточно высокого, чтобы вызвать побочные эффекты. Текущее исследование пластырей с тестостероном предполагает, что это может стать эффективным вариантом лечения в течение нескольких лет.Данные о кинетике абсорбции и постоянстве всасывания тестостерона ограничены. Поскольку уровень тестостерона необходимо тщательно контролировать и ни один из этих продуктов не стандартизирован, они не рекомендуются для широкого применения. Хотя это официально не одобрено для использования женщинами в Соединенных Штатах, различные аптеки могут приготовить тестостерон в форме крема или 1% геля, поскольку они были одобрены для мужчин.
Недавно были опубликованы данные об использовании безрецептурного перорального DHEA для замещения андрогенов, с идеей о том, что, если пациенту будет предоставлен гормон-предшественник, это позволит организму преобразовать его в тестостерон.Этот продукт доступен в аптеках, супермаркетах и магазинах здорового питания в США. Пациенты могут забрать его с полок (например, «Твоя жизнь»), так как на такие продукты не требуется рецепт. Дозу следует начинать с 50 мг безрецептурного перорального ДГЭА каждое утро, а общий и свободный тестостерон у пациентов, а также другие уровни андрогенов следует контролировать каждые 2–3 месяца для проверки абсорбции продукта. Если уровень свободного тестостерона составляет от 1,8 до 2,2 нг / мл, этот режим продолжают.Если результат измерения ниже, дозу можно увеличить до 75 мг DHEA в день. Уровни андрогенов следует проверять в течение нескольких месяцев, и при необходимости доза может быть увеличена до 100 мг DHEA. Лечение DHEA используется у женщин в пременопаузе и постменопаузе с низким уровнем андрогенов. Положительный ответ наблюдается у многих женщин, принимающих ДГЭА. Из всех методов заместительной гормональной терапии предпочтителен ДГЭА, хотя доступны такие варианты, как эстратест и 1% гель с тестостероном. DHEA недавно использовался для лечения женщин с надпочечниковой недостаточностью, у которых по определению заметно снизился уровень DHEA.Было обнаружено, что он улучшает общую энергию, самочувствие и сексуальность. DHEA также изучался у пожилых мужчин и женщин, чтобы помочь в мышечной силе с различными ответами. При использовании в течение более длительных периодов времени (например, 1 год), DHEA вызывает некоторое усиление сексуальной функции.
Потенциальные риски и побочные эффекты
Существует очень мало клинических исследований по лечению женщин в пременопаузе. Из небольшого количества доступных исследований кажется, что уровни андрогенов, достигаемые лечением, а также побочные эффекты такие же, как у женщин в постменопаузе.Основные нежелательные эффекты — прыщи и волосы на лице. Это происходит, если уровень тестостерона выше нормы. Однако у некоторых чувствительных женщин эти эффекты могут быть в пределах нормы. Иногда может наблюдаться задержка жидкости. Если тестостерон поднимается выше физиологического уровня, может возникнуть аномальный липидный профиль. У самого DHEA нет побочных эффектов, потому что в организме нет рецепторов DHEA; все побочные эффекты связаны с продуктом превращения ДГЭА, которым является тестостерон. Женщинам с раком груди, тяжелым заболеванием печени или тяжелым флебитом глубоких вен в анамнезе не следует принимать андрогены, поскольку определенное количество тестостерона будет преобразовано в эстроген.Это лечение также противопоказано во время беременности, поскольку тестостерон и даже его предшественник ДГЭА проникают через плаценту и могут вызвать изменения в половых органах плода. С особой осторожностью следует относиться к женщинам детородного возраста. При назначении терапии тестостероном женщине обязательно прописать адекватный контроль над рождаемостью и предупредить о том, что лечение андрогенами следует немедленно прекратить, если беременность может быть даже отдаленно возможной, или если вы планируете беременность в ближайшем будущем.
Заключение
Дефицит андрогенов — истинное заболевание как у женщин в пре-, так и в постменопаузе. Самая важная рекомендация — прислушиваться к пациенту и учитывать дефицит андрогенов при наличии симптомов, даже если они кажутся неспецифическими. Диагноз и последующее лечение андрогенной недостаточности может быть сложной задачей из-за нехватки исследований по этому вопросу; лабораторные определения не имеют очень точных диапазонов, и в настоящее время предпринимаются попытки установить нормальные диапазоны.Следует тщательно контролировать лечение андрогенами из-за возможных вредных последствий чрезмерного уровня тестостерона. Хотя очевидно, что необходимы дополнительные данные для определения точных случаев андрогенной недостаточности и точных уровней андрогенов в крови у женщин разного возраста, обнадеживает то, что состояние, которое долгое время игнорировалось, теперь оценивается и успешно лечится.
Определение уровня выработки тестостерона у мужчин и женщин с использованием стабильного изотопа / разбавления и масс-спектрометрии * | Журнал клинической эндокринологии и метаболизма
Абстрактные
Уровень продукции тестостерона определяли у здоровых мужчин и женщин во время фолликулярной фазы их менструального цикла с использованием метода разбавления стабильных изотопов и анализа методом газовой хроматографии / масс-спектрометрии.В начальной серии экспериментов вводили 0,07 мг / ч (мужчины) или 0,01 мг / ч (женщины) 1,2- d -тестостерон в течение 36 часов. После 12-часового периода уравновешивания образцы крови отбирали с 20-минутными интервалами в течение 24 часов. У мужчин не наблюдалось суточной ритмичности выработки тестостерона, тогда как у женщин скорость выработки тестостерона была максимальной в период с 04:00 до 12:00. Во второй серии экспериментов вводимая доза 1,2- d -тестостерона была снижена до 0,015 мг / ч (мужчины) и 0.0001 мг / ч (женщины) соответственно. Образцы крови отбирали с 20-минутными интервалами в течение последних 12 часов (0800–2000 часов) периода наблюдения. В соответствии с результатами, полученными другими исследователями с использованием радиоактивных индикаторов, расчетная производительность составила 147 ± 31 мкг / ч (3,7 ± 2,2 мг / день для мужчин) и 1,8 ± 0,6 мкг / ч (0,4 ± 0,1 мг / день для женщин). Чтобы сократить как продолжительность эксперимента, так и количество образцов, которые необходимо обработать, мы впоследствии продемонстрировали, что аналогичные показатели производительности могут быть получены, когда период уравновешивания перед взятием образцов крови сокращается до 6 часов, а период отбора образцов крови сокращается до 4 часов. .Этот протокол подходит для клинического использования в рутинных условиях для получения аналитически правильных оценок выработки тестостерона in vivo .
ГАЗОВАЯ ХРОМАТОГРАФИЯ / МАСС-спектрометрия (ГХ / МС) и меченые стабильными изотопами аналоги тестостерона используются для определения концентраций (1–3) и MCR тестостерона и скорости его превращения в основные продукты метаболизма (4–6). Этот метод превосходит использование радиоактивных индикаторов как аналитически (7), так и этически. В данной серии экспериментов мы использовали инфузии тестостерона, меченного дейтерием, и анализ с помощью ГХ / МС, чтобы определить скорость выработки тестостерона у здоровых мужчин и женщин и установить протокол, подходящий для клинического использования у пациентов с потенциально аномальной производительностью тестостерона.
Материалы и методы
Протокол эксперимента
Двенадцать здоровых мужчин без ожирения в возрасте от 22 до 34 лет и 10 здоровых женщин без ожирения в возрасте от 19 до 32 лет (в фолликулярной фазе менструального цикла), которые были тщательно проинформированы о целях и возможных рисках исследования. их письменное согласие на участие в 1 или нескольких частях расследования. В день экспериментов в антекубитальную вену вводили постоянный катетер и вводили 1,2- d -тестостерон (в 500 мл 0.9% физиологический раствор, также содержащий 2 мл собственной крови) вводили внутривенно и непрерывно (Infusomat, Braun-Melsungen, Германия) до конца соответствующего протокола эксперимента. В начале и в конце каждой инфузии образец инфузата отбирали с конца линии инфузии, чтобы можно было скорректировать потери за счет адсорбции и определить фактические скорости инфузии с помощью анализа ГХ / МС. После периода уравновешивания продолжительностью 12 часов (Опыт 1 и 2) или 6 часов (Опыт 3) второй постоянный катетер был вставлен в противоположную руку, и образцы крови (5 мл) были взяты с 20-минутными интервалами до конца соответствующий протокол эксперимента.Затем образцы крови собирали в течение 4 часов. Кроме того, была объединена одна проба за весь период забора крови (24, 12 или 4 ч соответственно).
Опыт 1
В этом протоколе участвовали шесть здоровых мужчин и пять здоровых женщин. Инфузия 1,2- d -тестостерона была начата в 08:00 (13 мл / ч), чтобы обеспечить теоретическую скорость инфузии 0,2 мг / ч (мужчины) или 0,04 мг / ч (женщины), соответственно. Однако из-за потерь на адсорбцию средние фактические скорости инфузии во время этого протокола были только 0.07 мг / ч (мужчины) и 0,01 мг / ч (женщины). Начиная с 2000 часов, образцы крови (5,0 мл) отбирали с 20-минутными интервалами в течение следующих 24 часов.
Опыт 2
В этом протоколе приняли участие семь здоровых мужчин и семь здоровых женщин. Инфузия 1,2- d -тестостерона (20 мл / ч) была начата в 2000 ч, чтобы обеспечить теоретическую скорость инфузии 0,02 мг / ч (для мужчин) или 0,0004 мг / ч (для женщин). Однако из-за потерь на адсорбцию средние фактические скорости инфузии во время этого протокола были только 0.015 мг / ч у шести из семи мужчин. Седьмой доброволец-мужчина получил только одну десятую этой дозы, , то есть 0,0015 мг / ч. У пяти из семи здоровых женщин средняя фактическая скорость инфузии составила 0,0001 мг / ч. Остальные две женщины получили дозу примерно в 7 раз меньшую (17 и 14 нг / ч соответственно). Начиная с 08:00 следующего утра, образцы крови брали с 20-минутными интервалами в течение следующих 12 часов.
Опыт 3
Пятеро здоровых мужчин и пять здоровых женщин, участвовавших в этом протоколе, были частью опыта 2.Инфузия 1,2- d -тестостерона (40 мл / час) была начата в 08:00 с попытками скорости инфузии, как в Exp 2 (мужчины, 0,02 мг / час; женщины, 0,0004 мг / час). Начиная с 1400 часов, образцы крови отбирали с 20-минутными интервалами в течение одного 4-часового периода.
Материалы
Все органические растворители были чистыми для высокоэффективной жидкостной хроматографии и были закуплены у Baker Chemicals (Филлипсбург, Нью-Джерси). Неактивный тестостерон (17β-гидрокси-4-андростен-3-он) был получен от Steraloids (Wilton, NH).Радиоактивный [ 3 H] 1,2,6,7-тестостерон (SA, 100 Ки / ммоль) и стабильный меченый 1,2- d -тестостерон (изотопное обогащение 99,0%) были приобретены в New England Nuclear ( Бостон, Массачусетс) и CIL (Андовер, Массачусетс) соответственно.
Подготовка проб и анализ с помощью ГХ-МС
Образцы плазмы (5,0 мл) с добавлением 20000 dpm [ 3 H] тестостерона для последующего контроля восстановления и 20 мл 0,5% трифторуксусной кислоты (TFA) наносили на картриджи Sep-Pak C 18 (500 мг; Waters / Millipore, Milford, MA) предварительно обработали последовательным нанесением 5.0 мл метанола, 5,0 мл этилацетата, 20 мл воды и 5,0 мл TFA (0,5%, вес / объем). После нанесения образца картриджи сначала обрабатывали тремя дозами 5,0 мл TFA (0,5%, вес / объем). Затем тестостерон элюировали этилацетатом (две дозы, 1,0 мл), сушили в потоке азота при 37 ° C, восстанавливали в 100 мкл CH 2 Cl 2 и дополнительно очищали с помощью тонкослойной хроматографии (хлороформ-ацетон, 70:30). Зона, содержащая тестостерон, была элюирована (дважды, 2.5 мл метанола) и с добавлением 10 нг дегидротестостерона (1,4-андростадиен-17β-ол-3-он) в качестве внутреннего стандарта для анализа ГХ / МС. Затем производили дериватизацию смесью гептафтормасляный ангидрид-ацетон (1: 4; 60 мин) при комнатной температуре. Извлечение [ 3 H] тестостерона из дериватизированных образцов составило 38,5 ± 5,0% (n = 40). Затем был проведен анализ с помощью ГХ-МС (Finnigan MAT95, оборудованный 25-метровой колонкой из плавленого кварца CB5, Сан-Хосе, Калифорния) с использованием выбранного режима ионного мониторинга и электрической ионизации (разрешение 6000).Ионы индикаторов были [m / e 678 (дегидротестостерон; внутренний стандарт), m / e 680 (нативный тестостерон) и m / e 682 (1,2- d -тестостерон)]. Чувствительность при соотношении пик / шум 10: 1 была менее 100 фг.
Расчет скорости выработки тестостерона
Скорость продуцирования тестостерона (PR [T]) рассчитывалась как произведение известной скорости инфузии (Rt) и отношения обогащения индикаторным инфузатом (Et) к разбавлению индикатора в плазме (Es): (PR [T] = Rt × (Et / Es — 1) (8).
Результаты
Концентрации немеченого (нативного) тестостерона в плазме и уровни выработки тестостерона для Exp 1, 2 и 3 суммированы в таблицах 1 и 2 для мужчин и женщин, соответственно. У мужчин скорость продукции тестостерона варьировалась от 64 ± 25 до 101 ± 67 мкг / ч в течение 24-часового периода, когда 1,2- d -тестостерон вводили в сравнительно большой дозе (Опыт 1). Суточной ритмичности не было. Средняя скорость продуцирования, определяемая как среднее значение шести отдельных образцов, полученных у каждого добровольца, составила 77 ± 30 мкг / ч, что было идентично (77 ± 33 мкг / ч) значению, полученному при анализе дополнительного образца, объединенного на протяжении всего исследования. 24 ч.Таким образом, суточная выработка тестостерона на основе этого эксперимента составляла 1,8 ± 0,7 мг / день, что примерно в 10 раз больше, чем количество введенного 1,2- d -тестостерона в течение этого периода (Таблица 1A).
Таблица 1А.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС и рассчитанные скорости продуцирования Т (2000–2000 ч) у шести здоровых мужчин Exp 1 Скорость инфузии 1, 2- д -Т (36 ч; 13 мл / ч ): Теоретическая: 0,2 мг / ч Фактическая: 0,07 мг / ч (среднее), что эквивалентно 168 мкг / 24 ч
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|
| 2000–2400 ч | |||||||
| T (нг / мл) | 3,74 | 3,74 | 2.63 | 4,08 | 5,19 | 7,70 | 4,51 ± 1,76 |
| PR T (мкг / ч) | 232 | 47 | 84 | 105 | 63 | 72 | 101 ± 67 |
| 0000–0400 ч | |||||||
| T (нг / мл) | 4,59 | 3,04 | 2,89 | 4.15 | 4,51 | 6,69 | 4,31 ± 1,37 |
| PR T (мкг / ч) | 130 | 51 | 84 | 71 | 63 | 61 | 76 ± 28 |
| 0400–0800 ч | |||||||
| T (нг / мл) | 3,84 | 3,91 | 5,42 | 5,53 | 3.72 | 6,72 | 4,86 ± 1,22 |
| PR T (мкг / ч) | 89 | 51 | 95 | 76 | 63 | 69 | 74 ± 16 |
| 0800–1200 h | |||||||
| T (нг / мл) | 3,90 | 2,48 | 4,71 | 4,63 | 3,48 | 3.92 | 3,85 ± 0,82 |
| PR T (мкг / ч) | 111 | 42 | 108 | 71 | 62 | 55 | 75 ± 28 |
| 1200–1600 ч | |||||||
| T (нг / мл) | 4,05 | 2,45 | 3,20 | 2,23 | 3,95 | 4,24 | 3.35 ± 0,86 |
| PR T (мкг / ч) | 114 | 43 | 83 | 95 | 50 | 54 | 73 ± 28 |
| 1600–2000 ч | |||||||
| T (нг / мл) | 3,01 | 2,23 | 3,22 | 2,99 | 3,35 | 3,51 | 3,05 ± 0.45 |
| PR T (мкг / ч) | 88 | 40 | 99 | 63 | 43 | 49 | 64 ± 25 |
| 2000–2000 ч (средние значения рассчитаны по приведенным выше цифрам ) | |||||||
| T (нг / мл) | 3,86 | 2,98 | 3,67 | 3,94 | 4,03 | 5,46 | 3,99 ± 0,81 |
| PR T (мкг / ч) | 127 | 46 | 92 | 80 | 57 | 60 | 77 ± 30 |
| 2000–2000 ч (оценка по дополнительному образцу с помощью анализа ГХ-МС) | |||||||
| T (нг / мл) | 3 .80 | 2,95 | 3,72 | 3,95 | 3,97 | 5,36 | 3,96 ± 0,78 |
| PR T (мкг / ч) | 119 | 50 | 97 | 80 | 58 | 60 | 77 ± 33 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|
| 2000–2400 ч | |||||||
| T (нг / мл) | 3,74 | 3,74 | 2,63 | 4,08 | 5,19 | 7,70 | 4,51 ± 1,76 |
| PR T (мкг / ч) | 232 | 47 | 84 | 105 | 63 | 72 | 101 ± 67 |
| 0000–0400 ч | |||||||
| T (нг / мл) | 4.59 | 3,04 | 2,89 | 4,15 | 4,51 | 6,69 | 4,31 ± 1,37 |
| PR T (мкг / ч) | 130 | 51 | 84 | 71 | 63 | 61 | 76 ± 28 |
| 0400–0800 ч | |||||||
| T (нг / мл) | 3,84 | 3.91 | 5,42 | 5,53 | 3,72 | 6,72 | 4,86 ± 1,22 |
| PR T (мкг / ч) | 89 | 51 | 95 | 76 | 63 | 69 | 74 ± 16 |
| 0800–1200 ч | |||||||
| T (нг / мл) | 3,90 | 2,48 | 4.71 | 4,63 | 3,48 | 3,92 | 3,85 ± 0,82 |
| PR T (мкг / ч) | 111 | 42 | 108 | 71 | 62 | 55 | 75 ± 28 |
| 1200–1600 ч | |||||||
| T (нг / мл) | 4,05 | 2,45 | 3,20 | 2.23 | 3,95 | 4,24 | 3,35 ± 0,86 |
| PR T (мкг / ч) | 114 | 43 | 83 | 95 | 50 | 54 | 73 ± 28 |
| 1600–2000 ч | |||||||
| T (нг / мл) | 3,01 | 2,23 | 3,22 | 2,99 | 3.35 | 3,51 | 3,05 ± 0,45 |
| PR T (мкг / ч) | 88 | 40 | 99 | 63 | 43 | 49 | 64 ± 25 |
| 2000–2000 ч (средние значения рассчитаны по приведенным выше цифрам) | |||||||
| T (нг / мл) | 3,86 | 2,98 | 3,67 | 3,94 | 4,03 | 5,46 | 3,99 ± 0,81 |
| PR T (мкг / ч) | 127 | 46 | 92 | 80 | 57 | 60 | 77 ± 30 |
| 2000–2000 ч (оценка по дополнительному образцу методом ГХ-МС) | |||||||
| T (нг / мл) | 3.80 | 2,95 | 3,72 | 3,95 | 3,97 | 5,36 | 3,96 ± 0,78 |
| PR T (мкг / ч) | 119 | 50 | 97 | 80 | 58 | 60 | 77 ± 33 |
Таблица 1А.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС и рассчитанные скорости продуцирования Т (2000–2000 ч) у шести здоровых мужчин Exp 1 Скорость инфузии 1, 2- д -Т (36 ч; 13 мл / ч ): Теоретическая: 0.2 мг / ч Фактическое: 0,07 мг / ч (среднее), что эквивалентно 168 мкг / 24 ч
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|
| 2000–2400 ч | |||||||
| T (нг / мл) | 3.74 | 3,74 | 2,63 | 4,08 | 5,19 | 7,70 | 4,51 ± 1,76 |
| PR T (мкг / ч) | 232 | 47 | 84 | 105 | 63 | 72 | 101 ± 67 |
| 0000–0400 ч | |||||||
| T (нг / мл) | 4,59 | 3.04 | 2,89 | 4,15 | 4,51 | 6,69 | 4,31 ± 1,37 |
| PR T (мкг / ч) | 130 | 51 | 84 | 71 | 63 | 61 | 76 ± 28 |
| 0400–0800 ч | |||||||
| T (нг / мл) | 3,84 | 3,91 | 5.42 | 5,53 | 3,72 | 6,72 | 4,86 ± 1,22 |
| PR T (мкг / ч) | 89 | 51 | 95 | 76 | 63 | 69 | 74 ± 16 |
| 0800–1200 ч | |||||||
| T (нг / мл) | 3,90 | 2,48 | 4,71 | 4.63 | 3,48 | 3,92 | 3,85 ± 0,82 |
| PR T (мкг / ч) | 111 | 42 | 108 | 71 | 62 | 55 | 75 ± 28 |
| 1200–1600 ч | |||||||
| T (нг / мл) | 4,05 | 2,45 | 3,20 | 2,23 | 3.95 | 4,24 | 3,35 ± 0,86 |
| PR T (мкг / ч) | 114 | 43 | 83 | 95 | 50 | 54 | 73 ± 28 |
| 1600–2000 h | |||||||
| T (нг / мл) | 3,01 | 2,23 | 3,22 | 2,99 | 3,35 | 3.51 | 3,05 ± 0,45 |
| PR T (мкг / ч) | 88 | 40 | 99 | 63 | 43 | 49 | 64 ± 25 |
| 2000–2000 ч (среднее значения рассчитаны на основе приведенных выше цифр) | |||||||
| T (нг / мл) | 3,86 | 2,98 | 3,67 | 3,94 | 4,03 | 5,46 | 3,99 ± 0,81 |
| PR T (мкг / ч) | 127 | 46 | 92 | 80 | 57 | 60 | 77 ± 30 |
| 2000–2000 ч (оценка по дополнительному образцу методом ГХ-МС) | |||||||
| T (нг / мл) | 3.80 | 2,95 | 3,72 | 3,95 | 3,97 | 5,36 | 3,96 ± 0,78 |
| PR T (мкг / ч) | 119 | 50 | 97 | 80 | 58 | 60 | 77 ± 33 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|
| 2000–2400 ч | |||||||
| T (нг / мл) | 3,74 | 3,74 | 2,63 | 4,08 | 5,19 | 7,70 | 4,51 ± 1,76 |
| PR T (мкг / ч) | 232 | 47 | 84 | 105 | 63 | 72 | 101 ± 67 |
| 0000–0400 ч | |||||||
| T (нг / мл) | 4.59 | 3,04 | 2,89 | 4,15 | 4,51 | 6,69 | 4,31 ± 1,37 |
| PR T (мкг / ч) | 130 | 51 | 84 | 71 | 63 | 61 | 76 ± 28 |
| 0400–0800 ч | |||||||
| T (нг / мл) | 3,84 | 3.91 | 5,42 | 5,53 | 3,72 | 6,72 | 4,86 ± 1,22 |
| PR T (мкг / ч) | 89 | 51 | 95 | 76 | 63 | 69 | 74 ± 16 |
| 0800–1200 ч | |||||||
| T (нг / мл) | 3,90 | 2,48 | 4.71 | 4,63 | 3,48 | 3,92 | 3,85 ± 0,82 |
| PR T (мкг / ч) | 111 | 42 | 108 | 71 | 62 | 55 | 75 ± 28 |
| 1200–1600 ч | |||||||
| T (нг / мл) | 4,05 | 2,45 | 3,20 | 2.23 | 3,95 | 4,24 | 3,35 ± 0,86 |
| PR T (мкг / ч) | 114 | 43 | 83 | 95 | 50 | 54 | 73 ± 28 |
| 1600–2000 ч | |||||||
| T (нг / мл) | 3,01 | 2,23 | 3,22 | 2,99 | 3.35 | 3,51 | 3,05 ± 0,45 |
| PR T (мкг / ч) | 88 | 40 | 99 | 63 | 43 | 49 | 64 ± 25 |
| 2000–2000 ч (средние значения рассчитаны по приведенным выше цифрам) | |||||||
| T (нг / мл) | 3,86 | 2,98 | 3,67 | 3,94 | 4,03 | 5,46 | 3,99 ± 0,81 |
| PR T (мкг / ч) | 127 | 46 | 92 | 80 | 57 | 60 | 77 ± 30 |
| 2000–2000 ч (оценка по дополнительному образцу методом ГХ-МС) | |||||||
| T (нг / мл) | 3.80 | 2,95 | 3,72 | 3,95 | 3,97 | 5,36 | 3,96 ± 0,78 |
| PR T (мкг / ч) | 119 | 50 | 97 | 80 | 58 | 60 | 77 ± 33 |
Таблица 1С.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС, и рассчитанные скорости продуцирования Т у пяти здоровых мужчин во время 12-часовой инфузии 1,2- d
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 1400–1800 ч | ||||||||
| T (нг / мл) | 8.61 | 5,91 | 9,77 | 5,78 | 9,76 | 7,97 ± 1,99 | ||
| PR T (мкг / ч) | 160 | 188 | 86 | 328 | 67 | 166 ± 103 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 1400–1800 ч | ||||||||
| T (нг / мл) | 8,61 | 5.91 | 9,77 900 | 5,78 | 9,76 | 7.97 ± 1,99 | ||
| PR T (мкг / ч) | 160 | 188 | 86 | 328 | 67 | 166 ± 103 |
Таблица 1C.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС, и рассчитанные скорости продуцирования Т у пяти здоровых мужчин во время 12-часовой инфузии 1,2- d
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 1400–1800 ч | ||||||||
| T (нг / мл) | 8,61 | 5.91 | 9,77 | 5,78 | 9,76 | 7,97 ± 1,99 | ||
| PR T (мкг / ч) | 160 | 188 | 86 | 328 | 67 | 166 ± 103 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 1400–1800 ч | ||||||||
| T (нг / мл) | 8,61 | 5.91 | 9,77 900 | 5,78 | 9,76 | 7,97 ± 1,99 | ||
| PR T (мкг / ч) | 160 | 188 | 86 | 328 | 67 | 166 ± 103 |
Таблица 2A.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС, и рассчитанные скорости продуцирования Т у 5 здоровых женщин Exp 1 Скорость инфузии 1,2-dT (36 ч: 13 мл / ч): Теоретическая: 0,4 мг / ч Фактическая: 0,01 мг / ч (среднее), что эквивалентно 0,24 мг / 24 ч
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|
| 2000–2400 ч | ||||||
| T (нг / мл) | 0,184 | 0,100 | 0,150 | 0,124 | 0,124 | 0,136 ± 0,032 |
| PR T (мкг / ч) | 6 | 4 | 7 | 3 | 2 | 4,4 ± 2,1 |
| 0000–0400 ч | ||||||
| T (нг / мл) | 0.164 | 0,110 | 0,147 | 0,125 | 0,162 | 0,142 ± 0,024 |
| PR T (мкг / ч) | 5 | 5 | 3 | 2 | 3 | 3,6 ± 1,3 |
| 0400–0800 ч | ||||||
| T (нг / мл) | 0,146 | 0,106 | 0,138 | 0.160 | 0,175 | 0,144 ± 0,026 |
| PR T (мкг / ч) | 8 | 6 | 9 | 2 | 4 | 5,8 ± 2,9 |
| 0800–1200 ч | ||||||
| T (нг / мл) | 0,208 | 0,097 | 0,142 | 0,090 | 0,145 | 0,136 ± 0,047 |
| PR T (мкг / ч ) | 10 | 3 | 7 | 2 | 8 | 6.0 ± 3,4 |
| 1200–1600 ч | ||||||
| T (нг / мл) | 0,117 | 0,107 | 0,107 | 0,126 | 0,176 | 0,127 ± 0,029 |
| PR T (мкг / ч) | 4 | 5 | 5 | 2 | 4 | 4,0 ± 1,2 |
| 1600–2000 ч | ||||||
| T (нг / мл) | 0.174 | 0,076 | 0,089 | 0,110 | 0,186 | 0,127 ± 0,050 |
| PR T (мкг / ч) | 6 | 3 | 5 | 2 | 4 | 4,0 ± 1,6 |
| 0800–2000 ч (средние значения рассчитаны из приведенных выше цифр) | ||||||
| T (нг / мл) | 0,166 | 0,099 | 0,129 | 0,123 | 0,161 | 0,136 ± 0.028 |
| PR T (мкг / ч) | 7 | 4 | 6 | 2 | 4 | 4,6 ± 1,9 |
| 0800–2000 ч (оценено с помощью ГХ / МС из дополнительной объединенной плазмы образец) | ||||||
| T (нг / мл) | 0,185 | 0,102 | 0,129 | 0,121 | 0,161 | 0,140 ± 0,033 |
| PR T (мкг / ч) | 14 | 11 | 9 | 5 | 9 | 9.6 ± 1,5 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|
| 2000–2400 ч | ||||||
| T (нг / мл) | 0.184 | 0,100 | 0,150 | 0,124 | 0,124 | 0,136 ± 0,032 |
| PR T (мкг / ч) | 6 | 4 | 7 | 3 | 2 | 4,4 ± 2,1 |
| 0000–0400 ч | ||||||
| T (нг / мл) | 0,164 | 0,110 | 0,147 | 0.125 | 0,162 | 0,142 ± 0,024 |
| PR T (мкг / ч) | 5 | 5 | 3 | 2 | 3 | 3,6 ± 1,3 |
| 0400–0800 ч | ||||||
| T (нг / мл) | 0,146 | 0,106 | 0,138 | 0,160 | 0,175 | 0,144 ± 0,026 |
| PR T (мкг / ч ) | 8 | 6 | 9 | 2 | 4 | 5.8 ± 2,9 |
| 0800–1200 ч | ||||||
| T (нг / мл) | 0,208 | 0,097 | 0,142 | 0,090 | 0,145 | 0,136 ± 0,047 |
| PR T (мкг / ч) | 10 | 3 | 7 | 2 | 8 | 6,0 ± 3,4 |
| 1200–1600 ч | ||||||
| T (нг / мл) | 0.117 | 0,107 | 0,107 | 0,126 | 0,176 | 0,127 ± 0,029 |
| PR T (мкг / ч) | 4 | 5 | 5 | 2 | 4 | 4,0 ± 1,2 |
| 1600–2000 ч | ||||||
| T (нг / мл) | 0,174 | 0,076 | 0,089 | 0.110 | 0,186 | 0,127 ± 0,050 |
| PR T (мкг / ч) | 6 | 3 | 5 | 2 | 4 | 4,0 ± 1,6 |
| 0800–2000 ч (среднее значения рассчитаны на основе приведенных выше цифр) | ||||||
| T (нг / мл) | 0,166 | 0,099 | 0,129 | 0,123 | 0,161 | 0,136 ± 0,028 |
| PR T (мкг / ч) | 7 | 4 | 6 | 2 | 4 | 4.6 ± 1,9 |
| 0800–2000 ч (оценено с помощью ГХ / МС по дополнительному объединенному образцу плазмы) | ||||||
| T (нг / мл) | 0,185 | 0,102 | 0,129 | 0,121 | 0,161 | 0,140 ± 0,033 |
| PR T (мкг / ч) | 14 | 11 | 9 | 5 | 9 | 9,6 ± 1,5 |
Таблица 2A.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС, и рассчитанные скорости продуцирования Т у 5 здоровых женщин Exp 1 Скорость инфузии 1,2-d-T (36 ч: 13 мл / ч): Теоретическая: 0.4 мг / ч Фактическое: 0,01 мг / ч (среднее), что эквивалентно 0,24 мг / 24 ч
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|
| 2000–2400 ч | ||||||
| T (нг / мл) | 0.184 | 0,100 | 0,150 | 0,124 | 0,124 | 0,136 ± 0,032 |
| PR T (мкг / ч) | 6 | 4 | 7 | 3 | 2 | 4,4 ± 2,1 |
| 0000–0400 ч | ||||||
| T (нг / мл) | 0,164 | 0,110 | 0,147 | 0.125 | 0,162 | 0,142 ± 0,024 |
| PR T (мкг / ч) | 5 | 5 | 3 | 2 | 3 | 3,6 ± 1,3 |
| 0400–0800 ч | ||||||
| T (нг / мл) | 0,146 | 0,106 | 0,138 | 0,160 | 0,175 | 0,144 ± 0,026 |
| PR T (мкг / ч ) | 8 | 6 | 9 | 2 | 4 | 5.8 ± 2,9 |
| 0800–1200 ч | ||||||
| T (нг / мл) | 0,208 | 0,097 | 0,142 | 0,090 | 0,145 | 0,136 ± 0,047 |
| PR T (мкг / ч) | 10 | 3 | 7 | 2 | 8 | 6,0 ± 3,4 |
| 1200–1600 ч | ||||||
| T (нг / мл) | 0.117 | 0,107 | 0,107 | 0,126 | 0,176 | 0,127 ± 0,029 |
| PR T (мкг / ч) | 4 | 5 | 5 | 2 | 4 | 4,0 ± 1,2 |
| 1600–2000 ч | ||||||
| T (нг / мл) | 0,174 | 0,076 | 0,089 | 0.110 | 0,186 | 0,127 ± 0,050 |
| PR T (мкг / ч) | 6 | 3 | 5 | 2 | 4 | 4,0 ± 1,6 |
| 0800–2000 ч (среднее значения рассчитаны на основе приведенных выше цифр) | ||||||
| T (нг / мл) | 0,166 | 0,099 | 0,129 | 0,123 | 0,161 | 0,136 ± 0,028 |
| PR T (мкг / ч) | 7 | 4 | 6 | 2 | 4 | 4.6 ± 1,9 |
| 0800–2000 ч (оценено с помощью ГХ / МС по дополнительному объединенному образцу плазмы) | ||||||
| T (нг / мл) | 0,185 | 0,102 | 0,129 | 0,121 | 0,161 | 0,140 ± 0,033 |
| PR T (мкг / ч) | 14 | 11 | 9 | 5 | 9 | 9,6 ± 1,5 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|
| 2000–2400 ч | ||||||
| T (нг / мл) | 0,184 | 0,100 | 0,150 | 0,124 | 0,124 | 0,136 ± 0,032 |
| PR T (мкг / ч) | 6 | 4 | 7 | 3 | 2 | 4.4 ± 2,1 |
| 0000–0400 ч | ||||||
| T (нг / мл) | 0,164 | 0,110 | 0,147 | 0,125 | 0,162 | 0,142 ± 0,024 |
| PR T (мкг / ч) | 5 | 5 | 3 | 2 | 3 | 3,6 ± 1,3 |
| 0400–0800 ч | ||||||
| T (нг / мл) | 0.146 | 0,106 | 0,138 | 0,160 | 0,175 | 0,144 ± 0,026 |
| PR T (мкг / ч) | 8 | 6 | 9 | 2 | 4 | 5,8 ± 2,9 |
| 0800–1200 ч | ||||||
| T (нг / мл) | 0,208 | 0,097 | 0,142 | 0.090 | 0,145 | 0,136 ± 0,047 |
| PR T (мкг / ч) | 10 | 3 | 7 | 2 | 8 | 6,0 ± 3,4 |
| 1200–1600 ч | ||||||
| T (нг / мл) | 0,117 | 0,107 | 0,107 | 0,126 | 0,176 | 0,127 ± 0,029 |
| PR T (мкг / ч ) | 4 | 5 | 5 | 2 | 4 | 4.0 ± 1,2 |
| 1600–2000 ч | ||||||
| T (нг / мл) | 0,174 | 0,076 | 0,089 | 0,110 | 0,186 | 0,127 ± 0,050 |
| PR T (мкг / ч) | 6 | 3 | 5 | 2 | 4 | 4,0 ± 1,6 |
| 0800–2000 ч (средние значения рассчитаны по вышеприведенным цифрам) | ||||||
| T (нг / мл) | 0.166 | 0,099 | 0,129 | 0,123 | 0,161 | 0,136 ± 0,028 |
| PR T (мкг / ч) | 7 | 4 | 6 | 2 | 4 | 4,6 ± 1,9 |
| 0800–2000 ч (по оценке ГХ / МС из дополнительной объединенной пробы плазмы) | ||||||
| T (нг / мл) | 0,185 | 0,102 | 0,129 | 0,121 | 0,161 | 0.140 ± 0,033 |
| PR T (мкг / ч) | 14 | 11 | 9 | 5 | 9 | 9,6 ± 1,5 |
Таблица 2C.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС, и рассчитанные скорости продуцирования Т у пяти здоровых женщин во время 12-часовой инфузии 1,2- d -T
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 1400–1800 ч | ||||||||
| T (нг / мл) | 0,185 | 0.202 | 0,224 | 0,221 | 0,135 | 0,193 ± 0,036 | ||
| PR T (мкг / ч) | 4,9 | 4,3 | 4,2 | 5,1 | 1,2 | 3,9 ± 1,6 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 1400–1800 ч | ||||||||
| T (нг / мл) | 0,185 | 0,202 | 0,224 | 0,221 | 0,135 | 0,193 ± 0,036 | ||
| PR T (мкг / ч) | 4.9 | 4,3 | 4,2 | 5,1 | 1,2 | 3,9 ± 1,6 |
Таблица 2C.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС, и рассчитанные скорости продуцирования Т у пяти здоровых женщин во время 12-часовой инфузии 1,2- d -T
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 1400–1800 ч | ||||||||
| T (нг / мл) | 0,185 | 0,202 | 0,224 | 0,221 | 0,135 | 0.193 ± 0,036 | ||
| PR T (мкг / ч) | 4,9 | 4,3 | 4,2 | 5,1 | 1,2 | 3,9 ± 1,6 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 1400–1800 ч | ||||||||
| T (нг / мл) | 0,185 | 0,202 | 0,224 | 0,221 | 0,135 | 0,193 ± 0,036 | ||
| PR T (мкг / ч) | 4.9 | 4,3 | 4,2 | 5,1 | 1,2 | 3,9 ± 1,6 |
У здоровых женщин скорость выработки тестостерона во время этой начальной серии экспериментов варьировалась от 3,6 ± 1,3 до 6,0 ± 3,4 мкг / ч. Наибольшая производительность наблюдалась в период с 04:00 до 08:00 и с 08:00 до 12:00. Средняя скорость продуцирования, определенная как среднее значение шести индивидуальных образцов, полученных от каждой женщины-добровольца, составила 4,6 ± 1,9 мкг / ч. Анализ дополнительной пробы, объединенной в течение 24 часов, привел к значению 9.6 ± 1,5 мкг / ч. Таким образом, суточная выработка тестостерона во время этого эксперимента варьировалась от 0,1 до 0,2 мг / день, количество в том же порядке, что и количество введенного 1,2- d -тестостерона в течение этого периода (Таблица 2A).
Уменьшая дозу вводимого 1,2- d -тестостерона в 5 раз до 0,015 мг / ч у мужчин и в 100 раз до 0,0001 мг / ч у женщин (Опыт 2), мы установили общее введенное количество 1,2- d -тестостерона должно быть намного ниже ожидаемой скорости продукции гормона, что исключает любое возможное вмешательство экзогенного тестостерона в его эндогенное производство.В этих условиях рассчитанные средние скорости выработки тестостерона составили 155 ± 94 мкг / ч (3,7 ± 2,2 мг / день для мужчин; Таблица 1B) и 1,8 ± 0,6 мкг / ч (0,4 ± 0,1 мг / день для женщин; Таблица 2Б). Сходные средние скорости производства тестостерона были обнаружены при идентичной скорости инфузии 1,2- d -тестостерона, но при сокращении периода уравновешивания с 12 до 6 часов (Опыт 3; мужчины, 166 ± 103 мкг / час; женщины, 3,9. ± 1,6 мкг / ч; таблицы 1C и 2C).
Обсуждение
Используя короткие (70 мин) инфузии радиоактивного индикатора, Rivarola et al. (9) 30 лет назад обнаружил, что уровень выработки тестостерона у двух здоровых мужчин составил 6,4 и 5,5 мг / день соответственно. У двух здоровых женщин уровень выработки тестостерона составлял 0,37 и 0,27 мг / день соответственно. Используя ту же технологию, более поздние исследователи сообщили о скорости выработки тестостерона в диапазоне от 3,0 до 7,0 мг / день (10, 11) у здоровых мужчин и около 0,3 мг / день (12) у здоровых женщин.
Преимущества стабильных меченых радиоактивных индикаторов по сравнению с радиоактивными материалами включают (13) способность долгосрочных инфузий для достижения условий устойчивого состояния, предотвращение неполного извлечения индикатора и следа из биологических материалов, а также тот факт, что оба меченых и эндогенные материалы одновременно анализируются с использованием идентичной технологии.Кроме того, этические соображения исключают вливание радиоактивных материалов, что заставляет некоторые страны, включая Австрию, запретить законом использование радиоактивных индикаторов у здоровых добровольцев.
Целью этого исследования было первое определение уровней выработки тестостерона у здоровых мужчин и женщин в течение 24 часов в течение 4-часовых периодов с использованием стабильного меченого соединения и анализа ГХ / МС в условиях устойчивого состояния, , то есть после 12 -h период предварительной калибровки. Аналитическая точность используемого метода демонстрируется тем фактом, что средние скорости выработки тестостерона в течение 24 часов, математически рассчитанные как среднее значение для этих шести отдельных образцов, были аналогичны аналитически полученному значению, полученному из дополнительной пробы плазмы, объединенной в течение 24 часов. .
Во время инфузий 1,2- d -тестостерона 0,07 и 0,01 мг / ч у мужчин и женщин, соответственно, средняя расчетная скорость продуцирования составила 77 мкг / ч (1,8 мг / день) у мужчин и 4,6 мкг / ч ( 0,1 мг / сут) у женщин. Для обоих полов эти значения ниже тех, о которых ранее сообщали другие (10–12), и неудобно близки к используемым скоростям инфузии тестостерона. Поэтому возник вопрос, могло ли такое сравнительно большое количество экзогенного тестостерона подавить скорость его эндогенной продукции.
Таким образом, во второй серии экспериментов введенная доза индикатора была снижена до 0,015 мг / ч у мужчин и 0,0001 мг / ч у женщин, что эквивалентно примерно 10% (мужчины) или 5% (женщины) потенциального тестостерона. темпы производства. Средняя скорость выработки тестостерона во время второй серии экспериментов составила 147 мкг / час у мужчин и 1,8 мкг / час у женщин. Один мужчина (№ 7) и две женщины (№ 5 и 6) получили еще меньшие дозы индикаторов (1,5 и 0,015 мкг / ч соответственно), что значительно расширило имеющиеся в настоящее время пределы обнаружения.Тем не менее, уровни выработки тестостерона у этих трех человек были в том же диапазоне, что и у остальных субъектов. Основываясь на этих результатах, маловероятно, что применяемые меньшие дозы тестостерона каким-либо образом повлияют на скорость его эндогенной продукции, хотя мы не можем с уверенностью исключить такую возможность. Скорее, мы считаем оправданным заключить, что средняя скорость выработки тестостерона, определенная во время этой второй серии экспериментов (мужчины, 3,7 ± 2,2 мг / день; женщины, 0.43 ± 0,14 мг / день) представляют собой точные показатели выработки эндогенного тестостерона в соответствии с оценками у молодых здоровых мужчин, о которых сообщают исследователи с использованием радиоактивных индикаторов (10, 11), тогда как у здоровых женщин эти показатели были немного ниже, чем показатели, о которых сообщалось ранее (12). Дополнительные эксперименты, проведенные внутри индивидуума, описанные ниже, привели нас к предположению, что уровни выработки тестостерона у женщин, по крайней мере, до 0,3 ± 0,4 мг / день, следует рассматривать как нормальные, как ранее описано Samoljik et al. (12) для здоровых женщин, не страдающих ожирением. Скорость продуцирования кортизола, полученная с помощью анализа ГХ / МС, оказалась ниже, чем предполагалось до сих пор (13). Что касается скорости производства тестостерона, однако, результаты, полученные с использованием этой более совершенной технологии, согласуются с данными, полученными с помощью метода радиоактивных индикаторов.
Показатели выработки тестостерона у мужчин не показали каких-либо суточных изменений ни в серии 1 (24-часовой период наблюдения), ни в серии 2 (12-часовой период наблюдения). Однако у женщин выработка тестостерона была выше после 04:00.Поскольку добровольцы мужского и женского пола изучались в одних и тех же экспериментальных условиях в условиях метаболической палаты, в значительной степени свободной от стресса, маловероятно, что методологические различия должны учитывать эти половые различия. По-видимому, суточный ритм АКТГ имеет недостаточное значение у здоровых мужчин, у которых основная доля тестостерона имеет тестикулярное происхождение, но влияет на секрецию тестостерона надпочечниками у женщин.
Обсуждаемые выше результаты должны были стать основой для будущих исследований у пациентов с нарушениями секреции андрогенов.Таким образом, чтобы обеспечить рутинную оценку скорости продукции тестостерона, 1,2- d инфузия -тестостерона была сокращена до 6 часов, а последующий забор крови до 4 часов, поскольку 36-часовой или даже 24-часовой экспериментальный протокол представляет собой логистическую проблему. для любого полурегулярного обследования, и de facto исключает его использование в амбулаторных условиях. Это также уменьшило количество образцов для анализа с помощью ГХ / МС до одного на человека. Чтобы продемонстрировать обоснованность этого подхода, эксперименты были выполнены на той же группе добровольцев, которые принимали участие в протоколе 2, с использованием идентичных скоростей инфузии 1,2- d -тестостерона (мужчины, 0.015 мг / ч; женщины, 0,0001 мг / ч). При использовании этого подхода у здоровых мужчин как концентрация эндогенного тестостерона в плазме, так и его расчетная скорость продукции находились в том же диапазоне, что и после более продолжительной инфузии индикатора. Что касается здоровых женщин, показатели выработки тестостерона во время этой серии были выше, хотя и в сопоставимом диапазоне. Таким образом, этот протокол обеспечивает сравнительно простой способ оценки скорости секреции тестостерона в различных патологических ситуациях.
Таблица 1B.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС и рассчитанные скорости продуцирования Т у семи здоровых мужчин Exp 2 Скорость инфузии 1, 2- d -T (24 ч; 20 мл / ч) Теоретическая: 0,02 мг / ч Фактическое: 0,015 мг / ч (среднее значение для субъектов 1–6; субъект 7, 0,0015 мг / ч)
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 0800–1200 ч | ||||||||
| T (нг / мл) | 7,81 | 6,81 | 6,19 | 9,21 | 5,87 | 13,93 | 7.96 ± 2,90 | |
| PR T (мкг / ч) | 149 | 115 | 161 | 329 | 56 | 266 | 76 | 165 ± 100 |
| 1200–1600 ч | ||||||||
| T (нг / мл) | 9,71 | 6,94 | 7,45 | 9,59 | 8,07 | 3.98 | 12,86 | 8,37 ± 2,76 |
| PR T (мкг / ч) | 91 | 108 | 164 | 247 | 72 | 336 | 63 | 154 ± 39 |
| 1600–2000 ч | ||||||||
| T (нг / мл) | 9,55 | 6,81 | 5,55 | 4.85 | 10,79 | 5,62 | 9,66 | 7,54 ± 2,40 |
| PR T (мкг / ч) | 95 | 92 | 160 | 188 | 86 | 328 | 67 | 145 ± 92 |
| 0800–2000 ч (средние значения рассчитаны по приведенным выше цифрам) | ||||||||
| T (нг / мл) | 9,02 | 6,85 | 6,40 | 7,88 | 8,23 | 5.16 | 12,15 | 7,96 ± 2,24 |
| PR T (мкг / ч) | 112 | 105 | 162 | 255 | 71 | 310 | 69 | 155 ± 94 |
| 0800–2000 ч (оценка ГХ-МС по дополнительному объединенному образцу плазмы) | ||||||||
| T (нг / мл) | 8,72 | 7,10 | 6,48 | 8,06 | 8,19 | 4,93 | 12.7 | 8,03 ± 2,43 |
| PR T (мкг / ч) | 111 | 103 | 150 | 241 | 70 | 281 | 71 | 147 ± 31 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 0800–1200 ч | ||||||||
| T (нг / мл) | 7,81 | 6,81 | 6,19 | 9,21 | 5,87 | 13,93 | 7,96 ± 2,90 | |
| PR T (мкг / ч) | 149 | 115 | 161 | 329 | 56 | 266 | 76 | 165 ± 100 |
| 1200–1600 ч | ||||||||
| T (нг / мл) | 9.71 | 6,94 | 7,45 | 9,59 | 8,07 | 3,98 | 12,86 | 8,37 ± 2,76 |
| PR T (мкг / ч) | 91 | 108 | 164 | 247 | 72 | 336 | 63 | 154 ± 39 |
| 1600–2000 ч | ||||||||
| T (нг / мл) | 9.55 | 6,81 | 5,55 | 4,85 | 10,79 | 5,62 | 9,66 | 7,54 ± 2,40 |
| PR T (мкг / ч) | 95 | 92 | 160 | 188 | 86 | 328 | 67 | 145 ± 92 |
| 0800–2000 ч (средние значения рассчитаны на основе приведенных выше цифр) | ||||||||
| T (нг / мл) | 9,02 | 6,85 | 6.40 | 7,88 | 8,23 | 5,16 | 12,15 | 7,96 ± 2,24 |
| PR T (мкг / ч) | 112 | 105 | 162 | 255 | 71 | 310 | 69 | 155 ± 94 |
| 0800–2000 ч (оценено с помощью ГХ-МС по дополнительному объединенному образцу плазмы) | ||||||||
| T (нг / мл) | 8,72 | 7,10 | 6,48 | 8.06 | 8,19 | 4,93 | 12,7 | 8,03 ± 2,43 |
| PR T (мкг / ч) | 111 | 103 | 150 | 241 | 70 | 281 | 71 | 147 ± 31 |
Таблица 1B.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС, и рассчитанные скорости продуцирования Т у семи здоровых мужчин Exp 2 Скорость инфузии 1, 2- d -T (24 ч; 20 мл / ч) Теоретическая: 0.02 мг / ч Фактическое: 0,015 мг / ч (среднее значение для субъектов 1–6; субъект 7, 0,0015 мг / ч)
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 0800–1200 ч | ||||||||
| T (нг / мл) | 7.81 | 6,81 | 6,19 | 9,21 | 5,84 | 5,87 | 13,93 | 7,96 ± 2,90 |
| PR T (мкг / ч) | 149 | 115 | 161 | 329 | 56 | 266 | 76 | 165 ± 100 |
| 1200–1600 ч | ||||||||
| T (нг / мл) | 9.71 | 6,94 | 7,45 | 9,59 | 8,07 | 3,98 | 12,86 | 8,37 ± 2,76 |
| PR T (мкг / ч) | 91 | 108 | 164 | 247 | 72 | 336 | 63 | 154 ± 39 |
| 1600–2000 ч | ||||||||
| T (нг / мл) | 9.55 | 6,81 | 5,55 | 4,85 | 10,79 | 5,62 | 9,66 | 7,54 ± 2,40 |
| PR T (мкг / ч) | 95 | 92 | 160 | 188 | 86 | 328 | 67 | 145 ± 92 |
| 0800–2000 ч (средние значения рассчитаны на основе приведенных выше цифр) | ||||||||
| T (нг / мл) | 9,02 | 6,85 | 6.40 | 7,88 | 8,23 | 5,16 | 12,15 | 7,96 ± 2,24 |
| PR T (мкг / ч) | 112 | 105 | 162 | 255 | 71 | 310 | 69 | 155 ± 94 |
| 0800–2000 ч (оценено с помощью ГХ-МС по дополнительному объединенному образцу плазмы) | ||||||||
| T (нг / мл) | 8,72 | 7,10 | 6,48 | 8.06 | 8,19 | 4,93 | 12,7 | 8,03 ± 2,43 |
| PR T (мкг / ч) | 111 | 103 | 150 | 241 | 70 | 281 | 71 | 147 ± 31 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 0800–1200 ч | ||||||||
| T (нг / мл) | 7,81 | 6,81 | 6,19 | 9,21 | 5,87 | 13,93 | 7,96 ± 2,90 | |
| PR T (мкг / ч) | 149 | 115 | 161 | 329 | 56 | 266 | 76 | 165 ± 100 |
| 1200–1600 ч | ||||||||
| T (нг / мл) | 9.71 | 6,94 | 7,45 | 9,59 | 8,07 | 3,98 | 12,86 | 8,37 ± 2,76 |
| PR T (мкг / ч) | 91 | 108 | 164 | 247 | 72 | 336 | 63 | 154 ± 39 |
| 1600–2000 ч | ||||||||
| T (нг / мл) | 9.55 | 6,81 | 5,55 | 4,85 | 10,79 | 5,62 | 9,66 | 7,54 ± 2,40 |
| PR T (мкг / ч) | 95 | 92 | 160 | 188 | 86 | 328 | 67 | 145 ± 92 |
| 0800–2000 ч (средние значения рассчитаны на основе приведенных выше цифр) | ||||||||
| T (нг / мл) | 9,02 | 6,85 | 6.40 | 7,88 | 8,23 | 5,16 | 12,15 | 7,96 ± 2,24 |
| PR T (мкг / ч) | 112 | 105 | 162 | 255 | 71 | 310 | 69 | 155 ± 94 |
| 0800–2000 ч (оценено с помощью ГХ-МС по дополнительному объединенному образцу плазмы) | ||||||||
| T (нг / мл) | 8,72 | 7,10 | 6,48 | 8.06 | 8,19 | 4,93 | 12,7 | 8,03 ± 2,43 |
| PR T (мкг / ч) | 111 | 103 | 150 | 241 | 70 | 281 | 71 | 147 ± 31 |
Таблица 2B.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС, и рассчитанные скорости продуцирования Т у семи здоровых женщин Exp 2 Скорость инфузии 1,2- d -T (24 ч; 20 мл / ч) Теоретическая: 0.0004 мг / ч Фактическое: 0,0001 мг / ч (среднее для пациентов 1–5, пациента 6, 14 нг / час; пациента 7, 14 нг / час)
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 0800–1200 ч | ||||||||
| T (нг / мл) | 0.136 | 0,138 | 0,276 | 0,186 | 0,197 | 0,206 | 0,128 | 0,181 ± 0,053 |
| PR T (мкг / ч) | 1,0 | 2,1 | 2,3 | 2,8 | 2,5 | 2,0 | 1,3 | 2,0 ± 0,6 |
| 1200–1600 ч | ||||||||
| T (нг / мл) | 0.127 | 0,130 | 0,203 | 0,147 | 0,150 | 0,157 | 0,136 | 0,150 ± 0,026 |
| PR T (мкг / ч) | 0,9 | 2,9 | 2,1 | 2,4 | 1,6 | 1,6 | 1,0 | 1,8 ± 0,7 |
| 1600–2000 ч | ||||||||
| T (нг / мл) | 0.121 | 0,099 | 0,218 | 0,126 | 0,118 | 0,138 | 0,109 | 0,133 ± 0,040 |
| PR T (мкг / ч) | 1,0 | 2,1 | 2,3 | 2,0 | 1,8 | 1,5 | 0,9 | 1,7 ± 0,6 |
| 0800–2000 ч (средние значения рассчитаны на основе приведенных выше цифр) | ||||||||
| T (нг / мл) | 0,128 | 0,122 | 0.232 | 0,153 | 0,155 | 0,167 | 0,124 | 0,154 ± 0,038 |
| PR T (мкг / ч) | 1,0 | 2,2 | 2,2 | 2,5 | 2,0 | 1,7 | 1,0 | 1,8 ± 0,6 |
| 0800–2000 ч (по данным ГХ-МС по дополнительному объединенному образцу плазмы) | ||||||||
| T (нг / мл) | 0,127 | 0,121 | 0,235 | 0.160 | 0,161 | 0,171 | 0,118 | 0,156 ± 0,041 |
| PR T (мкг / ч) | 1,0 | 2,2 | 2,2 | 2,5 | 2,0 | 1,7 | 1,0 | 1,8 ± 0,6 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 0800–1200 ч | ||||||||
| T (нг / мл) | 0,136 | 0,138 | 0,276 | 0,186 | 0,197 | 0,206 | 0,128 | 0,181 ± 0,053 |
| PR T (мкг / ч) | 1.0 | 2,1 | 2,3 | 2,8 | 2,5 | 2,0 | 1,3 | 2,0 ± 0,6 |
| 1200–1600 ч | ||||||||
| T (нг / мл) | 0,127 | 0,130 | 0,203 | 0,147 | 0,150 | 0,157 | 0,136 | 0,150 ± 0.026 |
| PR T (мкг / ч) | 0,9 | 2,9 | 2,1 | 2,4 | 1,6 | 1,6 | 1,0 | 1,8 ± 0,7 |
| 1600–2000 ч | ||||||||
| T (нг / мл) | 0,121 | 0,099 | 0,218 | 0,126 | 0,118 | 0.138 | 0,109 | 0,133 ± 0,040 |
| PR T (мкг / ч) | 1,0 | 2,1 | 2,3 | 2,0 | 1,8 | 1,5 | 0,9 | 1,7 ± 0,6 |
| 0800–2000 ч (средние значения рассчитаны по приведенным выше цифрам) | ||||||||
| T (нг / мл) | 0,128 | 0,122 | 0,232 | 0,153 | 0,155 | 0,167 | 0,124 | 0.154 ± 0,038 |
| PR T (мкг / ч) | 1,0 | 2,2 | 2,2 | 2,5 | 2,0 | 1,7 | 1,0 | 1,8 ± 0,6 |
| 0800–2000 ч (оценочно методом ГХ-МС из дополнительной объединенной пробы плазмы) | ||||||||
| T (нг / мл) | 0,127 | 0,121 | 0,235 | 0,160 | 0,161 | 0,171 | 0,118 | 0,156 ± 0.041 |
| PR T (мкг / ч) | 1,0 | 2,2 | 2,2 | 2,5 | 2,0 | 1,7 | 1,0 | 1,8 ± 0,6 |
Таблица 2B.
Концентрации нативного Т в плазме, определенные с помощью ГХ-МС и рассчитанные скорости продуцирования Т у семи здоровых женщин. Exp 2 Скорость инфузии 1,2- сут -Т (24 ч; 20 мл / ч) Теоретическая: 0,0004 мг / ч Фактический: 0,0001 мг / ч (среднее для пациентов 1–5, пациентов 6, 14 нг / ч; пациентов 7, 14 нг / ч)
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 0800–1200 ч | ||||||||
| T (нг / мл) | 0.136 | 0,138 | 0,276 | 0,186 | 0,197 | 0,206 | 0,128 | 0,181 ± 0,053 |
| PR T (мкг / ч) | 1,0 | 2,1 | 2,3 | 2,8 | 2,5 | 2,0 | 1,3 | 2,0 ± 0,6 |
| 1200–1600 ч | ||||||||
| T (нг / мл) | 0.127 | 0,130 | 0,203 | 0,147 | 0,150 | 0,157 | 0,136 | 0,150 ± 0,026 |
| PR T (мкг / ч) | 0,9 | 2,9 | 2,1 | 2,4 | 1,6 | 1,6 | 1,0 | 1,8 ± 0,7 |
| 1600–2000 ч | ||||||||
| T (нг / мл) | 0.121 | 0,099 | 0,218 | 0,126 | 0,118 | 0,138 | 0,109 | 0,133 ± 0,040 |
| PR T (мкг / ч) | 1,0 | 2,1 | 2,3 | 2,0 | 1,8 | 1,5 | 0,9 | 1,7 ± 0,6 |
| 0800–2000 ч (средние значения рассчитаны на основе приведенных выше цифр) | ||||||||
| T (нг / мл) | 0,128 | 0,122 | 0.232 | 0,153 | 0,155 | 0,167 | 0,124 | 0,154 ± 0,038 |
| PR T (мкг / ч) | 1,0 | 2,2 | 2,2 | 2,5 | 2,0 | 1,7 | 1,0 | 1,8 ± 0,6 |
| 0800–2000 ч (по данным ГХ-МС по дополнительному объединенному образцу плазмы) | ||||||||
| T (нг / мл) | 0,127 | 0,121 | 0,235 | 0.160 | 0,161 | 0,171 | 0,118 | 0,156 ± 0,041 |
| PR T (мкг / ч) | 1,0 | 2,2 | 2,2 | 2,5 | 2,0 | 1,7 | 1,0 | 1,8 ± 0,6 |
| . | 1 . |
2 . |
3 . |
4 . |
5 . |
6 . |
7 . |
Среднее ± стандартное отклонение . |
|---|---|---|---|---|---|---|---|---|
| 0800–1200 ч | ||||||||
| T (нг / мл) | 0,136 | 0,138 | 0,276 | 0,186 | 0,197 | 0,206 | 0,128 | 0,181 ± 0,053 |
| PR T (мкг / ч) | 1.0 | 2,1 | 2,3 | 2,8 | 2,5 | 2,0 | 1,3 | 2,0 ± 0,6 |
| 1200–1600 ч | ||||||||
| T (нг / мл) | 0,127 | 0,130 | 0,203 | 0,147 | 0,150 | 0,157 | 0,136 | 0,150 ± 0.026 |
| PR T (мкг / ч) | 0,9 | 2,9 | 2,1 | 2,4 | 1,6 | 1,6 | 1,0 | 1,8 ± 0,7 |
| 1600–2000 ч | ||||||||
| T (нг / мл) | 0,121 | 0,099 | 0,218 | 0,126 | 0,118 | 0.138 | 0,109 | 0,133 ± 0,040 |
| PR T (мкг / ч) | 1,0 | 2,1 | 2,3 | 2,0 | 1,8 | 1,5 | 0,9 | 1,7 ± 0,6 |
| 0800–2000 ч (средние значения рассчитаны по приведенным выше цифрам) | ||||||||
| T (нг / мл) | 0,128 | 0,122 | 0,232 | 0,153 | 0,155 | 0,167 | 0,124 | 0.154 ± 0,038 |
| PR T (мкг / ч) | 1,0 | 2,2 | 2,2 | 2,5 | 2,0 | 1,7 | 1,0 | 1,8 ± 0,6 |
| 0800–2000 ч (оценочно методом ГХ-МС из дополнительной объединенной пробы плазмы) | ||||||||
| T (нг / мл) | 0,127 | 0,121 | 0,235 | 0,160 | 0,161 | 0,171 | 0,118 | 0,156 ± 0.041 |
| PR T (мкг / ч) | 1,0 | 2,2 | 2,2 | 2,5 | 2,0 | 1,7 | 1,0 | 1,8 ± 0,6 |
Благодарности
Благодарим г-жи А. Фюрст, г-жи А. Хофер и г-жи Э. Новотны за техническую помощь.
1
Baba
S
,
Shonohara
Y
, Kasuya Y.
1980
Дифференциация эндогенного и экзогенного тестостерона в плазме и моче человека после перорального введения меченного дейтерием тестостерона методом массовой фрагментографии.
Дж Клин Эндокринол Метаб
.
50
:
889
—
894
,2
Shinohara
Y
,
Baba
S
, Kasuya Y.
1980
Поглощение, метаболизм и выведение орального тестостерона у людей методом массовой фрагментографии.
Дж Клин Эндокринол Метаб
.
51
:
1459
—
1462
,3
Fujioka
M
,
Shinohara
Y
,
Baba
S
,
Irie
M
, Inoue K.
1986
Фармакокинетические свойства пропионата тестостерона у нормальных мужчин.
Дж Клин Эндокринол Метаб
.
63
:
1361
—
1364
,4
Johnson
DW
,
McEnvoy
M
,
Seamark
RF
,
Cox
LW
, Phillipou G.
LW
, Phillipou G.
Меченые дейтерием стероидные гормоны: индикаторы для измерения скорости клиренса андрогенов из плазмы у женщин.
Дж Стероид Биохимия
.
22
:
349
—
353
,5
Vierhapper
H
,
Nowotny
P
, Waldhäusl W.
1988
Оценка методом газовой хроматографии-масс-спектрометрии с выбранным ионным мониторингом мочи дозы 3α-андростандиола во время / после в / в введение 13 C-меченного тестостерона человеку.
Дж Стероид Биохим
.
29
:
105
—
109
.6
Vierhapper H.
1990
Образование андростандиола из 13 C-меченного тестостерона у людей.
Стероиды
.
55
:
177
—
180
,7
Bier DM.
1987
Использование стабильных изотопов в метаболических исследованиях.
Baillieres Clin Endocrinol Metab
.
1
:
817
—
836
,8
Wootton
R
,
Ford
GC
,
Cheng
KN
, Halliday D.
1985
Расчет скорости оборота в исследованиях стабильных изотопов.
Phys Med Biol
.
30
:
1143
—
1149
,9
Риварола
MA
,
Saez
JM
,
Meyer
WJ
,
Jenkins
ME
, Migeon CJ.
1966
Скорость метаболического клиренса и скорость продукции крови тестостерона и андрост-4-ен-3,17-диона в базовых условиях, при стимуляции АКТГ и ХГЧ.Сравнение с уровнем выработки тестостерона с мочой.
Дж Клин Эндокринол Метаб
.
26
:
1208
–
1218
.10
Kley
HK
,
Niederau
C
,
Stremmel
W
,
Lax
R
,
3 Per
3 Gruhmeyer
Strohmeyer HL.
1985
Превращение андрогенов в эстрогены при идиопатическом гемохроматозе: сравнение с алкогольным циррозом печени.
Дж Клин Эндокринол Метаб
.
61
:
1
—
6
.11
Мейкл
AW
,
Stringham
JD
,
Bishop
DT
, West DW.
1988
Количественная оценка генетических и негенетических факторов, влияющих на выработку андрогенов и скорость выведения их у мужчин.
Дж Клин Эндокринол Метаб
.
67
:
104
—
109
.12
Samojlik
E
,
Киршнер
MA
,
Silber
D
,
Schneider
G
, Ertel NH.
1984
Повышенная выработка и метаболический клиренс андрогенов у женщин с патологическим ожирением.
Дж Клин Эндокринол Метаб
.
59
:
949
—
953
,13
Эстебан
NV
,
Loughlin
T
,
Yergey
AL
,
Zawadzki
JK
,
Booth Winterer
JC
, Лорио DL.
1991
Суточная скорость выработки кортизола у человека, определенная с помощью разбавления стабильных изотопов / масс-спектрометрии.
Дж Клин Эндокринол Метаб
.
71
:
39
—
45
.
Авторские права © 1997, Общество эндокринологов
Подавление выработки тестостерона посредством регуляции рецептора лютеинизирующего гормона у самцов крыс, подвергшихся воздействию 17α-этинилэстрадиола
Gore, A.C. et al. . EDC-2: Второе научное заявление эндокринного общества о химических веществах, нарушающих работу эндокринной системы. Endocr.Ред. 36 , E1 – E150 (2015).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Диаманти-Кандаракис, Э. и др. . Химические вещества, нарушающие работу эндокринной системы: научное заявление эндокринного общества. Endocr. Ред. 30 , 293–342 (2009).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Schug, T. T., Janesick, A., Blumberg, B. & Heindel, J. J. Химические вещества, нарушающие эндокринную систему, и восприимчивость к болезням. J. Steroid Biochem. Мол. Биол. 127 , 204–215 (2011).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Казальс-Касас, К. и Десвернь, Б. Эндокринные разрушители: от эндокринной системы до нарушения метаболизма. Annu. Rev. Physiol. 73 , 135–162 (2011).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Де Костер, С. & ван Ларебеке, Н. Химические вещества, нарушающие работу эндокринной системы: связанные нарушения и механизмы действия. J. Environ. Общественное здравоохранение 2012 , 713696 (2012).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Мюррей, Т.Дж., Леа, Р. Г., Абрамович, Д. Р., Хайтес, Н. Э. и Фаулер, П. А. Химические вещества, нарушающие эндокринную систему: влияние на мужское репродуктивное здоровье человека. Ранняя беременность 5 , 80–112 (2001).
CAS
PubMed
PubMed Central
Google ученый
Кнез, Дж. Химические вещества, нарушающие работу эндокринной системы, и мужское репродуктивное здоровье. Reprod Biomed Online 26 , 440–448 (2013).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Маклахлан, Дж. А., Симпсон, Э. и Мартин, М. Эндокринные нарушения и женское репродуктивное здоровье. Best Pract. Res. Clin. Эндокринол. Метаб. 20 , 63–75 (2006).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Дарбре, П. Д. Экологические эстрогены, косметика и рак груди. Best Pract. Res. Clin. Эндокринол. Метаб. 20 , 121–143 (2006).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Бергман А. и др. . Производственные сомнения в отношении науки, разрушающей эндокринную систему — опровержение критических комментариев, спонсируемых промышленностью, к отчету ЮНЕП / ВОЗ «Состояние науки в области химикатов, нарушающих работу эндокринной системы, 2012 г.». Регул. Toxicol. Pharmacol. 73 , 1007–1017 (2015).
Артикул
Google ученый
Куль, Х. Фармакология эстрогенов и прогестагенов: влияние различных путей введения. Climacteric 8 (Приложение 1), 3–63 (2005).
Артикул
CAS
Google ученый
Станчик, Ф. З., Арчер, Д. Ф. и Бхавнани, Б. Р. Этинилэстрадиол и 17-бета-эстрадиол в комбинированных пероральных контрацептивах: фармакокинетика, фармакодинамика и оценка риска. Контрацепция 87 , 706–727 (2013).
Артикул
CAS
Google ученый
Thorpe, K. L. et al . Относительные потенции и комбинированные эффекты стероидных эстрогенов у рыб. Environ. Sci. Technol. 37 , 1142–1149 (2003).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google ученый
Vethaak, A. D. et al . Комплексная оценка эстрогенного загрязнения и биологических эффектов в водной среде Нидерландов. Chemosphere 59 , 511–524 (2005).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google ученый
Арис, А.З., Шамсуддин, А.С. и Правина, С.М. Распространение 17альфа-этинилэстрадиола (EE2) в окружающей среде и его влияние на экспонированную биоту: обзор. Environ. Int. 69 , 104–119 (2014).
Артикул
CAS
Google ученый
Usuda, K. et al . Воздействие 17α-этинилэстрадиола на новорожденных влияет на экспрессию кисспептина и уровень ЛГ у самок крыс. J. Vet.Med. Sci. 76 , 1105–1110 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Широта, М. и др. . Дозозависимое ускорение отсроченных эффектов неонатального перорального воздействия низких доз 17альфа-этинилэстрадиола на репродуктивные функции у самок крыс Sprague-Dawley. J. Toxicol. Sci. 40 , 727–738 (2015).
Артикул
CAS
Google ученый
Zhang, H., Taya, K., Nagaoka, K., Yoshida, M. & Watanabe, G. Воздействие 17альфа-этинилэстрадиола (EE) на новорожденных нарушает развитие фолликулов и профили репродуктивных гормонов у самок крыс . Toxicol. Lett. 276 , 92–99 (2017).
Артикул
CAS
Google ученый
Гир, Р. Б. и Белчер, С. М. Воздействие бисфенола А и этинилэстрадиола на селезенку мышей CD-1 самцов и самок. Sci. Отчетность 7 , 856 (2017).
Артикул
ОБЪЯВЛЕНИЯ
CAS
PubMed
PubMed Central
Google ученый
Саваки, М. и др. . Воздействие этинилэстрадиола в утробе матери в процессе кормления грудью вызывает расщелину фаллоса и отсрочивает дисфункцию яичников у потомства. Toxicol.Sci. 75 , 402–411 (2003).
Артикул
CAS
Google ученый
Howdeshell, K. L. et al . Гестационное и лактационное воздействие этинилэстрадиола, но не бисфенола А, снижает андроген-зависимую массу репродуктивных органов и количество сперматозоидов в придатке яичка у самцов крыс с длинным капюшоном Эванса. Toxicol. Sci. 102 , 371–382 (2008).
Артикул
CAS
Google ученый
Орн, С., Холбек, Х., Мадсен, Т. Х., Норргрен, Л. и Петерсен, Г. И. Развитие гонад и выработка вителлогенина у рыбок данио (Danio rerio), подвергшихся воздействию этинилэстрадиола и метилтестостерона. Aquat. Toxicol. 65 , 397–411 (2003).
Артикул
CAS
Google ученый
Scholz, S. & Gutzeit, H.O. 17-α-этинилэстрадиол влияет на репродукцию, половую дифференциацию и экспрессию гена ароматазы медаки (Oryzias latipes). Aquat. Toxicol. 50 , 363–373 (2000).
Артикул
CAS
Google ученый
Монтгомери, Т.М., Браун, А.С., Гендельман, Х.К., Ота, М. и Клотфельтер, Е.Д. Воздействие 17альфа-этинилэстрадиола снижает подвижность и АТФ в сперме самцов боевой рыбы Betta splendens. Environ. Toxicol. 29 , 243–252 (2014).
Артикул
CAS
Google ученый
Партридж К., Ботчер А. и Джонс А. Г. Кратковременное воздействие синтетического эстрогена нарушает динамику спаривания у иглы. Horm. Behav. 58 , 800–807 (2010).
Артикул
CAS
Google ученый
Hogan, N. S., Currie, S., LeBlanc, S., Hewitt, L. M. и MacLatchy, D. L. Модуляция стероидогенеза и передачи сигналов эстрогена у эстуариновой киллифы (Fundulus heteroclitus), подвергшейся воздействию этинилэстрадиола. Aquat. Toxicol. 98 , 148–156 (2010).
Артикул
CAS
Google ученый
Kumar, S., Blumberg, D. L., Canas, J. A. & Maddaiah, V. T. Хорионический гонадотропин человека (ХГЧ) увеличивает содержание свободного в цитозоле кальция в клетках Лейдига взрослых крыс. Cell Calcium 15 , 349–355 (1994).
Артикул
CAS
Google ученый
Walker, W. H. Передача сигналов тестостерона и регуляция сперматогенеза. Сперматогенез 1 , 116–120 (2011).
Артикул
PubMed
PubMed Central
Google ученый
Kashiwagi, B. et al . Изменения уровней тестостерона и дигидротестостерона в дополнительных половых органах самцов крыс, сыворотке и семенной жидкости после кастрации: создание нового высокочувствительного метода одновременного измерения андрогенов. Дж. Андрол 26 , 586–591 (2005).
Артикул
CAS
Google ученый
Аззуни, Ф., Годой, А., Ли, Ю. и Молер, Дж. Семейство 5 изоферментов альфа-редуктазы: Обзор основ биологии и их роли в заболеваниях человека. Adv. Урол . 2012 (2012).
Zhu, Y. S. & Sun, G. H. Изоферменты 5α-редуктазы в простате. J. Med. Sci. 25 , 1–12 (2005).
ADS
PubMed
PubMed Central
Google ученый
Johnson, A.C. & Williams, R.J. Модель для оценки концентрации эстрадиола, эстрона и этинилэстрадиола на входе и выходе при очистке сточных вод. Environ. Sci. Technol. 38 , 3649–3658 (2004).
Артикул
ОБЪЯВЛЕНИЯ
CAS
PubMed
PubMed Central
Google ученый
Десброу, К., Рутледж, Э. Дж., Брайти, Г. К., Самптер, Дж. П. и Уолдок, М. Идентификация эстрогенных химических веществ в сточных водах STW. 1. Химическое фракционирование и in vitro биологический скрининг. Environ. Sci. Technol. 32 , 1549–1558 (1998).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google ученый
Attina, T. M. et al. . Воздействие химикатов, нарушающих работу эндокринной системы, в США: анализ бремени болезней и затрат на популяцию. Lancet Diabetes Endocrinol. 4 , 996–1003 (2016).
Артикул
PubMed
PubMed Central
Google ученый
Trasande, L. et al . Бремя болезней и затраты, связанные с воздействием химикатов, нарушающих работу эндокринной системы, в Европейском Союзе: обновленный анализ. Андрология 4 , 565–572 (2016).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Юревич Дж., Ханке В., Радван М. и Бонд Дж. П. Факторы окружающей среды и качество спермы. Внутр. J. Occup. Med. Environ. Здоровье. 22 , 305–329 (2009).
PubMed
PubMed Central
Google ученый
Li, C.J. и др. . Снижение качества спермы у мужчин на севере Тайваня в период с 2001 по 2010 год. Подбородок. J. Physiol. 59 , 355–365 (2016).
Артикул
PubMed
PubMed Central
Google ученый
Ruixue, W. et al . Влияние качества спермы, профессионального воздействия факторов окружающей среды и образа жизни на повторяющуюся потерю беременности. J. Assist. Репрод. Genet. 30 , 1513–1518 (2013).
Артикул
PubMed
PubMed Central
Google ученый
Дженг, Х. А. Воздействие химических веществ, нарушающих эндокринную систему, и мужское репродуктивное здоровье. Фронт. Общественное здравоохранение 2 , 55 (2014).
Артикул
PubMed
PubMed Central
Google ученый
Xu, H. et al . Воздействие 17альфа-этинилэстрадиола ухудшает репродуктивные функции как самцов, так и самок рыбок данио (Danio rerio). Aquat. Toxicol. 88 , 1–8 (2008).
Артикул
CAS
Google ученый
Bhandari, R.K., vom Saal, F. S. & Tillitt, D.E. Эффекты трансгенерации от воздействия бисфенола А или 17альфа-этинилэстрадиола на раннем этапе развития в medaka, Oryzias latipes. Sci. Отчет 5 , 9303 (2015).
Артикул
ОБЪЯВЛЕНИЯ
CAS
PubMed
PubMed Central
Google ученый
Форест, М. Г., Де Перетти, Э. и Бертран, Дж. Гипоталамо-гипофизарно-гонадные отношения у человека от рождения до полового созревания. Clin. Эндокринол. (Oxf.) 5 , 551–569 (1976).
Артикул
CAS
Google ученый
Ewing, L. L., Wing, T. Y., Cochran, R. C., Kromann, N. & Zirkin, B.R. Влияние лютеинизирующего гормона на структуру клеток Лейдига и секрецию тестостерона. Эндокринология 112 , 1763–1769 (1983).
Артикул
CAS
Google ученый
Mendis-Handagama, S.М. Лютеинизирующий гормон на структуру и функцию клеток Лейдига. Histol. Histopathol. 12 , 869–882 (1997).
CAS
Google ученый
Ху, Дж., Чжан, З., Шен, У. Дж. И Азхар, С. Доставка холестерина в клетки, внутриклеточная обработка и использование для биосинтеза стероидных гормонов. Nutr. Метаб. (Лондон) 7 , 47 (2010).
Артикул
CAS
Google ученый
Roselli, C.F. Ароматаза мозга: роль в воспроизводстве и нейрозащите. J. Steroid Biochem. Мол. Биол. 106 , 143–150 (2007).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Реско, Дж. А., Квадри, С. К. и Спайс, Х. Г. Контроль гонадотропинов у самцов макак-резусов с отрицательной обратной связью: влияние времени после кастрации и взаимодействия тестостерона и эстрадиола-17бета. Эндокринология 101 , 215–224 (1977).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Ханссон В., Сколхегг Б. С. и Таскен К. Циклическая АМФ-зависимая протеинкиназа (ПКА) в клетках яичек. Клеточно-специфическая экспрессия, дифференциальная регуляция и нацеливание на субъединицы PKA. J. Steroid Biochem. Мол. Биол. 73 , 81–92 (2000).
Артикул
PubMed
PubMed Central
Google ученый
Абду, Х. С., Вильнев, Г. и Тремблей, Дж. Дж. Путь передачи сигналов кальция регулирует стероидогенез клеток Лейдига посредством транскрипционного каскада с участием ядерного рецептора NR4A1 и стероидогенного белка острой регуляции. Эндокринология 154 , 511–520 (2013).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Garcia-Reyero, N. et al . Ответы на экспрессию генов у самцов толстоголовых гольянов, подвергшихся воздействию бинарных смесей эстрогена и антиэстрогена. BMC Genomics 10 , 308 (2009).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Колман, Дж. Р., Болдуин, Д., Джонсон, Л. Л. и Шольц, Н. Л. Влияние синтетического эстрогена 17альфа-этинилэстрадиола на агрессию и ухаживание у самцов рыбок данио (Danio rerio). Aquat. Toxicol. 91 , 346–354 (2009).
Артикул
CAS
Google ученый
Браун, К. Х., Шульц, И. Р., Клауд, Дж. Г. и Наглер, Дж. Дж. Образование анеуплоидных сперматозоидов у радужной форели, подвергшейся воздействию эстрогена 17 {альфа-этинилэстрадиола из окружающей среды. Proc. Natl. Акад. Sci. США 105 , 19786–19791 (2008).
Артикул
ОБЪЯВЛЕНИЯ
Google ученый
Iwase, T., Sano, F., Murakami, T. & Inazawa, K. Токсичность этинилэстрадиола для мужской репродуктивной системы, связанная с 4-недельным ежедневным дозированием крыс перед спариванием. J. Toxicol. Sci. 20 , 265–279 (1995).
Артикул
CAS
Google ученый
Takahashi, M. et al . Ранние индикаторы отсроченных побочных эффектов в женских репродуктивных органах крыс, получавших неонатальное воздействие 17альфа-этинилэстрадиола. J. Toxicol. Sci. 39 , 775–784 (2014).
Артикул
CAS
Google ученый
Лиу, Ф. К. и др. . Влияние плавания на выработку альдостерона у крыс. PLoS One 9 , e87080 (2014).
Артикул
ОБЪЯВЛЕНИЯ
CAS
PubMed
PubMed Central
Google ученый
Wu, J. J. et al. . Дифференциальные эффекты нонилфенола на секрецию тестостерона в клетках Лейдига крыс. Токсикология 268 , 1–7 (2010).
Артикул
CAS
Google ученый
Chen, C.C. и др. . Взаимодействие кортикостерона и лактата на регуляцию выработки тестостерона в клетках Лейдига крыс. J. Cell. Physiol . (2016).
Wang, K. L. et al . Влияние полибромированных дифениловых эфиров на стероидогенез в клетках Лейдига крыс. Hum. Репрод. 26 , 2209–2217 (2011).
Артикул
CAS
Google ученый
Ван, К. Л. и др. . Адаптация выработки тестостерона в ответ на действие низких доз нонилфенола. Адапт. Med. 7 , 44–51 (2015).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google ученый
Лин, П. Х. и др. . Индукция экспрессии маркерного белка-30 почечного старения (SMP30) тестостероном и его вклад в абсорбцию кальция с мочой у самцов крыс. Sci.Отчет 6 , 32085 (2016).
Артикул
ОБЪЯВЛЕНИЯ
CAS
PubMed
PubMed Central
Google ученый
Tseng, H.C. et al. . Механизмы, лежащие в основе ингибирования емкости сперматозоидов мышей семенным белком SPINKL. J. Cell. Биохим. 114 , 888–898 (2013).
Артикул
CAS
Google ученый
Ли, С. Х. и др. . Ингибитор сериновой протеазы SERPINE2 обратимо модулирует емкость сперматозоидов мышей. Внутр. J. Mol. Sci . 19 (2018).
Стил, Р. Г. Д. и Торри, Дж. Х. Принципы и процедуры статистики: биометрический подход . 2-е изд. (McGraw-Hill, 1980).
Ученые разработали рецепт клеток, вырабатывающих тестостерон
Серия факторов роста и других белков стимулирует пролиферацию стволовых клеток и дифференцировку в клетки, вырабатывающие мужской гормон
Исследователи под руководством групп из Школы общественного здравоохранения Блумберга Джонса Хопкинса и Китайского медицинского университета Вэньчжоу обнаружили способ сохранить взрослые стволовые клетки. клетки, которым суждено стать продуцирующими тестостерон клетками, размножающимися и находящимися на пути к выполнению своей судьбы, сообщает новое исследование.
Результаты могут в конечном итоге помочь ученым разработать трансплантируемые клетки, которые могут производить тестостерон, избегая множества недостатков, связанных с другими способами введения этого основного мужского гормона. Отчет об исследовании опубликован в журнале Proceedings of the National Academy of Sciences.
Ученым давно известно, что тестостерон, вырабатываемый клетками Лейдига в яичках, необходим мужской репродуктивной системе для развития у плода и для поддержания мужской репродуктивной функции в более позднем возрасте.Более поздние исследования показали, что тестостерон выполняет множество других важных функций в организме, при этом его дефицит способствует увеличению жировых отложений, снижению мышечной массы, повышенной утомляемости, депрессивному настроению, снижению когнитивной функции и снижению иммунного ответа. Низкий уровень тестостерона также связан с повышенным риском смертности у пожилых мужчин.
Чтобы бороться с этими проблемами и синхронизировать вторичные половые признаки с гендерной идентичностью у трансгендерных мужчин, врачи часто назначают добавки тестостерона, которые можно вводить различными способами, включая инъекции или местно.Но у этих методов есть ряд побочных эффектов, включая повышенный риск сердечных приступов и инсультов, увеличение простаты, увеличение груди и прыщей. Эти проблемы, говорит руководитель исследования Хаолинь Чен, доктор философии, старший научный сотрудник отдела биохимии и молекулярной биологии школы Блумберг, связаны с резкими пиками и падениями концентрации гормона в крови в результате искусственного введения.
Один из способов избежать этих проблем — имитировать естественный процесс выработки тестостерона в организме с помощью клеток, которые постепенно выделяют гормон.Хотя Чен и его коллеги преуспели в выделении взрослых стволовых клеток, которые должны были стать клетками Лейдига, они не знали, как поддерживать размножение клеток, процесс, известный как пролиферацию, и, кроме того, направить их на продуцирование тестостерона, процесс, известный как дифференциация. .
В новом исследовании исследователи использовали метод, который они разработали ранее, чтобы поддерживать жизнь стволовых клеток, культивируя их на изолированных участках трубок, по которым сперма переносится в яички, известные как семенные канальцы.В течение следующих нескольких недель исследователи скармливали этим образцам различные факторы роста и другие белки, которые, как предполагали предыдущие исследования, могли играть роль в пролиферации и дифференцировке.
Они обнаружили множество факторов, которые стимулировали пролиферацию, включая белки пустынного хэджхог (DHH), основной фактор роста фибробластов, фактор роста тромбоцитов и активин. DHH и активин также стимулировали дифференцировку. Исследование также показало, что DHH играет жизненно важную роль в преобразовании стволовых клеток в полностью функционирующие, производящие тестостерон клетки Лейдига.
Кроме того, Чен и его коллеги определили, что белок под названием CD90, обнаруженный на поверхности клеток, может надежно различать стволовые клетки на поверхности семенных канальцев, которые могут направляться в клетки Лейдига.
Вместе, говорит Чен, эти результаты могут быть полезны как для фундаментальных исследований в качестве модельной системы для стволовых клеток в целом, так и для того, чтобы когда-нибудь помочь исследователям создать популяцию продуцирующих тестостерон клеток, пригодных для трансплантации, путем выделения нужных стволовых клеток. , побуждая их размножаться, а затем дифференцироваться в клетки Лейдига.