что это такое, полезные свойства и как их правильно принимать

© Yulia Furman — stock.adobe.com
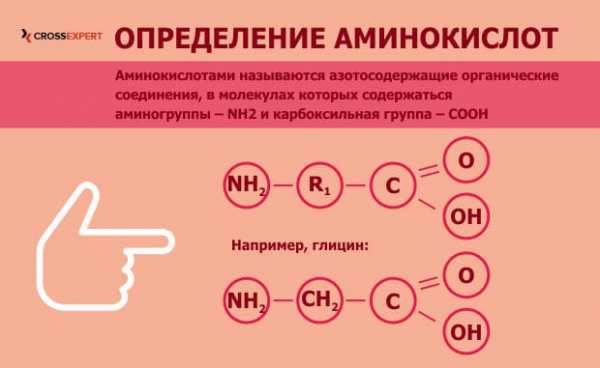
Аминокислоты — органические вещества, состоящие из углеводородного скелета и двух дополнительных групп: аминной и карбоксильной. Последние два радикала обусловливают уникальные свойства аминокислот — они могут проявлять свойства как кислот, так и щелочей: первые — за счет карбоксильной группы, вторые — за счет аминогруппы.
Итак, мы выяснили, что такое аминокислоты с точки зрения биохимии. Теперь рассмотрим их влияние на организм и применение в спорте. Для спортсменов аминокислоты важны своим участием в протеиновом обмене. Именно из отдельных аминокислот строятся протеины для роста мышечной массы нашего тела — мышечная, скелетная, печеночная, соединительная ткани. Помимо этого, некоторые аминокислоты напрямую участвуют в обмене веществ. К примеру, аргинин участвует в орнитиновом цикле мочевины — уникальном механизме обезвреживания аммиака, образующегося в печени в процессе переваривания белков.
- Из тирозина в коре надпочечников синтезируются катехоламины — адреналин и норадреналин — гормоны, функция которых — поддержание тонуса сердечно сосудистой системы, мгновенная реакция на стрессовую ситуацию.
- Триптофан — предшественник гормона сна — мелатонина, вырабатывающегося в шишковидном теле головного мозга — эпифизе. При недостатке этой аминокислоты в рационе процесс засыпания усложняется, развивается бессонница и ряд других заболеваний, ею обусловленных.
Перечислять можно долго, однако остановимся на аминокислоте, значение которой особенно велико для спортсменов и людей, умеренно занимающихся спортом.
Для чего нужен глютамин
Глютамин — аминокислота, лимитирующая синтез протеина, из которого состоит наша иммунная ткань — лимфатические узлы и отдельные образования лимфоидной ткани. Значение этой системы переоценить трудно: без должного сопротивления инфекциям ни о каком тренировочном процессе говорить не приходится. Тем более, что каждая тренировка — не важно, профессиональная или любительская — это дозированный стресс для организма.
Стресс — необходимое условие, чтобы сдвинуть с места нашу «точку равновесия», то есть вызвать определенные биохимические и физиологические изменения в организме. Любой стресс — это цепь реакций, мобилизующих тело. В промежуток, характеризующий регресс каскада реакций симпатоадреналовой системы (а именно они и представляют собой стресс), происходит снижение синтеза лимфоидной ткани. По этой причине процесс распада превышает скорость синтеза, а значит, иммунитет ослабевает. Так вот, дополнительный прием глютамина сводит к минимуму этот крайне нежелательный, но неизбежный эффект физической нагрузки

Незаменимые и заменимые аминокислоты
Чтобы понять, для чего нужны незаменимые аминокислоты в спорте, необходимо иметь общие представления о белковом обмене. Потребленные человеком белки на уровне желудочно-кишечного тракта обрабатываются ферментами — веществами, расщепляющими пищу, которую мы употребили.
В частности, белки распадаются сперва до пептидов — отдельных цепочек аминокислот, не имеющих четвертичной пространственной структуры. И уже пептиды распадутся на отдельные аминокислоты. Те, в свою очередь, усваиваются организмом человека. Это значит, что аминокислоты всасываются в кровь и только с этого этапа могут быть использованы в качестве продуктов для синтеза белка тела.

Забегая вперед скажем, что прием отдельных аминокислот в спорте сокращает этот этап — отдельные аминокислоты будут сразу же всасываться в кровь и процессы синтеза, а также биологический эффект аминокислот наступят быстрее.
Всего существует двадцать аминокислот. Чтобы процесс синтеза белка в теле человека стал возможным в принципе, в рационе человека должен присутствовать полный спектр — все 20 соединений.
Незаменимые
Вот с этого момента и появляется понятие незаменимости. К незаменимым аминокислотам относятся те, которые наше тело не способно синтезировать самостоятельно из других аминокислот. А это значит, что появится им, кроме как из продуктов питания, неоткуда. Таких аминокислот насчитывается 8 плюс 2 частично-заменимые.
Рассмотрим в таблице, в каких продуктах содержится каждая незаменимая аминокислота и какова ее роль в организме человека:
| Название | В каких продуктах содержится | Роль в организме |
| Лейцин | Орехи, овес, рыба, яйца, курица, чечевица | Снижает содержание сахара в крови |
| Изолейцин | Нут, чечевица, кешью, мясо, соя, рыба, яйца, печень, миндаль, мясо | Восстанавливает мышечную ткань |
| Лизин | Амарант, пшеница, рыба, мясо, большинство молочных продуктов | Принимает участие в усвоении кальция |
| Валин | Арахис, грибы, мясо, бобовые, молочные продукты, многие зерновые | Принимает участие в обменных процессах азота |
| Фенилаланин | Говядина, орехи, творог, молоко, рыба, яйца, разные бобовые | Улучшение памяти |
| Треонин | Яйца, орехи, бобы, молочные продукты | Синтезирует коллаген |
| Метионин | Фасоль, соя, яйца, мясо, рыба, бобовые, чечевица | Принимает участие в защите от радиации |
| Триптофан | Кунжут, овес, бобовые, арахис, кедровые орехи, большинство молочных продуктов, курица, индейка, мясо, рыба, сушенные финики | Улучшает и делает сон глубже |
| Гистидин (частично-заменимая) | Чечевица, соевые бобы, арахис, тунец, лосось, говяжье и куриное филе, свиная вырезка | Принимает участие в противовоспалительных реакциях |
| Аргинин (частично-заменимая) | Йогурт, кунжут, семена тыквы, швейцарский сыр, говядина, свинина, арахис | Способствует росту и восстановлению тканей организма |
В достаточном количестве аминокислоты содержатся в животных источниках белка — рыбе, мясе, птице. При отсутствии таковых в рационе весьма целесообразен прием недостающих аминокислот в качестве добавок спортивного питания, что особенно актуально для спортсменов-вегетарианцев.
Основное внимание последним стоит обратить на такие добавки, как ВСАА — смесь лейцина, валина и изолейцина. Именно по этим аминокислотам возможна «просадка» в рационе, не содержащем животных источников белка. Для спортсмена (как профессионала, так и любителя) это абсолютно не допустимо, так как в долгосрочной перспективе приведет к катаболизму со стороны внутренних органов и к заболеваниям последних. В первую очередь страдает от недостатка аминокислот печень.

© conejota — stock.adobe.com
Заменимые
Заменимые аминокислоты и их роль рассмотрим в таблице ниже:
| Название | Роль в организме |
| Аланин | Принимает участие в глюконеогенезе печени |
| Пролин | Отвечает за составление прочной структуры коллагена |
| Левокарнитин | Поддерживает кофермент А |
| Тирозин | Отвечает за ферментативную активность |
| Серин | Отвечает за построение природных белков |
| Глютамин | Синтезирует протеины мышц |
| Глицин | Снижает напряжение т уменьшает агрессивность |
| Цистеин | Положительно влияет на текстуру и состояние кожи |
| Таурин | Оказывает метаболическое действие |
| Орнитин | Принимает участие в биосинтезе мочевины |
Что происходит с аминокислотами и протеинами в вашем теле
Аминокислоты, попавшие в кровоток, в первую очередь распределяются по тканям тела, где в них есть наибольшая потребность. Если у вас есть «просадка» по определенным аминокислотам, прием дополнительного количества белка, богатого ими, или прием дополнительных аминокислот, будет особенно полезен.
Синтез белка происходит на клеточном уровне. В каждой клетка есть ядро — самая важная часть клетки. Именно в ней происходит считывание генетической информации и ее воспроизводство. По сути, вся информация о строении клеток закодирована в последовательности аминокислот.
Как выбрать аминокислоты рядовому любителю, умеренно занимающемуся спортом 3-4 раза в неделю? Никак. Они ему просто не нужны.
Более важны для современного человека следующие рекомендации:
- Начать питаться регулярно в одно и то же время.
- Сбалансировать рацион по белкам жирам и углеводам.
- Убрать из рациона фастфуд и некачественную пищу.
- Начать употреблять достаточное количество воды — 30 мл на килограмм массы тела.
- Отказаться от рафинированного сахара.
Эти элементарные манипуляции принесут гораздо больше, чем добавление в рацион каких бы то ни было добавок. Более того, добавки без соблюдения указанных условий будут абсолютно бесполезны.
Зачем знать, какие аминокислоты вам нужны, если вы питаетесь непонятно чем? Откуда вы знаете, из чего сделаны котлеты в столовой? Или сосиски? Или что за мясо в котлете в бургера? Про начинку для пиццы вообще промолчим.
Поэтому прежде, чем делать вывод о потребности в аминокислотах, нужно начать питаться простыми, чистыми и полезными продуктами и выполнить описанные выше рекомендации.
То же самое касается дополнительного приема белка. Если в вашем рационе присутствует белок, в количестве 1,5- 2 г на килограмм массы тела, никакой дополнительный белок вам не нужен. Лучше потратить деньги на покупку качественных продуктов питания.
Важно также понимать, что протеин и аминокислоты — это не фармакологические препараты! Это всего лишь добавки спортивного питания. И ключевое слово здесь — добавки. Добавляют их по потребности.
Чтобы понять, есть ли потребность, нужно контролировать свое питание. Если вы уже прошли описанные выше шаги и поняли, что добавки все-таки необходимы, первое, что вы должны сделать — пойти в магазин спортивного питания и выбрать соответствующий продукт в соответствии с финансовыми возможностями. Единственное, чего не стоит делать новичкам — это покупать аминокислоты с натуральным вкусом: пить их будет затруднительно по причине чрезвычайной горечи.
Вред, побочные эффекты, противопоказания
Если у вас есть заболевания, характеризующиеся непереносимостью одной из аминокислот, вы об этом знаете с рождения, так же, как и ваши родители. Этой аминокислоты нужно избегать и дальше. Если же этого нет, говорить о вреде и противопоказаниях добавок нет смысла, поскольку это полностью натуральные вещества.
Аминокислоты — составляющая часть белка, белок — привычная часть рациона человека. Все то, что продается в магазинах спортивного питания — не является фармакологическими препаратами! Только дилетанты могут говорить о каком-то вреде и противопоказаниях. По той же причине нет смысла рассматривать такое понятие, как побочные эффекты аминокислот — при умеренному потреблении никаких негативных реакций быть не может.
Трезво подходите к своему рациону и спортивным тренировкам! Будьте здоровы!
Оцените материал
Научный консультант проекта.
Физиолог (биологический факультет СПБГУ, бакалавриат).
Биохимик (биологический факультет СПБГУ, магистратура).
Инструктор по хатха-йоге (Институт управления развитием человеческих ресурсов, проект GENERATION YOGA). Научный сотрудник (2013-2015 НИИ акушерства, гинекологии и репродуктологии им. Отта, работа с маркерами женского бесплодия, анализ биологических образцов; 2015-2017 НИИ особо чистых биопрепаратов, разработка лекарственных средств) Автор и научный консультант сайтов по тематике ЗОЖ и науке (в области продления жизни) C 2019 года научный консультант проекта Cross.Expert.
Редакция Cross.Expert
cross.expert
Аминокислоты — Википедия
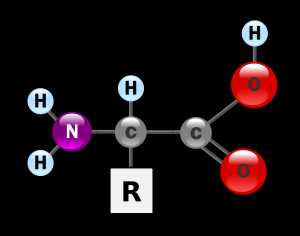
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде).
[1]
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.[1]
Открытие аминокислот в составе белков
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены незаменимые аминокислоты
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
D-Аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[5].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация
| Аминокислота | 3-буквы[13] | 1-буква[13] | аминокислот | мнемоническое
правило[14] |
Полярность[15] | радикалу | Mr | Vw
(Å3) |
pI | шкала гидрофобности[16] | частота в белках (%)[17] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75.067 | 48 | 6.06 | −0.4 | 7.03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89.094 | 67 | 6.01 | 1.8 | 8.76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117.148 | 105 | 6.00 | 4.2 | 6.73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131.175 | 124 | 6.05 | 4.5 | 5.49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131.175 | 124 | 6.01 | 3.8 | 9.68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6.30 | −1.6 | 5.02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105.093 | 73 | 5.68 | −0.8 | 7.14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119.119 | 93 | 5.60 | −0.7 | 5.53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Неполярные | Серосодержащие | 121.154 | 86 | 5.05 | 2.5 | 1.38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149.208 | 124 | 5.74 | 1.9 | 2.32 |
| Аспарагиновая
кислота |
Asp | D | GAU, GAC | asparDic acid | Полярные
заряженные отрицательно |
заряженные отрицательно | 133.104 | 91 | 2.85 | −3.5 | 5.49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132.119 | 96 | 5.41 | −3.5 | 3.93 |
| Глутаминовая
кислота |
Glu | E | GAA, GAG | gluEtamic acid | Полярные
заряженные отрицательно |
заряженные отрицательно | 147.131 | 109 | 3.15 | −3.5 | 6.32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146.146 | 114 | 5.65 | −3.5 | 3.9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146.189 | 135 | 9.60 | −3.9 | 5.19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10.76 | −4.5 | 5.78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные
заряженные положительно |
Гетероциклические | 155.156 | 118 | 7.60 | −3.2 | 2.26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165.192 | 135 | 5.49 | 2.8 | 3.87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181.191 | 141 | 5.64 | −1.3 | 2.91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические,
Гетероциклические |
204.228 | 163 | 5.89 | −0.9 | 6.73 |
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[15]
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.[18]
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты.[19]
См. также
Примечания
- ↑ 1 2 (November 1983) «New Naturally Occurring Amino Acids». Angewandte Chemie International Edition in English 22 (11): 816–28. DOI:10.1002/anie.198308161.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Карпов В. Л. От чего зависит судьба гена // Природа. — 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada (1975). «Aspartic acid racemization in tooth enamel from living humans». Proceedings of the National Academy of Sciences 72 (8): 2891 -2894. Проверено 2011-09-05.
- ↑
CLOOS P; FLEDELIUS C. Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Проверено 5 сентября 2011. Архивировано 2 февраля 2012 года. - ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R–36R. — ISSN 0959-6658.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514–3526. — ISSN 1742-464X. — DOI:10.1111/j.1742-4658.2008.06515.x.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317–327. — ISSN 0950-382X.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) — General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1–13. — ISSN 0304-4165. — DOI:10.1016/j.bbagen.2005.05.010.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706–712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29–35. — ISSN 1552-4450. — DOI:10.1038/nchembio847.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — DOI:10.1186/1745-6150-6-14.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105–132. — ISSN 0022-2836.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112–D1116. — ISSN 1362-4962. — DOI:10.1093/nar/gkw978.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — DOI:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
Литература
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
Ссылки
wikipedia.green
АМИНОКИСЛОТЫ • Большая российская энциклопедия
АМИНОКИСЛО́ТЫ, органич. соединения, содержащие карбоксильные COOH и аминогруппы NH2. Исключение составляет пролин. Обладают свойствами и кислот и оснований. В зависимости от положения аминогруппы в углеродной цепи относительно карбоксильной группы различают α-, β-, γ- и др. А. У ω-А. аминогруппа находится на конце цепи. Участвуют в обмене азотистых веществ всех организмов, являясь исходными соединениями при биосинтезе белков, пептидов, пуриновых и пиримидиновых оснований, ряда витаминов, пигментов, алкалоидов и др.
Классификация
Описано свыше 150 природных А., среди которых особенно важны 20 α-А. (табл.), входящих в состав белков, кодируемых генетическим кодом; общая формула:
В зависимости от природы боковой цепи R α-А. подразделяют на две группы: А. с неполярными (гидрофобными) и А. с полярными (гидрофильными) боковыми цепями. К 1-й группе относятся шесть А. с алифатич. боковой цепью – аланин, валин, лейцин, изолейцин, метионин, пролин и две с ароматической – фенилаланин и триптофан. Среди представителей 2-й группы боковые цепи семи А. содержат группировки, способные нести отрицат. или положит. заряд. В аспарагиновой и глутаминовой кислотах β- и γ-карбоксильные группы при рН 7,0 заряжены отрицательно. К осно́вным А. относятся лизин, аргинин и гистидин. ε-Аминогруппа лизина и гуанидиновая группировка аргинина несут положит. заряд (протонированы) в нейтральной среде, а имидазольная группировка гистидина – в кислой. В щелочных условиях отрицат. заряд могут приобретать боковые группы тирозина и цистеина. Характерной особенностью остатков цистеина является их способность в составе молекулы белка подвергаться окислению с образованием остатков цистина. А. присвоены сокращённые трёхбуквенные и однобуквенные обозначения, используемые в науч. литературе. В 1986 в ряде белков архебактерий, истинных бактерий (эубактерий) и животных была обнаружена α-А. – селеноцистеин (ей присвоены символы Sec и U), в 2002 открыт пирролизин (пока обнаружен только у одного вида метанобразующих архей). Обе эти А. кодируются триплетами, которые обычно служат «стоп-кодонами» (т. е. оповещают об окончании синтеза белка на рибосомах): селеноцистеин – триплетом UGA, а пирролизин – UAG.
Пирролизин (где R=Ch4, Nh3 или OH)
Цистин
Селеноцистеин
Большая часть А., обнаруженных в тканях живых организмов, но не входящих в состав белков, могут выполнять важные функции. Так, орнитин и цитрулин участвуют в обмене веществ, в частности в синтезе мочевины у животных, 2,4-дигидрооксифенилаланин (ДОФА) образуется в качестве промежуточного продукта в ходе распада фенилаланина и тирозина в организме и является медиатором центральной нервной системы. Кроме того, имеются А., функция которых пока не ясна. В ряде белков (уже после их синтеза на рибосомах) боковые группы А. претерпевают изменения в ходе посттрансляционной модификации. Напр., в составе молекулы коллагена пролин и лизин превращаются соответственно в 4-гидроксипролин и 5-гидроксилизин, в миозине присутствует N-метиллизин, только в эластине встречается ферментативно модифицированный лизин – десмозин. Помимо α-А. в свободном виде и в составе некоторых биологически важных пептидов, встречаются А., аминогруппа которых связана не с α-углеродным атомом. К их числу относятся β-аланин, входящий в состав пантотеновой кислоты, γ-аминомасляная кислота, играющая важную роль в функционировании нервной системы, δ-аминолевулиновая кислота, являющаяся промежуточным продуктом синтеза порфиринов.
Физические и химические свойства
А. – бесцветные кристаллич. вещества, растворимые в воде; темп-ры плавления 220–315 °C. В кристаллах и водных растворах при нейтральных значениях рН α-А. существуют преим. в виде диполярных ионов (цвиттер-ионов), у которых аминогруппы протонированы , а карбоксильные группы диссоциированы (СОО—). А. являются амфолитами; ионизация их молекул зависит от рН раствора:
Значения pH, при котором концентрация катионов А. равна концентрации анионов, называется изоэлектрической точкой (pI). Аминогруппа А. ионизирована в неск. меньшей степени, чем карбоксильная группа, поэтому водный раствор А. имеет слабокислый характер. Все α-А., кроме глицина, имеют асимметрический (хиральный) α-углеродный атом и существуют в виде двух энантиомеров. У изолейцина и треонина хиральными являются также и β-углеродные атомы.
За редким исключением природные α-А. относятся к L-ряду и только в оболочках бактерий, в составе некоторых антибиотиков и в метаболитах грибов, а также в коже некоторых видов южноамериканских лягушек и корне женьшеня обнаружены А. D-ряда.
В результате взаимодействия α-аминогруппы одной А. с α-карбоксильной группой другой А. в процессе биосинтеза белка (трансляции) происходит образование пептидной связи.
Превращения аминокислот в организмах
Высшие растения и хемосинтезирующие организмы все необходимые им А. синтезируют из аммониевых солей и нитратов, а также из кето- или гидроксикислот – продуктов дыхания и фотосинтеза. Человек и животные синтезируют большинство А. из обычных безазотистых продуктов обмена и аммониевого азота. Это т. н. заменимые А. Но ряд А. – незаменимых – они должны получать в готовом виде с пищей. Для человека, напр., незаменимыми А. являются валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин, а для детей также аргинин и гистидин. Недостаток в организме той или иной аминокислоты приводит к нарушению обмена веществ, замедлению роста и развития. А. участвуют в поддержании азотистого баланса в организме. Окислит. распад А. путём дезаминирования приводит к образованию кето- и гидроксикислот – промежуточных продуктов цикла трикарбоновных кислот; далее они превращаются в углеводы, новые А. и т. д. или окисляются до СО2 и Н2О с выделением энергии. У животных азот в виде аммониевых солей, мочевины или мочевой кислоты выводится из организма. У растений усвоение А. происходит т. о., что азотистые отходы практически отсутствуют. Некоторые А. являются предшественниками важных гормонов и нейромедиаторов: тирозин и фенилаланин – дофамина и адреналина, триптофан – серотонина, гистидин – гистамина, глутаминовая кислота – γ-аминомасляной кислоты, аргинин – оксида азота (NO).
Практическое использование
Таблица. Важнейшие аминокислоты, входящие в состав белков (цветом обозначены боковые цепи)
Смеси L-α-А., а также отдельные А. применяют в медицине для лечения больных с заболеваниями пищеварит. органов (гистидин, метионин), при малокровии, ожогах (метионин), нервно-психич. заболеваниях (глицин и глутаминовая кислота), при сосудистых заболеваниях головного мозга (γ-аминомасляная кислота) и т. д. Для обогащения кормов в животноводстве и лечения животных используются лизин, метионин, треонин, триптофан, в пищевой пром-сти – глутамат натрия и лизин. ω-А. и их лактамы служат для пром. произ-ва полиамидов. Ароматич. А. нашли применение в синтезе красителей и лекарственных препаратов. Некоторые L-α-А. получают микробиологич. синтезом (лизин, триптофан, треонин, глутаминовая кислота) или выделяют из гидролизатов богатых ими белков (пролин, аргинин, гистидин, глутаминовая кислота, тирозин).
bigenc.ru
Аминокислоты — что это и как принимать.

Аминокислотами называют органические вещества, состоящие из углеводородного скелета в комплексе с двумя группами: аминной плюс карбоксильной. Наличие последних двух радикалов является причиной наличия уникальных свойств, которые одновременно обладать свойствами кислот либо щелочей: 1-вые обусловлены наличием карбоксильной группы, 2-рые — наличием аминогруппы.
Незаменимые аминокислоты эффективно используются в качестве строительного материала для белков, необходимых нашему организму, для образования мышц, сухожилий, связок, кожи и волос. Они способствуют повышению эффективности тренировок в комплексе с наращиванием мышечной массы. Аминокислоты эффективно способствуют быстрому восстановлению и избавлению от болей после интенсивных тренировок. Отметим, что затраты, связанные с усвоением данного «строительного материала», достаточно высоки. Следовательно, процесс эффективно и непосредственно способствует снижению веса.
Аминокислоты в организме человека
Перейдем к рассмотрению влияния аминокислот для спортсменов для физических упражнений в целом. Для каждого человека, предпочитающего активный образ жизни, именно АК являются важными участниками протеинового обмена. Они участвуют в строительстве протеинов, способствующих наращиванию мышечной массы: от скелетной до печеночной, от мышечной до соединительной ткани. Некоторые непосредственно участвуют в обмене веществ. Аргинин – участник орнитинового цикла мочевины, являющегося уникальным механизмом, способствующим обезвреживанию аммиака, который способен образовываться в печени во время переваривания белков.
Тирозин участвует в синтезе катехоламинов – адреналина и норадреналина – гормонов, поддерживающих в тонусе сердечно-сосудистую систему, реагируя мгновенно на возникновение стрессовых ситуаций.
Аминокислота триптофан является предшественником мелатонина, являющегося гормоном сна, образующегося в области эпифиза, являющегося шишковидным телом головного мозга. При нехватке данного элемента происходит усложнение процесса засыпания, развитие бессонницы и иных заболеваний, связанных с ней.
Содержание в продуктах
Принимаемый нами комплекс аминокислот способствует поддержанию нормального азотистого равновесия. Достающийся здоровым людям с пищей азот при нормальном рационе питания, равняется выделяемой мочевине, аммониевым солям. После сложного заболевания либо при растущем организме происходит нарушение равновесия и сдвиг баланса в сторону несколько меньшего выведения азота в сравнении с полученным. С отрицательным балансом сталкиваются при старении организма, в связи с голоданием либо недостатком белков.
Аминокислоты bcaa созданы для восполнения недостатка конкретных веществ. Хотя получать элементы в натуральной форме также необходимо, что обеспечивается сбалансированным питанием. Наш организм не обходится без белковой пищи. К наиболее полноценным белкам относят молоко, а ценность растительного белка гораздо ниже. Благодаря правильному комбинированию продуктов можно добиться обеспечения необходимого количества важных для нас 20 аминокислот,например, благодаря смеси бобов и кукурузы. В этих продуктах содержится органичное сочетание необходимых веществ. Для получения суточной нормы достаточно 500-т грамм молочных продуктов, не забывая и о другой еде.
Аминокислоты в спортивном питанииэффективны в качестве незаменимого источника восполнения энергии и содержатся в следующих продуктах:
-
Лейцин: от орехах до нешлифованного, бурого риса, от соевой муки до чечевицы, от овса до всех семян. -
Фенилаланин: от молочных продуктов до авокадо, от бобовых до семечек и орехов. Образуется в процессе распада аспартама — сахарозаменителя, зачастую используемого в пищевых продуктах. -
Валин аминокислота: от всех молочных продуктов до соевого протеина, от зерновых до грибов и арахиса. -
Триптофан: от овса до бобовых, от молока до творога, от йогурта до кедровых орешков, от арахиса до кунжута и семечек. -
Изолейцин: от орехов, особенно миндаля и кешью, до всех семян, от ржи до сои, от гороха до чечевицы. -
Лизин аминокислота: от сыра до молочных продуктов, от пшеницы до картофеля. -
Метионин: от чечевицы до фасоли, от чеснока до лука, от сои до бобов, от всех семян до молочных продуктов. -
Треонин: от молока до йогурта, от творога до сыра, от зелёных овощей до зерновых, от бобов до орехов. -
Аргинин: от тыквенных семечек до кунжута, от арахиса до изюма, от швейцарского сыра до шоколада. -
Гистидин: от молочных продуктов до риса, от пшеницы до ржи, от соевых бобов до арахиса.
Дозировка и правила приема
Производители обязаны указывать, как принимать аминокислоты, размещая информацию на упаковке. Этих рекомендаций следует придерживаться. Хотя иногда можно допускать превышение дозировки, пятью граммами редко ограничиваются. Для организма подобная поддержка окажется практически незаметной. Спортсменам, занимающимся силовыми видами, рекомендуется прием от 20-ти до 30-ти грамм комплексных АК ежесуточно.
Анализ на аминокислоты показывает, что с указанным выше количеством добавок можно добиваться поддержания мускулатуры и прочих положительных эффектов. Желательно прием суточной дозы осуществлять в несколько приемов, чтобы добиться более полного усвоения спортивного питания.
Как же принимать аминокислоты всаа?
-
До начала тренировки. Это важно для наполнения крови свободными АК и сбережения мышечных волокон от распада в связи с силовыми нагрузками. -
В период тренировки. В течение получаса интенсивных занятий организм практически остается без энергетических запасов. Благодаря приему АК можно эффективно поддержать работу тела. -
-
По завершении тренировки. Это поможет снизить воздействие катаболических процессов, уберечь мышцы, подкормить их для восстановления.
В те дни, когда спортсмен делает перерыв между занятиями, принятие АК способствует остановке процесса распада мышечных волокон и поддержке нормального уровня свободных АК. Например, габа аминокислотаспособствует снятию нервного напряжения, оказанию хорошего тонизирующего и успокаивающего эффекта. В целебных целях с помощью данного биогенного вещества улучшают половую дисфункцию, благодаря оказанию сильного релаксирующего влияния.
Для чего нужны аминокислоты в спорте? Существуют комплексные формы, а также изолированные, содержащие единственную АК. Физически активным людям рекомендуется прием незаменимых аминокислот. Они пособствуют значительному повышению работоспособности организма, при сохранении собственных ресурсов. Норма приема соответствует вашим индивидуальным потребностям. Это особенно касается подростков, что обусловлено активным развитием организма.
Важно для спортсменов обеспечивать увеличенную дозу данных веществ. Необходимость в незаменимых АК связана с восполнением энергетических запасов, обусловленных интенсивными занятиями. Прием пищевых добавок осуществляется исключительно после консультации с врачом. Продажа добавок осуществляется без рецепта. Не следует заниматься бесконтрольным приемом подобных препаратов. Гораздо эффективней будет употребление этих веществ в натуральной форме.
Если в рацион включать полноценно здоровую пищу, в сочетании с активным образом, можно прекрасно обходиться без пищевых добавок. При этом функционирование организма будет безукоризненным, работа органов будет происходить без единого сбоя.
Норма потребления АК соответствует индивидуальным особенностям. Об их недостатке можно судить по следующим симптомам:
-
От потери аппетита до общей слабости; -
От головокружений до постоянной сонливости; -
От ослабления иммунитета до анемии; -
От выпадения волос до ухудшения состояния кожи; -
-
От замедления роста до задержек в развитии.
Благодаря употреблению АК можно добиться значительного улучшения тренировочного процесса, насыщения органов и мышц питательными веществами и сокращения периодов восстановления.Необходимо при этом помнить о правильном питании, ведь АК не могут создать полноценную замену пище. Данная добавка является безопасной для употребления, не вызывая привыкания. В соответствии с вашими целями (восстановлением после тренировочного процесса либо набором мышечной массы), можно ограничиться приемом определенной АК.
Побочные действия
Если потребитель будет руководствоваться указанными выше дозировками и правилами приема, никаких проблем не возникнет. Исключительно из-за сильного превышения суточной дозы возможно возникновение нарушений, связанных с работой печени и почек, являющихся главными фильтрами организма.Именно такими критериями определяется вред и польза аминокислот в спорте.
Следует помнить об ограничениях в приеме, при возникновении любых недомоганий начать со снижения дозировки и даже отказа от добавок. Затем обратиться врачу, чтобы проконсультироваться по поводу безопасного спортивного питания.
Для производства АК комплексов зачастую используют сыворотку. Если потребители страдают аллергией, связанной с молочными продуктами и непереносимостью лактозы, с подобными добавками следует обращаться осторожно.
Среди тревожных симптомов упомянем о:
-
сыпи или раздражении на кожных покровах; -
ухудшении дыхания; -
замутнении сознания; -
расстройстве пищеварения.
При возникновении данных проявлений следует прекратить прием кето аналогов аминокислот и обратиться на врачебной помощью. Во многих аминокислотных комплексах содержится набор простых углеводов, что проблематично для пользователей, страдающих диабетом. Диабетики могут наблюдать ухудшение самочувствия по следующим симптомам:
-
частому мочеиспусканию; -
резкому снижению активности; -
тошноте; -
сильной жажде; -
головной боли; -
обморокам; -
-
проблемам с ЖКТ.
Диабетик, принимающий жидкие аминокислоты, при обнаружении подобных симптомов должен незамедлительно обратиться к эндокринологу, отказавшись от добавок.
Прием комплекса АК рекомендуется для набора массы в сочетании с так называемой сушкой. Прием протеина не стоит сочетать с дополнительной подпиткой. Дозировку определяют в зависимости от вашего веса и рекомендаций на упаковке. Это обусловлено различным процентом чистых АК в продуктах. В среднем диапазон приема ограничен ежесуточно 10-тью – 20-тью граммами, в соответствии с целями тренинга, временем и длительностью тренировки. Усвояемость каждой формы считается индивидуальной, кому-то удобней принимать порошковую форму, кому-то – в капсулах либо в жидком виде.
При аллергии у детей на белки, содержащиеся в коровьем молоке, рекомендуется прием Нутрилон аминокислот. Данную смесь разработали специально для малышей, нуждающихся в правильном интеллектуальном развитии. Ее можно использовать в качестве питания для новорожденных деток.
Список аминокислот
В соответствии с наиболее популярной классификацией, существуют заменимые и незаменимые аминокислоты. Процессы, связанные с синтезом заменимых веществ в основном происходят в печени. Среди них отметим следующие АК:
1. Тирозин способствует улучшению внимания, выработке дофамина, снабжению энергией;
2. Серин является исходным материалом, способствующим образованию креатина, а таккже трансформации гликогена;
3. Таурин аминокислота обладает функциями кардиотонического, антикатарактного, метаболического действия, обладает огромной ролью для липидного обмена, оптимизации энергетических процессов;
4. Орнитин обладает антикатаболическим воздействием, способствует улучшению атлетических показателей;
5. Пролин аминокислотаспособствует обеспечению организма энергией;
6. Глютамин способствует эффективности роста мышц;
7. Глицин аминокислота способствует повышению мозговой активности, защите от психоэмоциональных напряжений;
8. Действие гамма-аминомаслянной кислоты является аналогичным транквилизатору, способствует улучшению кровоснабжения мозга;
9. Глютамовая кислота эффективна для утилизации глюкозы;
10. Цитруллин способствует улучшению питания мышц, укреплению иммунной системы, обеспечению азотистого баланса, повышению выносливости и снижению утомляемости;
11. Цистеин обеспечивает детоксикацию, способствуя повышению спортивной выносливости;
12. Аспарагин принимает участие в образуемых пиримидиновых основаниях, в обменных процессах азотистых веществ;
13. Аланин является веществом, входящим в состав биологически активных соединений, участниккком глюкозо-аланинового цикла;
14. Аргинин является донатором азота, способствует снижению параметров, связанных с вредным холестерином, усилению секреции гормона роста, улучшению транспортировки креатина, ускорению восстановления.
Незаменимыми называют ак, оказывающиеся в составе добавок, самостоятельно не синтезирующихся в организме.
1. Валин обладает стимулирующим действием, способствует метаболизму, ускоренному восстановлению после интенсивных тренировок;
2. Гистидин способствует восстановлению тканей, содержится в гемоглобине;
3. Лейцин способствует защите мышечных тканей, эффективен для избавления от артритов, повышения анаболической реакции мышц;
4. Изолейцин способствует клеткам в усвоении глюкозы, усилении роста мышц, синтезе гемоглобина;
5. Лизин известен противовирусными свойствами, необходим для стимулирования иммунитета, способствует профилактике остеопороза;
6. Метионин обладает метаболическим и гепатопротекторным действием, является участником обмена серосодержащих аминокислот;
7. Фенилаланин эффективен для борьбы с различными заболеваниями: от витилиго до депрессии и СДВГ;
8. Триптофан является участником выработки серотонина, синтеза мелатонина, известен положительным влиянием на иммунную систему;
9.Треонин способствует поддержке баланса белков в организме.
crossfit.ru
Аминокислоты — это… Что такое Аминокислоты?
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 10 апреля 2012. |
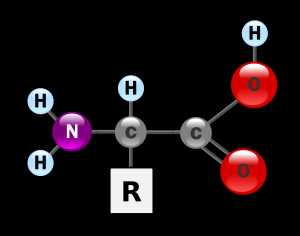
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
История
Открытие аминокислот в составе белков
Физические свойства
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Общие химические свойства
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
- NH2 —CH2COOH N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
Данную особенность «живых» аминокислот весьма трудно объяснить, так как в реакциях между оптически неактивными веществами L и D-формы образуются в одинаковых количествах. Возможно, выбор одной из форм (L или D) — просто результат случайного стечения обстоятельств: первые молекулы, с которых смог начаться матричный синтез, обладали определенной формой, и именно к ним «приспособились» соответствующие ферменты.
D-аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: так в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[2], что может быть использовано для определения возраста млекопитающих. Рацемизация остатков аспарагиновой также отмечена при старении коллагена, предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутремолекулярном ацилировании пептидного азота свободной карбоксильной группой аспарагиновой кислоты[3].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих.
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путем нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-я и 22-я аминокислоты.
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся не решённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20-ти протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Для запоминания однобуквенного обозначения протеиногенных аминокислот используется мнемоническое правило (последний столбец).
Классификация
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
- Полярные заряженные отрицательно при pH<7: аспартат, глутамат
- Полярные заряженные положительно при pH>7: лизин, аргинин, гистидин
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями. По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы: глюкогенные (при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат), кетогенные (распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды), глюко-кетогенные (при распаде образуются метаболиты обоих типов).
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты[4].
Примечания
См. также
Ссылки
Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с. [1]
Плазмозамещающие и перфузионные растворы — АТХ код: B05
| B05A |
|
||
|---|---|---|---|
| B05B |
|
||
| B05C |
|
||
| B05D |
|
||
| B05X |
|
||
| B05Z |
dic.academic.ru
Аминокислоты I Что это? Для чего? Как принимать?
ru — RUB Изменить
- Связаться с нами
- Помощь
Myprotein Russia Назад
- Питание
- Бестселлеры
- Наборы
- Новинки
- Пробники
- Распродажа
- Нет опыта использования добавок?
- Питание Домашняя Страница
- Популярное
- Бестселлеры
- Наборы
- Новинки
- Пробники
- Распродажа
- Нет опыта использования добавок?
- Протеин
- Протеин Домашняя Страница
- Сывороточный протеин
- Молоко и казеин
- Протеин для веганов
- Смеси и формулы
- Аминокислоты
- Аминокислоты Домашняя Страница
- BCAA
- Глyтамин
- L-Карнитин
- Креатин
- Креатин Домашняя Страница
- Моногидрат креатина
- Управление весом тела
- Управление весом тела Домашняя Страница
- Набор массы
- Жиросжигатели
- Диетические шейки
- Добавки для приема до, во время и после тренировки
- Добавки для приема до, во время и после тренировки Домашняя Страница
- До тренировки
- Во время тренировки
- После тренировки
- Углеводы
- Углеводы Домашняя Страница
- Энергетические добавки
- Энергетические батончики
- Энергетические гели
- Энергетические напитки
- Еда и закуски
- Еда и закуски Домашняя Страница
- Протеиновые батончики
- Ореховые пасты
- Ароматизаторы и сахарозаменители
- Протеиновые напитки
- Заменители питания
- Еда
- Протеиновые закуски
- Витамины и минералы
- Витамины и минералы Домашняя Страница
- Мультивитамины
- Витаминные добавки
- Минералы
- Клетчатка и незаменимые жиры
- Клетчатка и незаменимые жиры Домашняя Страница
- Добавки с клетчаткой
- Растения, травы и нутриенты
- Омега 3 и рыбий жир
- Аксессуары
- Аксессуары Домашняя Страница
- Бутылки и шейкеры
- Контейнеры для еды
- Мерные ложки и тубы
- Аксессуары для тренировок
- Одежда
- Одежда Домашняя Страница
- Мужская одежда
- Мужская одежда Домашняя Страница
- Новинки
- Футболки и топы
- Куртки и жилеты
- Толстовки и худи
- Спортивные штаны
- Майки
- Шорты
- Шорты для плавания
- Нижнее бельё и носки
- Вся Одежда
- Женская одежда
- Женская одежда Домашняя Страница
- Новинки
- Спортивные леггинсы
- Спортивные Бюстгальтеры
- Куртки и жилеты
- Толстовки и худи
- Спортивные штаны
- Футболки и топы
- Спортивные Шорты
- Майки
- Нижнее бельё и носки
- Вся Одежда
- Коллекции одежды
- Коллекции одежды Домашняя Страница
- Новинки
- Бестселлеры
- Аутлет
- Коллекция Superlite
- Коллекция Dry-Tech
- Коллекция Performance
- Коллекция Pro-Tech
- Коллекция Seamless
- Коллекция Tru-Fit
- Коллекция Heartbeat
- Аксессуары
www.myprotein.ru
20 аминокислот: формулы, таблица, названия
Ни для кого не секрет, что человеку для поддержания жизнедеятельности на высоком уровне необходим белок – своеобразный строительный материал для тканей организма; в состав белков входят 20 аминокислот, названия которых вряд ли что-то скажут обычному офисному работнику. Каждый человек, особенно если говорить о женщинах, хоть раз слышал о коллагене и кератине – это протеины, которые отвечают за внешний вид ногтей, кожи и волос.
Аминокислоты – что это такое?
Аминокислоты (или же аминокарбоновые кислоты; АМК; пептиды) – органические соединения, на 16 % состоящие из аминов – органических производных аммония, — что отличает их от углеводов и липидов. Они участвуют в биосинтезе белка организмом: в пищеварительной системе под влиянием ферментов все белки, поступающие с едой, разрушаются до АМК. Всего в природе существует около 200 пептидов, но в построении организма человека участвуют всего 20 основных аминокислот, которые подразделяются на заменимые и незаменимые; иногда встречается и третий вид – полузаменимые (условно заменяемые).
Заменимые аминокислоты
Заменимыми называют те аминокислоты, которые как потребляются с продуктами питания, так и воспроизводятся непосредственно в теле человека из других веществ.
- Аланин – мономер большого числа биологических соединений и белков. Осуществляет один из главенствующих путей глюкогенеза, то есть в печени превращается в глюкозу, и наоборот. Высокоактивный участник метаболических процессов в организме.
- Аргинин – АМК, способная синтезироваться в организме взрослого, но не способная к синтезу в теле ребёнка. Содействует выработке гормонов роста и других. Единственный переносчик азотистых соединений в организме. Содействует увеличению мышечной массы и уменьшению жировой.
- Аспарагин – пептид, участвующий в азотном обмене. В ходе реакции с ферментом аспарагиназой отщепляет аммониак и превращается в аспарагиновую кислоту.
- Аспарагиновая кислота – принимает участие в создании иммуноглобулина, деактивирует аммиак. Необходим при сбоях в работе нервной и сердечно-сосудистой систем.
- Гистидин – используется для профилактики и лечения болезней ЖКТ; оказывает положительную динамику при борьбе со СПИДом. Уберегает организм от пагубного воздействия стресса.
- Глицин – нейромедиаторная аминокислота. Применяется в качестве мягкое успокоительное и антидепрессивное средство. Усиливает действие некоторых ноотропных препаратов.
- Глутамин – в большом объёме входит в состав гемоглобина. Активатор процессов восстановления тканей.
- Глутаминовая кислота – обладает нейромедиаторным действием, а также стимулирует метаболические процессы в ЦНС.
- Пролин – является одним из составляющих практически всех протеинов. Им особенно богаты эластин и коллаген, отвечающие за эластичность кожи.
- Серин – АМК, что содержится в нейронах головного мозга, а также способствует выделению большого количества энергии. Является производной глицина.
- Тирозин – составляющая тканей животных и растений. Может воспроизводиться из фенилаланина под действием фермента фенилаланингидроксилазы; обратного процесса не происходит.
- Цистеин – один из компонентов кератина, отвечающего за упругость и эластичность волос, ногтей, кожи. Ещё он является антиоксидантом. Может производиться из серина.
Аминокислоты, не способные к синтезу в организме, — незаменимые
Незаменимыми аминокислотами называют те, которые не способные генерироваться в организме человека и способны поступать только с продуктами питания.
- Валин – АМК, которая содержится практически во всех белках. Повышает координацию мышц и снижает чувствительность организма к температурным перепадам. Поддерживает гормон серотонин на высоком уровне.
- Изолейцин – естественный анаболик, который в процессе окисления насыщает энергией мышечную и мозговую ткани.
- Лейцин – аминокислота, улучшающая метаболизм. Является своеобразным «строителем» структуры белка.
- Эти три АМК входят в так называемый комплекс BCAA, особо востребованный среди спортсменов. Вещества этой группы выступают в качестве источника для увеличения объема мышечной массы, уменьшения жировой массы и поддержания хорошего самочувствия при особо интенсивных физических нагрузках.
- Лизин – пептид, ускоряющий регенерацию тканей, выработку гормонов, ферментов и антител. Отвечает за прочность сосудов, содержится в мышечном белке и коллагене.
- Метионин – пронимает участие в синтезе холина, недостаток которого может привести к усиленному накоплению жира в печени.
- Треонин – придает эластичность и силу сухожилиям. Очень положительно влияет на сердечную мышцу и зубную эмаль.
- Триптофан – поддерживает эмоциональное состояние, так как в организме преобразуется в серотонин. Незаменим при депрессиях и других психологических расстройствах.
- Фенилаланин – улучшает внешний вид кожи, нормализуя пигментацию. Поддерживает психологическое благополучие, улучшая настроение и привнося ясность в мышление.
Другие методы классификации пептидов
С научной стороны 20 незаменимых аминокислот подразделяют, основываясь на полярности их боковой цепи, то есть радикалов. Таким образом, выделяются четыре группы: неполярные, полярные (но не имеющие заряда), положительно заряженные и отрицательно заряженные.
Неполярными являются: валин, аланин, лейцин, изолейцин, метионин, глицин, триптофан, фенилаланин, пролин. В свою очередь, к полярным, имеющим отрицательный заряд относят аспарагиновую и глутаминовую кислоты. Полярными, имеющими положительный заряд, называют аргинин, гистидин, лизин. К аминокислотам, обладающим полярностью, но не имеющим заряда, относят непосредственно цистеин, глутамин, серин, тирозин, треонин, аспарагин.
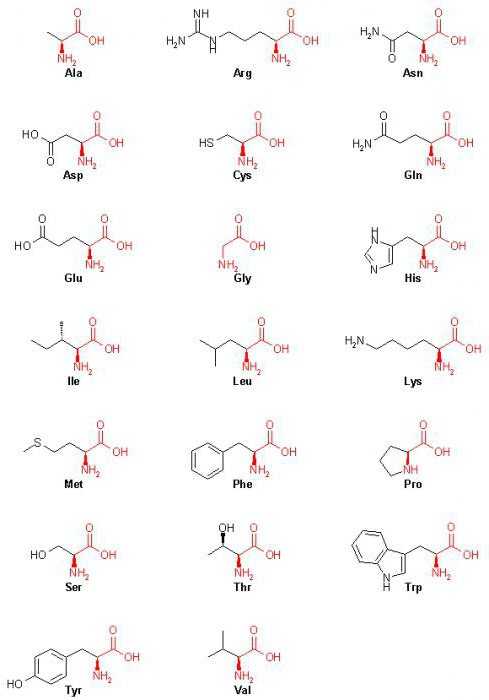
20 аминокислот: формулы (таблица)
|
Аминокислота |
Аббревиатура |
Формула |
|
Аланин |
Ala, A |
C3H7NO2 |
|
Аргинин |
Arg, R |
C6h24N4O2 |
|
Аспарагин |
Asn, N |
C4H8N2O3 |
|
Аспарагиновая кислота |
Asp, D |
C4H7NO4 |
|
Валин |
Val, V |
C5h21NO2 |
|
Гистидин |
His, H |
C6H9N3O2 |
|
Глицин |
Gly, G |
C2H5N1O2 |
|
Глутамин |
Gln, Q |
С5Н10N2O3 |
|
Глутаминовая кислота |
Glu, E |
C5H9NO4 |
|
Изолейцин |
Ile, I |
C6h23O2N |
|
Лейцин |
Leu, L |
C6h23NO2 |
|
Лизин |
Lys, K |
C6h24N2O2 |
|
Метионин |
Met, M |
C5h21NO2S |
|
Пролин |
Pro, P |
C5H7NO3 |
|
Серин |
Ser, S |
C3H7NO3 |
|
Тирозин |
Tyr, Y |
C9h21NO3 |
|
Треонин |
Thr, T |
C4H9NO3 |
|
Триптофан |
Trp, W |
C11h22N2O2 |
|
Фенилаланин |
Phe, F |
C9h21NO2 |
|
Цистеин |
Cys, C |
C3H7NO2S |
Основываясь на этом, можно отметить, что все 20 аминокислот (формулы в таблице выше) имеют в своем составе углерод, водород, азот и кислород.
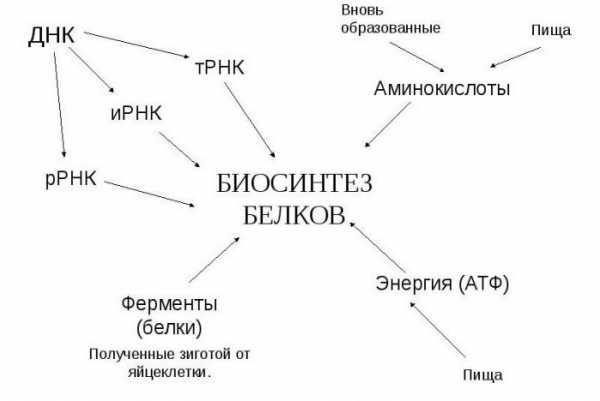
Аминокислоты: участие в жизнедеятельности клетки
Аминокарбоновые кислоты участвуют в биологическом синтезе белка. Биосинтез белка – процесс моделирования полипептидной («поли» — много) цепи из остатков аминокислот. Протекает процесс на рибосоме – органелле внутри клетки, отвечающей непосредственно за биосинтез.
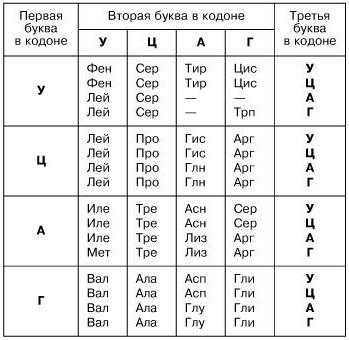
Информация считывается с участка цепи ДНК по принципу комплементарности (А-Т, Ц-Г), при создании м-РНК (матричная РНК, или и-РНК – информационная РНК – тождественно равные понятия) азотистое основание тимин заменяется на урацил. Далее всё по тому же принципу создается т-РНК (транспортная РНК), переносящая молекулы аминокислот к месту синтеза. Т-РНК закодирована триплетами (кодонами) (пример: УАУ), и если знать, какими азотистыми основаниями представлен триплет, можно узнать, какую именно аминокислоту он переносит.
Группы продуктов питания с наибольшим содержанием АМК
В молочных продуктах и яйцах содержатся такие важные вещества, как валин, лейцин, изолейцин, аргинин, триптофан, метионин и фенилаланин. Рыба, белое мясо обладают высоким содержанием валина, лейцина, изолейцина, гистидина, метионина, лизина, фенилаланина, триптофана. Бобовые, зерновые и крупы богаты на валин, лейцин, изолейцин, триптофан, метионин, треонин, метионин. Орехи и различные семена насытят организм треонином, изолейцином, лизином, аргинином и гистидином.
Ниже приведено содержание аминокислот в некоторых продуктах.
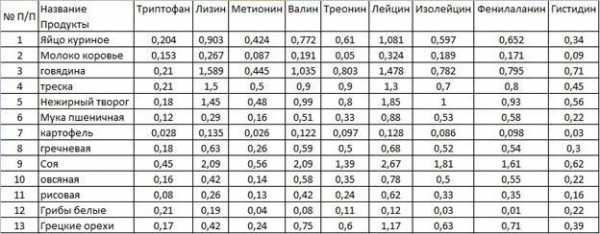
Наибольшее количество триптофана и метионина можно обнаружить в твёрдом сыре, лизина – в мясе кролика, валина, лейцина, изолейцина, треонина и фенилаланина – в сое. При составлении рациона, основанного на поддержании АМК в норме, стоит обратить внимание на кальмаров и горох, а наиболее бедными в плане содержания пептидов можно назвать картофель и коровье молоко.
Нехватка аминокислот при вегетарианстве
То, что существуют такие аминокислоты, которые содержатся исключительно в продуктах животного происхождения, – миф. Более того, учёные выяснили, что белок растительного происхождения усваивается человеческим организмом лучше, чем животного. Однако при выборе вегетарианства как стиля жизни очень важно следить за рационом. Основная проблема такова, что в ста граммах мяса и в таком же количестве бобов содержится разное количество АМК в процентном соотношении. На первых порах необходимо вести учёт содержания аминокислот в потребляемой пище, затем уже это должно дойти до автоматизма.
Какое количество аминокислот нужно потреблять в день
В современном мире абсолютно во всех продуктах питания содержатся нужные для человека питательные вещества, поэтому не следует переживать: все 20 белковых аминокислот благополучно поступают с пищей, и этого количества хватает для человека, ведущего обычный образ жизни и хоть немного следящего за своим питанием.

Рацион спортсмена же необходимо насыщать белками, потому что без них просто невозможно построение мышечной массы. Физические упражнения ведут к колоссальному расходу запаса аминокислот, поэтому профессиональные бодибилдеры вынуждены принимать специальные добавки. При интенсивном построении мышечного рельефа количество белков может доходить до ста граммов белков в день, но такой рацион не подходит для ежедневного потребления. Любая добавка к пище подразумевает инструкцию с содержанием разных АМК в дозе, с которой перед применением препарата необходимо ознакомиться.
Влияние пептидов на качество жизни обычного человека
Потребность в белках присутствует не только у спортсменов. Например, белки эластин, кератин, коллаген влияют на внешний вид волос, кожи, ногтей, а также на гибкость и подвижность суставов. Ряд аминокислот влияет на метаболические процессы в организме, сохраняя баланс жира на оптимальном уровне, предоставляют достаточное количество энергии для повседневной жизни. Ведь в процессе жизнедеятельности даже при самом пассивном образе жизни затрачивается энергия, хотя бы для осуществления дыхания. Вдобавок невозможна и когнитивная деятельность при нехватке определенных пептидов; поддержание психоэмоционального состояния осуществляется в том числе за счет АМК.
Аминокислоты и спорт
Диета профессиональных спортсменов предполагает идеально сбалансированные питание, которое помогает поддерживать мышцы в тонусе. Очень облегчают жизнь аминокислотные комплексы, разработанные специально для тех спортсменов, которые работают на набор мышечной массы.
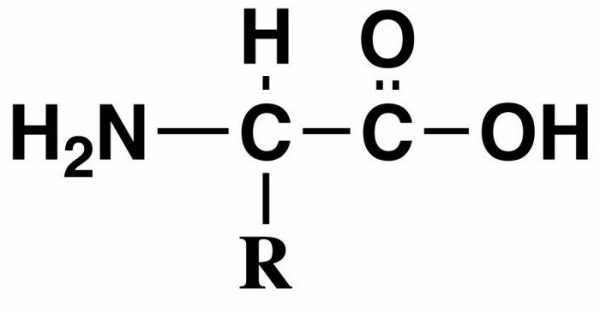
Как уже писалось ранее, аминокислоты – основной строительный материал белков, необходимых для роста мышц. Также они способны ускорять метаболизм и сжигать жир, что тоже важно для красивого мышечного рельефа. При усердных тренировках необходимо увеличивать потребление АМК ввиду того, что они увеличивают скорость наращивания мышц и уменьшают боли после тренировок.
20 аминокислот в составе белков могут потребляться как в составе аминокарбоновых комплексов, так и из пищи. Если выбирать сбалансированное питание, то нужно учитывать абсолютно все граммовки, что трудно реализовать при большой загруженности дня.
Что происходит с организмом человека при нехватке или переизбытке аминокислот
Основными симптомами нехватки аминокислот считаются: плохое самочувствие, отсутствие аппетита, ломкость ногтей, повышенная утомляемость. Даже при нехватке одной АМК возникает огромное количество неприятных побочных эффектов, которые значительно ухудшают самочувствие и продуктивность.
Перенасыщение аминокислотами может повлечь за собой нарушения в работе сердечно-сосудистой и нервной систем, что, в свою очередь, не менее опасно. В свой черед могут появиться симптомы, схожие с пищевым отравлением, что тоже не влечет за собой ничего приятного.
Во всем надо знать меру, поэтому соблюдение здорового образа жизни не должно приводить к переизбытку тех или иных «полезных» веществ в организме. Как писал классик, «лучшее – враг хорошего».
В статье мы рассмотрели формулы и названия всех 20 аминокислот, таблица содержания основных АМК в продуктах приведена выше.
fb.ru