Строение белков — урок. Химия, 8–9 класс.
Белки являются обязательной составной частью любого живого организма и играют важнейшую роль в обеспечении процессов жизнедеятельности.
В состав белков обязательно входят четыре химических элемента: углерод, водород, кислород и азот. Многие белки содержат серу. В состав некоторых входит фосфор. Есть белки, содержащие атомы металлов.
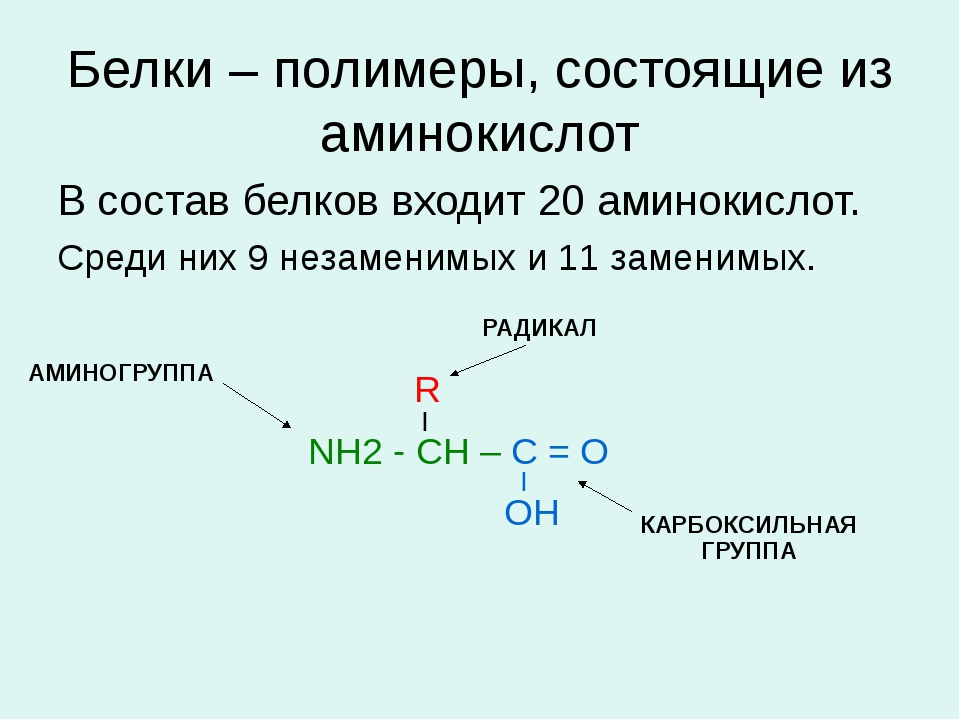
Белки — природные высокомолекулярные вещества (полимеры), состоящие из остатков аминокислот.
Аминокислотные остатки соединены в макромолекулах белков пептидной группой −NH−CO−, поэтому белки относят к полипептидам.
В состав белков входят двадцать аминокислот строения Nh3−C|H−COOHR. Аминокислотные остатки соединяются в макромолекулы белков в различной последовательности. Число аминокислотных остатков в молекулах тоже может быть разное. Поэтому многообразие белков практически безгранично. Каждый организм на Земле имеет свой собственный неповторимый набор белков.
Белковые молекулы могут содержать от одного до нескольких сотен и даже тысяч аминокислотных остатков, поэтому их относительные молекулярные массы изменяются от десятков тысяч до нескольких миллионов. Так, относительная молекулярная масса гемоглобина равна \(68 000\), яичного белка — \(44 000\), а вируса гриппа — \(32 000 000\).
Так, относительная молекулярная масса гемоглобина равна \(68 000\), яичного белка — \(44 000\), а вируса гриппа — \(32 000 000\).
Свойства белка в первую очередь определяются порядком соединения аминокислотных остатков в полипептидной цепи.
Последовательность аминокислотных остатков в макромолекуле называется первичной структурой белка.
Первичная структура
Существуют вторичная (спираль) и третичная (клубок) структуры белковых молекул. Они образуются в результате внутримолекулярного взаимодействия частей полипептидной цепи.
Вторичная структура
Третичная структура
Несколько белковых молекул могут соединяться друг с другом и образовывать четвертичную структуру.
Четвертичная структура
Источники:
Рудзитис Г. Е., Фельдман Ф. Г. Химия. 9 класс. М.: Просвещение, 2009. — 170 с.
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 226 с.
М.: Дрофа, 2011. — 226 с.
Вишневская Е. И., Ельницкий А. П. и др. Химия. 9 класс. Минск: Нар. асвета, 2012. — 199 с.
Видеоурок по биологии «Белки»
Белки — это строительные материалы и живые нано-машины нашего тела. По сравнению с липидами и углеводами белки являются наиболее важными для организма.
Каждый из сотен тысяч разных белков обладает неповторимой пространственной структурой. И у каждого белка своя задача и функция. Есть белки костной и мышечной ткани, белки тканей кожи и мозга. Белки ферменты и рецепторы.
Если в организме отсутствует хотя бы один белок (например, белковый гормон инсулин), жизнь человека в опасности, так как инсулин оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Белки — это самые сложные молекулярные системы, имеющиеся в природе.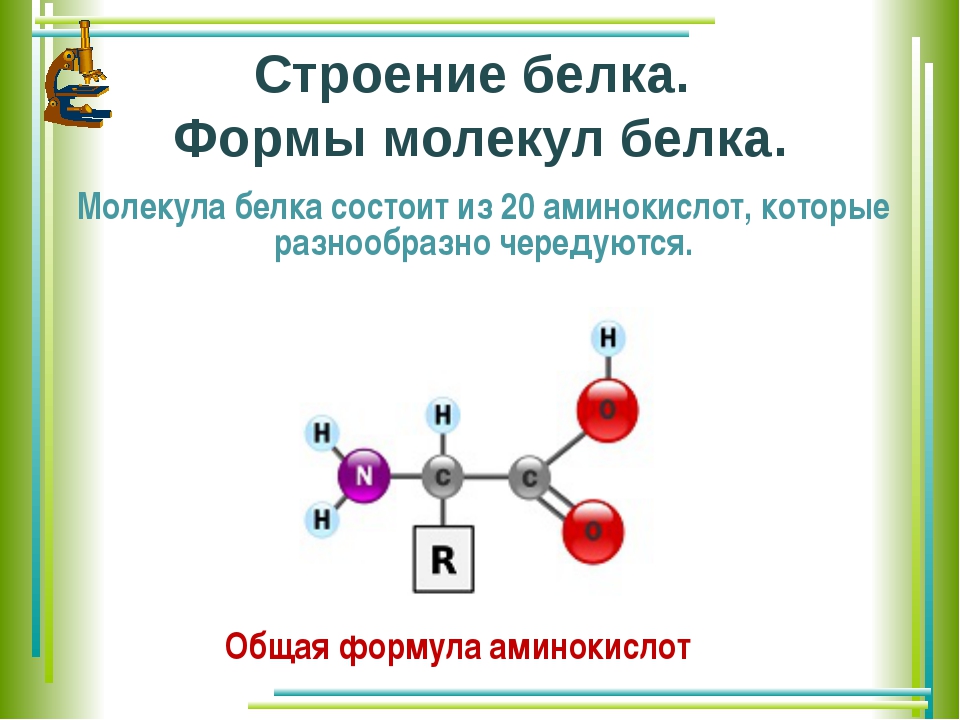
Кроме углерода, кислорода, водорода и азота в состав белков могут входить сера, фосфор, железо.
Белки построены из мономеров, которыми являются аминокислоты.
Среди двухсот известных аминокислот только 20 из них участвуют во внутриклеточном синтезе белков. Их называют протеиногенными или стандартными аминокислотами. Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих.
Из 20 аминокислот, входящих в состав белков, может быть образовано вот такое число комбинаций различных белков, которые будут обладать совершенно одинаковым составом, но различным строением.
Все аминокислоты подразделяют на заменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека, к ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, глицин, глутамин, глутаминовую кислоту, пролин, серин, тирозин и цистеин.
Незаменимые аминокислоты в организме не синтезируются и должны в обязательном порядке поступать с пищей. Это валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Содержатся они в основном в продуктах животного происхождения.
Это валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Содержатся они в основном в продуктах животного происхождения.
Для удобства названия аминокислот имеют общепринятые сокращения.
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (─ ) с основными свойствами, другая —карбоксильной группой (─COOH) с кислотными свойствами. Часть молекулы, которая называется радикалом (в формулах она обычно обозначается большой латинской буквой R), у разных аминокислот имеет различное строение.
Аминокислоты соединяются между собой. Так образуется молекула, которая представляет собой пептид. Эта реакция называется (полимеризацией). В процессе полимеризации выделяется молекула воды, а освободившиеся электроны образуют ковалентную связь, которая получила название пептидной. Это связь между атомами углерода и азота.
Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты.
Также белки могут состоять и из большого числа аминокислотных остатков. И, кроме того, каждая аминокислота может встречаться в белке несколько раз.
В состав белка может входить одна, две и более полипептидные цепи. Например, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырёх цепей.
Среди белков различают протеины, состоящие только из белков, и протеиды, содержащие не белковую часть. Например, гемоглобин.
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве небелкового компонента здесь выступает особая пигментная группа, содержащая железо, — гем.
Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1и β2.
Четвертичная структура гемоглобина придаёт ему способность регулировать присоединение и отщепление кислорода.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии.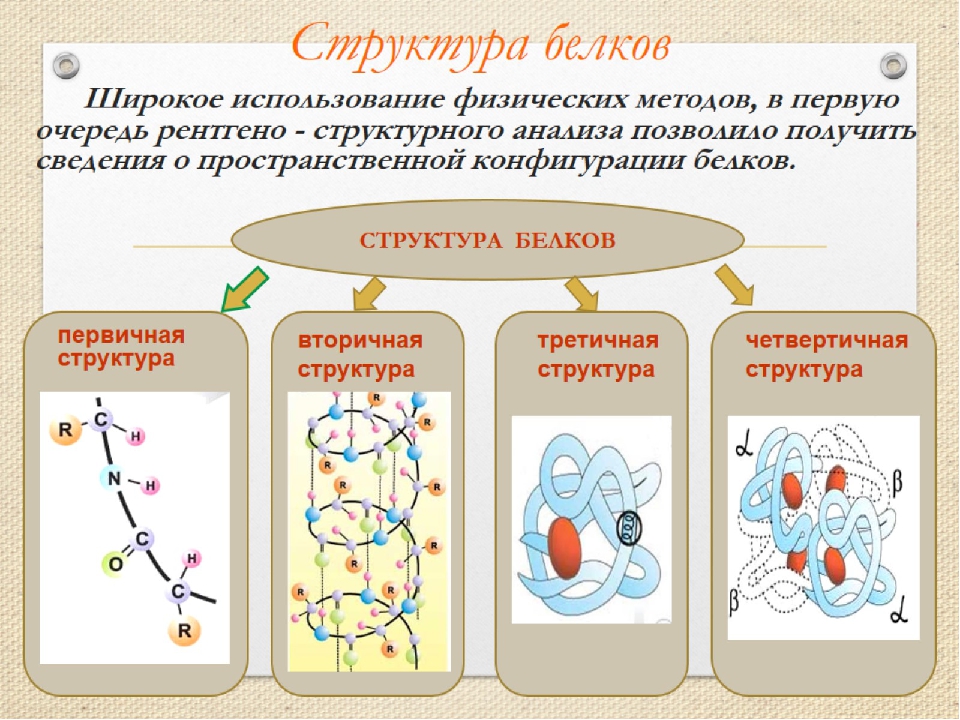 В эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина.
В эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина.
Эритроцит при этом приобретает форму серпа. Из-за этого малярийный плазмодий не проникает в эритроцит и не питается белком-гемоглобином. Изменение в форме эритроцита приводит к заболеванию ─ серповидноклеточной анемии.
Если белки состоят только из аминокислот, то их называют простыми.
Если в состав белков входят компоненты неаминокислотной природы, то такие белки относят к сложным.
Если в состав сложных белков входят углеводы, то их называют «гликопротеиды». Если входят липиды — то «липопротеиды», а если нуклеиновые кислоты — «нуклеопротеиды».
Именно строение белковых молекул определяет многообразие функций белков и их особую роль в жизненных процессах. Поэтому исследование структуры белков ─ самая важная стадия познания явлений, происходящих в живой клетке.
Белок можно выявить при помощи его денатурации. Денатурация — это утрата белковой молекулой своей первоначальной структуры.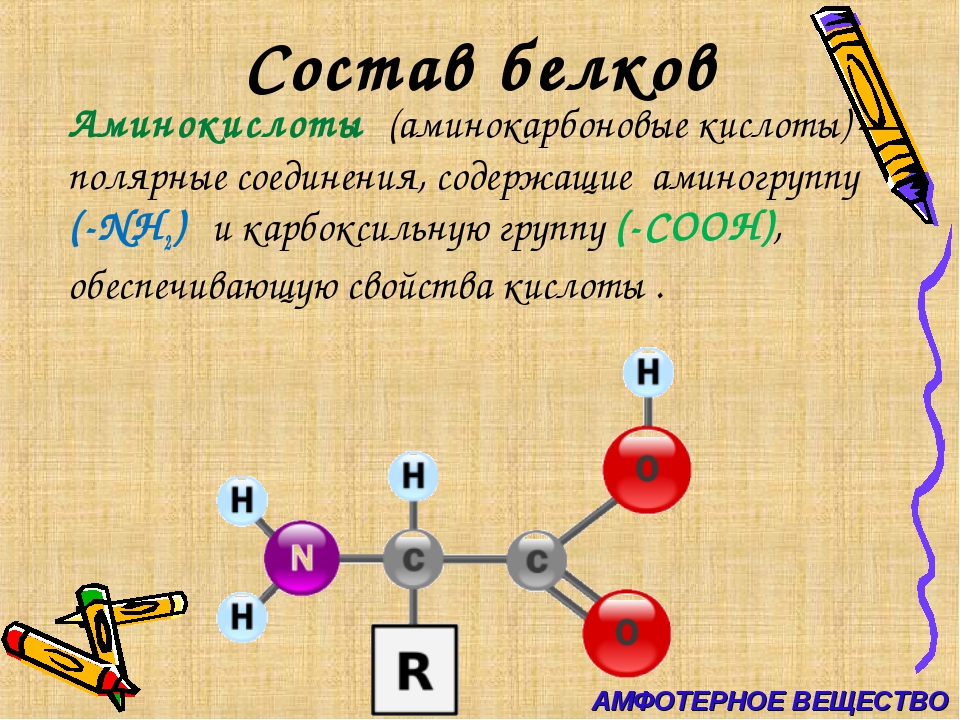
Денатурация может возникать под воздействием нагревания (температуры), химических веществ (например, кислот, оснований, органических растворителей), обезвоживания, облучения и других факторов, в результате которых свойство белковых молекул резко изменяется.
Зажигаем спиртовку, наливаем в демонстрационную пробирку каллоидный раствор белка в дистиллированной воде. Закрепляем пробирку в держалке и осторожно нагреваем содержимое пробирки. Уже при небольшом нагревании хорошо видны изменения, происходящие в растворе. Он перестаёт быть прозрачным, появляется белый осадок. Это и есть свернувшийся белок. Температура (нагревание) вызывает свёртывание коллоидного раствора белка.
Следующий опыт
В пробирку с коллоидным раствором белка в дистиллированной воде добавляем разбавленный раствор азотной кислоты. Признак реакции — образование осадка. Белок денатурирован.
Третий опыт
Денатурация белка происходит и под действием растворов солей тяжёлых металлов.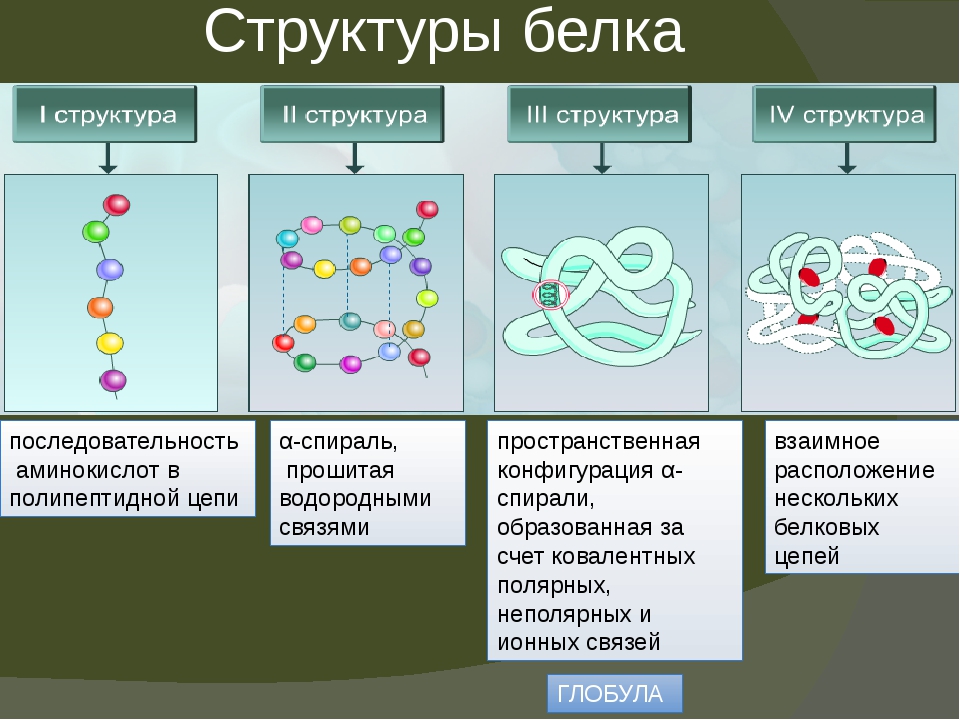 К раствору белка добавляем раствор сульфата меди. Признаком реакции является образование белого непрозрачного осадка. Это и есть денатурированный белок.
К раствору белка добавляем раствор сульфата меди. Признаком реакции является образование белого непрозрачного осадка. Это и есть денатурированный белок.
Обнаружив белок, мы ничего не можем сказать о его составе, структуре, свойствах. Что бы ответить на все эти вопросы, необходимо, прежде всего, выделить белок — получить его в чистом виде. Существует множество методов получения белков в чистом виде.
Процесс, обратный денатурации, при котором белки возвращают свою природную структуру, называется ренатурацией.
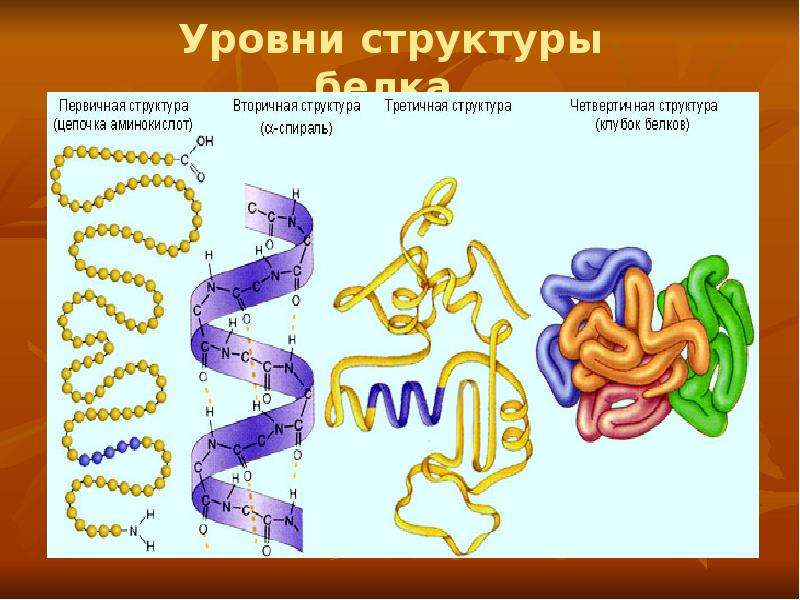
Уровни организации белковой молекулы
Молекулы белков могут принимать различные пространственные формы —конформации, которые представляют собой четыре уровня их организации.
Последовательное чередование различных аминокислотных звеньев в полипептидной цепи называется — первичной структурой белковой молекулы. Она уникальна для любого белка и определяет его форму, свойства и функции.
Молекула белка обладает определённой пространственной формой — это вторичная структура. Такая структура поддерживается водородными связями. Водородные связи возникают межу амино- и карбоксильными группами амикислотных остатков полипептидной цепи.
Такая структура поддерживается водородными связями. Водородные связи возникают межу амино- и карбоксильными группами амикислотных остатков полипептидной цепи.
Водородные связи фиксируют различные пространственные структуры. Хотя они и малопрочные, но из-за того, что их большое количество, — вторичная структура белка достаточно прочна. Части белковой молекулы могут организовываться в спираль или в другие виды вторичной структуры.
Третичная структура белка имеет вид клубка (глобулы). Третичная структура — это трёхмерная организация белковой молекулы. Она поддерживается водородными и дисульфидными (-S-S-) связями между остатками цисцеина (аминокислоты), а также гидрофобными взаимодействиями.
Существует и четвертичная структура белка. Однако она характерна не для всех молекул белка. Четвертичная структура возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови состоит из четырёх таких субъединиц.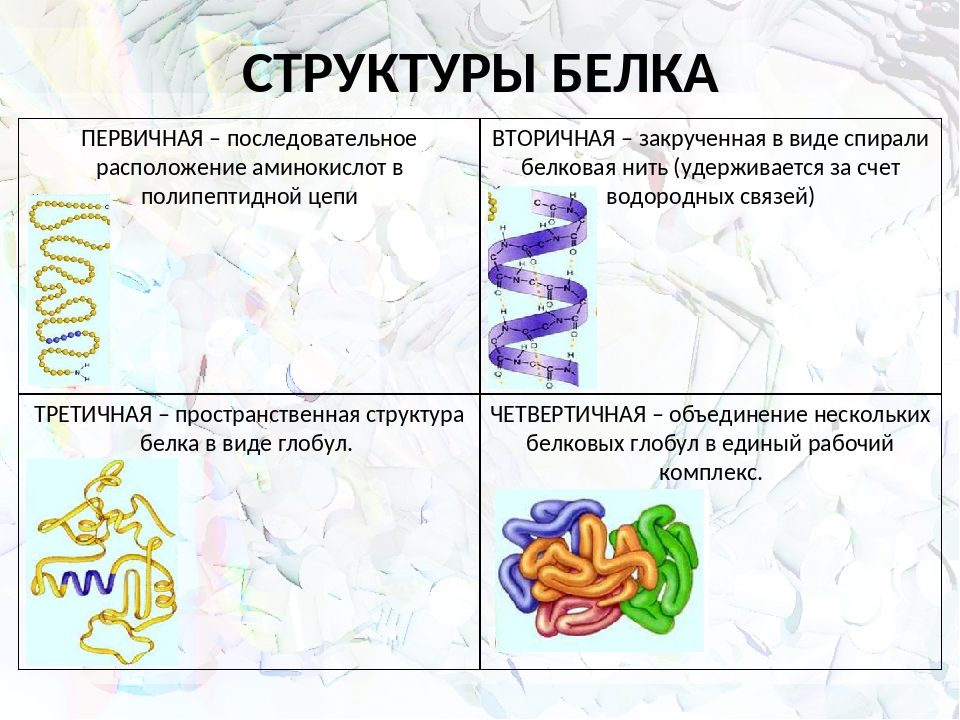
Как вы уже поняли, белки многочисленны и многообразны. И у каждого белка своя задача и функция.
Структурная функция белков
Так как белки являются основой всех биологических мембран, они выполняют строительную функцию.
Белок коллаген — важный составной компонент соединительных тканей.
Эластин — эластичный компонент связок, стенок кровеносных сосудов.
Кератин — фибриллярный белок, обладающий механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и роговой чехол, который покрывает клюв птиц.
Ферментативная функция белков
Ферменты — вещества белковой природы. Их молекулы состоят в основном из аминокислотных звеньев. Ферменты специфичны для каждого вещества. Основная функция их — это ускорение биохимических реакций организма, реакций распада и синтеза.
Основная функция их — это ускорение биохимических реакций организма, реакций распада и синтеза.
Они действуют в строго определённой последовательности. Почему так? Дело в том, что избирательность действия ферментов на разные химические вещества связана с их строением. Ферменты имеют специфические активные участки (центры), с которыми связываются субстраты.
Форма и химическое строение активного центра таково, что с ним могут связаться только определённые молекулы в силу их пространственного соответствия, они подходят друг к другу, как ключ к замку.
Связывание субстрата осуществляется именно в активном центре фермента. Одни ферментные системы направляют процессы биосинтеза. Этот процесс требует затрат энергии.
Другие ферментные системы регулируют распад и окисление веществ. При этих реакциях энергия выделяется.
На заключительном этапе химической реакции комплекс распадается с образованием конечных продуктов и свободного фермента.
Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества — субстрата.
Многие ферменты, как мы уже сказали, представлены белковыми молекулами. Другие состоят не только из белка, но и из небелкового соединения (кофермента). В качестве кофермента могут выступать различные вещества, но, как правило, это витамины и ионы металлов.
Отсутствие витамина в пище сначала приводит к недостаточному образованию кофермента, а без него не может работать (активироваться) соответствующий фермент. Поэтому скорость биохимической реакции, за которую отвечает этот фермент, значительно падает. Итогом этого становится нарушение обмена веществ.
Транспортная функция белков имеет важное значение. Так, гемоглобин переносит кислород из лёгких к клеткам других тканей.
В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения.
Они предохраняют организм от вторжения чужеродных организмов и от повреждения.
Например, на проникновение в организм чужеродных белков реагирует иммунная система организма. Она бросает против них целую армию своих белков, так называемых антител. Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов.
При помощи антиген-связывающих участков антитела присоединяются к вирусам и бактериям, чужеродным белкам, препятствуя их размножению.
Ещё один важный белок нашего организма — интерферон — универсальный противовирусный белок.
Фибриноген и тромбин предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами.
Регуляторная функция белков присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является упомянутый выше инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии.
Но в качестве источника энергии белки используются в последнюю очередь, после углеводов и жиров. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Таким образом, роль белков огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счёте набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Синтетическая биология: новые аминокислоты, новые белки | Научные открытия и технические новинки из Германии | DW
Первые в истории человечества искусственные постройки были сооружены, конечно же, из природных материалов — глины, древесины, камней. Сегодня строители располагают поистине необъятным ассортиментом искусственных материалов — от бетона и стали до пластмасс и стекла. Столь широкий выбор стройматериалов и связанные с ними новые возможности предопределили и изменения в архитектуре сооружений. Похоже, сходные метаморфозы ждут нас и в биологии.
Сегодня строители располагают поистине необъятным ассортиментом искусственных материалов — от бетона и стали до пластмасс и стекла. Столь широкий выбор стройматериалов и связанные с ними новые возможности предопределили и изменения в архитектуре сооружений. Похоже, сходные метаморфозы ждут нас и в биологии.
Новые задачи требуют новых белков
Природа создала практически все живые организмы — от бактерии до человека — по одному рецепту: наследственная информация, закодированная в генах, определяет состав и последовательность синтеза белков в клетках. Именно белки, собственно, и являются основой жизни — по крайней мере, в той форме, в которой она существует на Земле. Белки же представляют собой высокомолекулярные органические вещества, состоящие преимущественно из аминокислот. Набор аминокислот, образующих белки, невелик: их всего 20, так что все гигантское многообразие свойств белковых молекул определяется лишь различными комбинациями этих аминокислот.
Так задумала природа.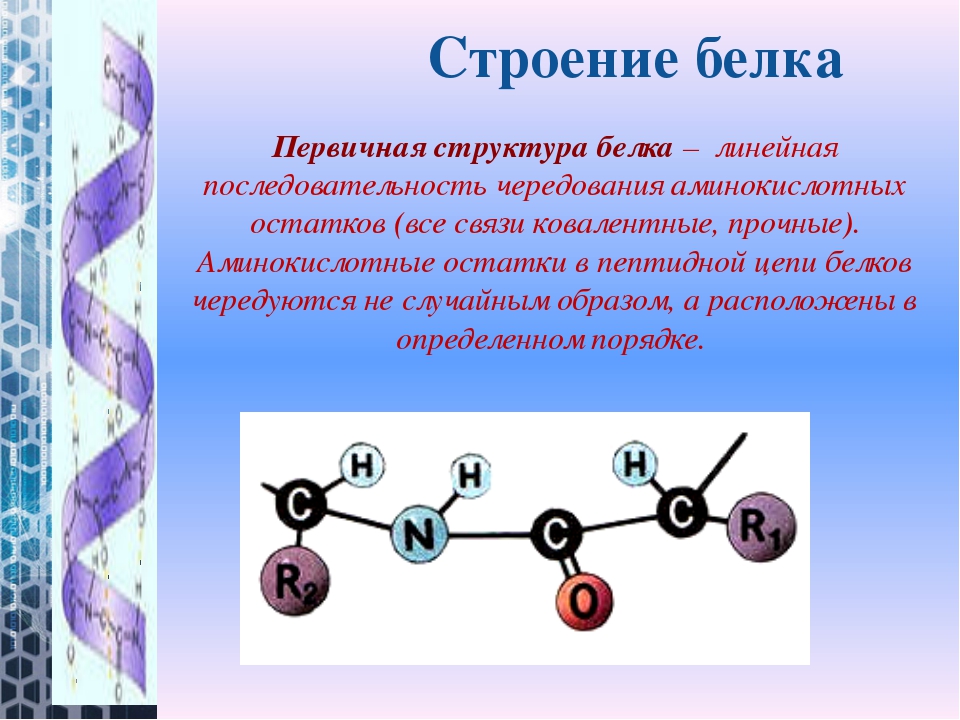 Однако эти рамки представляются некоторым исследователям слишком узкими. В их числе и Недилько Будиша (Nediljko Budiša), хорватский ученый, работающий в Германии, в Институте биохимии Общества Макса Планка в Мартинсриде близ Мюнхена: «Все живые организмы используют эти 20 основных кирпичиков для синтеза белков, — поясняет ученый. — Но природа не могла предусмотреть, что мы поставим перед собой какие-то новые цели и начнем развивать биотехнологии».
Однако эти рамки представляются некоторым исследователям слишком узкими. В их числе и Недилько Будиша (Nediljko Budiša), хорватский ученый, работающий в Германии, в Институте биохимии Общества Макса Планка в Мартинсриде близ Мюнхена: «Все живые организмы используют эти 20 основных кирпичиков для синтеза белков, — поясняет ученый. — Но природа не могла предусмотреть, что мы поставим перед собой какие-то новые цели и начнем развивать биотехнологии».
Это и побудило исследователя взяться за создание новых аминокислот — с тем, чтобы использовать их в качестве составных элементов новых белков. Он начал с того, что сконструировал две не существующие в природе аминокислоты, а затем ему удалось заставить бактерии производить белки, в состав которых вошли и эти самые искусственные субстанции. Сегодня ученый уже владеет богатым ассортиментом приемов, с помощью которых он может заставить бактерии встраивать в синтезируемые ими белки самые разные химические элементы, природой там отнюдь не предусмотренные.
Фторопласты, липазы и катализаторы
«Фтор — это элемент, который природа практически никогда не использовала, или использовала крайне редко, — говорит Недилько Будиша. — Так, в организме человека фтор содержится разве что в зубной эмали. Это связано, прежде всего, с тем, что фториды — кристаллические соединения, в форме которых фтор встречается в природе, — нерастворимы в воде. Между тем, за последние годы и десятилетия в мире сформировалось целое направление органической химии, занимающееся фторсодержащими соединениями. Это чрезвычайно перспективное направление, здесь уже имеются весьма значительные достижения. Если мы искусственно создадим фторсодержащую аминокислоту и встроим ее в белок, то такой белок может и в органических растворителях быть таким же активным, как в воде».
Химической промышленности такие фторсодержащие белки будут как нельзя более кстати. Ведь сегодня фторопласты, то есть полимеры, содержащие атомы фтора и обладающие поэтому высокой химической стойкостью, получают чисто химическим путем, используя метод электролиза. Между тем, в биореакторах синтез фторопластов был бы более экологичным и обходился бы дешевле, — уверен Недилько Будиша.
Между тем, в биореакторах синтез фторопластов был бы более экологичным и обходился бы дешевле, — уверен Недилько Будиша.
Еще один пример — это липазы, водорастворимые ферменты, помогающие расщеплять жиры. Они широко применяются в моющих средствах и стиральных порошках. Путем внедрения в состав этих ферментов целого ряда специальных, не существовавших ранее в природе, аминокислот исследователю удалось существенно повысить эффективность моющих средств.
«Если говорить о важных в промышленном отношении ферментах, то их эффективность — как, например, в случае с этими липазами, — можно повысить ни много ни мало в 10 раз, — подчеркивает Недилько Будиша. — Ну, скажем, в 10 раз уменьшить расход катализаторов, необходимых для поддержания технологических процессов. Ведь эти катализаторы чрезвычайно дороги, и вот появляется возможность повысить их эффективность в 10 раз».
То, что поначалу выглядело — а возможно, и было, — забавой, сегодня стало уже серьезной инновацией. Казалось бы, промышленность должна двумя руками ухватиться за эту разработку. Но не тут-то было, — сетует Недилько Будиша: «Сравнивая свою ситуацию с ситуацией моих американских коллег, я должен сказать, что немецкая промышленность не проявляет особого интереса к новым технологиям. Она берет только то, что полностью готово к внедрению и не требует никаких дополнительных капиталовложений».
Но не тут-то было, — сетует Недилько Будиша: «Сравнивая свою ситуацию с ситуацией моих американских коллег, я должен сказать, что немецкая промышленность не проявляет особого интереса к новым технологиям. Она берет только то, что полностью готово к внедрению и не требует никаких дополнительных капиталовложений».
Впрочем, 20-ти аминокислотам потребовалось 3,5 миллиарда лет на то, чтобы прочно занять свое место в составе белков. Ясно, что новичкам приходится туго.
Автор: Владимир Фрадкин
Редактор: Дарья Брянцева
Биологические молекулы • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Жизнь — таинственная, сложная, загадочная — не что иное как совокупность достаточно крупных молекул и довольно простых химических реакций. Если бы вам понадобилось конструировать крупные молекулы, вы пошли бы по одному из двух путей. Либо, как в кустарном ювелирном деле, вы стали строить каждую молекулу «с нуля», проделывая каждый раз уникальную работу. Либо — этот путь используется в современных строительных технологиях — вы бы изготовили набор простых молекул, из которых можно собирать самые разнообразные молекулы большего размера, сочетая модули тем или иным образом. Оказывается, именно такое модульное строение имеют биологические молекулы. Согласно теории эволюции, таким и должен был быть самой простой путь к крупным молекулам, поскольку в начале эволюционного процесса необходимость в конструировании очень сложных молекул отсутствовала. Со временем же могли добавляться новые модули, расширяя коллекцию крупных разнородных элементов, что вполне соответствует духу эволюции.
Либо — этот путь используется в современных строительных технологиях — вы бы изготовили набор простых молекул, из которых можно собирать самые разнообразные молекулы большего размера, сочетая модули тем или иным образом. Оказывается, именно такое модульное строение имеют биологические молекулы. Согласно теории эволюции, таким и должен был быть самой простой путь к крупным молекулам, поскольку в начале эволюционного процесса необходимость в конструировании очень сложных молекул отсутствовала. Со временем же могли добавляться новые модули, расширяя коллекцию крупных разнородных элементов, что вполне соответствует духу эволюции.
Белки
Основной структурной единицей белков являются молекулы аминокислот. Чтобы понять, что такое аминокислота, представьте себе совокупность атомов, у которых с одной стороны наружу выступает водород, с другой — соединенные между собой кислород и водород, а посередине расположены разнообразные другие компоненты. Подобно тому как бусины нанизываются на нить, из этих аминокислот собираются белки — ион водорода (Н+) одной аминокислоты объединяется с ионом гидроксила (ОН–) другой аминокислоты с образованием молекулы воды. (Представьте, как каждый раз при соединении двух аминокислотных молекул между ними пробегает капелька воды.) Среди белков самую важную роль играют белки-ферменты (см. Катализаторы и ферменты), регулирующие химические реакции в клетках; но белки также являются важными структурными компонентами живых организмов. Например, ваши волосы и ногти состоят из белков.
(Представьте, как каждый раз при соединении двух аминокислотных молекул между ними пробегает капелька воды.) Среди белков самую важную роль играют белки-ферменты (см. Катализаторы и ферменты), регулирующие химические реакции в клетках; но белки также являются важными структурными компонентами живых организмов. Например, ваши волосы и ногти состоят из белков.
Углеводы
Углеводы содержат кислород, водород и углерод в соотношении 1:2:1. Во многих живых системах молекулы углеводов выполняют роль источников энергии. Одним из важнейших углеводов можно считать сахар глюкозу, содержащую шесть атомов углерода (С6Н12О6). Глюкоза — конечный продукт фотосинтеза и, следовательно, основа всей пищевой цепи в биосфере. Соединяя молекулы глюкозы, как основные строительные модули, можно получить сложные углеводы. Как и белки, углеводы играют вспомогательную роль в клетках, поскольку входят в клеточные структуры. Например, растительные волокна состоят из целлюлозы, которая представляет собой вереницу сцепленных особым образом молекул глюкозы.
Липиды
Липиды — это нерастворимые в воде органические молекулы. Вы получите правильное представление о липидах, если вообразите капельки жира, плавающие на поверхности бульона. В живых организмах липиды выполняют две важные функции. Один класс молекул — фосфолипиды — состоят из маленькой головки, содержащей фосфатную группу (атом фосфора, соединенный с четырьмя атомами кислорода), и длинного углеводородного хвоста. Углеводородный хвост этой молекулы гидрофобен, то есть энергетическое состояние молекулы минимально, когда этот хвост находится не в воде. Напротив, фосфатная головка гидрофильна, то есть энергетическое состояние молекулы минимально при контакте головки с водой . Если поместить молекулы фосфолипидов в воду, они будут стремиться достичь минимального энергетического состояния и выстроятся таким образом, что их хвосты окажутся вместе, а головки — врозь. Такая двухслойная структура очень стабильна, поскольку головки будут в контакте с водой, но вода будет вытеснена из области, окружающей хвосты молекул.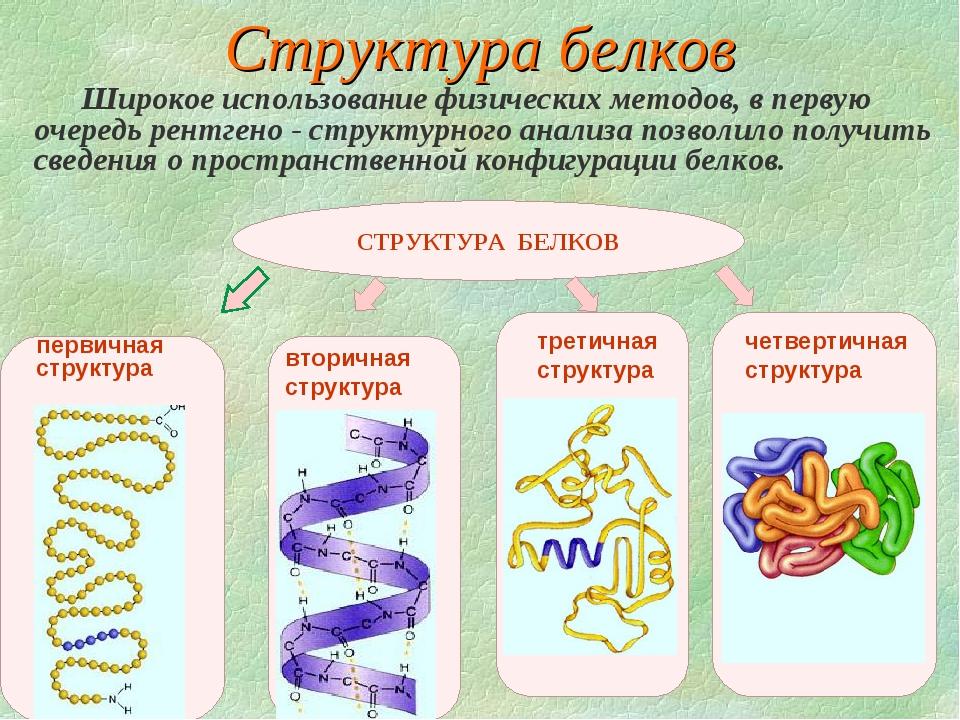 Для перемещения липидным молекулам необходима энергия — либо чтобы удалить гидрофильные участки из воды, либо чтобы поместить в воду гидрофобные участки. Из таких липидных двухслойных структур состоят клеточные мембраны и мембраны, разделяющие компоненты клетки. Эти пластичные и прочные молекулы отделяют живое от неживого.
Для перемещения липидным молекулам необходима энергия — либо чтобы удалить гидрофильные участки из воды, либо чтобы поместить в воду гидрофобные участки. Из таких липидных двухслойных структур состоят клеточные мембраны и мембраны, разделяющие компоненты клетки. Эти пластичные и прочные молекулы отделяют живое от неживого.
Кроме того, в липидах запасается энергия. Липиды могут накапливать примерно вдвое больше энергии на единицу массы, чем углеводы. Вот почему, когда вы переедаете и ваш организм хочет запасти энергию на случай непредвиденных обстоятельств в будущем, когда пищи не будет, он станет запасать ее в форме жира. На этом простом факте строится многомиллиардная индустрия диетических продуктов.
Нуклеиновые кислоты
Молекулы ДНК и РНК (см. Центральная догма молекулярной биологии) переносят информацию о химических процессах, идущих в клетке, и участвуют в передаче содержащейся в ДНК информации в цитоплазму клетки. В ДНК живого организма закодированы белки-ферменты, которые катализируют все химические реакции, происходящие в этом организме.
Молекулы-переносчики энергии
Жизнедеятельность требует затрат энергии. В частности, нужно, чтобы энергия, произведенная в одном месте, могла быть использована в другом. Эту функцию в клетке осуществляет целая армия специализированных молекул. Пожалуй, самые важные из них — аденозин трифосфат (АТФ) и аденозин дифосфат (АДФ). Обе молекулы устроены так: группа из атомов углерода, водорода и азота (она называется аденин) присоединена к молекуле рибозы (это сахар), и все это вместе крепится к хвосту из фосфатов. Из названий молекул понятно, что в хвосте АДФ содержится два фосфата, а в хвосте АТФ — три. Когда в клетке происходит химический процесс, например фотосинтез, образующаяся энергия идет на присоединение третьего фосфата к хвосту АДФ. Полученная молекула АТФ затем переносится в другие части клетки. Там запасенная энергия может быть использована в других химических процессах: она выделяется при отщеплении последнего фосфата от АТФ, в результате чего АТФ вновь превращается в АДФ.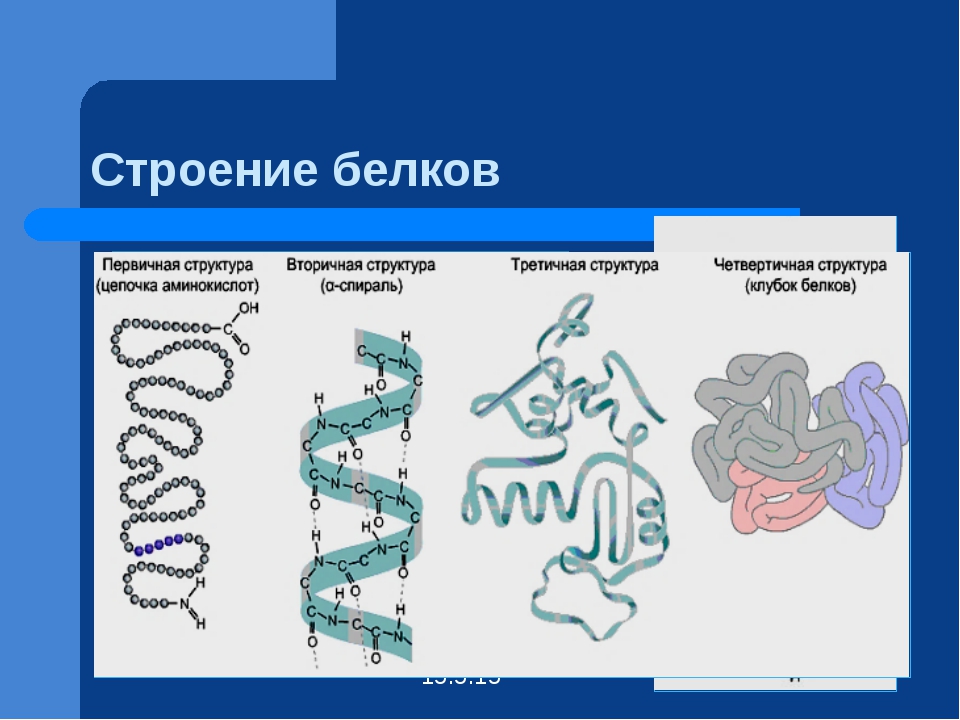
Как мы уже упоминали, существуют и другие молекулы, которые переносят энергию в клетке. Набор таких молекул чем-то напоминает разные варианты оплаты счетов. Вы можете выбрать наличные, банковский перевод, кредитную карту и т. д. — в зависимости от того, какой способ вам удобнее. Так же и клетка для поддержания своей жизнедеятельности может использовать АТФ (эквивалент наличных денег) или любую другую из большого набора более сложных молекул.
См. также:
Презентация по окружающему миру на тему «Белки» (5 класс)
Презентация «Белки»
«Жизнь- это открытые саморегулирующиеся и самовоспроизводящиеся системы совокупностей живых организмов,построенных из сложных биологических полимеров- белков и нуклеиновых кислот».
Основой всего живого считаются нуклеиновые кислоты и белки, так как они функционируют в клетке, образовывают сложные соединения, которые входят в структуру всех живых организмов. Все живые организмы в природе состоят из одинаковых уровней организации, это общая для всех живых организмов характерная биологическая закономерность. (слайд2)
(слайд2)
Белки- высокомолекулярные органические соединения- (ВМС), нерегулярные биополимеры, состоящие из мономеров-аминокислот, соединенных пептидной связью. В живыхорганизмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. (слайд 3)
Уровни структуры белка
Первичная струтура — последовательность аминокислот в полипептидной цепи. Определяется и соответствует последовательности нуклеотидов в молекуле ДНК (слайды 10,11)
Вторичная структура-локальное упорядованивание фрагмента полипептидной цепи,стабилизированное водородными связми и гидрофобными взаимодействиями (слайд 12)
Третичная структура-пространственное строение полипептидной цепи-взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между боковыми цепями аминокислотных остатков. в стабилизации третичной структуры принимают участие химические связи (слайд 13)
Четвертичная структура-субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса(слайд 14)
Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса(слайд 14)
Функции белков
- Строительная (материал клетки)
- Транспортная (переносят различные вещества)
- Защитная (обезвреживают защитные вещества)
- Каталитическая (ускоряют протекание химических реакций в организме)
- Двигательная (выполняют все виды движений)
- Регуляторная (регулируют обменные процессы) (слайд 15)
Строение и функции белков
Строение белков
Определение 1
Белки – сложные органические соединения (биополимеры), в состав молекул которых входят углерод, водород, кислород и азот (иногда серы). Их мономеры — аминокислоты.
Белки играют первостепенное значение в жизни всех организмов. Они характеризуются неисчерпаемым разнообразием, которое одновременно очень специфично.
Замечание 1
Белки и нуклеиновые кислоты являются материальной основой всего богатства организмов окружающей среды. Их доля составляет 50 – 80% сухой массы клетки.
Их доля составляет 50 – 80% сухой массы клетки.
Молекулы белков похожи на длинные цепи, состоящие из 50 – 1500 остатков аминокислот, соединённых крепкой ковалентной азотно-углеродной (пептидной) связью. В результате образуется первичная структура белка — полипептидная цепь.
Замечание 2
Молекула белка — это полипептид, молекулярная масса которого составляет от 5 тыс. до 150 тыс. Бывает и больше.
Простые белки состоят лишь из аминокислот, а сложные белки, кроме аминокислот, могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), углеводы (гликопротеиды), окрашенные химические соединения (хромопротеиды) и т.п.
Все свойства клетки (химические, морфологические, функциональные) зависят от специфических белков, содержащихся в ней.
Замечание 3
Именно набор аминокислот, их количество и последовательность расположения в полипептидной цепи и определяет специфичность белка.
Замена лишь одной аминокислоты в составе белковой молекулы или изменение последовательности расположения аминокислот может привести к изменению функций белка. Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры. Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры. Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Пространственное расположение полипептидных цепей также определяет свойства белков. В живой клетке полипептидные цепи скрученные или согнутые, имеют вторичную или третичную структуру.
Вторичная структура представлена спирально закрученной белковой цепочкой. Витки спирали удерживаются благодаря водородным связям, образующимся между расположенными на соседних витках СО – и NH – группами.
В результате дальнейшего закручивания спирали возникает специфическая конфигурация каждого белка — третичная структура. Образуется она благодаря связям между белковыми радикалами аминокислотных остатков:
- ковалентным дисульфидным (S – S-связям) между остатками цистеина,
- водородным,
- ионными.
- гидрофобным взаимодействиям.
В количественном соотношении наиболее важными являются гидрофобные взаимодействия, вызванные тем, что неполярные боковые цепи аминокислот стремятся объединиться друг с другом, не смешиваясь с водной средой. Белок при этом свёртывается так, чтобы его гидрофобные боковые цепи были спрятаны внутри молекулы, то есть защищены от контакта с водой, а наружу, наоборот, выставлены боковые гидрофильные цепи.
Для каждого белка специфичны количество молекуламинокислот с гидрофобными радикалами и количество молекул цистеина и характер их взаимного расположения в полипептидной цепи.
Взаимное расположение групп атомов, обходимое для проявления активности белка как катализатора, его гормональных функций и др. обеспечивается сохранением определённой формы молекулы. Потому стойкость макромолекул – не случайное свойство, а один из важнейших способовстабилизации организма.
Биологическая активность белка может проявлятся лишь когда он имеет третичную структуру, потому при замене в полипептидной цепи даже одной аминокислоты могут возникнуть изменения в конфигурации белка, а его биологическая активность снизится или же исчезнет совсем.
Иногда две, три, и больше белковых молекул с третичной структурой могут объединиться в единый комплекс. Подобные образования являются четвертичной структурой белка.
Пример 1
Примером такого сложного белка является гемоглобин, который состоит из четырёх субединиц и небелковой части – гема. Он способен выполнять свои функции только в такой форме.
В четвертичной структуре белковые субединицы не связаны химически, однако вся структура достаточно крепкая благодаря действию слабых межмолекулярных сил.
Под влиянием разнообразных физических и химических факторов (обработка щелочами, кислотами, спиртом, ацетоном, влияние высоких температур и давления и пр.) третичная и четвертичная структуры белка изменяются, потому что разрываются водородные и ионные связи.
Определение 2
Денатурация – нарушение естественной (нативной) структуры белка.
При денатурации уменьшается растворимость белков, изменяется форма и размеры молекул, теряется ферментативная активность и т. п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
Замечание 4
Все особенности строения и функционирования белковой макромолекулы зависят от его первичной структуры.
Функции белков в клетке
- Строительная (пластическая) функция белковых молекул является одной из важнейших.Они являются составным компонентом клеточных мембран и органел. Стенки кровеносных сосудов, сухожилия, хрящи высших животных также состоят в основном из белка.
- Двигательная функция обеспечивается особенными сократительными белками, благодаря которым осуществляются движения жгутиков и ресничек, перемещение хромосом во время деления клеток, сокращение мускулатуры, движения органов растений и т.п., пространственные изменения положения различных структур организма.
-
Транспортная функция белков обеспечивается их способностью связывать и переносить с течением крови химические соединения.
Пример 2
Белок крови гемоглобин переносит кислород из лёгких в клетки других органов и тканей (аналогичную функцию в мышцах выполняет миоглобин).
Белки сыворотки крови переносят липиды и жирные кислоты, различные биологически активные вещества.
Молекулы белков, входящих в состав плазматической мембраны, берут участие в транспорте веществ как в клетку, так и из неё.
Белки выполняют и защитную функцию. Как ответ на проникновение внутрь чужеродных веществ (антигенов – белков или высокомолекулярных полисахаридов бактерий, вирусов) в клетке вырабатываются особенные белки – иммуноглобулины (антитела), которые нейтрализуют чужеродные вещества и осуществляют иммунологичную защиту организма.
Благодаря функционированию иммунной системы организма обеспечивается распознавание антигенов антигенным детерминантам (характерным участкам их молекул). Благодаря этому специфически связываются и обеззараживаются чужеродные вещества за.
Замечание 5
Внешнюю защитную функцию могут выполнять также и белки, токсические для других организмов ( белок яда змей).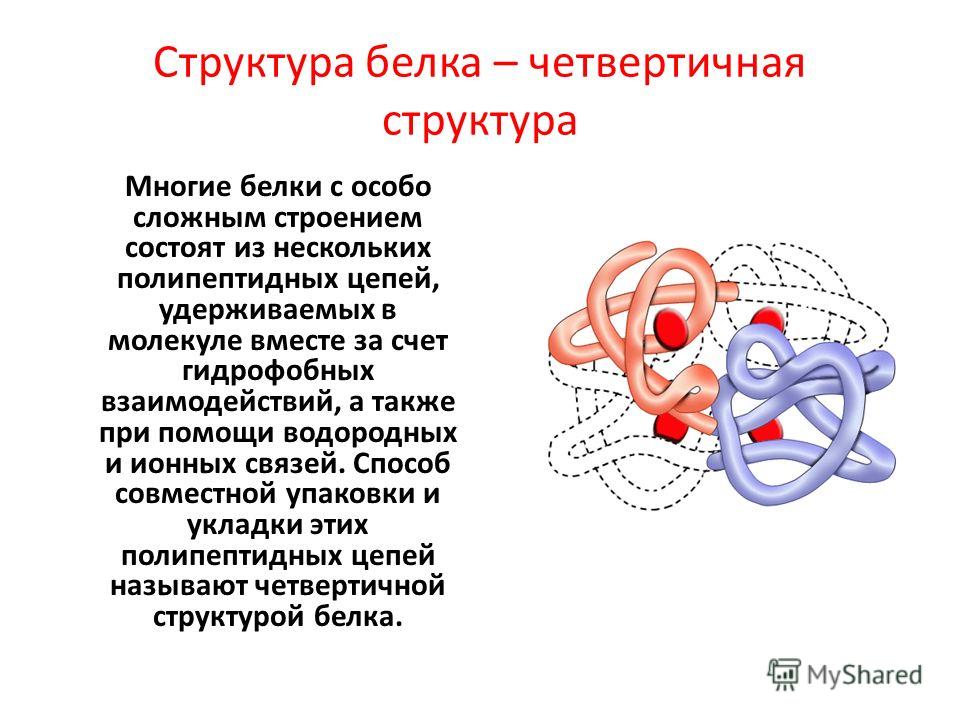
Белкам свойственна также сигнальная функция. В поверхность клеточной мембранны встроены молекулы белков, которые в ответ на действия факторов внешней среды способны к изменению свей третичной структуры. Так происходит восприятие сигналов из внешней среды и передача команд в клетку.
Регуляторная функция свойственна белкам-гормонам, которые влияют на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, учавствуют в росте размножении и других жизненно важных процессах.
Пример 3
Одним из наиболее известных гормонов является инсулин, понижающий содержание сахара в крови. В случае стойкой недостаточности инсулина содержание сахара в крови увеличивается и развивается сахарны диабет. Главными регуляторами биохимических процессов в организме могут быть и многочисленные белки-ферменты (каталитическая функция).
Белки являются и энергетическим материалом. При расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.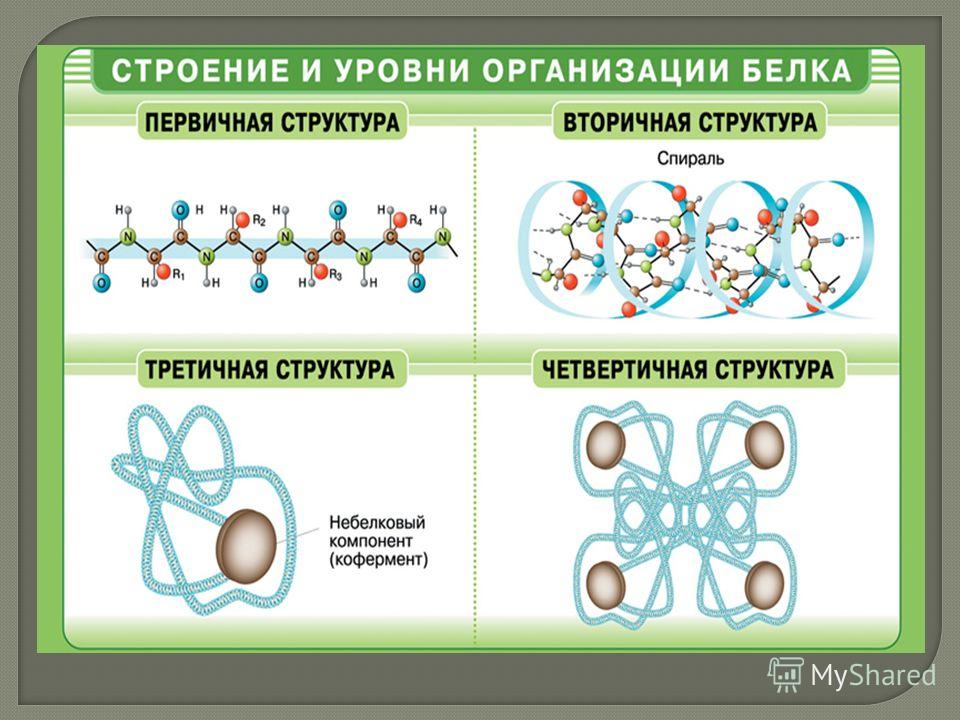
Ферменти, их роль в клетке
Определение 3
Ферменты (энзимы) – это специфические белки, присутствующие во всех организмах и выполняющие функцию биологических катализаторов.
Химические реакции в живой клетке происходят при умеренной температуре нормальном давлении и в нейтральной среде. При таких условиях течение реакций синтеза или распада веществ в клетке был быочень медленным, если бы не действие ферментов. Ферменты ускоряют реакции за счёт снижения энергии активации не измененяя их общего результата, то есть при их наличии для придания молекулам, вступающим в реакцию, реакционной способности, необходимо значительно меньше энергии
Все процессы в живом организме прямо или косвенно происходят с участием ферментов.
Под действием ферментов составляющие компоненты пищи (белки, липиды, углеводы и др.) расщепляются до простейших соединений, а из них позже синтезируются новые, свойственные данному виду макромолекулы. Потому нарушение образования и активности ферментов часто становятся причиной тяжёлых заболеваний.
Ферментативный катализ подчиняется тем же законам, что и неферментативный катализ в химической промышленности, однако в отличие от последнего характеризируется чрезвычайно высокой степенью специфичности (фермент катализирует только одну реакцию или действует
лишь на один тип связи). Этим обеспечивается тонкое регулирование всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и т. п.), происходящих в клетке и организме.
Пример 4
Фермент уреаза катализирует расщепление только одного вещества – мочевины, но не действует каталитически на структурно родственные соединения.
Для понятия механизма действия ферментов, которые имеют высокую специфичность, чрезвычайно важна теория активного центра. Согласно с ней, в молекуле каждого фермента есть один или больше участков, в которых катализ происходит за счёт тесного (во многих местах) контакта между молекулами фермента и субстрата (специфического вещества), а функциональная группа (пример – ОН – группа аминокислоты серина), или же отдельная аминокислота, выступает активным центром.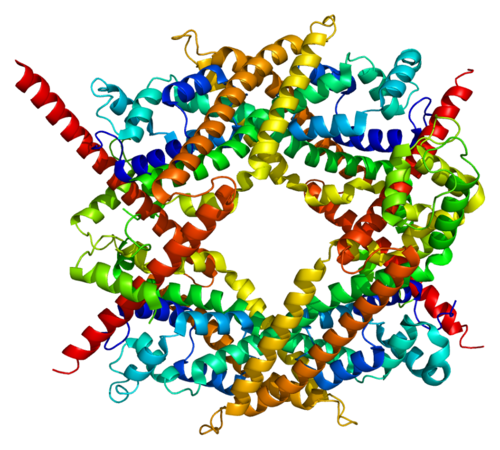
Обычно для действия катализатора необходимо, чтобы объединились несколько аминокислотных остатков, расположенных в определённой последовательности (в среднем 3 – 12).
Активный центр также может формироваться благодаря связи ферментов с ионами металов, витаминами и другими соединениями небелковой природы – так называемыми коферментами, или кофакторами.
Химическое строение и форма активного центра такова, что с ним способны связывать лишь определённые субстраты благодаря их идеальному соответствию (взаимодополняемости, или комплементарности) друг другу.
Остальные аминокислотные остатки обеспечивают большой молекуле ферментп соответствующую глобулярную форму, необходимую для эффективной работы самого центра.
Кроме того, вокруг большой молекулы фермента возникает сильное электрическое поле. В таком поле становится возможной ориентация молекул субстрата и приобретение ими ассиметрической формы. В результате ослабевают химические связи и начальная затрата энергии на реакцию, которая катализируется, будет меньше, а значит, значительно увеличится её скорость.
Пример 5
Одна молекула фермента каталазы способна за 1 мин расщепить более 5 млн. молекул перекиси водорода, которая возникает во время окисления в организме различных соединений.
Активный центр некоторых ферментов в присутствии субстрата может изменять конфигурацию: для обеспечения наибольшей каталитической активности такой фермент специально ориентирует свои функциональные группы. Молекулы субстрата, присоединяясь к ферменту, также в определённых пределах изменяют свою конфигурацию для увеличения реакционной способностит функциональных групп центра. На заключительном этапе химической реакции комплекс фермента и субстрата распадается, образуются конечные продукты и свободный фермент. Активный центр при этом освобождается и способен снова принимать новые молекулы субстрата.
Скорость реакций с участием ферментов зависит от многих факторов: от концентрации фермента, от природы субстрата, от давления, температуры, кислотности среды, от наличия ингибиторов.
При температурах, близких к 0˚С, до минимума замедляется скорость биохимических реакций. Это свойство широко используют в различных отраслях, особенно в медицине и сельском хозяйстве.
Пример 6
Для консервации органы человека (почки, серце, селезёнка, печень) перед пересадкой больному подвергают охлаждению, чтобы понизить интенсивность биохимических реакций и тем самым продлить время жизни этих органов. При быстром замораживании пищевых продуктов предотвращается размножение микроорганизмов, а так же инактивируются их ферменты, потому они уже не способны вызывать разложение пищевых продуктов.
эволюцию гемоглобина воссоздали в пробирке
Биологи выяснили происхождение гемоглобина и синтезировали белки, которые были его предками. Оказалось, что поразительная эффективность этого вещества, сделавшая позвоночных господами планеты, возникла благодаря всего двум ключевым мутациям.
Достижение описано в научной статье, опубликованной в журнале Nature.
Великолепная четвёрка
Все современные наземные позвоночные и почти все морские, за исключением жалкой сотни видов, относятся к группе челюстных. Но выделяются они не только челюстями, но и строением гемоглобина. Он невероятно эффективно справляется с переносом кислорода. Несомненно, это стало одним из главных эволюционных козырей челюстных, позволивших им оккупировать верхние уровни всех пищевых цепей на суше и в море.
Гемоглобин челюстных – белок с характером. Его молекула – это комплекс из четырёх субъединиц, каждая из которых, в общем-то, и сама представляет собой полноценную молекулу белка. Таким образом, наш гемоглобин – это белок, состоящий из других белков.
Таких белков два, и обозначаются они греческими буквами α и β. Каждая молекула гемоглобина в нашей крови состоит из двух молекул α-белка (α-субъединиц) и двух молекул β-белка (β-субъединиц).
При этом все четыре субъединицы связывают или высвобождают кислород одновременно. Так что молекула гемоглобина транспортирует живительный газ по принципу «четыре грузовика по цене одного». Ничего удивительного, что организмы с такой щедрой кислородной логистикой добились господствующего положения на земном шаре.
Так что молекула гемоглобина транспортирует живительный газ по принципу «четыре грузовика по цене одного». Ничего удивительного, что организмы с такой щедрой кислородной логистикой добились господствующего положения на земном шаре.
Удивительная эффективность гемоглобина позволяет нам иметь быстрый обмен веществ.
Потомки индивидуалистов
При этом и α-, и β-белок входят в обширное семейство глобинов. Удивительно, но их ближайшие известные «сородичи» по этому семейству совсем не склонны объединятся в комплексы и брать на себя скромную роль субъединиц. Они предпочитают гордое одиночество. В таком случае когда и как они обрели способность к объединению (за что им огромное спасибо от имени всех челюстных)? До сих пор ответа не было.
Между прочим, эта загадка касается не только гемоглобина. Большинство белков представляют собой комплексы из нескольких субъединиц и только благодаря этому могут выполнять свои биологические функции. И совершенно неизвестно, как и когда молекулы-субъединицы научились подобной кооперации.
И совершенно неизвестно, как и когда молекулы-субъединицы научились подобной кооперации.
И, пожалуй, именно с гемоглобина удобнее всего было начать распутывать эту головоломку.
«Структура и функция гемоглобина изучены лучше, чем, возможно, любой другой молекулы. Но ничего не было известно о том, как они возникли в ходе эволюции, – рассказывает первый автор статьи Арвид Пиллаи (Arvind Pillai) из Чикагского университета. – Это отличная модель [для изучения эволюции белков], потому что компоненты гемоглобина являются частью обширного семейства белков, и их самые близкие «родственники» не образуют комплексов, а функционируют в одиночку».
Отзвуки прошлого
Проанализировав структуру разных глобинов, исследователи восстановили их эволюционное древо. Они исходили из того, что все глобины происходят от общего белка-предка. При этом чем больше похожи друг на друга последовательности аминокислот в двух белках, тем позже разошлись их эволюционные пути. А зная, насколько часто происходят мутации, можно установить и когда произошло это ветвление.
А зная, насколько часто происходят мутации, можно установить и когда произошло это ветвление.
Биологи не просто вычислили структуру белков-предков. Они синтезировали эти вещества и изучили их в эксперименте. Здесь авторам опять-таки помог тот факт, что человечество десятилетиями пристально изучало гемоглобин и накопило целый арсенал методов для этого занятия. Он подошёл и для исследования «воскрешенных» молекул.
«Есть отличные лабораторные инструменты для анализа их свойств», – отмечает Пиллаи.
Эволюционное дерево гемоглобина челюстных согласно новому исследованию.
Захватывающая история из жизни белков
У авторов получилась следующая история из жизни белков. Это быль, но, чтобы облегчить участь читателя, расскажем её в тоне сказки.
Жил-был на свете белок, последний общий предок гемоглобина и миоглобина (исследователи назвали его AncMH). И никаких комплексов ни с кем он образовывать не умел и не хотел.
Но однажды он мутировал, и получился из него белок Ancα/β – последний общий предок α- и β-белков гемоглобина. Две молекулы Ancα/β уже умели образовывать пару друг с другом.
Долго ли, коротко ли, но Ancα/β тоже мутировал. И возникло два новых белка: Ancα и Ancβ. И оказалось, что молекула Ancα так нравится молекуле Ancβ, а та настолько отвечает ей взаимностью, что две эти молекулы могут образовать пару.
До гемоглобина остался лишь один шаг. Ancα и Ancβ снова претерпели каждый свою мутацию. После чего из Ancα получился уже α-белок собственной персоной, а из Ancβ – β-белок. А пара, состоящая из одной молекулы α-белка и одной молекулы β-белка, обрела способность объединиться с другой такой же парой.
Так и получилась молекула-четвёрка, поныне снабжающая каждого из нас кислородом (в этом месте все челюстные дружно поаплодировали руками, лапами и плавниками).
Три революции в одной
Удивительно, но две мутации, научившие пары Ancα+Ancβ объединяться в четвёрки, привели к ещё одному животворному изменению.
Молекулы всех предшественников нашего современного гемоглобина, включая Ancα и Ancβ, слишком уж страстно сливались в объятиях с молекулой кислорода и неохотно расставались с ней. Поэтому они плохо выполняли свою функцию по снабжению этим веществом клеток.
Мутации, собравшие четыре белка в один, не заменили ни одной аминокислоты в участке молекулы, который соединяется с кислородом. Но когда четыре молекулы объединились, аминокислотная нить буквально натянулась как верёвка. Участок, связывающий кислород, изменил свою форму. В результате белок умерил свой пыл в отношении O2.
Более того, при этом возникла и та самая склонность всех субъединиц присоединять или отдавать кислород одновременно (очень удачно для каждого из нас).
Происходит этот процесс так. Когда одна субъединица соединяется с молекулой кислорода, натяжение аминокислотной нити ослабевает. «Кислородосвязывающий» участок соседней субъединицы возвращает себе исходную форму. Примерно ту самую, которую он имел в жадной до O2 молекуле Ancα или Ancβ. Поэтому эта субъединица тоже сразу же хватает пролетающий мимо кислород. Потом приходит черёд третьей субъединицы, а затем и четвёртой.
Поэтому эта субъединица тоже сразу же хватает пролетающий мимо кислород. Потом приходит черёд третьей субъединицы, а затем и четвёртой.
Когда приходит время расставаться с добычей, всё происходит в обратном порядке. Достаточно одной субъединице отдать свою молекулу газа, как аминокислотная нить снова натягивается. Форма связывающего кислород участка ближайшей субъединицы меняется, и она уже не настолько крепко держит молекулу O2. Потом та же участь постигает третью и четвёртую субъединицу.
Так и получается наш замечательный гемоглобин. Его молекула состоит из четырёх субъединиц, присоединяющих или отдающих кислород одновременно. И чувство родства с кислородом у него ровно такое, какое выгодно организму. Он охотно забирает этот газ из лёгких или жабр, но при этом послушно отдаёт его нуждающимся клеткам. И всё благодаря двум простым мутациям, научившим пары молекулы объединяться в четвёрку.
Кстати, произошли они более 400 миллионов лет назад, ещё до того, как разделились эволюционные линии человека и акулы.
Эффективный гемоглобин стал эволюционным козырем челюстных позвоночных.
Всемогущая случайность
«Мы были поражены, когда увидели, что такой простой механизм может породить такие сложные свойства, – признаётся глава исследовательской группы Джозеф Торнтон (Joseph Thornton) из Чикагского университета. – Это говорит о том, что во время эволюции скачки в сложности могут происходить внезапно и даже случайно, создавая новые молекулярные объекты, которые в конечном итоге становятся необходимыми для нашей биологии».
Традиционный взгляд на эволюцию, восходящий ещё к Дарвину, заключается в том, что новое не возникает сразу. Мутации, ведущие к кардинальным изменениям в организме, конечно, случаются, но они могут быть только вредными. Получится урод, монстр, который не сможет выжить и размножиться.
Живой организм настолько сложен, говорят сторонники этой позиции, что любое крупное изменение нарушит какой-нибудь важный процесс. Изменить живое и при этом оставить его живым можно только в мелочах. Конечно, мелкие изменения постепенно накапливаются, рано или поздно меняя организм до неузнаваемости. Но нужны целые эпохи, чтобы потомок перестал походить на предка.
Изменить живое и при этом оставить его живым можно только в мелочах. Конечно, мелкие изменения постепенно накапливаются, рано или поздно меняя организм до неузнаваемости. Но нужны целые эпохи, чтобы потомок перестал походить на предка.
Между тем восстановленная авторами история гемоглобина убедительно демонстрирует, что иногда ключевые изменения происходят скачком, за одну-две мутации. Кстати, это далеко не единственный пример того, как изменения в небольшом числе генов обеспечивают эволюционные прорывы. Так что, хотя эволюция действительно чаще всего работает через накопление небольших изменений, иногда случаются стремительные революции.
Другой урок этого исследования, пожалуй, в том, насколько нынешний облик всей биосферы определяется произошедшими когда-то случайностями.
«Представьте себе, если эти две мутации никогда не произошли <…>, – фантазирует Торнтон. – Гемоглобин в том виде, в котором мы его знаем, не эволюционировал. А вместе с ним многие последующие инновации, которые требуют эффективного транспорта кислорода, такие как быстрый обмен веществ и способность достигать гораздо больших размеров и двигаться гораздо быстрее, чем наши древние морские предки».

Впрочем, как ни удивительно, ключевые эволюционные прорывы нередко происходят независимо в разных эволюционных линиях. Например, животные и растения стали многоклеточными независимо друг от друга. Так что было бы слишком опрометчиво утверждать, что без этих двух мутаций позвоночные так и остались бы мелкими и медлительными морскими созданиями с неэффективным дыханием. Возможно, случились бы какие-то другие изменения в белках, решившие проблему доставки кислорода. Но, вероятно, жизнь в этом случае была бы совсем не похожа на ту, частью которой мы являемся.
К слову, ранее «Вести.Наука» (nauka.vesti.ru) рассказывали об эволюционной истории другого ключевого изобретения живых организмов – фотосинтеза.
белков — что это такое и как они производятся — Science Learning Hub
Белки являются ключевыми рабочими молекулами и строительными блоками во всех клетках. Они производятся во всех организмах с помощью аналогичного двухэтапного процесса — сначала ДНК транскрибируется в РНК, а затем РНК транслируется в белок.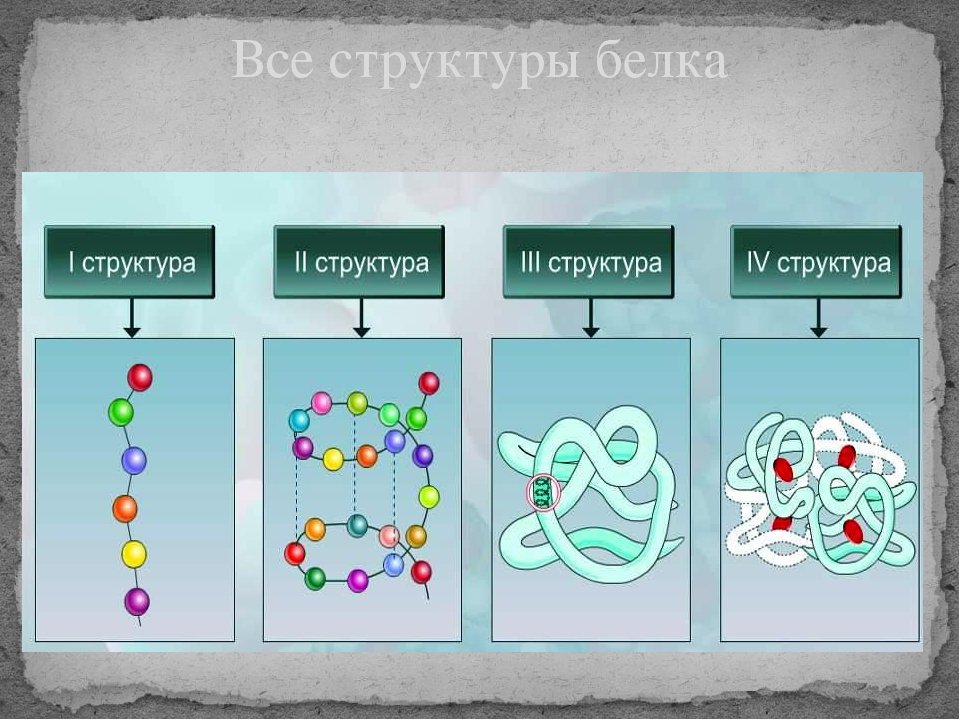
Перед отдельными генами последовательности ДНК, называемые промоторами, определяют, когда и в каких количествах производятся белки.
Что такое белок?
Белки являются основными «рабочими молекулами» в каждом организме.Помимо прочего, белки катализируют реакции, переносят кислород и защищают организмы от инфекций. Они также являются важными строительными блоками организмов. Они являются основными компонентами шерсти, хрящей и молока, они упаковывают ДНК в хромосомы и изолируют клетки нервной системы. Короче говоря, белки очень важны!
Белки состоят из большого количества аминокислот, соединенных встык. Цепочки складываются, образуя трехмерные молекулы сложной формы — это можно представить как оригами с очень длинным и тонким листом бумаги.Точная форма каждого белка вместе с содержащимися в нем аминокислотами определяет, что он делает.
Белки: ключевые примеры в Hub
Ферменты — это белки. Многие ферменты имеют полезные применения в медицинской или промышленной биотехнологии. Узнайте больше в видеоклипе: Улучшение ферментов.
Узнайте больше в видеоклипе: Улучшение ферментов.
Инсулин — это белок, регулирующий уровень глюкозы в крови. У диабетиков 1 типа инсулин не вырабатывается. Узнайте больше в видеоклипе: Сахарный диабет 1 типа.
Мидии крепко держатся за камни и груды своей прочной биссальной нитью, состоящей из протеина.Узнайте больше в интерактиве: Как выращивают мидии в Новой Зеландии.
Антитела — это белки, подробнее читайте в статье: Иммунная система.
Казеин — это белок молока, из которого делают сыр. Узнайте больше в анимационном видео: Сыр: молекулярный взгляд.
Факторы транскрипции — это специализированные белки, которые контролируют производство других белков. Узнайте больше в видеоклипе: Что влияет на телесный цвет яблока ?.
Макрофибриллы шерсти состоят из белка.Узнайте больше в интерактивном материале: Структура и свойства шерстяных волокон.
Белки экспрессируются генами
Все организмы вырабатывают белки по существу одинаковым образом. Процесс начинается с гена — «инструкции» по созданию белка. По этой причине процесс создания белка также называется экспрессией генов.
Процесс начинается с гена — «инструкции» по созданию белка. По этой причине процесс создания белка также называется экспрессией генов.
Экспрессия гена состоит из двух основных стадий: транскрипции и трансляции.
Транскрипция
Структуры в клетке определяют начало и конец гена и считывают последовательность ДНК между ними (порядок оснований A, C, G и T в гене).Создается молекулярное сообщение (молекула мРНК), которое повторяет последовательность самого гена. Во многих отношениях мРНК похожа на одноцепочечный фрагмент ДНК.
Трансляция
Рибосома получает молекулу мРНК и начинает выстраивать цепочку аминокислот (белок), которая точно соответствует инструкциям внутри мРНК. Рибосома «считывает» последовательность мРНК как серию трехосновных фрагментов или кодонов. Каждый кодон сообщает аппарату по производству белка, какую аминокислоту добавить следующей.
Генетический код по существу одинаков во всей природе.
Примечательно, что во всей жизни каждый кодон имеет одно и то же «значение» в любой данной клетке (за некоторыми незначительными исключениями).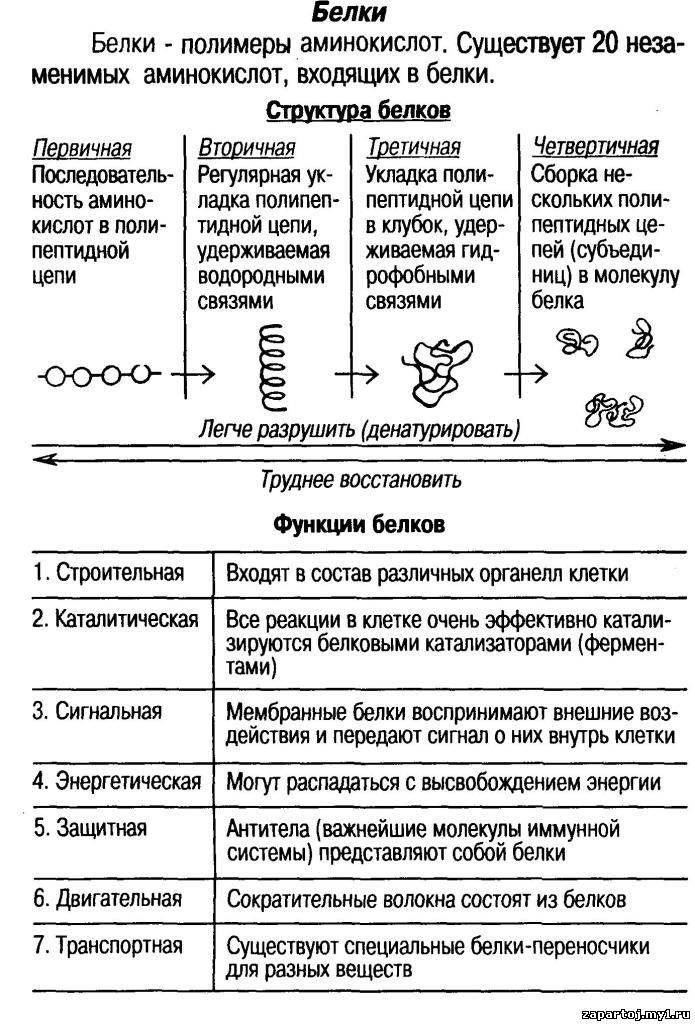 Например, кодон AGA — это инструкция по добавлению аминокислоты аргинина к растущему белку — независимо от того, растет ли этот белок в бактериальных клетках или клетках человека. Другими словами, каждая клетка следует одним и тем же правилам при производстве нового белка.
Например, кодон AGA — это инструкция по добавлению аминокислоты аргинина к растущему белку — независимо от того, растет ли этот белок в бактериальных клетках или клетках человека. Другими словами, каждая клетка следует одним и тем же правилам при производстве нового белка.
См. Статью Как добавить чужеродную ДНК к бактериям для получения дополнительной информации.
Какие белки производятся, когда — сила промотора
В любой клетке одновременно производится только часть белков. Белки, которые выполняют важные функции, производятся постоянно, в то время как другие экспрессируются только тогда, когда они необходимы. Клеткам также необходимы большие количества одних белков (таких как ферменты, участвующие в непрерывных процессах, таких как транскрипция и трансляция), и меньшие количества других (например, гормонов). Но как клетка решает, какие гены экспрессировать и сколько производить?
Промоторы — это последовательности ДНК, которые определяют, когда экспрессируется ген. Эти участки ДНК располагаются перед генами и обеспечивают «место посадки» для факторов транскрипции (белков, которые включают и выключают экспрессию генов) и РНК-полимеразы (белка, который считывает ДНК и создает копию мРНК). Различные промоторные последовательности имеют разную силу, и гены с «сильными» промоторами экспрессируются на более высоком уровне, чем гены со «слабыми» промоторами.
Эти участки ДНК располагаются перед генами и обеспечивают «место посадки» для факторов транскрипции (белков, которые включают и выключают экспрессию генов) и РНК-полимеразы (белка, который считывает ДНК и создает копию мРНК). Различные промоторные последовательности имеют разную силу, и гены с «сильными» промоторами экспрессируются на более высоком уровне, чем гены со «слабыми» промоторами.
Промоторы и цвет мякоти яблока
В компании Plant & Food Research Ричард Эспли и его коллеги изучают роль промоторов в определении того, имеют ли яблоки мякоть белого или красного цвета.Группа обнаружила фактор транскрипции (MYB10), который связывается с промотором нескольких генов, которые производят красный пигмент в яблоках, вызывая их экспрессию. В яблоках с красной мякотью намного больше MYB10, чем в яблоках с белой мякотью, поэтому эти гены пигмента экспрессируются на более высоком уровне и образуют больше красного пигмента.
Подробнее читайте в статье: Узнайте, что контролирует цвет мякоти яблока.
Белки и экспрессия генов
Эти статьи содержат дополнительную информацию об экспрессии генов и белках.
Полезная ссылка
В этом интерактивном режиме из Учебного центра генетических наук Университета Юты исследуйте процесс экспрессии генов, беря фрагмент ДНК через процессы транскрипции и трансляции.
Биологические белки | Биология | Visionlearning
Паучий шелк, гемоглобин, кератин в ногтях и волосах, актин и миозин в мышечных волокнах — все это белки. Как класс биологических соединений, они жизненно важны практически для каждого биологического процесса, поскольку могут принимать очень много разных форм.Белки могут быть длинными волокнами, способными скользить, как в мышцах; они могут быть большими и шаровидными, как фактор фон Виллебранда, который способствует свертыванию крови; или они могут быть небольшими, как инсулин, который необходим для метаболизма сахара. Инсулин — один из самых известных белков из-за его использования для лечения диабета, но он также знаком биохимикам, потому что это была первая открытая полная структура белка.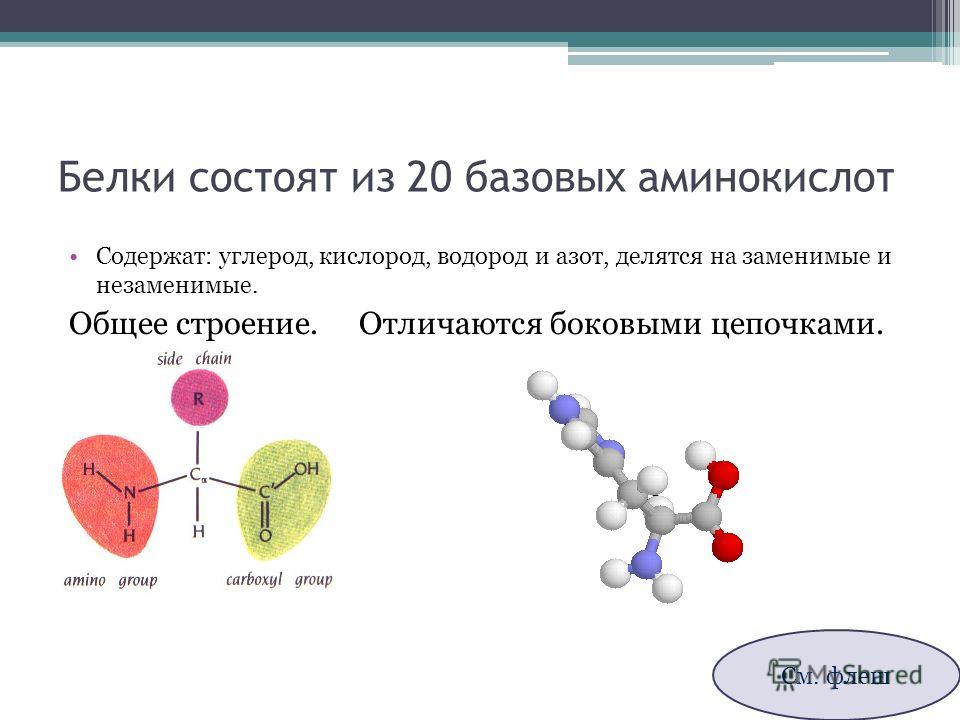
В 1921 году Фредерик Бантинг и Чарльз Бест извлекли инсулин из поджелудочной железы собак и узнали, что это гормон, влияющий на уровень сахара в крови.В течение года его использовали, чтобы спасти жизнь мальчика-диабетика. Это вызвало волну исследований, которые поставили инсулин в центр внимания, достигнув пика в 1950-х годах, когда британский биохимик Фредерик Сэнджер выяснил точную последовательность, в которой строительные блоки аминокислот соединяются для создания инсулина.
Последовательность строительных блоков
Во время Второй мировой войны, когда Сэнгер обратил свое внимание на инсулин, он и другие биохимики того времени уже знали, что этот гормон является белком.Сегодня мы знаем, что белки — это полимеры, состоящие из строительных блоков, называемых аминокислотами (рис. 1).
Рисунок 1 : Общая структура аминокислоты.
Возможно множество аминокислот. Фактически, метеорит Мерчисон (рис. 2), упавший в Австралии в 1969 году, содержал семьдесят различных аминокислот, но жизнь на Земле использует только двадцать, но этого достаточно, чтобы создать астрономическое количество возможных белков.
2), упавший в Австралии в 1969 году, содержал семьдесят различных аминокислот, но жизнь на Земле использует только двадцать, но этого достаточно, чтобы создать астрономическое количество возможных белков.
Рис. 2 : Метеорит Мерчисон, приземлившийся в Австралии в 1969 году, показал, что он содержит много типов химикатов, необходимых для жизни на Земле. Справа — обломок метеорита размером с гальку; при увеличении в 10 раз и помещении в поляризованный свет на кусочке метеорита можно увидеть различные минералы разного цвета. image © NASA
Одно только человеческое тело содержит около 100 000 различных белков из-за того, что одни и те же 20 аминокислот могут сочетаться множеством способов.Но ученые в начале 20-го века не думали, что структура белков каким-либо образом влияет на их функцию, и Сэнгер сыграл ключевую роль в изменении этой идеи.
До крупных открытий Сэнгера биохимики узнали о функции белков, называемой дисульфидным мостиком (рис. 3). Они также обнаружили, что обработка химическими веществами, называемыми восстановителями, разрывает дисульфидный мостик между двумя цистеинами, а также заставляет большие белки расщепляться на более мелкие белки, утверждая, что эти связи существуют в белках, чтобы удерживать их вместе.
3). Они также обнаружили, что обработка химическими веществами, называемыми восстановителями, разрывает дисульфидный мостик между двумя цистеинами, а также заставляет большие белки расщепляться на более мелкие белки, утверждая, что эти связи существуют в белках, чтобы удерживать их вместе.
Рис. 3 : Дисульфидный мостик (соединенные молекулы S), соединяющий два цистеина.
Следовательно, биохимики в эпоху Второй мировой войны считали, что аминокислоты должны быть связаны в цепочки таким образом, который сегодня можно сравнить с бусинками на нитке. Они знали, что каждая аминокислота в цепи связана со следующей аминокислотой через особый тип химической связи, называемой амидной связью, также называемой пептидной связью.
Контрольная точка понимания
В организме человека более 100 000 различных аминокислот.
Пептидная связь
Чтобы понять пептидную связь, нам нужно более внимательно изучить структуру аминокислот. Как отмечалось ранее, разные типы аминокислот различаются на основе группы R.Например, если R представляет собой атом водорода, аминокислота представляет собой глицин. Если R представляет собой метильную группу (CH 3 ), аминокислота представляет собой аланин. Если R представляет собой сульфгидрил (CH 2 SH), аминокислота представляет собой цистеин. Это всего лишь несколько примеров, но, за исключением группы R, все аминокислоты в остальном одинаковы. На одном конце каждая аминокислота имеет функциональную группу COOH, называемую карбоксилом. С другой стороны, каждая аминокислота имеет группу NH 2 , называемую амино. (См. Рисунок 4 для пептидной связи в аминокислоте.)
Как отмечалось ранее, разные типы аминокислот различаются на основе группы R.Например, если R представляет собой атом водорода, аминокислота представляет собой глицин. Если R представляет собой метильную группу (CH 3 ), аминокислота представляет собой аланин. Если R представляет собой сульфгидрил (CH 2 SH), аминокислота представляет собой цистеин. Это всего лишь несколько примеров, но, за исключением группы R, все аминокислоты в остальном одинаковы. На одном конце каждая аминокислота имеет функциональную группу COOH, называемую карбоксилом. С другой стороны, каждая аминокислота имеет группу NH 2 , называемую амино. (См. Рисунок 4 для пептидной связи в аминокислоте.)
Рис. 4 : Пептидная связь
Пептидная связь образуется, когда карбоксильный атом углерода одной аминокислоты ковалентно соединяется с атомом азота аминогруппы другой аминокислоты, вытесняя молекулу воды (H 2 O). Связывание нескольких аминокислот их карбоксильными и аминогруппами дает небольшой белок, также называемый полипептидом, поскольку он содержит несколько пептидных связей (рис. 5).Соединение аминокислот таким образом дает цепь с COOH на одном конце и Nh3 на другом конце, называемую карбоксильным и амино-концом соответственно.
Связывание нескольких аминокислот их карбоксильными и аминогруппами дает небольшой белок, также называемый полипептидом, поскольку он содержит несколько пептидных связей (рис. 5).Соединение аминокислот таким образом дает цепь с COOH на одном конце и Nh3 на другом конце, называемую карбоксильным и амино-концом соответственно.
Рис. 5 : Соединение двух аминокислот (красный) с удаленной молекулой воды (синий).
Ко времени Сэнгера биохимики использовали кислотные химические вещества, чтобы разорвать пептидные связи белка, таким образом разделяя отдельные аминокислоты.Кроме того, они знали, что белок может иметь более одной полипептидной цепи, соединенной друг с другом дисульфидными связями, прикрепленными к участкам цепи, содержащей цистеин. Обрабатывая белок для разрушения дисульфидных мостиков, биохимики в начале 1940-х годов могли узнать количество цепей в белке. Кроме того, разрывая пептидные связи и проводя химические тесты, они могли определить идентичность аминокислот белка и относительные количества каждой аминокислоты.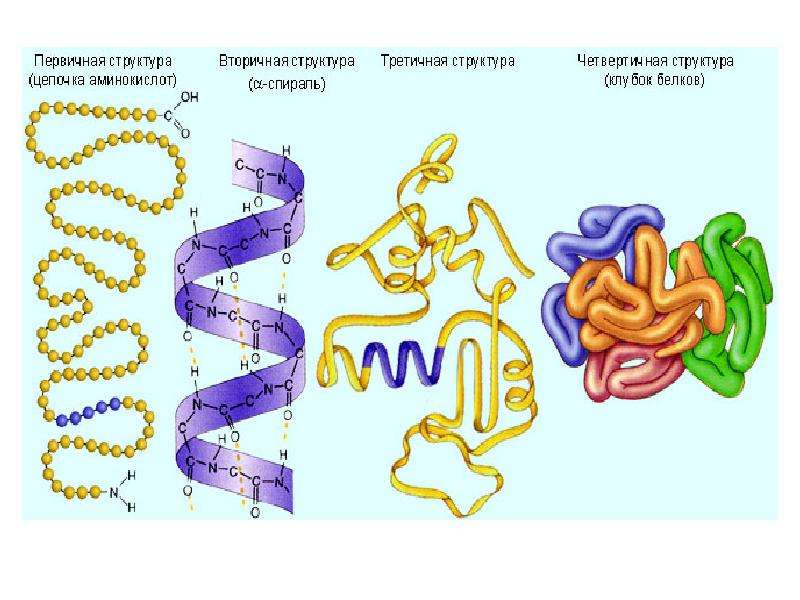
Однако это не сообщило биохимикам последовательность, в которой эти аминокислоты были связаны друг с другом.Что отличает Сэнгера от его современников, так это понимание того, что относительные количества каждого типа аминокислот и их последовательность могут быть чрезвычайно важны. Это могло быть основой того, как функционировал каждый белок. Если это так, то аминокислотная последовательность также будет ключом к тому, как функционирует жизнь. Учитывая преобладание белков в организмах, эта идея имела большой смысл, но теперь задачей Сэнгера было доказать это. Сделать это было бы непросто, но первым делом нужно было выбрать конкретный белок, на котором он будет сосредоточивать свою работу.
Контрольная точка понимания
Чтобы разделить отдельные аминокислоты, ученые используют _____ химикатов, чтобы разорвать пептидные связи белка.
Инсулин как модель для изучения структуры белка
Поскольку инсулин имеет небольшие размеры и важен для лечения болезни, Сэнгер стал логичным выбором для начала своей работы по секвенированию аминокислот. Он начал с бычьего инсулина, поскольку его было легко получить и очистить в больших количествах. Первое, что он сделал, — обработал инсулин химическим веществом, разрушающим дисульфидные мостики. Если бы инсулин состоял только из одной полипептидной цепи, тестирование размера белка до и после химической обработки дало бы одинаковый результат.
Он начал с бычьего инсулина, поскольку его было легко получить и очистить в больших количествах. Первое, что он сделал, — обработал инсулин химическим веществом, разрушающим дисульфидные мостики. Если бы инсулин состоял только из одной полипептидной цепи, тестирование размера белка до и после химической обработки дало бы одинаковый результат.
Аминокислоты в белках несут электрические заряды, поэтому белок или фрагменты белка могут двигаться в электромагнитном поле разной степени силы.Этот метод называется электрофорезом (рис. 6). Это было в новинку для Сангера, но дало ему очень четкие результаты. В то время как до обработки дисульфидным мостиком инсулин вел себя одним определенным образом при электрофорезе, после обработки электрофорез давал два разных результата, оба отличающиеся от результата до обработки. Это означало, что инсулин был разделен на две части, каждая с немного разным размером. Другими словами, инсулин состоял из двух пептидных цепей, и теперь задача состояла в том, чтобы найти аминокислотную последовательность каждой из них.
Рис. 6 : Современный пример гель-электрофореза. В лабораторных условиях для разделения молекул по размеру используется электрический ток. image © Jean-Etienne Poirrier
Точно так же, как большие фрагменты белка могут перемещаться определенным образом с помощью электрофореза, так и более мелкие фрагменты, в том числе когда белок фрагментирован на части, состоящие из 10-15 аминокислот каждый.Он произвел фрагментацию, обработав каждую цепь ферментом под названием трипсин, который разрезает только некоторые аминокислоты (лизин и аргинин). Впоследствии он мог использовать другие ферменты для большей фрагментации каждого фрагмента, вплоть до отдельных аминокислот. Каждый фрагмент имеет свой рисунок при электрофорезе.
С помощью другого метода, называемого хроматографией (рис. 7), Сэнгер мог идентифицировать фрагменты, которые были связаны с определенным химическим агентом, который он разработал, известным как динитрофторбензол (DNFB), который может химически реагировать с аминогруппами, не являющимися частью пептидной связи . После выполнения первой фрагментации с использованием трипсина, но перед дальнейшей фрагментацией каждой части на отдельные аминокислоты, он добавил DNFB, который изменил любую аминокислоту на амино-конце фрагмента (также называемую N-концевой аминокислотой). Из-за этого, когда он затем разбил фрагмент на отдельные аминокислоты, аминокислота, которая была на N-конце, осталась связанной с DNFB. Он мог идентифицировать эту связанную с DNFB аминокислоту в хроматографии, сравнивая хронографический сигнал разорванной цепи с 20 «стандартами» — образцами соединений, состоящих из DNFB, связанного с одной из 20 аминокислот, каждая из которых давала отчетливый хроматографический образец. .
После выполнения первой фрагментации с использованием трипсина, но перед дальнейшей фрагментацией каждой части на отдельные аминокислоты, он добавил DNFB, который изменил любую аминокислоту на амино-конце фрагмента (также называемую N-концевой аминокислотой). Из-за этого, когда он затем разбил фрагмент на отдельные аминокислоты, аминокислота, которая была на N-конце, осталась связанной с DNFB. Он мог идентифицировать эту связанную с DNFB аминокислоту в хроматографии, сравнивая хронографический сигнал разорванной цепи с 20 «стандартами» — образцами соединений, состоящих из DNFB, связанного с одной из 20 аминокислот, каждая из которых давала отчетливый хроматографический образец. .
Рис. 7 : Страница из записной книжки Фредерика Сэнгера, подробно описывающая работу с инсулином для коров и свиней. Справа — одна из его бумажных хроматограмм. image © Frederick Sanger Papers, SABIO / P / 1/13, Wellcome Library
Если бы аминокислота была изменена с помощью DNFB, это была бы аминокислота на амино-конце фрагмента белковой цепи.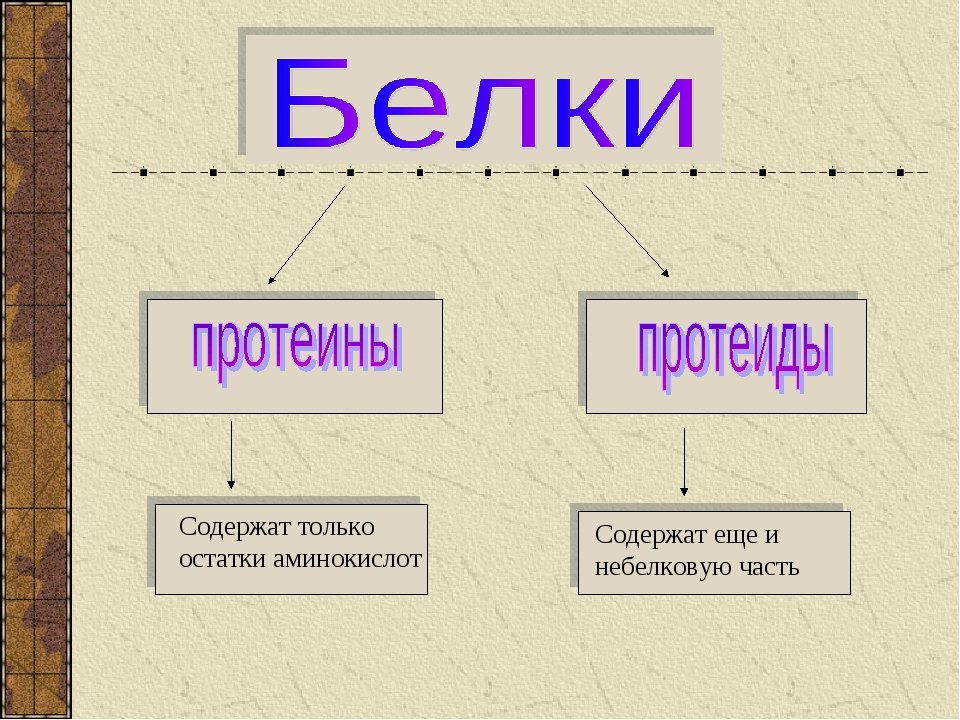 Зная идентичность аминокислоты на N-конце фрагмента, он мог использовать фермент, который разрезал бы карбоксильный конец этой известной аминокислоты, тем самым получая фрагмент, содержащий следующую аминокислоту в качестве N-концевой аминокислоты. .На этом измененном фрагменте он мог повторить процедуру связывания DNFB и хроматографию и таким образом узнать идентичность этой второй аминокислоты фрагмента.
Зная идентичность аминокислоты на N-конце фрагмента, он мог использовать фермент, который разрезал бы карбоксильный конец этой известной аминокислоты, тем самым получая фрагмент, содержащий следующую аминокислоту в качестве N-концевой аминокислоты. .На этом измененном фрагменте он мог повторить процедуру связывания DNFB и хроматографию и таким образом узнать идентичность этой второй аминокислоты фрагмента.
Он повторил методику для каждого фрагмента, получив, таким образом, аминокислотную последовательность всех из них. Затем он повторил всю процедуру, используя другой фермент, а не трипсин, чтобы разбить большую цепь на фрагменты из 10-15 аминокислот, а затем снова используя другой фермент.Он использовал четыре разных фермента, каждый из которых работал, разрезая рядом с определенными аминокислотами, а не с другими, и это позволяло только одну возможность для того, чтобы порядок фрагментов был связан вместе в исходной цепи.
Это был долгий и утомительный процесс, но у Сэнгера была аминокислотная последовательность обеих цепей в 1952 году.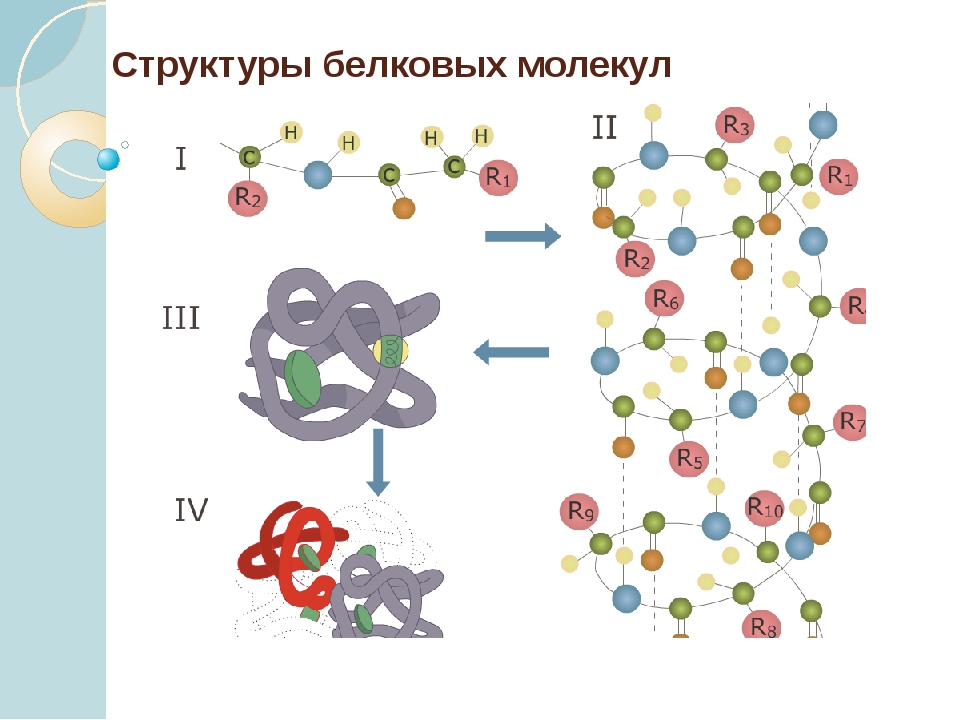 Еще через три года подобной химической тактики он и несколько коллег продемонстрировали, что для инсулиновых цепей A и B, чтобы они работали вместе, как физиологически функциональный инсулин, они должны были быть связаны тремя дисульфидными мостиками в трех различных точках (рис. 8).
Еще через три года подобной химической тактики он и несколько коллег продемонстрировали, что для инсулиновых цепей A и B, чтобы они работали вместе, как физиологически функциональный инсулин, они должны были быть связаны тремя дисульфидными мостиками в трех различных точках (рис. 8).
Рисунок 8 : Метод Ф. Сенгера анализа концевых групп пептидов. Все начинается с использования его реагента, DNFB, для реакции с N-концевой аминокислотой. При этом аминокислота остается связанной с DNFB ( A ). Затем посредством гидролиза ( B ) он смог идентифицировать аминокислоту с помощью хроматографии.
Инсулин считается малым для белка, потому что вместе его две цепи содержат всего 51 аминокислоту, но открытие Сенгера применимо к белкам в целом.Маленькие или большие белки были построены из определенных аминокислотных последовательностей; изменение последовательности сделало бы его другим белком. Открытие, которое принесло Сангеру первую Нобелевскую премию по химии в 1958 году. Позже он получил вторую Нобелевскую премию по химии за разработку аналогичного подхода к секвенированию ДНК, что поместило его в очень короткий список людей, получивших Нобелевскую премию. Приз более чем один раз.
Открытие, которое принесло Сангеру первую Нобелевскую премию по химии в 1958 году. Позже он получил вторую Нобелевскую премию по химии за разработку аналогичного подхода к секвенированию ДНК, что поместило его в очень короткий список людей, получивших Нобелевскую премию. Приз более чем один раз.
Контрольная точка понимания
Сангер выбрал инсулин для своего исследования по аминокислотному секвенированию, потому что
Аминокислотные последовательности влияют на химические свойства белка
Открытие Сэнгером инсулина показало не только то, как белки определяют химические структуры, но и почему разные белки имеют разные функции.Подобно тому, как разные буквы алфавита имеют разное звучание, различные цепи R придают двадцати аминокислотам разные химические свойства. Таким образом, соединение аминокислот вместе в различных комбинациях приводит к белкам с чрезвычайно разнообразными свойствами и формами.
Исследования Сэнгера по инсулину послужили трамплином для работы других химиков-протеинов в 1950-х и 60-х годах, посвященных взаимосвязи структуры и функции. Пропуская рентгеновские лучи через различные белки, исследователи получали изображения их трехмерных структур.Изучая изображения и решая вопросы, связанные с физикой химических связей, биохимики середины 20 века узнали, что аминокислотная последовательность представляет структуру белка только на одном уровне. Они начали называть последовательность первичной структурой, поскольку она заставляет белковую цепь скручиваться и изгибаться таким образом, что придает белку более сложную форму.
Некоторые аминокислоты, например, позволяют полипептидной цепи изгибаться, в то время как другие аминокислоты удерживают цепь более жесткой (рис. 9).Некоторые цепи R очень гидрофильны; им нравится находиться в воде, и поэтому аминокислота становится водорастворимой. Другие цепи R гидрофобны; они не смешиваются с водой. Часто наличие гидрофобной области или «кармана» внутри белка может помочь белку выполнять свою конкретную работу, например захватывать гидрофобный субстрат для его химического изменения.
| Первичная структура | Вторичная структура |
| Третичная структура | Четвертичная структура |
| Рис. 9 : Различные белковые структуры. | |
В зависимости от цепей R аминокислоты также могут различаться по кислотности и щелочности. Когда окружающая среда нейтральна (pH 7), аминокислоты аспартат и глутамат действуют как кислоты, тогда как аргинин и лизин действуют как основания, и это тоже имеет большое значение для свойств белка.
Высшие порядки белковой структуры
За исключением очень коротких цепей (настолько коротких, что их обычно даже не называют белками), полипептиды изгибаются и скручиваются в сложные формы почти сразу после их построения, что приводит к вторичной и третичной структуре белка.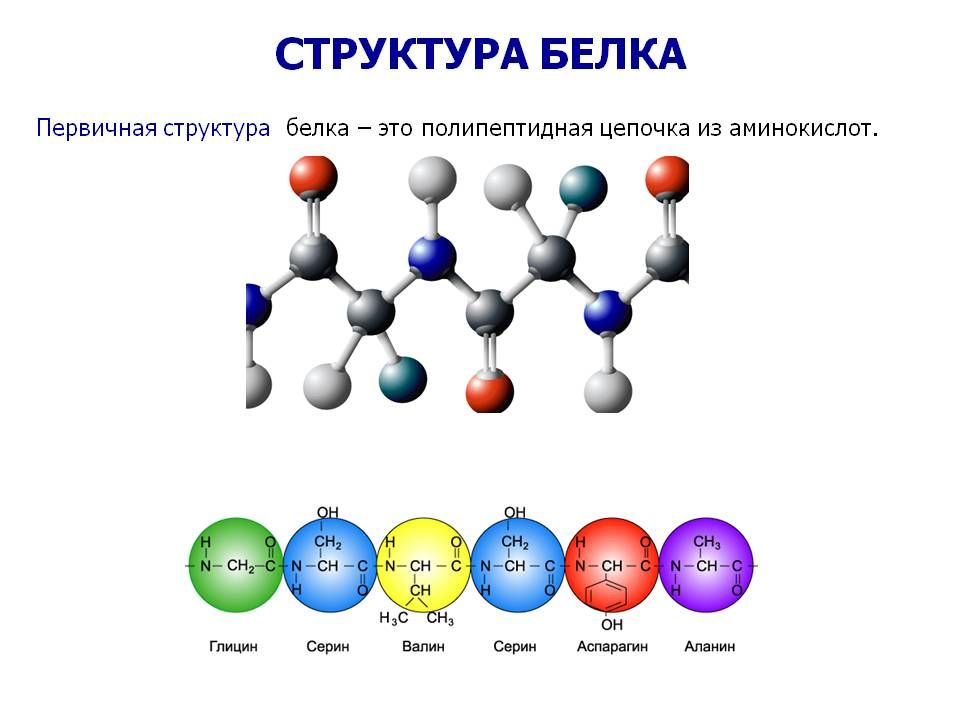
Наиболее распространенной вторичной структурой является альфа-спираль (рис. 9). Думайте об этом как о винтовой лестнице. Каждый виток спирали состоит из 3,6 аминокислот; другими словами, четыре аминокислоты составляют более одного витка. Обычно альфа-спираль содержит около 10 аминокислот и, следовательно, три витка, но они также могут быть короче или длиннее этого.Что касается их функции, то альфа-спираль может придавать форму, а также упругую гибкость следующему уровню структуры белка, третичной структуре. Следовательно, они присутствуют во многих различных белках, даже в таких небольших, как инсулин.
Другая распространенная вторичная структура называется бета-слоем, которая образуется, когда водородные связи стягивают различные несмежные сегменты или «бета-нити» полипептидной цепи, так что первичная структура многократно складывается сама по себе (см. Рисунок 9).В результате образуется область в форме ленты, которая, как спираль, имеет тенденцию укреплять и укреплять белок.
Рисунок 9).В результате образуется область в форме ленты, которая, как спираль, имеет тенденцию укреплять и укреплять белок.
Большие белки обычно содержат как альфа-спирали, так и бета-листы. Небольшой белок инсулин помогает регулировать перемещение глюкозы из крови в клетки, контролируя активность другого белка, фермента гексокиназы. Однако, в отличие от инсулина, гексокиназа огромна. Гексокиназа, состоящая из более чем 900 аминокислот, представляет собой хорошее сочетание альфа-спиралей и бета-листов.С другой стороны, гемоглобин почти полностью альфа-спиральный, а антитела почти полностью состоят из бета-листов.
Присутствие альфа-спиралей и бета-листов, а также взаимодействия между различными аминокислотами, не прилегающими друг к другу в цепи, заставляют белок еще больше складываться и скручиваться, но уникальным и нерегулярным образом. Это третичная структура, которая стабилизируется не только альфа-спиралями и бета-слоями внутри нее, но часто также дисульфидными (S-S) мостиками между цистеинами. Объясняя структуру инсулина, Сэнджер обнаружил, что один такой мостик S-S вносит вклад в третичную структуру, соединяя два цистеина, которые оба находятся в цепи А, но не находятся рядом друг с другом в первичной аминокислотной последовательности. Он также обнаружил два других моста S-S, соединяющих цепь A и цепь B.
Объясняя структуру инсулина, Сэнджер обнаружил, что один такой мостик S-S вносит вклад в третичную структуру, соединяя два цистеина, которые оба находятся в цепи А, но не находятся рядом друг с другом в первичной аминокислотной последовательности. Он также обнаружил два других моста S-S, соединяющих цепь A и цепь B.
С годами исследователи обнаружили, что большие белки обычно содержат множество дисульфидных мостиков. Лизоцим, например, фермент, который иммунные клетки используют для уничтожения бактерий, имеет четыре дисульфидных мостика, а количество антител зависит от подтипа антител.В начале 1970-х годов аргентинский исследователь Сезар Мильштейн помог определить, что дисульфидные мостики в антителах расположены по определенной схеме, которая позволяет каждому антителу принимать уникальную форму антитела (рис. 10). (См. Наш профиль Сезар Мильштейн: Клетки гибридомы для создания моноклональных антител для получения дополнительной информации об исследованиях Мильштейна.) Однако дисульфидные мостики не универсальны. Гемоглобин и связанный с ним белок, например миоглобин, известны тем, что вообще не имеют S-S-связей.
Гемоглобин и связанный с ним белок, например миоглобин, известны тем, что вообще не имеют S-S-связей.
Рисунок 10 : Схематическая диаграмма антитела и антигенов.
Последний уровень структуры — это четвертичная структура (см. Рис. 9), которая существует, когда две или более полипептидных цепей соединяются. Примером может служить гемоглобин, состоящий из четырех цепей. В дополнение к простому увеличению размера молекулы, четыре цепи гемоглобина фактически влияют друг на друга, вызывая эффект, который помогает молекуле захватывать кислород, когда кровь циркулирует через легкие, а затем отдает кислород тканям глубоко в теле, где он необходим.
Не все белки имеют четвертичную структуру, поскольку многие белки состоят только из одной цепи. Хотя Сэнджер обнаружил, что инсулин состоит из двух цепей, эти две цепи и соединяющие их дисульфидные связи на самом деле являются частью третичной структуры, а не четвертичной.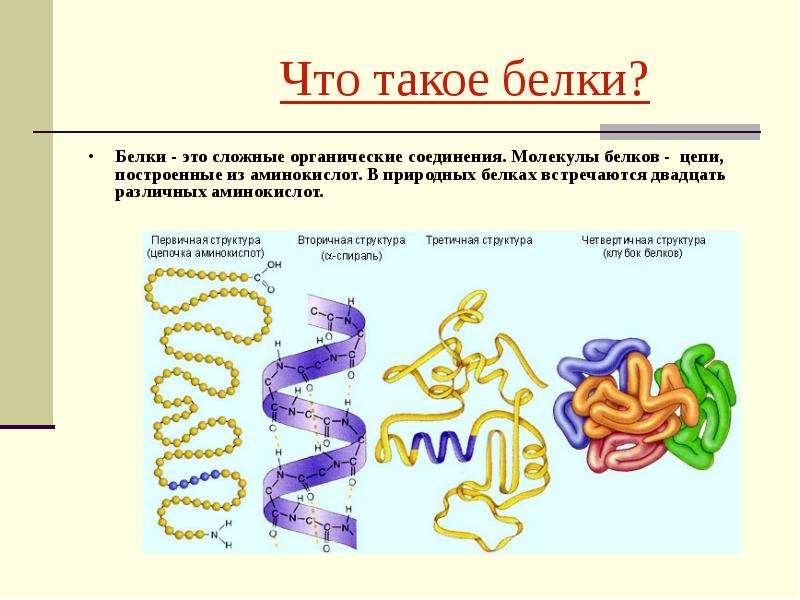 Причина в том, что инсулин производится из более крупного предшественника белка, называемого проинсулином, в котором цепи A и B связаны третьей последовательностью, цепью C. Вместо того, чтобы быть полученным из отдельных цепей, проинсулин синтезируется в клетках как одна цепь.Затем цепь изгибается сама по себе, и в этом процессе помогают три дисульфидные связи, но затем цепь C обрывается (рис. 11).
Причина в том, что инсулин производится из более крупного предшественника белка, называемого проинсулином, в котором цепи A и B связаны третьей последовательностью, цепью C. Вместо того, чтобы быть полученным из отдельных цепей, проинсулин синтезируется в клетках как одна цепь.Затем цепь изгибается сама по себе, и в этом процессе помогают три дисульфидные связи, но затем цепь C обрывается (рис. 11).
Фиг.11. : Структура проинсулина, показывающая С-пептид и А- и В-цепи инсулина. изображение © Zapyon
Контрольная точка понимания
Общие вторичные белковые структуры — это
Белковые структуры в медицинских исследованиях
Как и во времена Фредерика Сенгера, сегодня исследования структуры белков имеют большое значение в клинической медицине.Что касается вторичной структуры, например, исследователи развивают способность обнаруживать и контролировать определенные заболевания на их ранних стадиях. Хотя бета-листы являются нормальным явлением для многих белков, в некоторых случаях они являются признаком болезни. Ярким примером является вещество, называемое бета-амилоидом, которое образуется, когда нормальный белок в клетках организма развивает бета-слои, которых у него не должно быть. При болезни Альцгеймера бета-амилоид накапливается в клетках мозга, что приводит к слабоумию и ухудшению физического состояния.Это спорно, но ученые подозревают, что бета-амилоид накапливается также в стареющем мозге при отсутствии болезни Альцгеймера.
Хотя бета-листы являются нормальным явлением для многих белков, в некоторых случаях они являются признаком болезни. Ярким примером является вещество, называемое бета-амилоидом, которое образуется, когда нормальный белок в клетках организма развивает бета-слои, которых у него не должно быть. При болезни Альцгеймера бета-амилоид накапливается в клетках мозга, что приводит к слабоумию и ухудшению физического состояния.Это спорно, но ученые подозревают, что бета-амилоид накапливается также в стареющем мозге при отсутствии болезни Альцгеймера.
Недавно ученые Вашингтонского университета научились синтезировать альтернативную вторичную структуру белков, называемую альфа-листом. Он похож на более распространенный бета-лист, за исключением того, что он перевернут геометрически, как зеркальное отображение. По сути, в противоположность бета-листу, альфа-листы могут действовать как детекторы для бета-листов, подобно тому, как можно использовать правую руку, чтобы «обнаружить» присутствие левой руки в темноте. Исследователи ожидают, что не только белки, синтезированные для содержания альфа-листов, могут быть использованы для раннего обнаружения амилоидных заболеваний, но альфа-листы также могут быть использованы для лечения в виде лекарств, состоящих из белков с альфа-листами. При контакте с патологическим бета-амилоидом такие препараты альфа-листа должны разрушать водородные связи аномальных бета-слоев, тем самым заставляя бета-амилоид вернуться в нормальный белок. Это может быть чрезвычайно полезно для людей, страдающих дегенеративными заболеваниями, такими как болезнь Альцгеймера, и, возможно, это также может открыть новую эру вмешательства против более мягкого, но, тем не менее, разрушительного процесса, который традиционно игнорировался неизбежным для тех, кто достиг пожилого возраста.
Исследователи ожидают, что не только белки, синтезированные для содержания альфа-листов, могут быть использованы для раннего обнаружения амилоидных заболеваний, но альфа-листы также могут быть использованы для лечения в виде лекарств, состоящих из белков с альфа-листами. При контакте с патологическим бета-амилоидом такие препараты альфа-листа должны разрушать водородные связи аномальных бета-слоев, тем самым заставляя бета-амилоид вернуться в нормальный белок. Это может быть чрезвычайно полезно для людей, страдающих дегенеративными заболеваниями, такими как болезнь Альцгеймера, и, возможно, это также может открыть новую эру вмешательства против более мягкого, но, тем не менее, разрушительного процесса, который традиционно игнорировался неизбежным для тех, кто достиг пожилого возраста.
Сводка
Этот модуль исследует, как белки представляют собой полимеры, состоящие из строительных блоков, называемых аминокислотами. Используя исторические исследования инсулина Фредерика Сэнгера в качестве отправной точки, объясняются сложные структуры белков, обусловленные молекулярными связями, такими как дисульфидный мостик и пептидная связь.
Ключевые понятия
-
Белки являются жизненно важными компонентами почти любого биологического процесса.
-
Белки — это полимеры, состоящие из строительных блоков, называемых аминокислотами, из которых жизнь на Земле использует только двадцать.
-
Молекулярные связи определяют структуру аминокислот и белков. Пептидные связи связывают аминокислоты в цепочку; дисульфидные мостиковые связи удерживают белки вместе.
-
Используя такие методы, как электрофорез и хроматография, Фредерик Сэнджер обнаружил, что белки состоят из определенных аминокислотных последовательностей и что изменение последовательности сделает их другим белком.
-
Белки могут иметь четыре типа структур: (1) первичная, последовательность аминокислот, (2) вторичная, водородные связи между цепями аминокислот, образующих бета-листы или альфа-спирали, (3) третичная, трехкомпонентная размерная, скрученная структура, основанная на связывающих взаимодействиях между аминокислотными цепями, и (4) четвертичная, сложная структура, состоящая из множества свернутых субъединиц.
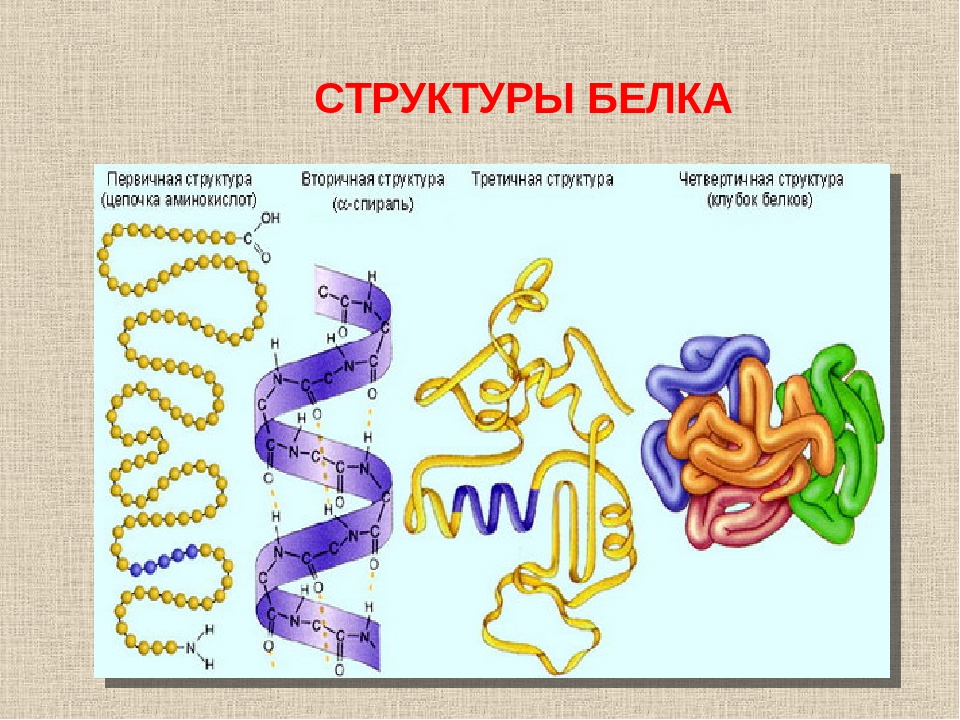
Дэвид Вармфлэш, доктор медицины, Натан Х. Ленц, доктор философии «Биологические белки» Visionlearning Vol.БИО-4 (9), 2016.
Что такое белок? Биолог объясняет
Примечание редактора: Натан Альгрен — доцент кафедры биологии Университета Кларка. В этом интервью он подробно объясняет, что такое белки, как они производятся, а также широкий спектр функций, которые они выполняют в организме человека.
Натан Альгрен объясняет, что делают белки в нашем организме.
Что такое белок?
Белок — это основная структура, которая встречается во всем живом.Это молекула. И главное в белке — это то, что он состоит из более мелких компонентов, называемых аминокислотами. Мне нравится думать о них как о бусинах разного цвета. Каждая бусинка представляет собой аминокислоту, представляющую собой более мелкие молекулы, содержащие атомы углерода, кислорода, водорода и иногда атомы серы. Итак, белок — это, по сути, цепочка, состоящая из этих маленьких отдельных аминокислот. Есть 22 разных аминокислоты, которые можно комбинировать по-разному.
Итак, белок — это, по сути, цепочка, состоящая из этих маленьких отдельных аминокислот. Есть 22 разных аминокислоты, которые можно комбинировать по-разному.
Белок обычно не существует в виде цепочки, но фактически сворачивается в определенную форму в зависимости от порядка и того, как эти разные аминокислоты взаимодействуют друг с другом.Эта форма влияет на то, что белок делает в нашем организме.
Откуда берутся аминокислоты?
Аминокислоты в нашем организме поступают из пищи, которую мы едим. Мы также производим их в нашем теле. Например, другие животные производят белки, а мы их едим. Наш организм берет эту цепочку и разбивает ее на отдельные аминокислоты. Затем он может преобразовать их в любой белок, который нам нужен.
После того, как белки расщепляются на аминокислоты в пищеварительной системе, они попадают в наши клетки и как бы плавают внутри клетки, как эти маленькие отдельные шарики в нашей аналогии.А внутри клетки ваше тело в основном связывает их вместе, чтобы вырабатывать белки, необходимые вашему организму.
Мы можем вырабатывать около половины необходимых нам аминокислот самостоятельно, а остальные мы должны получать из пищи.
Что делают белки в нашем организме?
Ученые точно не уверены, но большинство из них согласны с тем, что в нашем организме около 20 000 различных белков. Некоторые исследования предполагают, что их может быть даже больше. Они выполняют множество функций — от некоторых метаболических преобразований до удержания клеток вместе и заставляя ваши мышцы работать.
Их функции делятся на несколько широких категорий. Один структурный. Ваше тело состоит из множества различных структур — представьте себе струнные структуры, шарики, якоря и т. Д. Они образуют вещество, которое скрепляет ваше тело. Коллаген — это белок, который придает структуру вашей коже, костям и даже зубам. Интегрин — это белок, который обеспечивает гибкие связи между вашими клетками. Ваши волосы и ногти состоят из белка, называемого кератином.
Еще одна важная роль, которую они берут на себя, — это биохимия — то, как ваше тело выполняет определенные реакции в вашей клетке, такие как расщепление жиров или аминокислот. Помните, я сказал, что наше тело расщепляет белок из пищи, которую мы едим? Даже эту функцию выполняют такие белки, как пепсин. Другой пример — гемоглобин — белок, переносящий кислород в крови. Итак, они проводят эти особые химические реакции внутри вас.
Помните, я сказал, что наше тело расщепляет белок из пищи, которую мы едим? Даже эту функцию выполняют такие белки, как пепсин. Другой пример — гемоглобин — белок, переносящий кислород в крови. Итак, они проводят эти особые химические реакции внутри вас.
Белки также могут обрабатывать сигналы и информацию, например белки циркадных часов, которые отслеживают время в наших клетках, но это несколько основных категорий функций, которые белки выполняют в клетке.
Почему белок часто ассоциируется с мышцами и мясом?
Разные продукты имеют разное содержание белка. В таких растениях, как пшеница и рис, много углеводов, но они менее богаты белком. Но в мясе вообще больше белка. Для создания мышц вашего тела требуется много белка. Вот почему белок часто ассоциируется с употреблением мяса и наращиванием мышц, но на самом деле белки участвуют в гораздо большем, чем это.
[ Получайте удовольствие от разговора каждые выходные. Подпишитесь на нашу еженедельную рассылку. ]
]
3.4 Белки — Биология для курсов AP®
Цели обучения
В этом разделе вы исследуете следующие вопросы:
- Каковы функции белков в клетках и тканях?
- Какая связь между аминокислотами и белками?
- Каковы четыре уровня белковой организации?
- Какая связь между формой и функцией белка?
Соединение для AP
® Курсы
Белки представляют собой длинные цепи различных последовательностей из 20 аминокислот, каждая из которых содержит аминогруппу (-NH 2 ), карбоксильную группу (-COOH) и вариабельную группу.(Подумайте, сколько белковых «слов» можно составить из 20 «букв» аминокислот). Каждая аминокислота связана со своим соседом пептидной связью, образованной в результате реакции дегидратации. Длинная цепь аминокислот известна как полипептид. Белки выполняют в клетках множество функций. Они действуют как ферменты, которые катализируют химические реакции, обеспечивают структурную поддержку, регулируют прохождение веществ через клеточную мембрану, защищают от болезней и координируют сигнальные пути клетки. Структура белка организована на четырех уровнях: первичном, вторичном, третичном и четвертичном.Первичная структура — это уникальная последовательность аминокислот. Изменение только одной аминокислоты может изменить структуру и функцию белка. Например, серповидно-клеточная анемия возникает в результате замены одной аминокислоты в молекуле гемоглобина, состоящей из 574 аминокислот. Вторичная структура состоит из локального сворачивания полипептида за счет образования водородной связи; приводящие к конформациям α-спирали и β-складчатого листа. В третичной структуре различные взаимодействия, например водородные связи, ионные связи, дисульфидные связи и гидрофобные взаимодействия между группами R, способствуют укладке полипептида в различные трехмерные конфигурации.Большинство ферментов имеют третичную конфигурацию. Если белок денатурируется, теряет свою трехмерную форму, он может больше не функционировать. Условия окружающей среды, такие как температура и pH, могут денатурировать белки. Некоторые белки, такие как гемоглобин, образованы из нескольких полипептидов, и взаимодействия этих субъединиц образуют четвертичную структуру белков.
Структура белка организована на четырех уровнях: первичном, вторичном, третичном и четвертичном.Первичная структура — это уникальная последовательность аминокислот. Изменение только одной аминокислоты может изменить структуру и функцию белка. Например, серповидно-клеточная анемия возникает в результате замены одной аминокислоты в молекуле гемоглобина, состоящей из 574 аминокислот. Вторичная структура состоит из локального сворачивания полипептида за счет образования водородной связи; приводящие к конформациям α-спирали и β-складчатого листа. В третичной структуре различные взаимодействия, например водородные связи, ионные связи, дисульфидные связи и гидрофобные взаимодействия между группами R, способствуют укладке полипептида в различные трехмерные конфигурации.Большинство ферментов имеют третичную конфигурацию. Если белок денатурируется, теряет свою трехмерную форму, он может больше не функционировать. Условия окружающей среды, такие как температура и pH, могут денатурировать белки. Некоторые белки, такие как гемоглобин, образованы из нескольких полипептидов, и взаимодействия этих субъединиц образуют четвертичную структуру белков.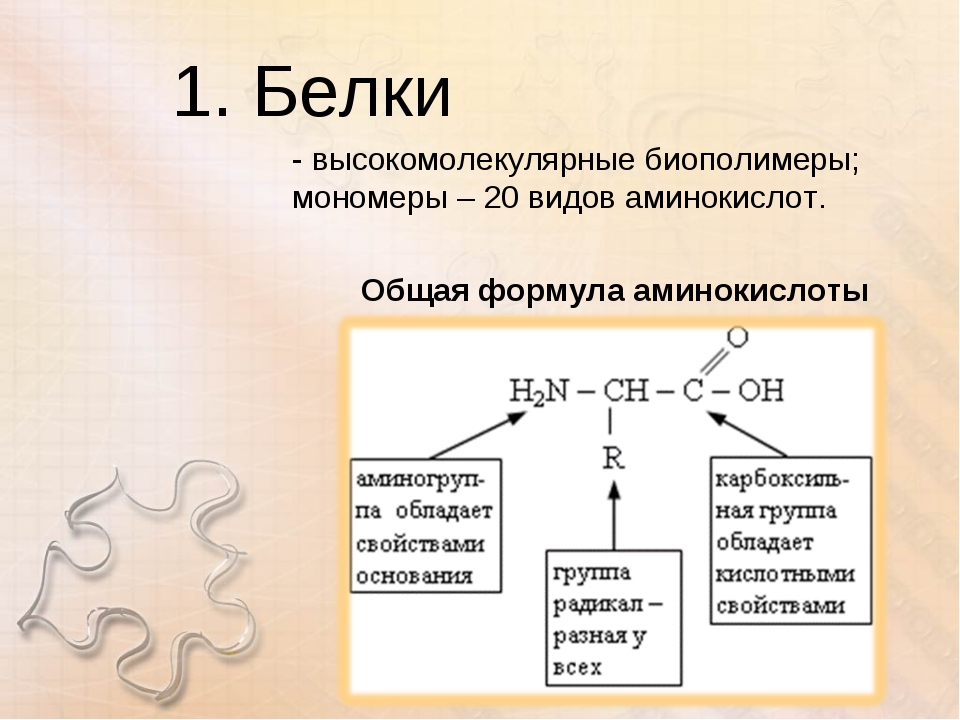
Представленная информация и примеры, выделенные в разделе, вспомогательные концепции и цели обучения, изложенные в Большой идее 4 Структуры учебной программы по биологии AP ® .Цели обучения, перечисленные в структуре учебной программы, обеспечивают прозрачную основу для курса биологии AP ® , лабораторного опыта на основе запросов, учебных мероприятий и экзаменационных вопросов AP ® . Цель обучения объединяет требуемый контент с одной или несколькими из семи научных практик.
| Большая идея 4 | Биологические системы взаимодействуют, и эти системы и их взаимодействия обладают сложными свойствами. |
| Постоянное понимание 4.A | Взаимодействия внутри биологических систем приводят к появлению сложных свойств. |
| Основные знания |
4. A.1 A.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 7,1 Учащийся может связывать явления и модели в пространственных и временных масштабах. |
| Цель обучения | 4,1 Учащийся может объяснить связь между последовательностью и подкомпонентами биологического полимера и его свойствами. |
| Основные знания |
4.A.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 1.3 Студент может уточнить представления и модели природных или антропогенных явлений и систем в предметной области. |
| Цель обучения | 4,2 Учащийся может уточнить представления и модели, чтобы объяснить, как подкомпоненты биологического полимера и их последовательность определяют свойства этого полимера. 
|
| Основные знания |
4.A.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 6,1 Студент может обосновать свои претензии доказательствами. |
| Научная практика | 6,4 Студент может делать утверждения и предсказания о природных явлениях на основе научных теорий и моделей. |
| Цель обучения | 4,3 Учащийся может использовать модели для прогнозирования и обоснования того, что изменения в подкомпонентах биологического полимера влияют на функциональность молекул. |
Поддержка учителей
Двадцать аминокислот могут быть преобразованы в практически неограниченное количество различных белков. Последовательность аминокислот в конечном итоге определяет окончательную конфигурацию белковой цепи, придавая молекуле ее специфическую функцию.
Последовательность аминокислот в конечном итоге определяет окончательную конфигурацию белковой цепи, придавая молекуле ее специфическую функцию.
Поддержка учителей
Подчеркните, что белки выполняют в организме множество функций. Таблица 3.1 содержит несколько примеров этих функций. Обратите внимание, что не все ферменты работают в одинаковых условиях.Амилаза работает только в щелочной среде, например, в слюне, а пепсин действует в кислой среде желудка. Обсудите другие вещества, которые могут переноситься белками в жидкостях организма в дополнение к веществам, перечисленным в тексте для транспортировки. Белки также переносят нерастворимые липиды в организме и заряженные ионы, такие как кальций, магний и цинк. Обсудите еще один важный структурный белок, коллаген, который содержится во всем теле, в том числе в большинстве соединительных тканей. Подчеркните, что не все гормоны являются белками и что гормоны на основе стероидов обсуждались в предыдущем разделе.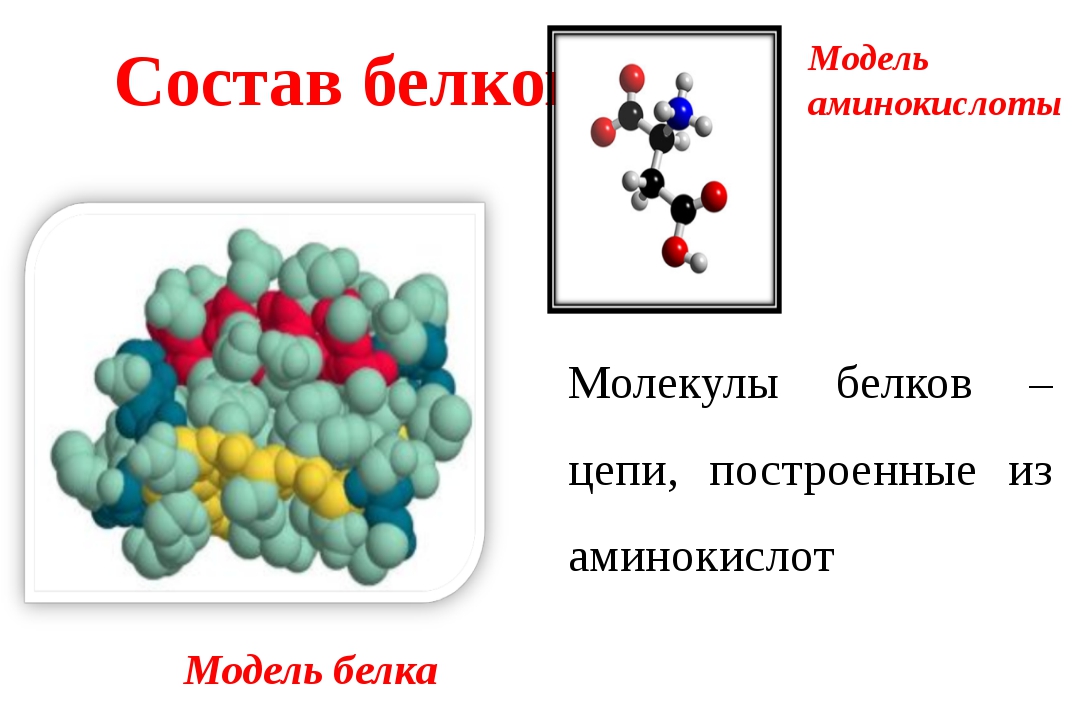
Аминогруппа аминокислоты теряет электрон и становится положительно заряженной. Карбоксильная группа легко получает электрон, становясь отрицательно заряженным. Это приводит к амфипатическим характеристикам аминокислот и обеспечивает растворимость соединений в воде. Присутствие обеих функциональных групп также позволяет дегидратационному синтезу объединять отдельные аминокислоты в пептидную цепь.
Структура белка объясняется так, как будто она состоит из трех-четырех дискретных этапов.В действительности структурные изменения, в результате которых образуется функциональный белок, происходят непрерывно. Поскольку первичная структура формируется из рибосом, полипептидная цепь претерпевает изменения, пока не будет достигнута окончательная конфигурация. Предложите учащимся представить себе нитку спагетти, готовящуюся в прозрачной посуде. Изначально прядь прямая (в этом примере не обращайте внимания на жесткость). Во время приготовления нить будет изгибаться, скручиваться и (опять же, в этом примере) складываться в неплотный шар, состоящий из нити макаронных изделий. Полученная прядь имеет особую форму. Спросите студентов, какие типы химических связей или сил могут влиять на структуру белка. Эти формы продиктованы положением аминокислот вдоль нити. Другие силы завершат складывание и поддержат конструкцию.
Полученная прядь имеет особую форму. Спросите студентов, какие типы химических связей или сил могут влиять на структуру белка. Эти формы продиктованы положением аминокислот вдоль нити. Другие силы завершат складывание и поддержат конструкцию.
Проблемные вопросы по научной практике содержат дополнительные тестовые вопросы для этого раздела, которые помогут вам подготовиться к экзамену AP. Эти вопросы касаются следующих стандартов:
[APLO 1.14] [APLO 2.12] [APLO 4.1] [APLO 4.3] [APLO 4.15] [APLO 4.22]
Типы и функции белков
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка в живой системе может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются.Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Их структуры, как и их функции, сильно различаются.Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Ферменты, которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или конъюгированные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях разложения, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами.Следует отметить, что все ферменты увеличивают скорость реакции и, следовательно, считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.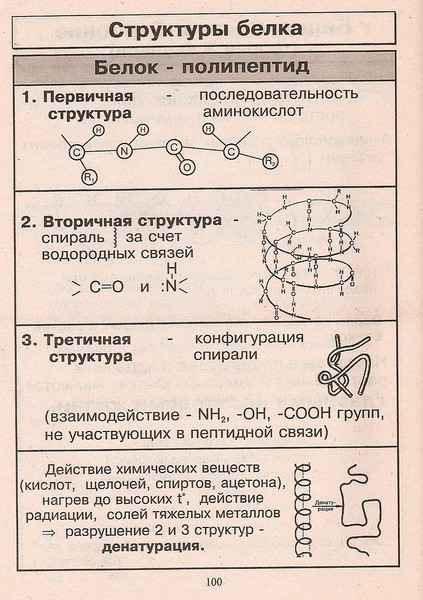
Гормоны — это химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.Основные типы и функции белков перечислены в таблице 3.1.
Типы и функции белков
| Тип | Примеры | Функции |
|---|---|---|
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи за счет катаболизма питательных веществ в мономерные единицы |
| Транспорт | Гемоглобин, альбумин в крови | вещества, содержащиеся в люмине, в крови тело |
| Структурная | Актин, тубулин, кератин | Создает различные структуры, такие как цитоскелет |
| Гормоны | Инсулин, тироксин | Координирует активность различных систем организма | Защитить организм от чужеродных патогенов |
| Сократимость | Актин, миозин | Эффект сокращения мышц |
| Хранение | Запасные белки бобовых, яичный белок (альбумин) | Обеспечить питание для раннего развития зародыша. саженец 9 0172 саженец 9 0172 |
Таблица 3.1
Белки имеют разную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин — это глобулярный белок, а коллаген, обнаруженный в нашей коже, — это волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается многими различными типами химических связей. Изменения температуры, pH и воздействие химикатов могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация.Все белки состоят из 20 наиболее распространенных аминокислот.
Аминокислоты
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и атом водорода. Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (Рисунок 3.24).
Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (Рисунок 3.24).
Рис. 3.24. Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (R-группа).
Название «аминокислота» происходит от того факта, что они содержат как аминогруппу, так и карбоксильную кислотную группу в своей основной структуре. Как уже упоминалось, в белках присутствует 20 общих аминокислот. Девять из них считаются незаменимыми аминокислотами для человека, потому что человеческий организм не может их производить, и они получают с пищей.Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. 3.25).
Визуальное соединение
Рис. 3.25. Обычно в белках содержится 20 общих аминокислот, каждая из которых имеет свою группу R (группа вариантов), которая определяет его химическую природу.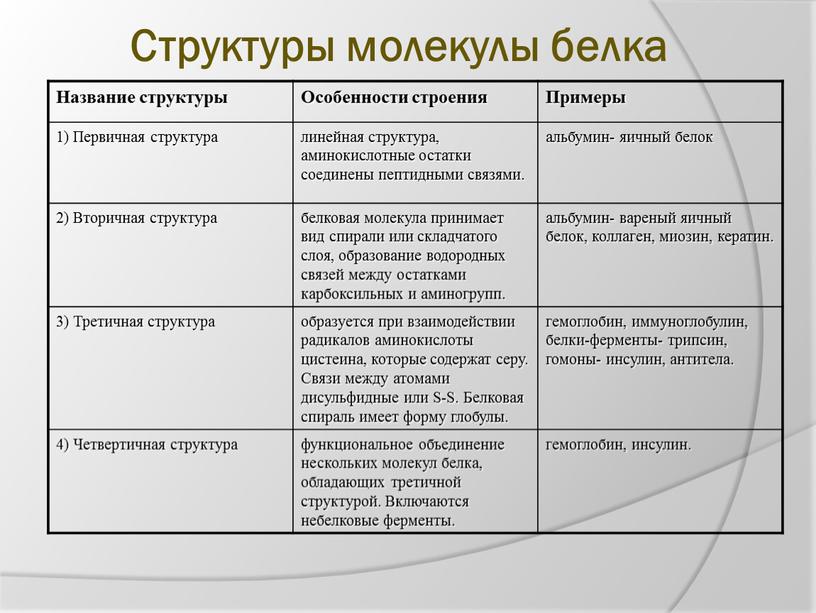
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри?
- Полярные и заряженные аминокислоты будут обнаружены на поверхности.Неполярные аминокислоты можно найти в интерьере.
- Полярные и заряженные аминокислоты будут найдены внутри. Неполярные аминокислоты будут обнаружены на поверхности.
- Неполярные и незаряженные белки могут быть найдены как на поверхности, так и внутри.
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R.Аминокислоты, такие как валин, метионин и аланин, неполярны или гидрофобны по природе, тогда как аминокислоты, такие как серин, треонин и цистеин, полярны и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры анимокислоты, поскольку его аминогруппа не отделена от боковой цепи (Рисунок 3.25).
Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры анимокислоты, поскольку его аминогруппа не отделена от боковой цепи (Рисунок 3.25).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением. Например, валин обозначается буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, а у людей они включают изолейцин, лейцин и цистеин. Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не производятся организмом; Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Полученная связь представляет собой пептидную связь (рис. 3.26).
Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Полученная связь представляет собой пептидную связь (рис. 3.26).
Рис. 3.26. Образование пептидной связи — это реакция синтеза дегидратации.Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом выделяется молекула воды.
Продукты, образованные такими связями, называются пептидами. По мере того, как к этой растущей цепи присоединяется больше аминокислот, полученная цепь называется полипептидом. Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец.Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению или фосфорилированию или могут потребовать добавления других химических групп.Только после этих модификаций белок становится полностью функциональным.
, и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению или фосфорилированию или могут потребовать добавления других химических групп.Только после этих модификаций белок становится полностью функциональным.
Ссылка на обучение
Просмотрите этапы синтеза белка в этом интерактивном руководстве.
Почему процесс синтеза белка так важен для жизни?
- Белок — предпочтительный источник энергии для организма для быстрого производства энергии.
- Белок хранится в печени и мышцах, обеспечивая энергию для использования в будущем.
- Белок необходим для образования тканей и состоит из гормонов и ферментов.
- Белки необходимы для усвоения всех жирорастворимых витаминов.
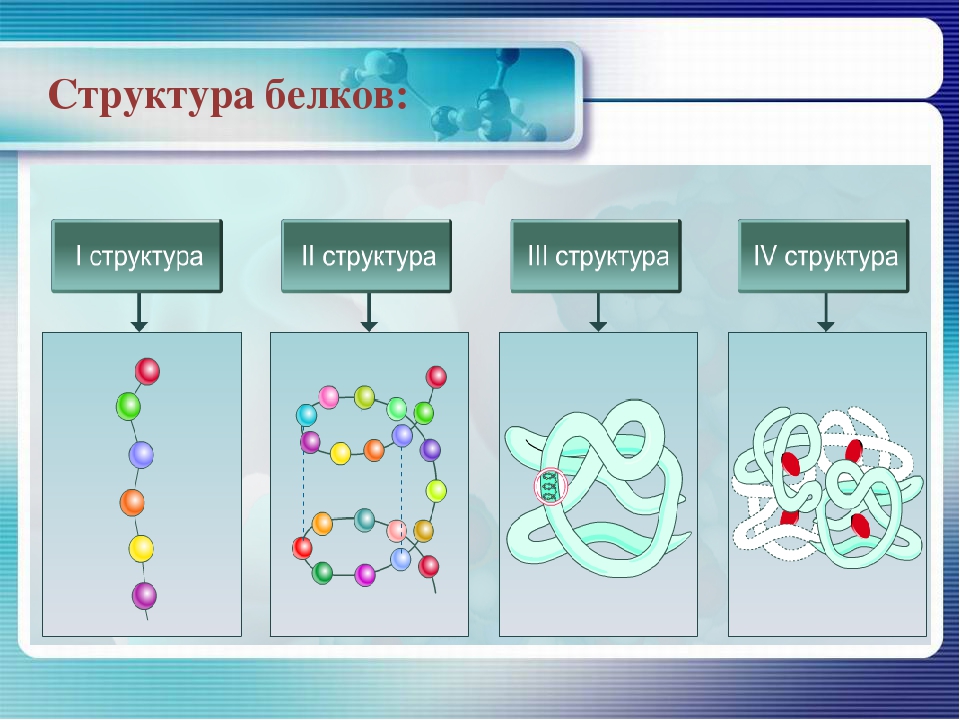
Evolution Connection
Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточной органелле, митохондрии. Этот белок имеет простетическую группу гема, а центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона. Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился.Секвенирование белков показало, что существует значительная гомология аминокислотных последовательностей цитохрома с среди различных видов; другими словами, эволюционное родство можно оценить путем измерения сходства или различий между последовательностями ДНК или белков различных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с из разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с.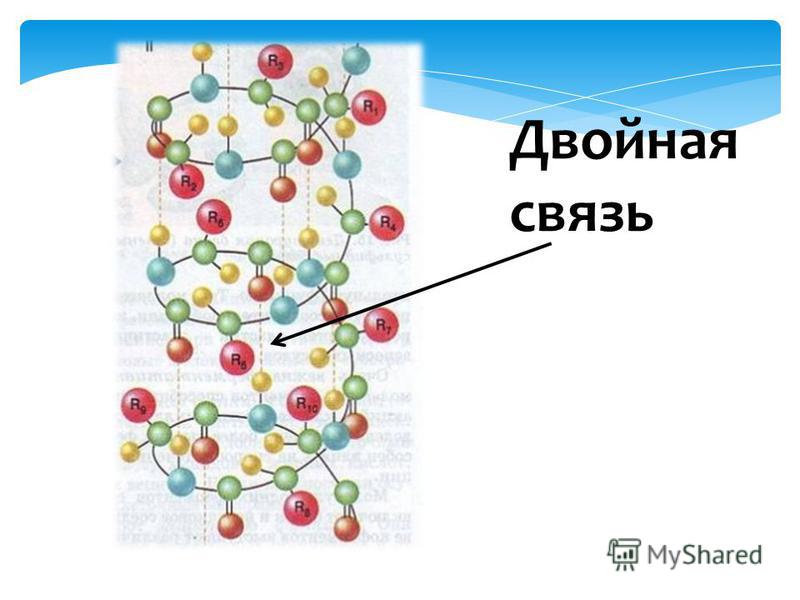 Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Белковая последовательность цитохрома с шимпанзе и человека идентична. Белковая последовательность цитохрома с макак-резусов отличается от последовательности человека на одну аминокислоту.Что предлагают эти сравнения?
- Обезьяны-резусы более близки к людям, чем шимпанзе.
- Шимпанзе более тесно связаны с макаками-резусами, чем с людьми.
- Люди родственны шимпанзе, но не связаны с макаками-резусами.
- Шимпанзе более тесно связаны с людьми, чем макаки-резусы.

Структура белка
Как обсуждалось ранее, форма белка имеет решающее значение для его функции.Например, фермент может связываться со специфическим субстратом в сайте, известном как активный сайт. Если этот активный сайт изменяется из-за локальных изменений или изменений в общей структуре белка, фермент может быть неспособен связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Уникальная последовательность аминокислот в полипептидной цепи — это ее первичная структура.Например, инсулин поджелудочной железы имеет две полипептидные цепи, А и В, и они связаны между собой дисульфидными связями. N-концевой аминокислотой A-цепи является глицин, а C-концевой аминокислотой — аспарагин (рис. 3.27). Последовательности аминокислот в цепях A и B уникальны для инсулина.
Рис. 3.27. Инсулин бычьей сыворотки — это белковый гормон, состоящий из двух пептидных цепей: A (длиной 21 аминокислота) и B (длиной 30 аминокислот). В каждой цепи первичная структура обозначена трехбуквенными сокращениями, которые представляют названия аминокислот в порядке их присутствия.Аминокислота цистеин (cys) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи A и B вместе, а третья помогает цепи A свернуться в правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности показаны разные размеры.
Уникальная последовательность каждого белка в конечном итоге определяется геном, кодирующим этот белок. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка.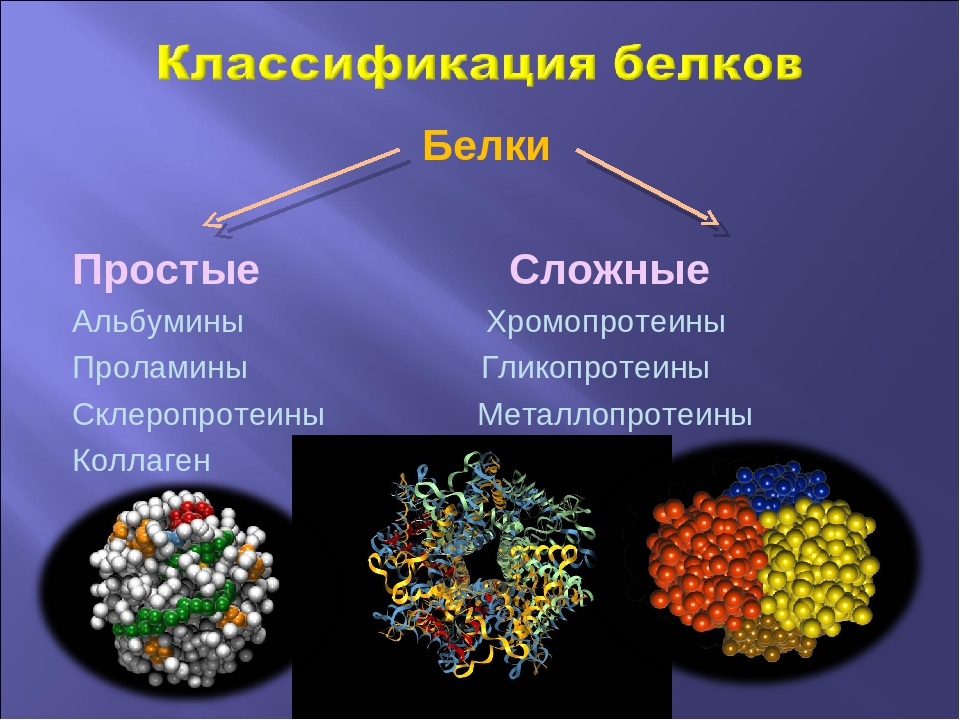 При серповидно-клеточной анемии цепь гемоглобина β (небольшая часть которой показана на рис. 3.28) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка. В частности, аминокислота глутаминовая кислота заменена валином в цепи β . Примечательно, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Таким образом, молекула содержит около 600 аминокислот.Структурное различие между нормальной молекулой гемоглобина и молекулой серповидноклеточных клеток — что резко снижает продолжительность жизни — состоит в одной из 600 аминокислот. Что еще более примечательно, так это то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, а мутация вызвано одним изменением основания (точечной мутацией), 1 из 1800 оснований.
При серповидно-клеточной анемии цепь гемоглобина β (небольшая часть которой показана на рис. 3.28) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка. В частности, аминокислота глутаминовая кислота заменена валином в цепи β . Примечательно, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Таким образом, молекула содержит около 600 аминокислот.Структурное различие между нормальной молекулой гемоглобина и молекулой серповидноклеточных клеток — что резко снижает продолжительность жизни — состоит в одной из 600 аминокислот. Что еще более примечательно, так это то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, а мутация вызвано одним изменением основания (точечной мутацией), 1 из 1800 оснований.
Рис. 3.28. Бета-цепь гемоглобина имеет длину 147 остатков, однако единственная аминокислотная замена приводит к серповидно-клеточной анемии.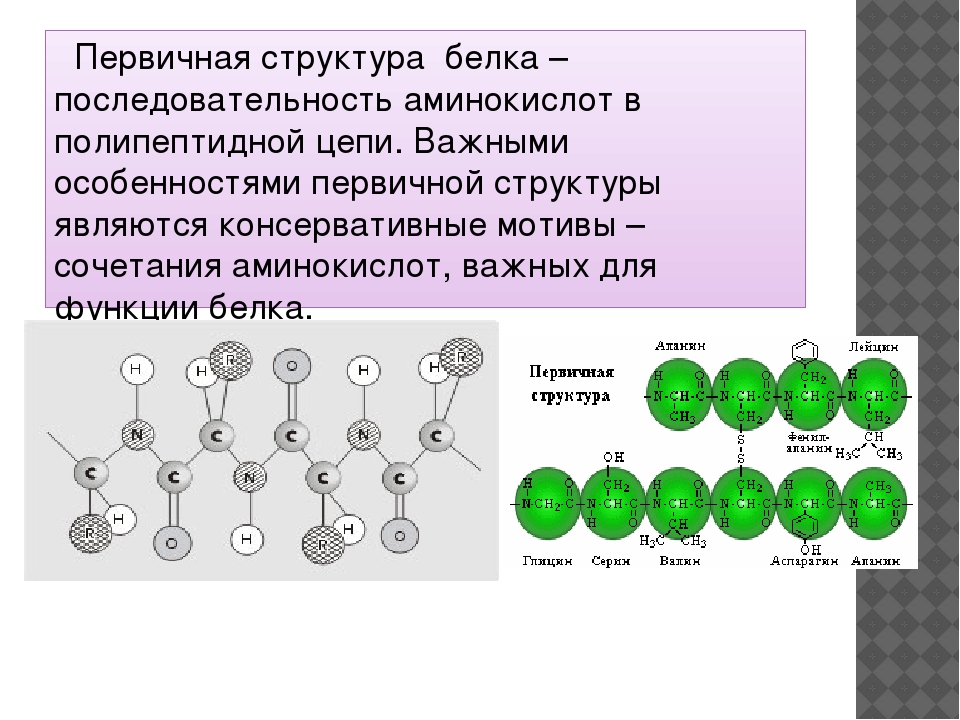 В нормальном гемоглобине аминокислота в седьмом положении — глутамат. В серповидно-клеточном гемоглобине этот глутамат заменен валином.
В нормальном гемоглобине аминокислота в седьмом положении — глутамат. В серповидно-клеточном гемоглобине этот глутамат заменен валином.
Из-за этого изменения одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые искажают двояковогнутые или дискообразные красные кровяные тельца и заставляют их принимать форму полумесяца или «серпа», что закупоривает кровеносные сосуды ( Рисунок 3.29). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у людей, страдающих этим заболеванием.
Рис. 3.29. В этом мазке крови, визуализированном при 535-кратном увеличении с помощью светлопольной микроскопии, серповидные клетки имеют форму полумесяца, тогда как нормальные клетки имеют форму диска. (кредит: модификация работы Эда Усмана; данные шкалы от Мэтта Рассела)
Вторичная структура
Локальное сворачивание полипептида в некоторых областях приводит к вторичной структуре белка. Наиболее распространенными являются α -спиральная и β -гофрированная листовые структуры (Рисунок 3.30). Обе структуры удерживаются вместе водородными связями. В структуре α -спираль водородные связи образуются между атомом кислорода в карбонильной группе в одной аминокислоте и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Наиболее распространенными являются α -спиральная и β -гофрированная листовые структуры (Рисунок 3.30). Обе структуры удерживаются вместе водородными связями. В структуре α -спираль водородные связи образуются между атомом кислорода в карбонильной группе в одной аминокислоте и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Рис. 3.30. Спираль α и складчатый лист β являются вторичными структурами белков, которые образуются из-за образования водородных связей между карбонильной и аминогруппой в основной цепи пептида. Некоторые аминокислоты имеют склонность образовывать α -спираль, в то время как другие имеют склонность образовывать складчатый лист β .
Каждый виток альфа-спирали содержит 3,6 аминокислотных остатка. Группы R (вариантные группы) полипептида выступают из цепи α -спираль. В листе с складками β «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи. Группы R прикреплены к атомам углерода и проходят выше и ниже складок складки. Гофрированные сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом водорода в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе основной цепи пептида.Спиральные структуры α и складчатые листы β обнаруживаются в большинстве глобулярных и волокнистых белков, и они играют важную структурную роль.
Группы R (вариантные группы) полипептида выступают из цепи α -спираль. В листе с складками β «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи. Группы R прикреплены к атомам углерода и проходят выше и ниже складок складки. Гофрированные сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом водорода в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе основной цепи пептида.Спиральные структуры α и складчатые листы β обнаруживаются в большинстве глобулярных и волокнистых белков, и они играют важную структурную роль.
Третичная структура
Уникальная трехмерная структура полипептида — это его третичная структура (рис. 3.31). Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка.Природа групп R, присутствующих в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные группы R неполярных аминокислот лежат внутри белка, тогда как гидрофильные группы R лежат снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственную ковалентную связь, образующуюся во время сворачивания белка.
В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка.Природа групп R, присутствующих в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные группы R неполярных аминокислот лежат внутри белка, тогда как гидрофильные группы R лежат снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственную ковалентную связь, образующуюся во время сворачивания белка.
Рис. 3.31. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Все эти взаимодействия, сильные и слабые, определяют окончательную трехмерную форму белка. Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки образованы из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар. Инсулин начинается как отдельный полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи.Шелк (волокнистый белок), однако, имеет складчатую листовую структуру β , которая является результатом водородной связи между различными цепями.
Четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный) показаны на рис. 3.32.
Рис. 3.32 На этих иллюстрациях можно увидеть четыре уровня белковой структуры. (кредит: модификация работы Национального исследовательского института генома человека)
Денатурация и сворачивание белка
Каждый белок имеет свою уникальную последовательность и форму, которые удерживаются вместе за счет химических взаимодействий.Если белок подвержен изменениям температуры, pH или воздействию химикатов, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в так называемой денатурации. Денатурация часто обратима, поскольку первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, позволяя белку возобновить свою функцию. Иногда денатурация необратима, что приводит к потере функции. Одним из примеров необратимой денатурации белка является жарение яйца.Белок альбумина в жидком яичном белке денатурируется при помещении на горячую сковороду. Не все белки денатурируются при высоких температурах; например, бактерии, которые выживают в горячих источниках, содержат белки, которые функционируют при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки как часть процесса пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Не все белки денатурируются при высоких температурах; например, бактерии, которые выживают в горячих источниках, содержат белки, которые функционируют при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки как часть процесса пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции.Первоначально считалось, что сами белки несут ответственность за процесс сворачивания. Только недавно было обнаружено, что часто они получают помощь в процессе сворачивания от белков-помощников, известных как шапероны (или шаперонины), которые связываются с целевым белком во время процесса сворачивания. Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и отделяются от белка, как только целевой белок сворачивается.
Ссылка на обучение
Чтобы получить дополнительную информацию о белках, просмотрите анимацию под названием «Биомолекулы: Белки. ”
”
Веганы — это люди, которые не употребляют в пищу продукты животного происхождения. Почему веганам нужно уделять особое внимание белку, который они едят?
- Растительные белки содержат все незаменимые и заменимые аминокислоты.
- Сложнее получить все незаменимые аминокислоты из отдельных растительных источников.
- Растительные белки содержат только заменимые аминокислоты.
- Белки растений не содержат всех незаменимых аминокислот, но содержат незаменимые аминокислоты.
Подключение к научной практике для курсов AP®
Подумай об этом
- Предскажите, что произойдет, если даже одна аминокислота будет заменена на другую в полипептиде, и представьте конкретный пример.
- Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой мембраны плазматической клетки?
Активность
Сворачивание — важное свойство белков, особенно ферментов.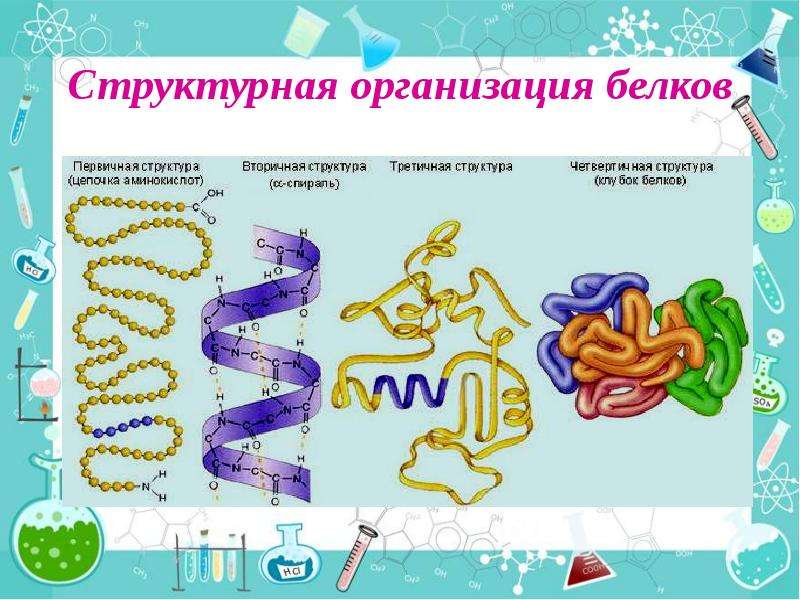 Белки имеют узкий диапазон условий, в которых они правильно сворачиваются; вне этого диапазона белки могут разворачиваться (денатурироваться) и часто не могут складываться заново и снова становиться функциональными. Изучите одно заболевание, которое возникает из-за неправильного сворачивания белка. Опишите причины разворачивания и последствия для молекулярной структуры полипептида, которые приводят к заболеванию.
Белки имеют узкий диапазон условий, в которых они правильно сворачиваются; вне этого диапазона белки могут разворачиваться (денатурироваться) и часто не могут складываться заново и снова становиться функциональными. Изучите одно заболевание, которое возникает из-за неправильного сворачивания белка. Опишите причины разворачивания и последствия для молекулярной структуры полипептида, которые приводят к заболеванию.
Поддержка учителей
Первый вопрос «Подумай об этом» — это применение цели обучения 4.3 и научных практик 6.1 и 6.4, потому что студенты предсказывают, как изменение подкомпонентов молекулы может повлиять на свойства молекулы.
Второй вопрос «Подумай об этом» — это применение Задачи обучения 4.2 и Научной практики 1.3, потому что студенты используют представления молекул вместе с моделью клеточной мембраны, чтобы описать, как молекулярная структура аминокислот определяет их расположение с белком или другим. структура, такая как бислой фосфолипидов.
структура, такая как бислой фосфолипидов.
Это упражнение является применением Задачи обучения 4.1 и научная практика 7.1, цель обучения 4.2 и научная практика 1.3, а также цель обучения 4.3 и научная практика 6.1 и 6.4, потому что студентов просят объяснить, как факторы окружающей среды могут изменить молекулярную структуру белка и как это изменение может привести к изменению в функции, то есть болезни.
белков | Основы биологии
Белки — это строительные блоки жизни. Они жизненно важны для нашего существования и присутствуют в каждом организме на Земле.
Белки — это наиболее распространенные молекулы, обнаруживаемые в клетках. Фактически, они составляют больше сухого вещества клетки, чем липиды, углеводы и все другие молекулы вместе взятые.
Белок состоит из одной или нескольких полипептидных цепей, и каждая полипептидная цепь построена из более мелких молекул, называемых «аминокислотами». Всего существует 20 аминокислот, которые можно упорядочить в триллионы и триллионы различных способов для создания белков, выполняющих огромное количество функций.
Белки на самом деле являются наиболее структурно сложными молекулами, известными биологии.
Функции белков
Белки бывают самых разных форм и выполняют широкий спектр функций. Примеры белков включают ферменты, антитела и некоторые гормоны, которые помогают ускорить химические реакции, защищают от болезней и регулируют активность клеток.
Белки также играют роль в движении, структурной поддержке, хранении, связи между клетками, пищеварении и транспортировке веществ по телу.
Движение
Моторные белки, такие как миозин и динеины, обладают способностью преобразовывать химическую энергию в движение.Миозин — это белок, содержащийся в мышцах, который вызывает сокращение мышечных волокон в мышцах.
Динеины обеспечивают питание жгутиков. Жгутики — это длинные тонкие структуры, прикрепленные к внешней стороне определенных клеток, таких как сперматозоиды, и отвечают за их подвижность.
Структура и поддержка
Многие белки обеспечивают структурную поддержку определенных частей организма. Например, кератин — это белок, содержащийся во внешних слоях кожи, который делает кожу сильным защитным слоем для внешнего мира.Кератин также является структурным белком, из которого состоят волосы, рога и ногти.
Например, кератин — это белок, содержащийся во внешних слоях кожи, который делает кожу сильным защитным слоем для внешнего мира.Кератин также является структурным белком, из которого состоят волосы, рога и ногти.
Сотовая связь
Клетки взаимодействуют с окружающей средой и другими клетками. Рецепторные белки в клеточной мембране получают сигналы извне клетки и передают сообщения в клетку. Как только сигнал попадает в клетку, он обычно передается между несколькими белками, прежде чем достигает своего конечного пункта назначения (также чаще всего белка).
Пищеварение
Пищеварение обеспечивается, как вы уже догадались, белками.Ферменты — это белки, которые стимулируют пищеварение, ускоряя химические реакции.
Пищеварение — это расщепление пищи из крупных нерастворимых молекул на более мелкие, которые могут растворяться в воде. Поскольку более мелкие молекулы растворимы в воде, они могут попадать в кровь и переноситься по телу.
Пищеварительные ферменты — это ферменты, ответственные за расщепление молекул пищи на более мелкие водорастворимые молекулы.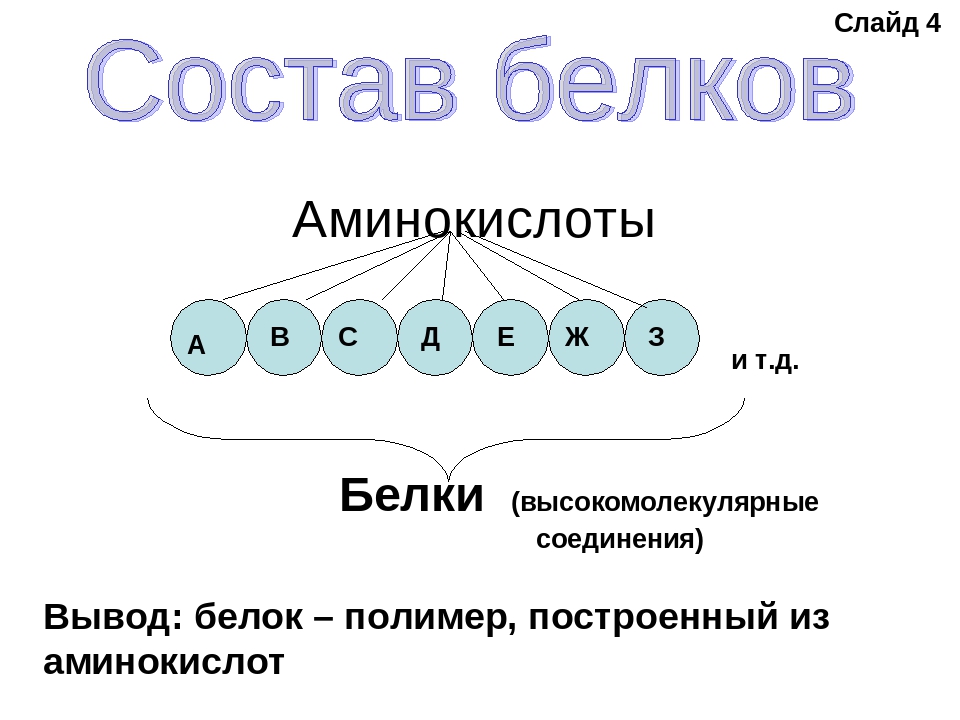 Некоторые примеры пищеварительных белков включают:
Некоторые примеры пищеварительных белков включают:
- Амилаза — фермент в слюне, расщепляющий крахмал на растворимые сахара
- Липаза — расщепляет жиры и другие липиды
- Пепсин — расщепляет белки в пище
Транспорт кислорода
Гемоглобин — еще один чрезвычайно важный белок для животных, таких как млекопитающие и птицы.Это белок крови, который связывается с кислородом, чтобы кислород мог транспортироваться по телу.
Гемоглобин содержит атом железа. Химическая структура гемоглобина вокруг атома железа позволяет кислороду связываться с железом, а затем высвобождаться в ткани, лишенные кислорода.
Как видите, белки чрезвычайно важны для здорового функционирования организма. Большинство примеров, которые я использовал, являются белками животного происхождения, но белки не менее важны для других форм жизни, таких как растения, грибы и бактерии.
Строительные блоки белков
Аминокислоты — строительные блоки белков. Всего в природе существует 20 различных аминокислот. Аминокислоты могут связываться друг с другом самыми разными способами, создавая разные белки.
Всего в природе существует 20 различных аминокислот. Аминокислоты могут связываться друг с другом самыми разными способами, создавая разные белки.
Химическая структура аминокислот — ключ к тому, почему белки стали основой жизни. Аминокислота состоит из карбоксильной группы (химическая структура -COOH), аминогруппы (-NH₂) и боковой цепи, состоящей в основном из углерода и водорода.
Сайдчейн часто называют группой R. Различия в группе R — это то, что отличает 20 аминокислот друг от друга.
В зависимости от структуры группы R аминокислота может быть водорастворимой (полярной), нерастворимой в воде (неполярной) или содержать положительный или отрицательный заряд. Эти характеристики, в свою очередь, влияют на поведение аминокислот при соединении и влияют на общую форму и функцию белка.
Все 20 аминокислот необходимы для хорошего здоровья.Если в организме мало одной из 20 аминокислот, определенные белки не могут быть построены, и потеря их функций вызовет проблемы со здоровьем для организма.
Некоторые аминокислоты могут быть созданы организмом с использованием других молекул, в то время как другие аминокислоты должны быть получены из пищи. Аминокислоты, которые необходимо употреблять в пищу, известны как «незаменимые аминокислоты», потому что они являются неотъемлемой частью здорового питания. Аминокислоты, которые может производить наш организм, известны как «заменимые аминокислоты».
Полипептиды
Полипептид представляет собой цепочку аминокислот и является простейшей формой белка. Аминокислоты связываются вместе, образуя длинные линейные цепи, длина которых может составлять более 2000 аминокислот.
Порядок, в котором аминокислоты связаны друг с другом, определяет окончательную форму и структуру полипептидной цепи. Белок будет содержать один полипептид или несколько полипептидов, связанных вместе с образованием больших сложных белков.
Аминокислоты связаны между собой между аминогруппой (-NH₂) одной аминокислоты и карбоксильной группой (-COOH) второй аминокислоты.
Поскольку две аминокислоты связываются вместе, два иона водорода удаляются из аминогруппы, а кислород удаляется из карбоксильной группы. Аминогруппа и карбоксильная группа связываются вместе, и в качестве побочного продукта образуется молекула воды. Связь известна как «пептидная связь».
Соединение нескольких аминокислот вместе пептидными связями создает основу полипептида с группой R, отходящей от каждой аминокислоты. Как упоминалось ранее, каждая группа R из 20 аминокислот имеет свою уникальную структуру и химические свойства.Структура и химические свойства (такие как реакционная способность и температура кипения) полипептида и, в конечном итоге, белка определяются уникальной последовательностью групп R, которые отходят от основной цепи полипептида. Когда группы R притягиваются или отталкиваются друг от друга, полипептидная цепь изгибается и скручивается в белок уникальной формы.
Структура белка
Белки имеют четыре уровня структуры, все из которых мы уже упоминали на этой странице.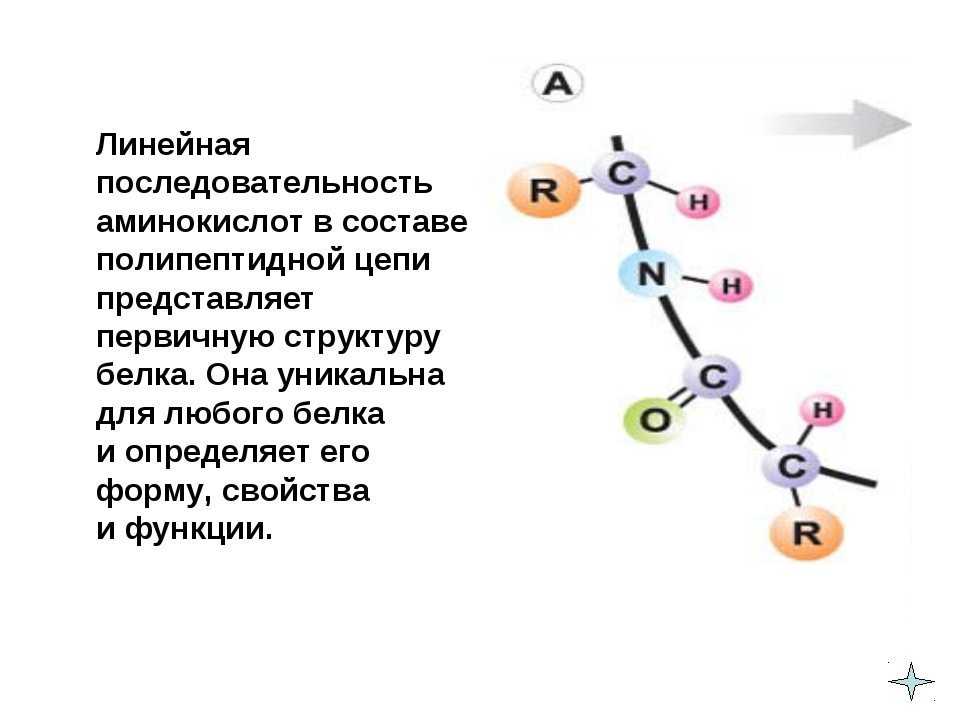 Эти четыре уровня известны как первичная, вторичная, третичная и четвертичная структура белка.
Эти четыре уровня известны как первичная, вторичная, третичная и четвертичная структура белка.
Первичная структура
Первичная структура — это определенная последовательность аминокислот, то есть порядок, в котором они связаны друг с другом. Точный порядок связывания аминокислот определяется информацией, хранящейся в генах.
Посредством процессов, называемых транскрипцией и трансляцией, ДНК предоставляет клеткам всю необходимую информацию для создания точной первичной структуры для тысяч различных белков. Первичная структура определяет вторичную и третичную структуры белков.
Вторичная структура
Вторичная структура белка образована водородными связями между атомами вдоль основной цепи полипептидной цепи.
Помня, что каждая аминокислота имеет карбоксильную группу и аминогруппу, небольшой отрицательный заряд кислорода карбоксильной группы образует слабую связь с небольшим положительным зарядом атома водорода аминогруппы другой аминокислоты.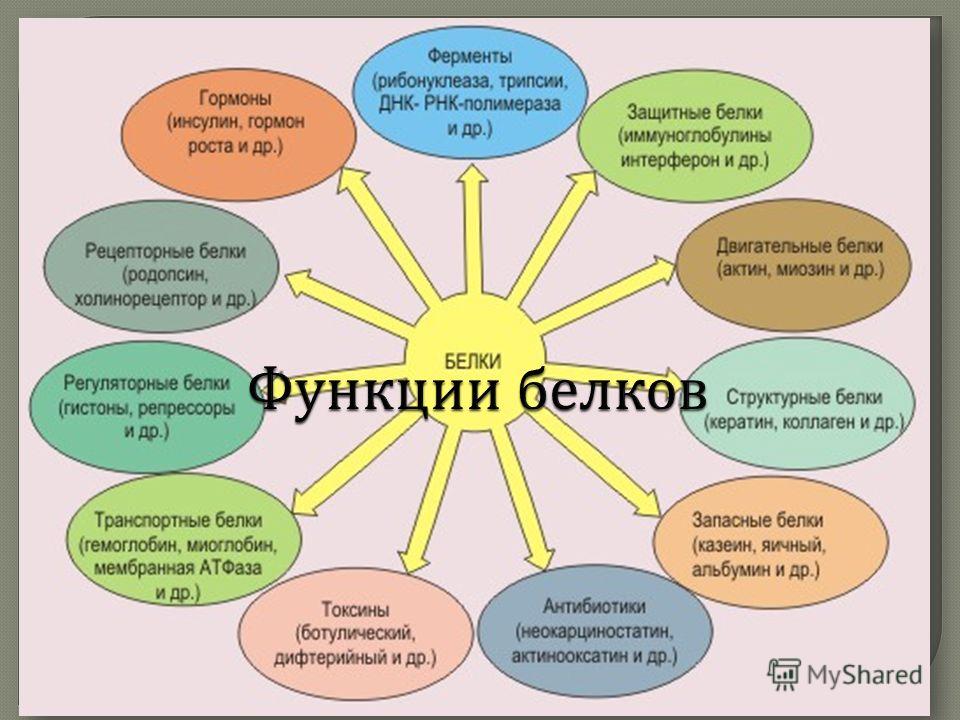 Водородные связи слабые, но многие из них создают достаточно прочности, чтобы влиять на форму полипептидной цепи.
Водородные связи слабые, но многие из них создают достаточно прочности, чтобы влиять на форму полипептидной цепи.
Водородные связи заставляют основную цепь полипептида складываться и скручиваться в две возможные формы — α-спираль и β-складчатые листы. Спираль α (греческая буква «альфа») представляет собой спираль, похожую на двойную спираль известной цепи ДНК, но только с одной спиралью, и образована водородными связями между каждой четвертой аминокислотой. Спираль α обычна в структурных белках, таких как кератин.
Складчатые листы β (греческая буква «бета») образуются, когда водородные связи возникают между двумя или более соседними полипептидными цепями и являются обычными для глобулярных белков (см. Ниже в разделе «Типы белков»).
Третичная структура
Третичная структура — это окончательная форма, которую принимает полипептидная цепь, и определяется группами R. Притяжение и отталкивание между различными группами R изгибает и складывает полипептид, создавая окончательную трехмерную форму белка.
Четвертичная структура
Не все белки имеют четвертичную структуру. Четвертичная структура возникает только тогда, когда несколько полипептидных цепей объединяются вместе с образованием большого сложного белка. В таких случаях каждый полипептид называют «субъединицей».
Гемоглобин является примером белка с четвертичной структурой. У большинства животных гемоглобин состоит из четырех глобулярных субъединиц.
Типы белков
Существует четыре основных типа белков. Наиболее известны глобулярные белки. Остальные три типа белков — это волокнистые, мембранные и неупорядоченные белки.
Глобулярные белки
Глобулярные белки — это любой белок, имеющий сферическую форму в своей третичной структуре. К ним относятся многие ферменты, антитела и белки, такие как гемоглобин.
Глобулярные белки растворимы в воде и создаются за счет притяжения и отталкивания различных R-групп водой. Полярные R-группы аминокислот в белках растворимы в воде, а неполярные R-группы нерастворимы в воде. Глобулярные белки образуются из-за того, что неполярные группы R прячутся во внутренних частях белка, а полярные группы R располагаются на внешней поверхности, которая подвергается воздействию окружающей воды.
Глобулярные белки образуются из-за того, что неполярные группы R прячутся во внутренних частях белка, а полярные группы R располагаются на внешней поверхности, которая подвергается воздействию окружающей воды.
Волокнистые белки
Волокнистые белки представляют собой удлиненные белки, не имеющие какой-либо третичной структуры.Вместо того, чтобы изгибаться и складываться с образованием глобулярного белка, волокнистые белки остаются в своей линейной вторичной структуре. Часто они являются важными структурными и поддерживающими белками.
Волокнистые белки нерастворимы в воде и часто имеют повторяющиеся структуры аминокислот вдоль их полипептидной цепи. Примеры волокнистых белков включают коллаген, кератин и шелк.
Мембранные белки
Мембранный белок — это любой белок, обнаруженный внутри или прикрепленный к клеточной мембране. Это уникальные белки из-за уникальной среды, в которой они существуют.
Клеточные мембраны состоят из двойного слоя фосфолипидов. Внутренние части клеточной мембраны неполярны, а внешние — полярны. Чтобы мембранные белки успешно существовали через клеточную мембрану, они должны содержать определенные неполярные и полярные участки.
Внутренние части клеточной мембраны неполярны, а внешние — полярны. Чтобы мембранные белки успешно существовали через клеточную мембрану, они должны содержать определенные неполярные и полярные участки.
Неупорядоченные белки
Открытие неупорядоченных белков в начале 2000-х годов бросило вызов историческому мышлению о белках. До этого считалось, что функция белка зависит от его фиксированной трехмерной структуры.Однако неупорядоченные белки не имеют упорядоченной структуры своей формы.
Некоторые белки могут быть полностью неструктурированными, в то время как другие частично структурированы с определенными неструктурированными участками. Другие белки обладают способностью существовать как неупорядоченные белки только для образования фиксированной структуры после связывания с другими молекулами.
Последний раз редактировалось: 23 апреля 2016 г.
БЕСПЛАТНЫЙ 6-недельный курс
Введите свои данные, чтобы получить доступ к нашему БЕСПЛАТНО 6-недельному вводному курсу электронной почты по биологии.
Узнайте о животных, растениях, эволюции, древе жизни, экологии, клетках, генетике, областях биологии и многом другом.
Успех! Письмо с подтверждением было отправлено на адрес электронной почты, который вы только что указали. Проверьте свою электронную почту и убедитесь, что вы щелкнули ссылку, чтобы начать наш 6-недельный курс.
Биологические строительные блоки | CancerQuest
Клетка — основная единица жизни. Все организмы состоят из одной или нескольких клеток. Как будет показано ниже, люди состоят из многих миллионов клеток.Чтобы понять, что происходит при раке, важно понимать, как работают нормальные клетки. Первый шаг — обсудить структуру и основные функции клеток.
Сначала мы познакомимся с общими строительными блоками ячеек. Все клетки, независимо от их функции или расположения в организме, имеют общие черты и процессы. Удивительно, но клетки почти полностью состоят всего из четырех основных типов молекул. Выше показана клетка, окруженная примерами этих молекул строительных блоков.
Поскольку они присутствуют в живых существах, эти строительные блоки называются биомолекулами. В следующих разделах описываются структуры и функции каждого из этих основных строительных блоков. Дополнительную информацию по темам на этой странице также можно найти в большинстве вводных учебников по биологии, мы рекомендуем «Биология Кэмпбелла», 11-е издание.
Углеводы
Первый класс биомолекул, который мы обсудим, — это углеводы. Эти молекулы состоят из элементов углерода (C), водорода (H) и кислорода (O).Обычно эти молекулы известны как сахара . Углеводы могут иметь размер от очень маленького до очень большого. Как и все другие биомолекулы, углеводы часто выстраиваются в длинные цепочки, связывая вместе более мелкие единицы. Это похоже на добавление бусинок к браслету, чтобы сделать его длиннее. Общий термин для отдельного звена или шарика — мономер . Термин для длинной цепочки мономеров — , полимер .
Примеры углеводов включают сахара, содержащиеся в молоке (лактоза) и столовый сахар (сахароза).Ниже представлена структура мономера сахара глюкозы, основного источника энергии для нашего тела.
Сфера
Палка
Поверхность
Повернуть
Углеводы выполняют в клетках несколько функций. Они являются отличным источником энергии для множества различных процессов, происходящих в наших клетках. Некоторые углеводы могут иметь структурную функцию. Например, материал, который заставляет растения стоять высоко и придает дереву жесткие свойства, представляет собой полимерную форму глюкозы, известную как целлюлоза.Другие типы сахарных полимеров составляют запасенные формы энергии, известные как крахмал и гликоген. Крахмал содержится в растительных продуктах, таких как картофель, а гликоген — в животных. Ниже показана короткая молекула гликогена. Вы можете сами манипулировать молекулой, чтобы хорошо рассмотреть.
Палка
Линия
Заполнение пространства
Повернуть
Углеводы необходимы клеткам для взаимодействия друг с другом.Они также помогают клеткам прилипать друг к другу и к материалу, окружающему клетки в организме. Способность организма защищаться от вторжения микробов и удаления инородных материалов из тела (например, улавливание пыли и пыльцы слизью в носу и горле) также зависит от свойств углеводов.
Узнайте больше о том, как доктор Майкл Пирс использует углеводы для исследования рака.
Белки
Как и углеводы, белки состоят из более мелких единиц.Мономеры, из которых состоят белки, называются аминокислотами . Существует около двадцати различных аминокислот. Структура простейшей аминокислоты, глицина, показана ниже.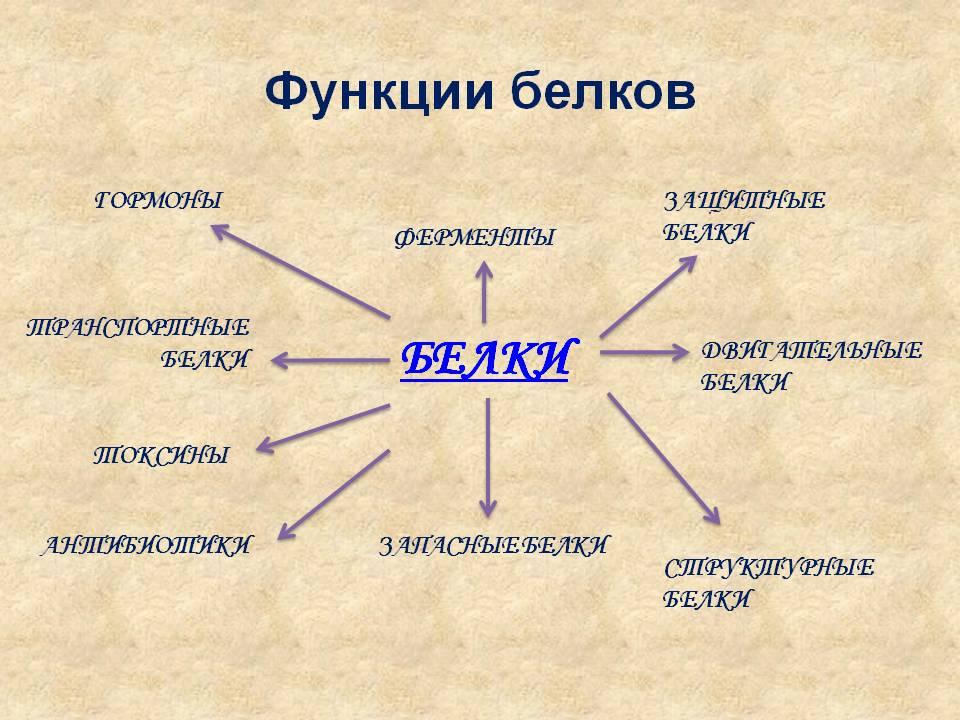
Сфера
Палка
Повернуть
Белки выполняют многочисленные функции в живых организмах, включая следующие:
- Они помогают формировать многие структурные элементы тела, включая волосы, ногти и мышцы.Белки являются основным структурным компонентом клеток и клеточных мембран.
- Они помогают транспортировать материалы через клеточные мембраны. Примером может служить захват глюкозы клетками из кровотока. Мы вернемся к этой важной способности, когда обсудим устойчивость раковых клеток к химиотерапевтическим агентам.
- Они действуют как биологические катализаторы. Большая группа белков, известных как ферменты, способна ускорять химические реакции, необходимые для правильной работы клеток.Например, существует множество ферментов, которые участвуют в расщеплении пищи, которую мы едим, и обеспечении доступности питательных веществ.
- Взаимодействия между клетками очень важны для поддержания организации и функционирования клеток и органов.
 Белки часто отвечают за поддержание контакта между соседними клетками и между клетками и их локальной средой. Хорошим примером могут служить взаимодействия клетки: клетки, которые удерживают клетки нашей кожи вместе. Эти взаимодействия зависят от белков соседних клеток, которые плотно связываются друг с другом.Как мы увидим, изменения в этих взаимодействиях необходимы для развития метастатического рака.
Белки часто отвечают за поддержание контакта между соседними клетками и между клетками и их локальной средой. Хорошим примером могут служить взаимодействия клетки: клетки, которые удерживают клетки нашей кожи вместе. Эти взаимодействия зависят от белков соседних клеток, которые плотно связываются друг с другом.Как мы увидим, изменения в этих взаимодействиях необходимы для развития метастатического рака. - Белки контролируют активность клеток, включая решения относительно деления клеток. Раковые клетки неизменно имеют дефекты в этих типах белков. Мы вернемся к этим белкам более подробно, когда будем говорить о регуляции деления клеток.
- Многие гормоны, сигналы, которые проходят по телу и изменяют поведение клеток и органов, состоят из белка.Ниже показан инсулин, небольшой белковый гормон, регулирующий усвоение глюкозы из кровотока.
Заполнение пространства
Лента
Проволочная рама
Повернуть
Липиды
Термин липид относится к широкому спектру биомолекул, включая жиры, масла, воски и стероидные гормоны. Независимо от их структуры, местоположения или функции в клетке / теле, все липиды имеют общие черты, которые позволяют группировать их вместе.
Независимо от их структуры, местоположения или функции в клетке / теле, все липиды имеют общие черты, которые позволяют группировать их вместе.
- Не растворяются в воде; они гидрофобны.
- Как и углеводы, они состоят в основном из углерода, водорода и кислорода.
Гидрофобная природа липидов обуславливает многие их применения в биологических системах. Жиры являются хорошим источником накопленной энергии, а масла и воски используются для образования защитных слоев на нашей коже, предотвращая заражение. Некоторые липиды, стероидные гормоны, являются важными регуляторами клеточной активности. Мы вернемся к этому во время обсуждения информационного потока в ячейках.Активность стероидных гормонов, таких как эстроген, связана с раком женской репродуктивной системы. Процедуры, основанные на этих знаниях, будут подробно обсуждаться в разделе лечения на сайте.
Заполнение пространства
Палка
Проволочная рама
Повернуть
Изображенный выше пример триацилглицерина или жира. Три длинные цепи состоят только из углерода и водорода, что придает молекуле гидрофобные свойства.Когда вы читаете о содержании насыщенных и ненасыщенных жиров на этикетке пищевых продуктов, они имеют в виду различия в этих длинных углеводородных цепях.
Три длинные цепи состоят только из углерода и водорода, что придает молекуле гидрофобные свойства.Когда вы читаете о содержании насыщенных и ненасыщенных жиров на этикетке пищевых продуктов, они имеют в виду различия в этих длинных углеводородных цепях.
Основная функция липидов — образование биологических мембран. Клетки окружены тонким слоем липидов. Слой состоит из липидов особого типа, которые обладают как гидрофобными, так и гидрофильными свойствами. Гидрофильные концы этих молекул обращены к заполненной водой среде внутри клеток и водной среде вне клеток.Внутри двух слоев существует гидрофобная область. Мембрана, окружающая клетки, богата белками и другими липидами, такими как холестерин.
Большинство химических веществ не могут проникать через липидный бислой. Вода и некоторые другие небольшие молекулы могут свободно проходить через мембрану, в то время как другие молекулы должны активно транспортироваться через белковые каналы, встроенные в мембрану.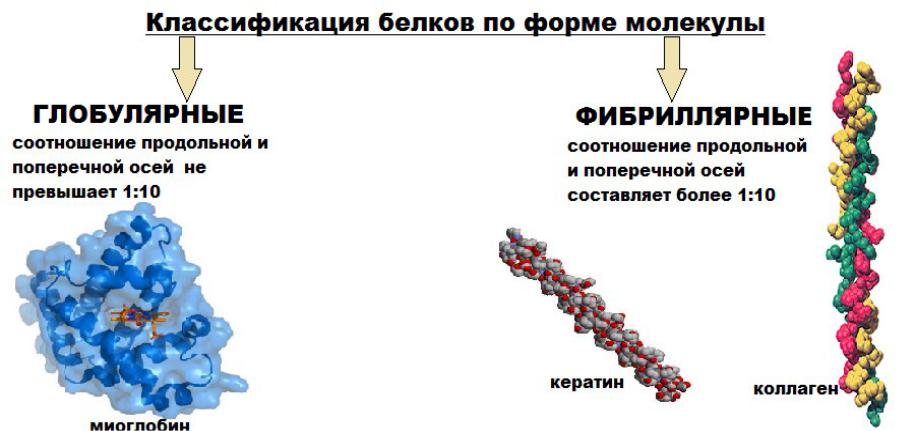 Мембраны также содержат комбинацию биомолекул, которые были описаны до сих пор. Как показано выше, белки могут быть связаны с углеводами с образованием гликопротеинов.Гликопротеины играют важную роль в клетке: клеточные взаимодействия обсуждались ранее, и изменения количества или типов этих белков наблюдаются при раке. Точно так же сочетание липидов и углеводов приводит к образованию гликолипидов.
Мембраны также содержат комбинацию биомолекул, которые были описаны до сих пор. Как показано выше, белки могут быть связаны с углеводами с образованием гликопротеинов.Гликопротеины играют важную роль в клетке: клеточные взаимодействия обсуждались ранее, и изменения количества или типов этих белков наблюдаются при раке. Точно так же сочетание липидов и углеводов приводит к образованию гликолипидов.
Нуклеиновые кислоты
Вся информация, необходимая для управления и построения клеток, хранится в этих молекулах.
Существует два основных типа нуклеиновых кислот: дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК).Обе эти молекулы являются полимерами. Они состоят из мономерных субъединиц, подобных ранее описанным углеводам и белкам. Мономеры, используемые для создания нуклеиновых кислот, называются нуклеотидами. Нуклеотиды часто обозначаются однобуквенными аббревиатурами A, C, G, T и U. Как и все мономеры, описанные до сих пор, мономеры, используемые для построения ДНК, похожи друг на друга, но не совсем похожи. Одно из различий между ДНК и РНК — это подмножество нуклеотидов, используемых для создания полимеров.ДНК содержит A, C, G и T, в то время как РНК содержит A, C, G и U.
Одно из различий между ДНК и РНК — это подмножество нуклеотидов, используемых для создания полимеров.ДНК содержит A, C, G и T, в то время как РНК содержит A, C, G и U.
Дезоксирибонуклеиновая кислота (ДНК)
ДНК
состоит из двух длинных цепочек (полимеров) нуклеотидов, скрученных друг вокруг друга и образующих спиральную или спиральную структуру, показанную ниже. Скрученные молекулы расположены определенным образом, причем определенные нуклеотиды всегда находятся напротив друг друга. Нуклеотид, содержащий аденин (A), всегда соединяется с нуклеотидом, содержащим тимин (T).Точно так же гуанин (G) всегда соединяется с цитозином (C). Если вы внимательно посмотрите на график ниже, вы увидите, что пары нуклеотидов взаимодействуют в середине спирали. Полимеры, образующие ДНК, могут быть очень длинными, достигая миллионов нуклеотидов на каждую отдельную молекулу ДНК. На следующем рисунке изображена короткая цепь двухцепочечной ДНК.
Сфера
Палка
Поверхность
Повернуть
ДНК
находится в ядре клетки, структура которой будет описана в следующем разделе сайта.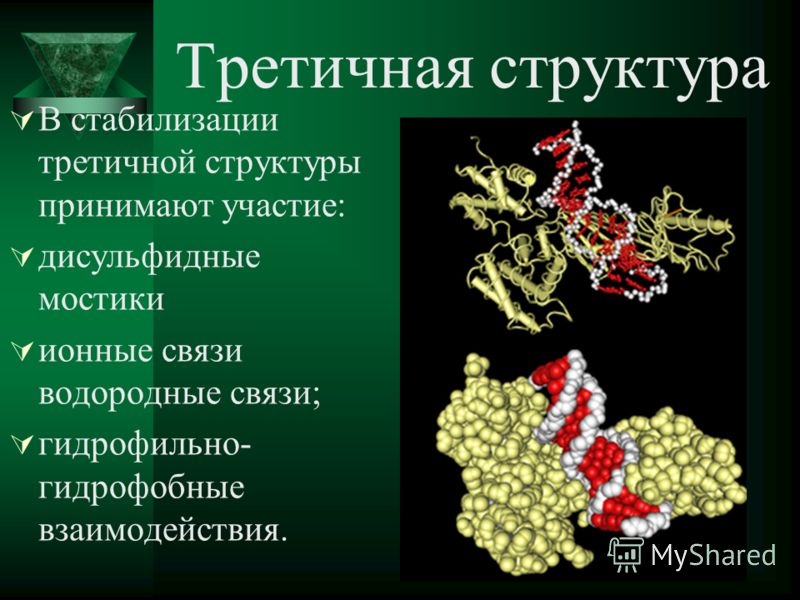 Все ядерные клетки человеческого тела имеют одинаковое содержание ДНК независимо от их функции. Разница в том, какие части ДНК используются в той или иной клетке. Например, клетки, из которых состоит печень, содержат ту же ДНК, что и клетки, из которых состоят мышцы. Существенно различающаяся активность этих двух типов клеток зависит от участков ДНК, которые активны в клетках. ДНК — это форма хранения генетической информации, которая действует как образец для клеток. Как мы увидим, изменения в последовательности ДНК могут приводить к изменениям в поведении клеток.Нерегулируемый рост, а также многие другие изменения, наблюдаемые при раке, в конечном итоге являются результатом мутаций, изменений в структуре ДНК.
Все ядерные клетки человеческого тела имеют одинаковое содержание ДНК независимо от их функции. Разница в том, какие части ДНК используются в той или иной клетке. Например, клетки, из которых состоит печень, содержат ту же ДНК, что и клетки, из которых состоят мышцы. Существенно различающаяся активность этих двух типов клеток зависит от участков ДНК, которые активны в клетках. ДНК — это форма хранения генетической информации, которая действует как образец для клеток. Как мы увидим, изменения в последовательности ДНК могут приводить к изменениям в поведении клеток.Нерегулируемый рост, а также многие другие изменения, наблюдаемые при раке, в конечном итоге являются результатом мутаций, изменений в структуре ДНК.
Рибонуклеиновая кислота
Рибонуклеиновая кислота (РНК) во многом похожа на ДНК. Это полимер нуклеотидов, несущий информацию, содержащуюся в генах. Помимо некоторых химических различий между РНК и ДНК, существуют важные функциональные различия.
- РНК копируется из ДНК в ядре, и большая часть ее отправляется в цитозоль.
- РНК — это рабочая форма информации, хранящейся в ДНК.
- РНК одноцепочечная, а не двухцепочечная
Информация, хранящаяся в ДНК, работает для клеток так же, как архитектор использует план. Конкретное производство РНК позволяет клетке использовать только те страницы «плана», которые требуются в любой конкретный момент. Очень важно, чтобы правильные РНК были произведены в правильное время. При раке производство или регуляция определенных РНК не происходит должным образом.Точно так же, как неправильное прочтение чертежа приведет к возникновению дефектов в здании, неправильное производство РНК вызывает изменения в поведении клеток, которые могут привести к раку. Эта важная тема будет подробно рассмотрена в разделе, посвященном функции генов. Сначала мы исследуем более сложные формы биомолекул, а затем познакомимся с некоторыми ключевыми функциональными компонентами эукариотических клеток.
Комбинации
Теперь мы познакомились с основными классами биомолекул.
- углеводы
- липиды
- белков
- нуклеиновых кислот
Эти биомолекулы работают вместе, чтобы выполнять определенные функции и создавать важные структурные особенности клеток. Например, в разделе, посвященном липидам, мы впервые увидели схему мембраны ниже.
Помимо липидного бислоя, состоящего из липидов особого типа, мембрана содержит множество белков и сахаров. Как показано, белки и сахара можно комбинировать с образованием гликопротеинов.К липидам также можно добавлять сахара для образования гликолипидов.
Многие из белков, которые важны для развития и / или выявления рака, являются гликопротеинами. Например, диагностические тесты на рак простаты включают тестирование образцов крови на наличие гликопротеина, называемого специфическим антигеном простаты или ПСА. Рак яичников можно контролировать по выработке другого гликопротеина, называемого СА-125. CA означает связанный с раком.
CA означает связанный с раком.
Подробнее о тесте CA-125
Часто многие белки и другие биомолекулы объединяются, образуя функциональные структуры в клетках.Далее мы исследуем некоторые из этих более сложных структур, называемых органеллами.
Сводка
Все живые существа, включая клетки, составляющие человеческое тело, состоят из небольшого подмножества различных биомолекул. Существует четыре основных класса, как описано ниже:
- Углеводы
- Углеводы состоят из элементов углерода (C), водорода (H) и кислорода (O).
- Сахар — это обычные углеводы.
- Углеводы внутри клеток выполняют несколько функций:
- Основной источник энергии
- Обеспечить структуру
- Связь
- Клеточная адгезия
- Защита от посторонних предметов и удаление посторонних предметов
- Белки
- Белки состоят из аминокислот.
- Белки внутри живых существ выполняют несколько функций:
- Структура волос, мышц, ногтей, компонентов клеток и клеточных мембран
- Транспорт клеток
- Биологические катализаторы или ферменты
- Поддержание контакта ячейки
- Контроль активности клеток
- Передача сигналов через гормоны
- Липиды
- Широкий спектр биомолекул, включая жиры, масла, воски и стероидные гормоны.

- Липиды не растворяются в воде (они гидрофобны) и в основном состоят из углерода (C), водорода (H) и кислорода (O).
- Липиды в живых организмах выполняют несколько функций:
- Образует биологические мембраны
- Жиры могут храниться в качестве источника энергии
- Масла и воски обеспечивают защиту путем покрытия участков, которые могут быть заражены микробами (например, кожа или уши)
- Стероидные гормоны регулируют активность клеток, изменяя экспрессию генов
- Широкий спектр биомолекул, включая жиры, масла, воски и стероидные гормоны.
- Нуклеиновые кислоты
- Вся информация, необходимая для управления и построения клеток, хранится в этих молекулах.
- Нуклеиновые кислоты состоят из нуклеотидов, обозначенных аббревиатурой A, C, G, T и U.
- Существует два основных типа нуклеиновых кислот, дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК):
- ДНК
- ДНК имеет структуру двойной спирали, состоящей из нуклеотидов A, C, G и T.

- ДНК находится в ядре клетки.
- ДНК — это форма хранения генетической информации.
- ДНК имеет структуру двойной спирали, состоящей из нуклеотидов A, C, G и T.
- РНК
- РНК обычно одноцепочечная и состоит из нуклеотидов A, G, C и U.
- РНК скопирована с ДНК и является рабочей формой информации.
- РНК производится в ядре, а мРНК экспортируется в цитозоль.
- ДНК
Дополнительные биомолекулы можно получить, комбинируя эти четыре типа. Например, многие белки модифицируются путем добавления углеводных цепей. Конечный продукт называется гликопротеином.
Если материал окажется для вас полезным, разместите ссылку на наш веб-сайт.
Британское общество клеточной биологии
Щелкните, чтобы просмотреть изображение микроскопа исследовательского уровня, интерпретированное с использованием технологии CIMR GridPoint
Быстрый просмотр:
Рибосома функционирует как микромашина для производства белков. Рибосомы состоят из особых белков и нуклеиновых кислот. ПЕРЕВОД информации и связывание аминокислот лежат в основе процесса производства белка. Рибосома, образованная из двух сцепляющихся вместе субъединиц, выполняет следующие функции: (1) переводит закодированную информацию из ядра клетки, предоставляемую матричной рибонуклеиновой кислотой (мРНК), (2) связывает вместе аминокислоты, выбранные и собранные из цитоплазмы путем переноса. рибонуклеиновая кислота (тРНК).(Порядок, в котором аминокислоты связаны друг с другом, определяется мРНК) и (3) Экспорт полученного полипептида в цитоплазму, где он сформирует функциональный белок.
ПЕРЕВОД информации и связывание аминокислот лежат в основе процесса производства белка. Рибосома, образованная из двух сцепляющихся вместе субъединиц, выполняет следующие функции: (1) переводит закодированную информацию из ядра клетки, предоставляемую матричной рибонуклеиновой кислотой (мРНК), (2) связывает вместе аминокислоты, выбранные и собранные из цитоплазмы путем переноса. рибонуклеиновая кислота (тРНК).(Порядок, в котором аминокислоты связаны друг с другом, определяется мРНК) и (3) Экспорт полученного полипептида в цитоплазму, где он сформирует функциональный белок.
Рибосомы находятся «свободными» в цитоплазме или связаны с эндоплазматическим ретикулумом (ER) с образованием грубого ER. В клетке млекопитающего может быть до 10 миллионов рибосом. К одной и той же цепи мРНК могут быть присоединены несколько рибосом, такая структура называется полисомой. Рибосомы существуют только временно.Когда они синтезируют полипептид, две субъединицы разделяются и либо повторно используются, либо разбиваются.
Рибосомы могут соединять аминокислоты со скоростью 200 в минуту. Таким образом, небольшие белки могут быть произведены довольно быстро, но для более крупных белков, таких как массивный мышечный белок титин, состоящий из 30 000 аминокислот, требуется два-три часа.
Рибосомы прокариот используют несколько иной процесс производства белков, чем рибосомы эукариот.К счастью, это различие представляет собой окно молекулярных возможностей для атаки антибиотиков, таких как стрептомицин. К сожалению, некоторые бактериальные токсины и вирус полиомиелита также используют его, чтобы атаковать механизм трансляции.
Чтобы просмотреть обзорную диаграмму производства белка, щелкните здесь.
(Диаграмма откроется в отдельном окне)
-
Это изображение, полученное с помощью электронного микроскопа, демонстрирующее часть шероховатой эндоплазматической сети в клетке корня растения кукурузы.Темные пятна — это рибосомы.
(любезно предоставлено Крисом Хоузом, Исследовательская школа биологии и молекулярных наук, Оксфордский университет Брукса, Оксфорд, Великобритания)
ПОДРОБНЕЕ ПОСМОТРЕТЬ Рибосомы:
Рибосомы — это макромолекулярные производственные единицы. Они состоят из рибосомных белков (рибопротеинов) и рибонуклеиновых кислот (рибонуклеопротеидов). Слово «рибосома» образовано из « рибо » из рибонуклеиновой кислоты и добавления его к « сома », латинскому слову «тело».Рибосомы могут быть связаны мембраной (мембранами), но они не являются мембранными.
Они состоят из рибосомных белков (рибопротеинов) и рибонуклеиновых кислот (рибонуклеопротеидов). Слово «рибосома» образовано из « рибо » из рибонуклеиновой кислоты и добавления его к « сома », латинскому слову «тело».Рибосомы могут быть связаны мембраной (мембранами), но они не являются мембранными.
Рибосома: микромашина для производства белков
Рибосома — это в основном очень сложная, но элегантная микромашина для производства белков. Каждая полная рибосома состоит из двух частей. Рибосома эукариот состоит из нуклеиновых кислот и около 80 белков и имеет молекулярную массу около 4200000 Да. Около двух третей этой массы состоит из рибосомальной РНК, а одна треть — из примерно 50+ различных рибосомных белков.
Рибосомы обнаружены в прокариотических и эукариотических клетках; в митохондриях, хлоропластах и бактериях. Те, что обнаруживаются у прокариот, обычно меньше, чем у эукариот. Рибосомы в митохондриях и хлоропластах по размеру сходны с таковыми у бактерий. В клетке млекопитающего около 10 миллиардов белковых молекул, и большинство из них вырабатываются рибосомами. Быстрорастущая клетка млекопитающего может содержать около 10 миллионов рибосом. [Одна клетка E. Coli содержит около 20 000 рибосом, что составляет около 25% от общей клеточной массы].
В клетке млекопитающего около 10 миллиардов белковых молекул, и большинство из них вырабатываются рибосомами. Быстрорастущая клетка млекопитающего может содержать около 10 миллионов рибосом. [Одна клетка E. Coli содержит около 20 000 рибосом, что составляет около 25% от общей клеточной массы].
Белки и нуклеиновые кислоты, которые образуют субъединицы рибосомы, образуются в ядрышке и экспортируются через ядерные поры в цитоплазму. Два субблока не равны по размеру и существуют в этом состоянии до тех пор, пока не потребуются для использования. Более крупная подгруппа примерно в два раза больше, чем меньшая.
Более крупный блок выполняет в основном каталитическую функцию; меньший подблок в основном декодирующий. В большой субъединице рибосомная РНК выполняет функцию фермента и называется рибозимом.Меньшая единица связывается с мРНК, а затем фиксируется на более крупной субъединице. Однажды сформированные рибосомы не являются статическими единицами. Когда производство определенного белка завершается, две субъединицы разделяются и затем обычно разбиваются. Рибосомы существуют только временно.
Рибосомы существуют только временно.
Иногда субъединицы рибосомы допускают мРНК, как только мРНК выходит из ядра. Когда это происходит с множеством рибосом, структура называется полисомой. Рибосомы могут функционировать в «свободном» состоянии в цитоплазме, но они также могут «оседать» на эндоплазматическом ретикулуме, образуя «грубый эндоплазматический ретикулум».Там, где имеется грубый эндоплазматический ретикулум, ассоциация между рибосомой и эндоплазматическим ретикулумом (ER) облегчает дальнейшую обработку и проверку вновь образованных белков с помощью ER.
Белковая фабрика: сайт и услуги.
Все предприятия нуждаются в таких услугах, как газ, вода, канализация и связь. Для того, чтобы они были предоставлены, должно быть место или участок.
Производство протеина также требует сервисных требований. Сайт, требующий предоставления услуг, образуется в небольшой субъединице рибосомы, когда цепь мРНК входит через одну селективную щель, а цепь инициаторной тРНК — через другую.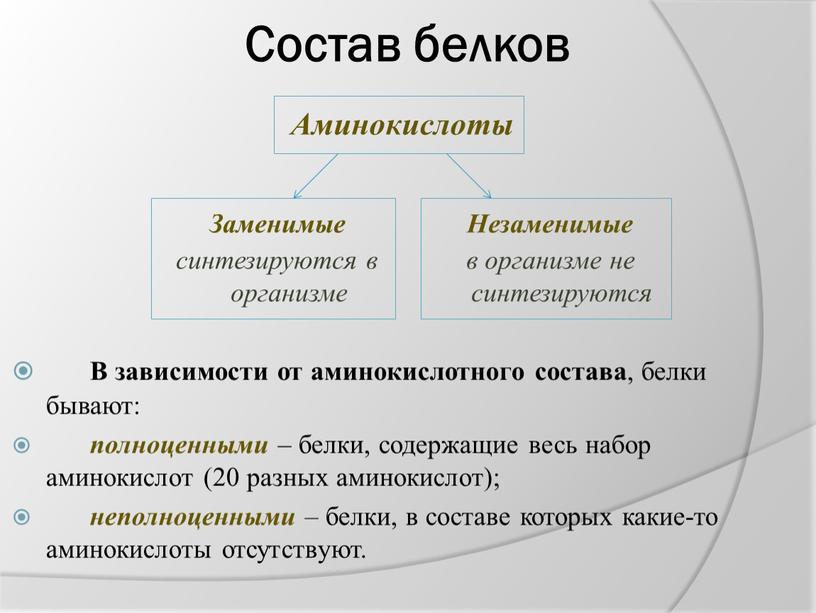 Это действие заставляет маленькую субъединицу связываться с большой субъединицей рибосомы, чтобы сформировать полную и активную рибосому. Теперь можно начинать удивительный процесс производства белка.
Это действие заставляет маленькую субъединицу связываться с большой субъединицей рибосомы, чтобы сформировать полную и активную рибосому. Теперь можно начинать удивительный процесс производства белка.
Для трансляции и синтеза белка задействованы многие химические вещества-инициаторы и высвобождающие вещества, а также происходит множество реакций с использованием ферментов. Однако существуют общие требования, и они должны быть выполнены. В приведенном ниже списке показаны основные требования и порядок их выполнения:
- Требование: Безопасное (без загрязнения) и подходящее оборудование для процесса производства белка.
- Предоставление: Это средство обеспечивается двумя субединицами рибосом. Когда две субъединицы сцепляются вместе, образуя полную рибосому, входящие и выходящие молекулы могут делать это только через селективные щели или туннели в молекулярной структуре.
- Требование: Информация в форме, которую рибосома может переводить с высокой степенью точности.
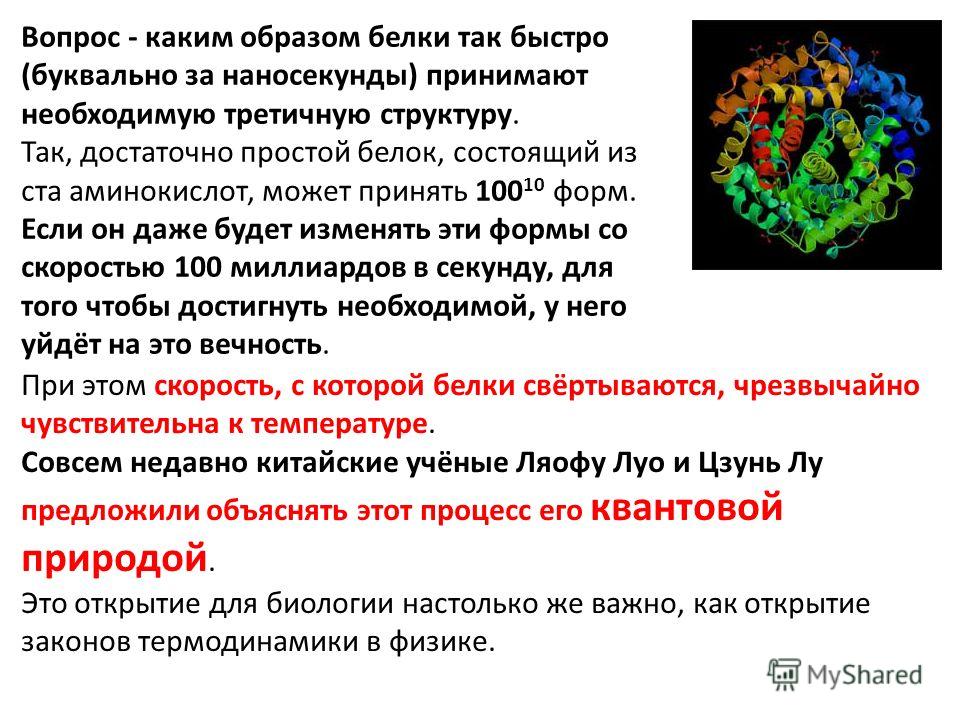 Перевод должен быть точным, чтобы производились правильные белки.
Перевод должен быть точным, чтобы производились правильные белки. - Предоставление: Информация предоставляется ядром и доставляется на рибосому в виде цепи мРНК.Когда мРНК образуется в ядре, интроны (некодирующие участки) вырезаются, а экзоны (кодирующие участки) соединяются вместе посредством процесса, называемого сплайсингом.
- Требование: Запас аминокислот, из которых рибосомный механизм может получать определенные необходимые аминокислоты.
- Обеспечение: Аминокислоты, поступающие в основном с пищей, обычно свободно доступны в цитоплазме.
- Требование: Система, которая может выбирать и фиксировать аминокислоту в цитоплазме и доставлять ее к сайту трансляции и синтеза в рибосоме.
- Предоставление: Короткие цепи переносящей рибонуклеиновой кислоты (тРНК), образующиеся в ядре и доступные в цитоплазме, действуют как «адаптерные инструменты». Когда цепь тРНК зафиксирована на аминокислоте, тРНК называется «заряженной».
 тРНК диффундирует в меньшую субъединицу рибосомы, и каждая короткая цепь тРНК будет доставлять ONE аминокислоту.
тРНК диффундирует в меньшую субъединицу рибосомы, и каждая короткая цепь тРНК будет доставлять ONE аминокислоту. - Требование: Средства высвобождения в цитоплазму: (a) новообразованный полипептид, (b) мРНК , которая использовалась в процессе трансляции, и (c) тРНК, которая доставила аминокислота, которую он нес, и теперь «незаряженная».
- Положение: (a) , когда вновь образованная пептидная цепь продуцируется глубоко внутри большой субъединицы рибосомы, она направляется в цитоплазму по туннелю или щели. (b) «Использованная» мРНК покидает меньшую субъединицу рибосомы через туннель на стороне, противоположной точке входа. Движение через рибосому вызывается только односторонним, прерывистым движением рибосомы вдоль и в направлении входящей цепи мРНК. (c ) тРНК в «незаряженном» состоянии выходит через туннель в молекулярной архитектуре большой субъединицы рибосомы.
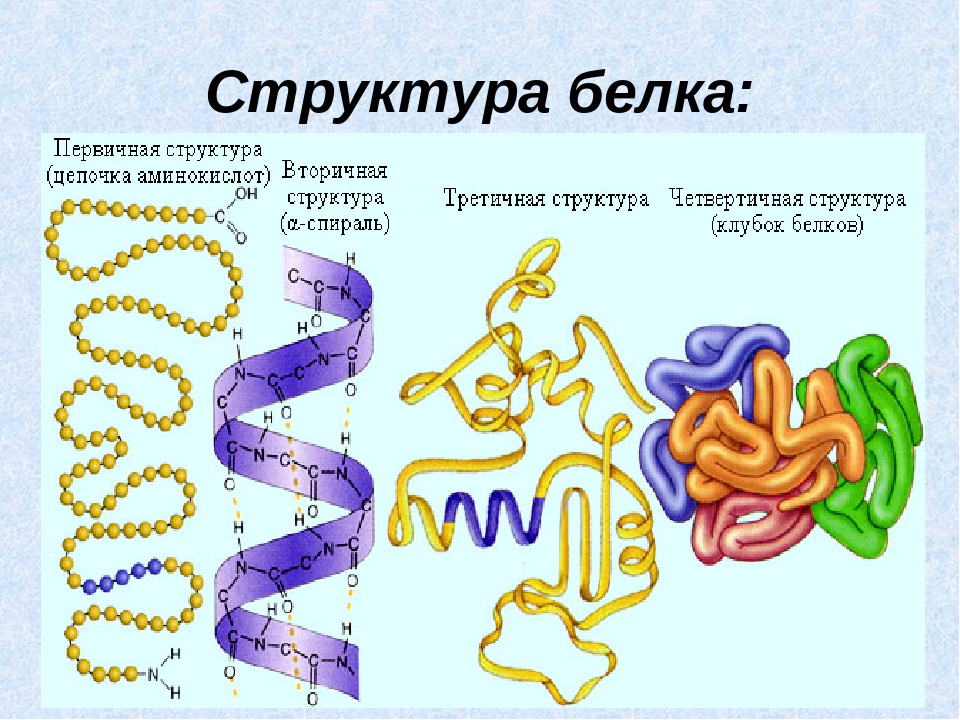
Белковая фабрика: что происходит внутри?
— Посмотрите на линию по производству белка, которая может соединять аминокислоты со скоростью 200 в минуту!
Теперь, когда мы рассмотрели требования и условия, необходимые для работы машины для производства белка, мы можем взглянуть на внутреннюю работу.
Как упоминалось ранее, в рибосоме протекают многие детальные биохимические реакции, и здесь дается только краткое описание, чтобы проиллюстрировать концепцию.
( См. Также «схема рибосомы» в конце раздела)
В рибосоме есть ТРИ ЭТАПА и ТРИ операционных САЙТА, задействованных в производственной линии белка.
Три ЭТАПА : (1) начало, (2) удлинение и (3) завершение.
Три рабочих или связывающих САЙТА — это A, P и E , считываемые с сайта входа мРНК (обычно с правой стороны).
Сайты A и P охватывают как субъединицы рибосомы, большая часть которых находится в большой субъединице рибосомы, так и меньшая часть — в меньшей субъединице. Сайт E , сайт выхода, находится в большой субъединице рибосомы.
Таблица сайтов связывания, положений и функций в рибосоме
(см. Также схему рибосомы в конце раздела)
|
Место привязки |
Сайт входа в цепь мРНК |
Биологический термин |
Основные процессы |
|
Участок А |
1-й |
A миноацил |
Допуск кодона мРНК «заряженной» цепи тРНК. |
|
Участок П |
2-я |
P эптидил |
Пептидный синтез, консолидация, удлинение и перенос пептидной цепи в сайт A |
|
Si t e E |
3-я |
Выход в цитоплазму |
Подготовка «незаряженной» тРНК для выхода |
Три этапа:
- Инициирование. На этом этапе небольшая субъединица рибосомы связывается с «начальным концом» цепи мРНК. «Инициатор тРНК» также входит в небольшую субъединицу.
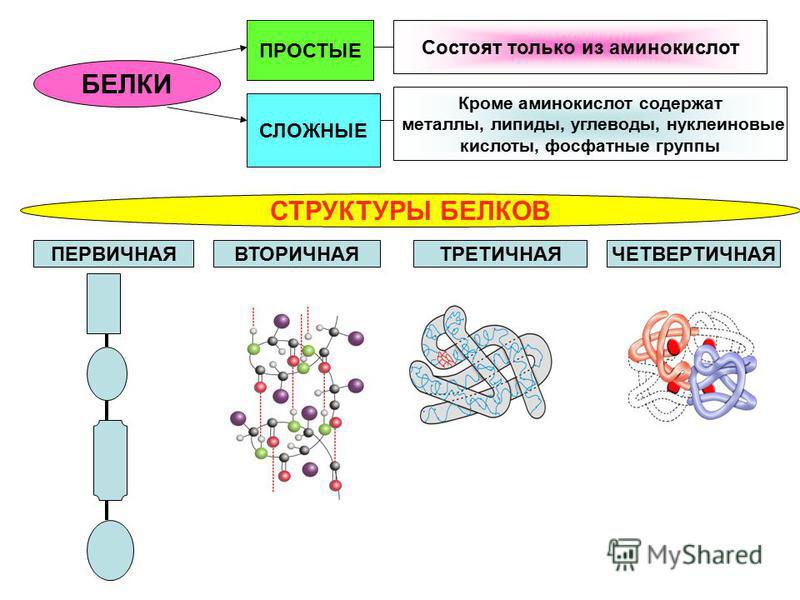 Затем этот комплекс присоединяется к большой субъединице рибосомы. В начале цепи мРНК имеется сообщение «начало трансляции», и цепь тРНК, «заряженная» одной конкретной аминокислотой, входит в сайт A и рибосомы. Производство полипептида уже начато. Чтобы тРНК не отвергалась, трехбуквенная кодовая группа, которую она несет (называемая антикодоном), должна совпадать с трехбуквенной кодовой группой (называемой кодоном) на цепи мРНК. в рибосоме.Это очень важная часть процесса перевода на , и удивительно, как мало возникает «ошибок перевода». [В общем, конкретная аминокислота, которую он несет, определяется трехбуквенным антикодоном, который он несет, например если трехбуквенный код — CAG ( C итозин, A денин, G уанин), то он выберет и перенесет аминокислоту глутамин (Gln)].
Затем этот комплекс присоединяется к большой субъединице рибосомы. В начале цепи мРНК имеется сообщение «начало трансляции», и цепь тРНК, «заряженная» одной конкретной аминокислотой, входит в сайт A и рибосомы. Производство полипептида уже начато. Чтобы тРНК не отвергалась, трехбуквенная кодовая группа, которую она несет (называемая антикодоном), должна совпадать с трехбуквенной кодовой группой (называемой кодоном) на цепи мРНК. в рибосоме.Это очень важная часть процесса перевода на , и удивительно, как мало возникает «ошибок перевода». [В общем, конкретная аминокислота, которую он несет, определяется трехбуквенным антикодоном, который он несет, например если трехбуквенный код — CAG ( C итозин, A денин, G уанин), то он выберет и перенесет аминокислоту глутамин (Gln)].
- Удлинение. Этот термин охватывает период между инициированием и завершением, и именно в это время вырабатывается основная часть обозначенного белка.
 Процесс состоит из серии циклов, общее количество которых определяется мРНК. Одним из основных событий при элонгации является транслокация . Это происходит, когда рибосома перемещается вдоль мРНК на одну кодонную выемку и начинается новый цикл. Во время процесса «запуска» «инициирующая тРНК» переместится в сайт P (см. Схему рибосомы в конце раздела). ), и рибосома допустит в сайт A , новую тРНК, «заряженную» одной аминокислотой.«Заряженная» тРНК находится в сайте A до тех пор, пока она не будет проверена и принята (или отвергнута) и пока растущая пептидная цепь, прикрепленная к тРНК в сайте P, не будет перенесена ферментами на «заряженную» тРНК в сайте A. Здесь одна новая аминокислота передается тРНК и добавляется к пептидной цепи. Благодаря этому процессу длина пептидной цепи увеличивается на одну аминокислоту. [Образованию пептидной связи между растущей пептидной цепью и вновь поступившей аминокислотой способствует пептидилтрансфераза и происходит в большой субъединице рибосомы.
Процесс состоит из серии циклов, общее количество которых определяется мРНК. Одним из основных событий при элонгации является транслокация . Это происходит, когда рибосома перемещается вдоль мРНК на одну кодонную выемку и начинается новый цикл. Во время процесса «запуска» «инициирующая тРНК» переместится в сайт P (см. Схему рибосомы в конце раздела). ), и рибосома допустит в сайт A , новую тРНК, «заряженную» одной аминокислотой.«Заряженная» тРНК находится в сайте A до тех пор, пока она не будет проверена и принята (или отвергнута) и пока растущая пептидная цепь, прикрепленная к тРНК в сайте P, не будет перенесена ферментами на «заряженную» тРНК в сайте A. Здесь одна новая аминокислота передается тРНК и добавляется к пептидной цепи. Благодаря этому процессу длина пептидной цепи увеличивается на одну аминокислоту. [Образованию пептидной связи между растущей пептидной цепью и вновь поступившей аминокислотой способствует пептидилтрансфераза и происходит в большой субъединице рибосомы.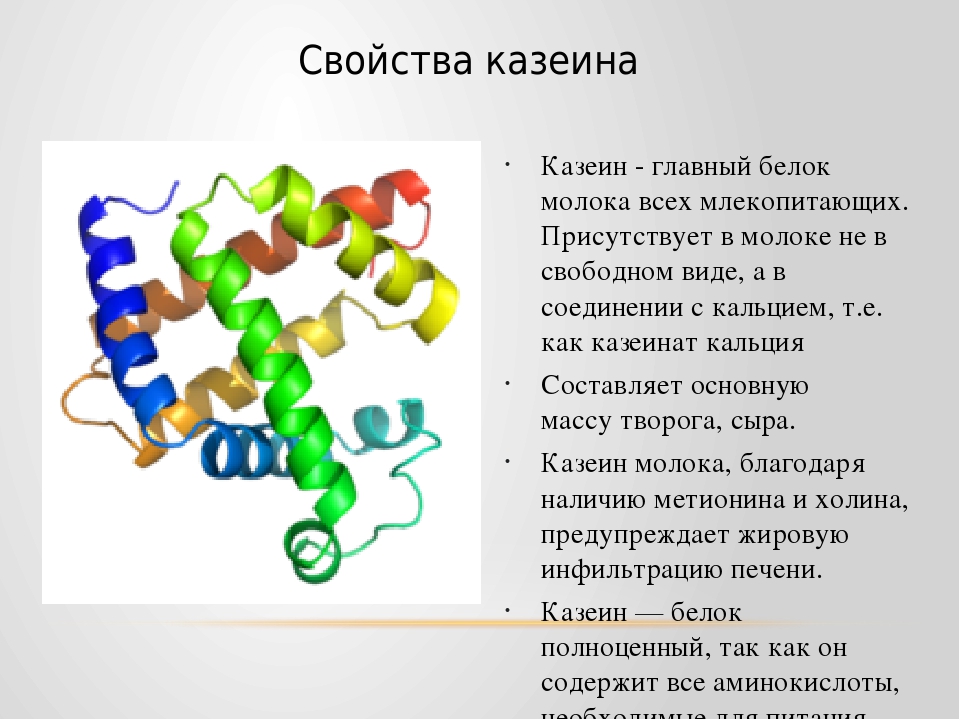 Реакция происходит между тРНК, которая несет зарождающуюся пептидную цепь, пептидил-тРНК, и тРНК, которая несет входящую аминокислоту, аминоацил-тРНК]. Когда это произошло, тРНК в сайте P , перенесла свою пептидную цепь и теперь без каких-либо прикреплений, перемещается в сайт E , сайт выхода . Затем тРНК в сайте A , в комплекте с пептидом. Цепь, увеличенная в длину на одну аминокислоту, переходит на сайт P . В сайте P рибопротеины действуют для консолидации связывания пептидной цепи с вновь добавленной аминокислотой.Если пептидная цепь длинная, самая старая часть будет перемещена в цитоплазму, и за ней последует остальная часть цепи по мере ее образования. Следующий цикл
Реакция происходит между тРНК, которая несет зарождающуюся пептидную цепь, пептидил-тРНК, и тРНК, которая несет входящую аминокислоту, аминоацил-тРНК]. Когда это произошло, тРНК в сайте P , перенесла свою пептидную цепь и теперь без каких-либо прикреплений, перемещается в сайт E , сайт выхода . Затем тРНК в сайте A , в комплекте с пептидом. Цепь, увеличенная в длину на одну аминокислоту, переходит на сайт P . В сайте P рибопротеины действуют для консолидации связывания пептидной цепи с вновь добавленной аминокислотой.Если пептидная цепь длинная, самая старая часть будет перемещена в цитоплазму, и за ней последует остальная часть цепи по мере ее образования. Следующий цикл
С сайтом A , теперь пустым, имеет место транслокация . Рибосома перемещается на расстояние в одну (трехбуквенную) кодонную выемку вдоль мРНК, чтобы ввести новый кодон в зону обработки. тРНК, «заряженная» присоединенной аминокислотой, теперь входит в сайт A, и при условии удовлетворительного совпадения кодона мРНК и антикодона тРНК цикл начинается снова.Этот процесс продолжается до тех пор, пока не будет достигнута стадия завершения.
тРНК, «заряженная» присоединенной аминокислотой, теперь входит в сайт A, и при условии удовлетворительного совпадения кодона мРНК и антикодона тРНК цикл начинается снова.Этот процесс продолжается до тех пор, пока не будет достигнута стадия завершения. - Прекращение действия. Когда рибосома достигает конца цепи мРНК, появляется сообщение о конце или «конце белкового кода». Это регистрирует конец продукции конкретного белка, кодируемого этой цепью мРНК. Химические вещества «фактора высвобождения» предотвращают дальнейшее добавление аминокислот, и новый белок (полипептид) полностью перемещается в цитоплазму через щель в большой субъединице. Две субъединицы рибосомы отделяются, разделяются и используются повторно или разрушаются.
Резюме:
- Почти все белки, необходимые клеткам, синтезируются рибосомами. Рибосомы находятся «свободными» в цитоплазме клетки, а также прикреплены к грубому эндоплазматическому ретикулуму.

- Рибосомы получают информацию от ядра клетки и строительных материалов из цитоплазмы.
- Рибосомы транслируют информацию , закодированную в матричной рибонуклеиновой кислоте (мРНК).
- Они связывают вместе определенных аминокислот с образованием полипептидов, и они экспортируют их в цитоплазму.
- Клетка млекопитающего может содержать до 10 миллионов рибосом, но каждая рибосома существует только временно.
- Рибосомы могут связывать аминокислоты со скоростью 200 в минуту.
- Рибосомы образуются в результате связывания небольшой субъединицы с большой субъединицей. Субъединицы обычно доступны в цитоплазме, причем большая из них примерно в два раза больше, чем меньшая.
- Каждая рибосома представляет собой комплекс рибонуклеопротеидов, две трети массы которого состоят из рибосомной РНК и примерно на одну треть рибосомного белка.
- Производство белка происходит в три стадии: (1) инициация , (2) элонгация , и (3 ) терминация.
 Проверка и расшифровка и начало «передачи» одной молекулы аминокислоты
Проверка и расшифровка и начало «передачи» одной молекулы аминокислоты