Карта сайта
Страница не найдена. Возможно, карта сайта Вам поможет.
-
Главная -
Университет-
Об университете -
Структура -
Нормативные документы и процедуры -
Лечебная деятельность -
Международное сотрудничество -
Пресс-центр-
Новости -
Анонсы -
События -
Объявления и поздравления -
Online конференции -
Фотоальбом-
Занятия в симуляционном центре ГрГМУ, имитирующем «красную зону» -
Торжественная церемония вручения дипломов о переподготовке -
Праздничный концерт, посвященный Дню Матери -
Церемония подписания договора о сотрудничестве вуза и Гродненской православной епархии -
Диалоговая площадка с председателем Гродненского облисполкома Владимиром Степановичем Караником -
Выставка-презентация учреждений высшего образования «Образование будущего» -
Товарищеский турнир по мини-футболу -
Конференция «Современные проблемы радиационной и экологической медицины, лучевой диагностики и терапии» -
Посвящение в первокурсники-2021 -
Встреча заместителя министра здравоохранения Д.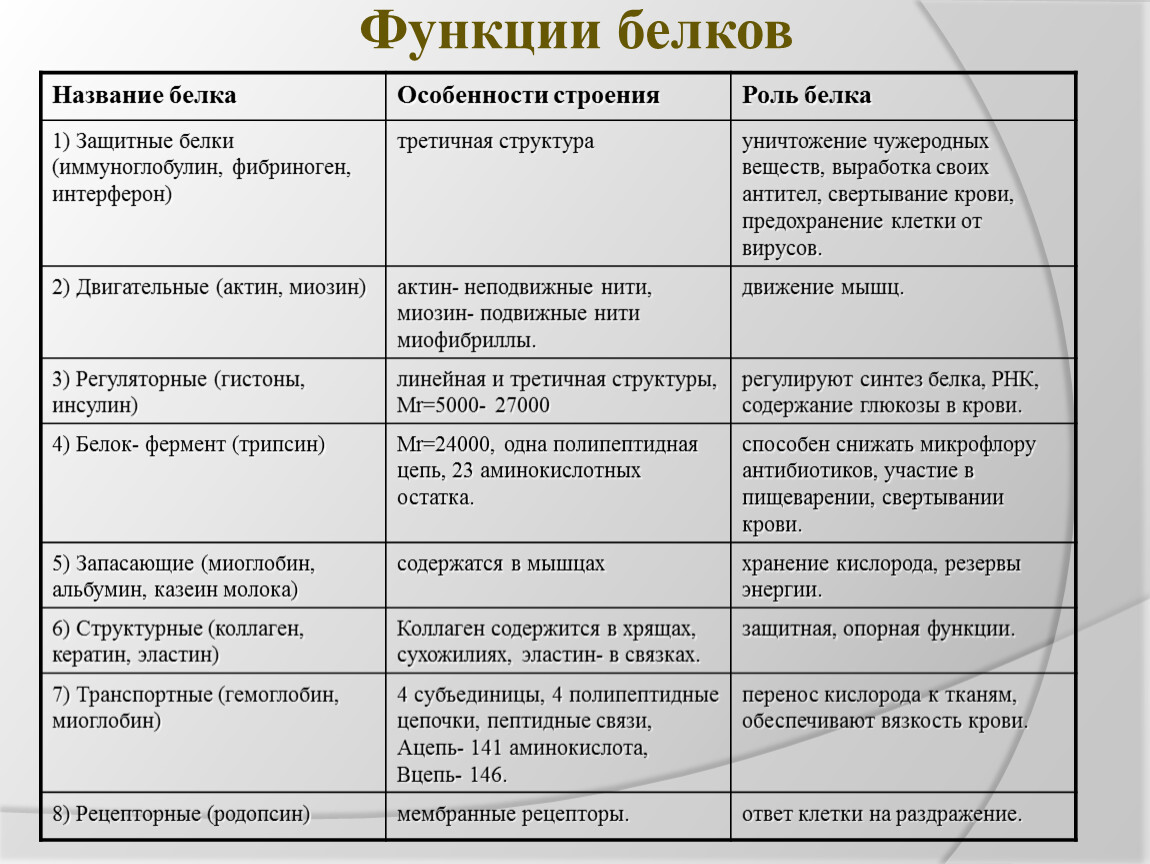 В. Чередниченко со студентами
В. Чередниченко со студентами
-
Открытый диалог, приуроченный к 19-летию БРСМ -
Группа переподготовки по специальности «Организация здравоохранения» -
Собрания факультетов для первокурсников-2021 -
День знаний — 2021 -
Совет университета -
Студенты военной кафедры ГрГМУ приняли присягу -
День освобождения Гродно-2021 -
Ремонтные и отделочные работы -
Итоговая практика по военной подготовке -
День Независимости-2021 -
Студенты военной кафедры ГрГМУ: итоговая практика-2021 -
Выпускной лечебного факультета-2021 -
Выпускной медико-психологического и медико-диагностического факультетов-2021 -
Выпускной педиатрического факультета-2021 -
Выпускной факультета иностранных учащихся-2021 -
Вручение дипломов выпускникам-2021 -
Митинг-реквием, посвященный 80-й годовщине начала Великой Отечественной войны -
Акция «Память», приуроченная к 80-летию начала Великой Отечественной войны -
Республиканский легкоатлетический студенческий забег «На старт, молодежь!» -
Актуальные вопросы гигиены питания -
Торжественное мероприятие к Дню медицинских работников-2021 -
Совет университета -
Выездное заседание Республиканского совета ректоров -
Церемония вручения медалей и аттестатов особого образца выпускникам 2021 года -
Предупреждение деструктивных проявлений в студенческой среде и влияния агрессивного информационного контента сети интернет -
Онлайн-выставка «Помнить, чтобы не повторить» -
Областная межвузовская конференция «Подвиг народа бессмертен» -
Финал первого Республиканского интеллектуального турнира ScienceQuiz -
Конференция «Актуальные вопросы коморбидности заболеваний в амбулаторной практике: от профилактики до лечения» -
День семьи-2021 -
Диалоговая площадка с председателем Гродненского областного Совета депутатов -
Праздничные городские мероприятия к Дню Победы -
Областной этап конкурса «Королева студенчества-2021″ -
Праздничный концерт к 9 мая 2021 -
IV Республиканский гражданско-патриотический марафон «Вместе – за сильную и процветающую Беларусь!» -
Университетский кубок КВН-2021 -
Музыкальная планета студенчества (завершение Дней ФИУ-2021) -
Молодёжный круглый стол «Мы разные, но мы вместе» -
Дни ФИУ-2021.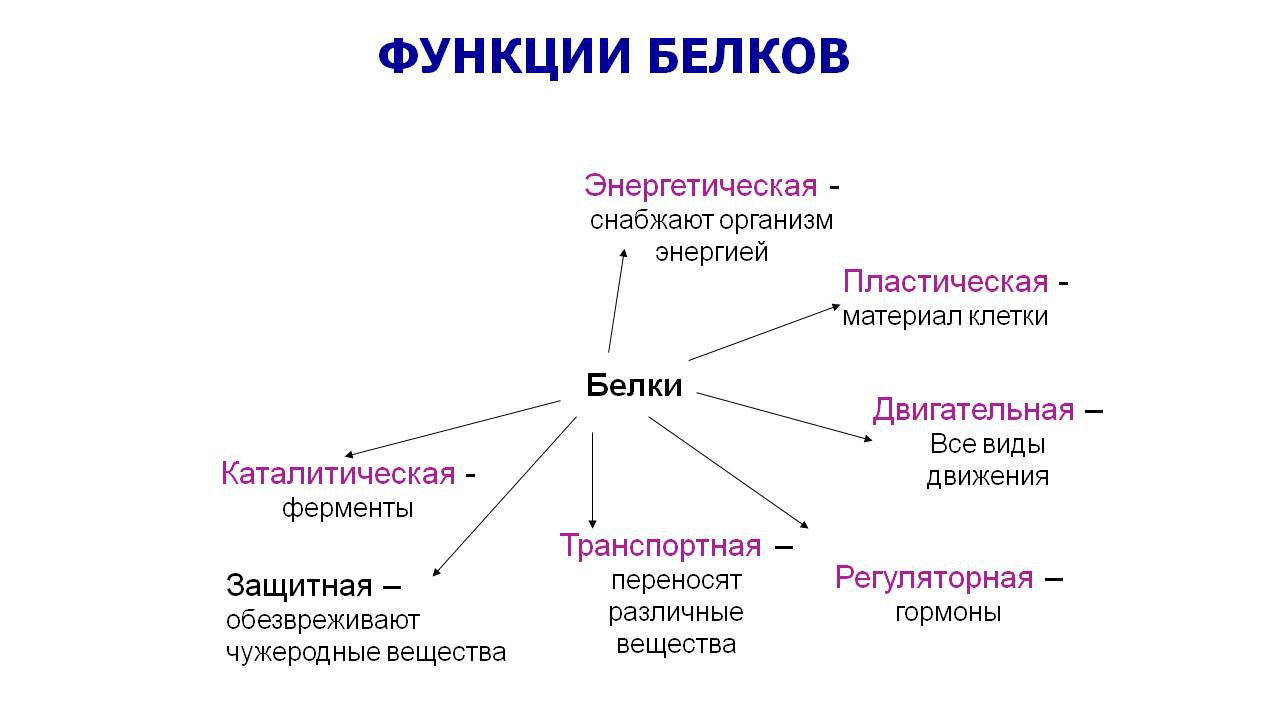 Интеллектуальная игра «Что?Где?Когда?»
Интеллектуальная игра «Что?Где?Когда?»
-
Неделя донорства в ГрГМУ -
Творческая гостиная. Дни ФИУ-2021 -
Открытие XVIII студенческого фестиваля национальных культур -
Передвижная мультимедийная выставка «Партизаны Беларуси» -
Республиканский субботник-2021 -
Семинар «Человек внутри себя» -
Международный конкурс «Здоровый образ жизни глазами разных поколений» -
Вручение нагрудного знака «Жена пограничника» -
Встреча с представителями медуниверситета г. Люблина -
Королева Студенчества ГрГМУ — 2021 -
День открытых дверей-2021 -
Управление личными финансами (встреча с представителями «БПС-Сбербанк») -
Весенний «Мелотрек» -
Праздничный концерт к 8 Марта -
Диалоговая площадка с председателем Гродненского облисполкома -
Расширенное заседание совета университета -
Гродно — Молодежная столица Республики Беларусь-2021 -
Торжественное собрание, приуроченное к Дню защитника Отечества -
Вручение свидетельства действительного члена Белорусской торгово-промышленной палаты -
Новогодний ScienceQuiz -
Финал IV Турнира трех вузов ScienseQuiz -
Областной этап конкурса «Студент года-2020″ -
Семинар дистанционного обучения для сотрудников университетов из Беларуси «Обеспечение качества медицинского образования и образования в области общественного здоровья и здравоохранения» -
Студент года — 2020 -
День Знаний — 2020 -
Церемония награждения лауреатов Премии Правительства в области качества -
Военная присяга -
Выпускной лечебного факультета-2020 -
Выпускной медико-психологического факультета-2020 -
Выпускной педиатрического факультета-2020 -
Выпускной факультета иностранных учащихся-2020 -
Распределение — 2020 -
Стоп коронавирус! -
Навстречу весне — 2020 -
Профориентация — 18-я Международная специализированная выставка «Образование и карьера» -
Спартакиада среди сотрудников «Здоровье-2020″ -
Конференция «Актуальные проблемы медицины» -
Открытие общежития №4 -
Встреча Президента Беларуси со студентами и преподавателями медвузов -
Новогодний утренник в ГрГМУ -
XIX Республиканская студенческая конференция «Язык. Общество. Медицина»
Общество. Медицина»
-
Alma mater – любовь с первого курса -
Актуальные вопросы коморбидности сердечно-сосудистых и костно-мышечных заболеваний в амбулаторной практике -
Областной этап «Студент года-2019″ -
Финал Science Qiuz -
Конференция «Актуальные проблемы психологии личности и социального взаимодействия» -
Посвящение в студенты ФИУ -
День Матери -
День открытых дверей — 2019 -
Визит в Азербайджанский медицинский университет -
Семинар-тренинг с международным участием «Современные аспекты сестринского образования» -
Осенний легкоатлетический кросс — 2019 -
40 лет педиатрическому факультету -
День Знаний — 2019 -
Посвящение в первокурсники -
Акция к Всемирному дню предотвращения суицида -
Турслет-2019 -
Договор о создании филиала кафедры общей хирургии на базе Брестской областной больницы -
День Независимости -
Конференция «Современные технологии диагностики, терапии и реабилитации в пульмонологии» -
Выпускной медико-диагностического, педиатрического факультетов и факультета иностранных учащихся — 2019 -
Выпускной медико-психологического факультета — 2019 -
Выпускной лечебного факультета — 2019 -
В добрый путь, выпускники! -
Распределение по профилям субординатуры -
Государственные экзамены -
Интеллектуальная игра «Что? Где? Когда?» -
Мистер и Мисс факультета иностранных учащихся-2019 -
День Победы -
IV Республиканская студенческая военно-научная конференция «Этих дней не смолкнет слава» -
Республиканский гражданско-патриотический марафон «Вместе — за сильную и процветающую Беларусь!» -
Литературно-художественный марафон «На хвалях спадчыны маёй» -
День открытых дверей-2019 -
Их имена останутся в наших сердцах -
Областной этап конкурса «Королева Весна — 2019″ -
Королева Весна ГрГМУ — 2019 -
Профориентация «Абитуриент – 2019» (г. Барановичи)
Барановичи)
-
Мероприятие «Карьера начинается с образования!» (г. Лида) -
Итоговое распределение выпускников — 2019 -
«Навстречу весне — 2019″ -
Торжественная церемония, посвященная Дню защитника Отечества -
Торжественное собрание к Дню защитника Отечества — 2019 -
Мистер ГрГМУ — 2019 -
Предварительное распределение выпускников 2019 года -
Митинг-реквием у памятника воинам-интернационалистам -
Профориентация «Образование и карьера» (г.Минск) -
Итоговая коллегия главного управления здравоохранения Гродненского областного исполнительного комитета -
Спартакиада «Здоровье — 2019» -
Итоговая научно-практическая конференция «Актуальные проблемы медицины».
-
Расширенное заседание Совета университета. -
Научно-практическая конференция «Симуляционные технологии обучения в подготовке медицинских работников: актуальность, проблемные вопросы внедрения и перспективы» -
Конкурс первокурсников «Аlma mater – любовь с первого курса» -
XVI съезд хирургов Республики Беларусь -
Итоговая практика -
Конкурс «Студент года-2018» -
Совет университета -
1-й съезд Евразийской Аритмологической Ассоциации (14.09.2018 г.) -
1-й съезд Евразийской Аритмологической Ассоциации (13.09.2018 г.) -
День знаний -
День независимости Республики Беларусь -
Церемония награждения победителей конкурса на соискание Премии СНГ -
День герба и флага Республики Беларусь -
«Стань донором – подари возможность жить» -
VIII Международный межвузовский фестиваль современного танца «Сделай шаг вперед» -
Конкурс грации и артистического мастерства «Королева Весна ГрГМУ – 2018» -
Окончательное распределение выпускников 2018 года -
Митинг-реквием, приуроченный к 75-летию хатынской трагедии -
Областное совещание «Итоги работы терапевтической и кардиологической служб Гродненской области за 2017 год и задачи на 2018 год» -
Конкурсное шоу-представление «Мистер ГрГМУ-2018» -
Предварительное распределение выпускников 2018 года -
Итоговая научно-практическая конференция «Актуальные проблемы медицины» -
II Съезд учёных Республики Беларусь -
Круглый стол факультета иностранных учащихся -
«Молодежь мира: самобытность, солидарность, сотрудничество» -
Заседание выездной сессии Гродненского областного Совета депутатов -
Областной этап республиканского конкурса «Студент года-2017» -
Встреча с председателем РОО «Белая Русь» Александром Михайловичем Радьковым -
Конференция «Актуальные вопросы инфекционной патологии», 27.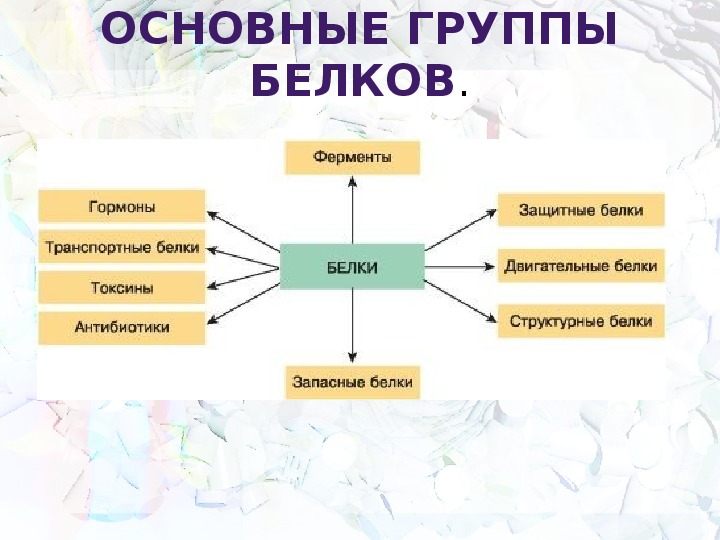 10.2017
10.2017
-
XIX Всемирный фестиваль студентов и молодежи -
Республиканская научно-практическая конференция «II Гродненские аритмологические чтения» -
Областная научно-практическая конференция «V Гродненские гастроэнтерологические чтения» -
Праздник, посвящённый 889-летию города Гродно -
Круглый стол на тему «Место и роль РОО «Белая Русь» в политической системе Республики Беларусь» (22.09.2017) -
ГрГМУ и Университет медицины и фармации (г.Тыргу-Муреш, Румыния) подписали Соглашение о сотрудничестве -
1 сентября — День знаний -
Итоговая практика на кафедре военной и экстремальной медицины -
Квалификационный экзамен у врачей-интернов -
Встреча с Комиссией по присуждению Премии Правительства Республики Беларусь -
Научно-практическая конференция «Амбулаторная терапия и хирургия заболеваний ЛОР-органов и сопряженной патологии других органов и систем» -
День государственного флага и герба -
9 мая -
Республиканская научно-практическая конференция с международным участием «V белорусско-польская дерматологическая конференция: дерматология без границ» -
«Стань донором – подари возможность жить» -
«Круглый стол» Постоянной комиссии Совета Республики Беларусь Национального собрания Республики Беларусь по образованию, науке, культуре и социальному развитию -
Весенний кубок КВН «Юмор–это наука» -
Мисс ГрГМУ-2017 -
Распределение 2017 года -
Общегородской профориентационный день для учащихся гимназий, лицеев и школ -
Праздничный концерт, посвященный Дню 8 марта -
Конкурсное шоу-представление «Мистер ГрГМУ–2017» -
«Масленица-2017» -
Торжественное собрание и паздничный концерт, посвященный Дню защитника Отечества -
Лекция профессора, д. м.н. О.О. Руммо
м.н. О.О. Руммо
-
Итоговая научно-практическая конференция «Актуальные проблемы медицины» -
Меморандум о сотрудничестве между областной организацией Белорусского общества Красного Креста и региональной организацией Красного Креста китайской провинции Хэнань -
Визит делегации МГЭУ им. А.Д. Сахарова БГУ в ГрГМУ -
«Студент года-2016» -
Визит Чрезвычайного и Полномочного Посла Королевства Швеция в Республике Беларусь господина Мартина Оберга в ГрГМУ -
Конкурс первокурсников «Аlma mater – любовь с первого курса» -
День матери в ГрГМУ -
Итоговая практика-2016 -
День знаний -
Визит китайской делегации в ГрГМУ -
Визит иностранной делегации из Вроцлавского медицинского университета (Республика Польша) -
Торжественное мероприятие, посвященное профессиональному празднику – Дню медицинского работника -
Визит ректора ГрГМУ Виктора Александровича Снежицкого в Индию -
Республиканская университетская суббота-2016 -
Республиканская акция «Беларусь против табака» -
Встреча с поэтессой Яниной Бокий -
9 мая — День Победы -
Митинг, посвященный Дню Государственного герба и Государственного флага Республики Беларусь -
Областная межвузовская студенческая научно-практическая конференция «1941 год: трагедия, героизм, память» -
«Цветы Великой Победы» -
Концерт народного ансамбля польской песни и танца «Хабры» -
Суботнiк ў Мураванцы -
«Мисс ГрГМУ-2016» -
Визит академика РАМН, профессора Разумова Александра Николаевича в УО «ГрГМУ» -
Визит иностранной делегации из Медицинского совета Мальдивской Республики -
«Кубок ректора Гродненского государственного медицинского университета по дзюдо» -
«Кубок Дружбы-2016» по мини-футболу среди мужских и женских команд медицинских учреждений образования Республики Беларусь -
Распределение выпускников 2016 года -
Визит Министра обороны Республики Беларусь на военную кафедру ГрГМУ -
Визит Первого секретаря Посольства Израиля Анны Кейнан и директора Израильского культурного центра при Посольстве Израиля Рей Кейнан -
Визит иностранной делегации из провинции Ганьсу Китайской Народной Республики в ГрГМУ -
Состоялось открытие фотовыставки «По следам Библии» -
«Кубок декана» медико-диагностического факультета по скалолазанию -
Мистер ГрГМУ-2016 -
Приём Первого секретаря Посольства Израиля Анны Кейнан в ГрГМУ -
Спартакиада «Здоровье» УО «ГрГМУ» среди сотрудников 2015-2016 учебного года -
Визит Посла Республики Индия в УО «ГрГМУ» -
Торжественное собрание и концерт, посвященный Дню защитника Отечества -
Митинг-реквием, посвященный Дню памяти воинов-интернационалистов -
Итоговое заседание коллегии главного управления идеологической работы, культуры и по делам молодежи Гродненского облисполкома -
Итоговая научно-практическая конференция Гродненского государственного медицинского университета -
Новогодний концерт -
Открытие профессорского консультативного центра -
Концерт-акция «Молодёжь против СПИДа» -
«Студент года-2015» -
Открытые лекции профессора, академика НАН Беларуси Островского Юрия Петровича -
«Аlma mater – любовь с первого курса» -
Открытая лекция Регионального директора ВОЗ госпожи Жужанны Якаб -
«Открытый Кубок по велоориентированию РЦФВиС» -
Совместное заседание Советов университетов г. Гродно
Гродно
-
Встреча с Министром здравоохранения Республики Беларусь В.И. Жарко -
День города -
Дебаты «Врач — выбор жизни» -
День города -
Праздничный концерт «Для вас, первокурсники!» -
Акция «Наш год – наш выбор» -
День знаний -
Открытое зачисление абитуриентов в УО «Гродненский государственный медицинский университет» -
Принятие военной присяги студентами ГрГМУ -
День Независимости Республики Беларусь -
Вручение дипломов выпускникам 2015 года -
Республиканская олимпиада студентов по педиатрии -
Открытие памятного знака в честь погибших защитников -
9 мая -
«Вторая белорусско-польская дерматологическая конференция: дерматология без границ» -
Мистер университет -
Мисс универитет -
КВН -
Гродненский государственный медицинский университет -
Чествование наших ветеранов -
1 Мая -
Cовместный субботник
-
-
Наши издания -
Медицинский календарь -
Университет в СМИ -
Видео-презентации
-
-
Общественные объединения -
Комиссия по противодействию коррупции -
Образовательная деятельность
-
-
Абитуриентам -
Студентам -
Выпускникам -
Слайдер -
Последние обновления -
Баннеры -
Иностранному гражданину -
Научная деятельность -
Поиск
Конспект по биологии 9 класс Состав и строение белков ответы и решения онлайн
Изображения обложек учебников приведены на страницах данного сайта исключительно в качестве иллюстративного материала (ст. 1274 п. 1 части четвертой Гражданского кодекса Российской Федерации)
1274 п. 1 части четвертой Гражданского кодекса Российской Федерации)
Издательство: Ксеноксс
Вид УМК: конспекты
Серия: Краткое содержание параграфов учебника для устного ответа
На данной странице представлено детальное решение Состав и строение белков по биологии для учеников 9 классa автор(ы)
Состав и строение белков
Белки – полимеры.
Мономеры белков – аминокислоты. 20 аминокислот, каждая имеет своё название, особое строение и свойства.
Белки называют полипептидами.
Молекулы белков могут иметь различные пространственные конфигурации – структуры белка, и в их строении различают 4 уровня структурной организации.
Денатурация – нарушение природной структуры белка.
Функции:
-
строительная;
-
каталитическая;
-
двигательная;
-
транспортная;
-
защитная;
-
регуляторная;
-
сигнальная;
-
энергетическая.
Состоят из аминогруппы, радикала, карбоксильной группы.
Ренатурация – восстановление структуры под воздействием (из 1 во 2) ферментов.
Нуклеиновые кислоты – группа органических веществ, полимер, мономерами которых являются нуклеотиды.
ДНК
Дезоксирибоза
аденин
гуанин
цитозин
тимин
Двойная спирально скрученная цепь
Ядро
Митохондрии
Хлоропласты (в хромосомах)
Хранение и передача генетической информации
Самоудвоение
РНК
Рибоза
аденин
гуанин
цитозин
урацил
Одиночная спирально скрученная цепь
Ядрышко в рибосомах
Цитоплазма
Биосинтез белка
Информационная (иРНК)
Транспортная (тРНК)
Рибосомная (рРНК (мРНК))
Принцип комплементарности – взаимное соответствие молекул или нуклеотидов.
Рис. 1. ГДЗ конспекты по биологии 9 класс Состав и строение белков
Add
Новыe решебники
Похожие решебники
по биологии 9 класс
Состав и строение белков | Параграф 1.4
«Введение в общую биологию и экологию. 9 класс». А.А. Каменский (гдз)
Вопрос 1. Какие вещества называются белками или протеинами?
Белки (протеины) — это гетерополимеры, состоящие из 20 различных мономеров — природных альфа-аминокислот. Белки — нерегулярные полимеры.
Общее строение аминокислоты может быть представлено следующим образом:
R—С(NH2)—СООН. Все аминокислоты имеют аминогруппу (—МН2) и карбоксильную группу (—СООН) и различаются строением и свойствами радикалов. Аминокислоты в белке связаны пептидной
связью —N(Н)—С(=О), поэтому белки ещё называют пептидами.
Вопрос 2. Что такое первичная структура белка?
В молекуле белка аминокислоты связаны друг с другом пептидной связью между атомами углерода и азота. В строении молекулы белка различают первичную структуру — последовательность аминокислотных остатков.
В строении молекулы белка различают первичную структуру — последовательность аминокислотных остатков.
Вопрос 3. Как образуются вторичная, третичная и четвертичная структуры белка?
Вторичная структура белка — как правило, это спиральная структура (альфа-спираль), которая удерживается множеством водородных связей, возникающих между находящимся близко друг от друга С=О и NН-группами. Другой тип вторичной структуры — это бета-слой, или складчатый слой; это две параллельные полипептидные цепи, связанные водородными связями, перпендикулярными цепям.
Третичная структура белковой молекулы — это пространственная конфигурация, напоминающая компактную глобулу. Она поддерживается ионными, водородными и дисульфидными (S=S) связями, а также гидрофобными взаимодействиями.
Четвертичная структура белка образуется при взаимодействии нескольких глобул, которые объединяются в комплекс (например, молекула гемоглобина состоит из четырех таких субъединиц).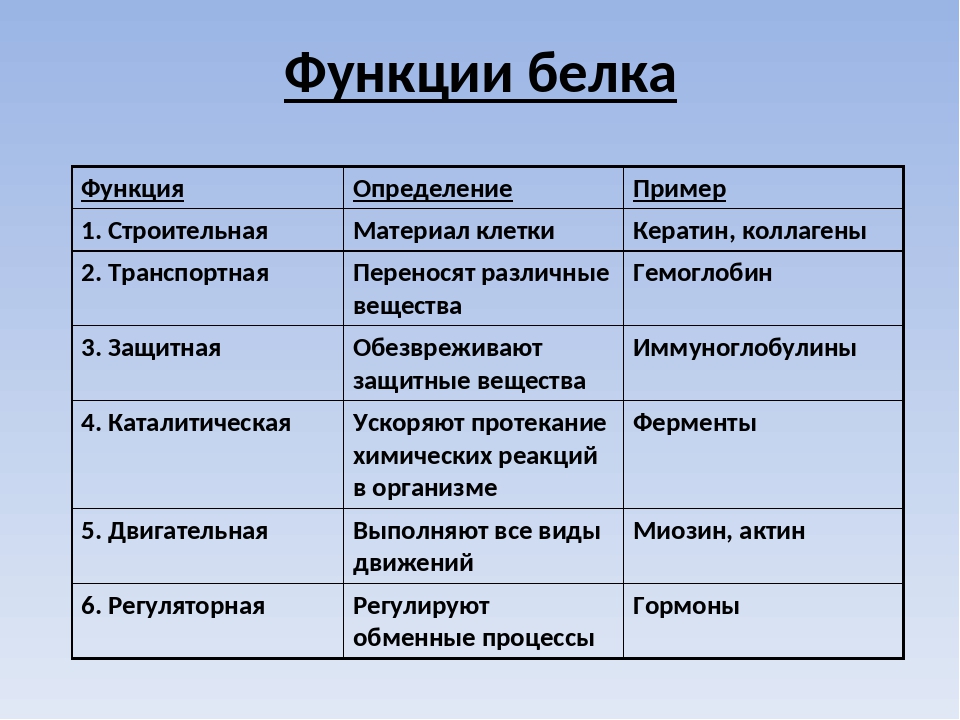
Вопрос 4. Что такое денатурация белка?
Утрата белковой молекулой своей структуры называется денатурацией; она может быть вызвана повышением температуры, обезвоживанием, облучением и т.д. Если при денатурации первичная структура не нарушается, то при восстановлении нормальных условий полностью воссоздается структура белка. Если же действие фактора нарастает, разрушается и первичная структура белка — полипептидная цепь. Это уже необратимый процесс — восстановить структуру белок не может. Например, при высокой температуре (выше 42oС) в организме человека многие белки денатурируют необратимо.
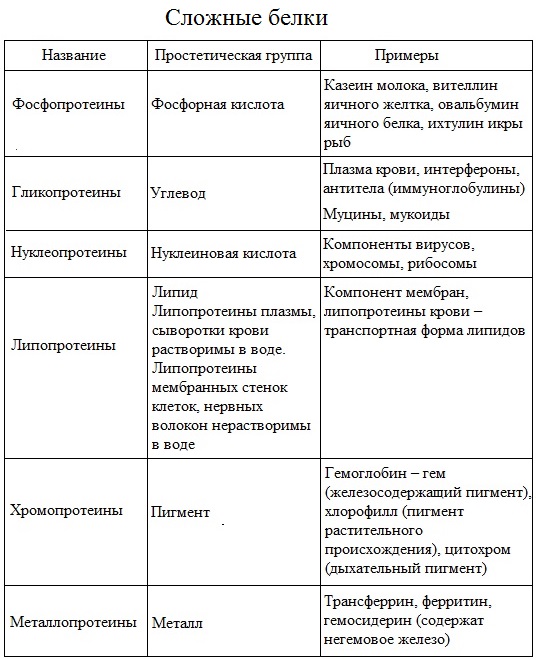
Вопрос 5. По какому признаку белки делятся на простые и сложные?
Простые белки (протеины) состоят исключительно из аминокислот (альбумины, глобулины, кератин, коллаген, гистон и другие). В состав сложных белков могут входить другие органические вещества: углеводы (тогда они называются гликопротеидами), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды), фосфорная кислота (фосфопротеиды), при сочетании белка с каким-либо окрашенным веществом образуются так называемые хромопротеиды. Из хромопротеидов наиболее изучен гемоглобин – красящее вещество красных кровяных шариков (эритроцитов).
Из хромопротеидов наиболее изучен гемоглобин – красящее вещество красных кровяных шариков (эритроцитов).
Состав и строение белков
Продолжаем
знакомство с органическими веществами клеток живых организмов.
Вы
уже преодолели две ступеньки лестницы, познакомившись с углеводами и липидами.
Дальше лестница подымается ещё круче вверх, становится страшнее, и может закружиться
голова, но это только пока не взойдёшь и не освоишься на следующей ступеньке.
Но как только это произойдёт, снова возникает жгучее желание взбираться дальше
вверх к удивительному и неизведанному.
Сегодняшняя
ступенька с белками достаточно сложная и насыщенная. Если, конечно, так можно
сказать о ступеньке.
Белки
имеют гораздо более запутанное строение, чем усвоенные вами углеводы и липиды.
А соответственно обладают и гораздо более широким набором функций в организме.
Считается,
что именно они являются основой жизни на Земле. Помните Фридриха Энгельса?
Помните Фридриха Энгельса?
«Жизнь
– это способ существования белковых тел, существенным
моментом
которого является постоянный обмен веществ с
окружающей
их природой, причём с прекращением этого обмена
веществ
прекращается и жизнь, что приводит к разложению белков».
Конечно,
белки не справились бы с
возложенными на них функциями без своих командиров – молекул нуклеиновых
кислот. Но следующая крутая ступенька с нуклеиновыми кислотами – носителями
наследственной информации – ждёт вас впереди.
Вы
помните, что и белки, и нуклеиновые кислоты являются полимерами. Помните, что
полимеры состоят из мономеров. Так вот факт условного превосходства нуклеиновых
кислот – если белковые молекулы насчитывают до нескольких десятков тысяч
мономеров, то ДНК – до сотен миллионов.
Так
что же представляют из себя эти загадочные белки при ближайшем рассмотрении?
Вначале
о том, что вы уже могли знать.
Как
мы уже сказали, белки – полимеры.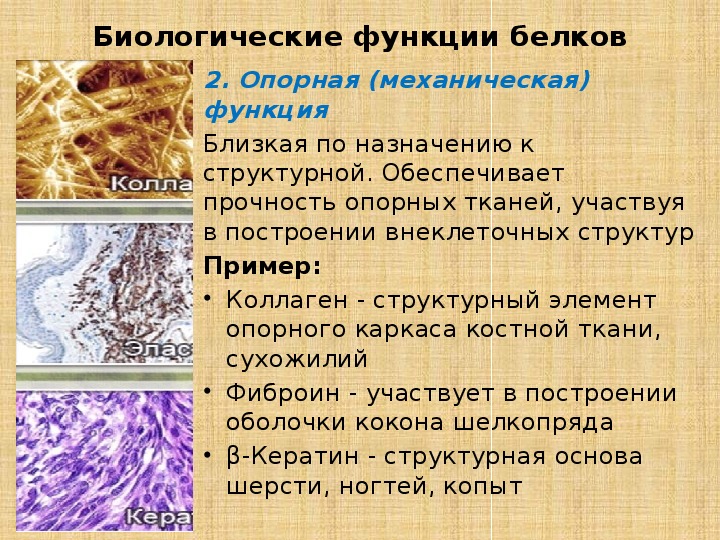 Мономерами белков являются аминокислоты.
Мономерами белков являются аминокислоты.
20 различных аминокислот может входить в состав белков. Поэтому белки являются гетерополимерами. Поскольку могут содержать
неодинаковые мономеры. 20 разных.
Здесь
нужно отметить, что разнообразие живых организмов… практически бесконечно.
Каждая особь живых существ, которая возникла в результате полового размножения
(если это не однояйцевые близнецы),
представлена своими уникальными белками. Сколько их может быть и каков порядок
чисел? По разным данным на Земле существует до 10 миллионов видов живых
организмов. Это уже минимум 10 миллионов комбинаций строения белковых молекул.
Здесь следует учесть, что в каждом организме далеко не по одному белку. А что
касается количества особей, то подсчитать становится просто невозможно.
Например, только одних насекомых на одного человека приходится около 250
миллионов. Можете умножить 7 миллиардов на 250 миллионов.
Так
вот, всё это разнообразие создаётся за счёт различного сочетания всего 20 (!)
аминокислот.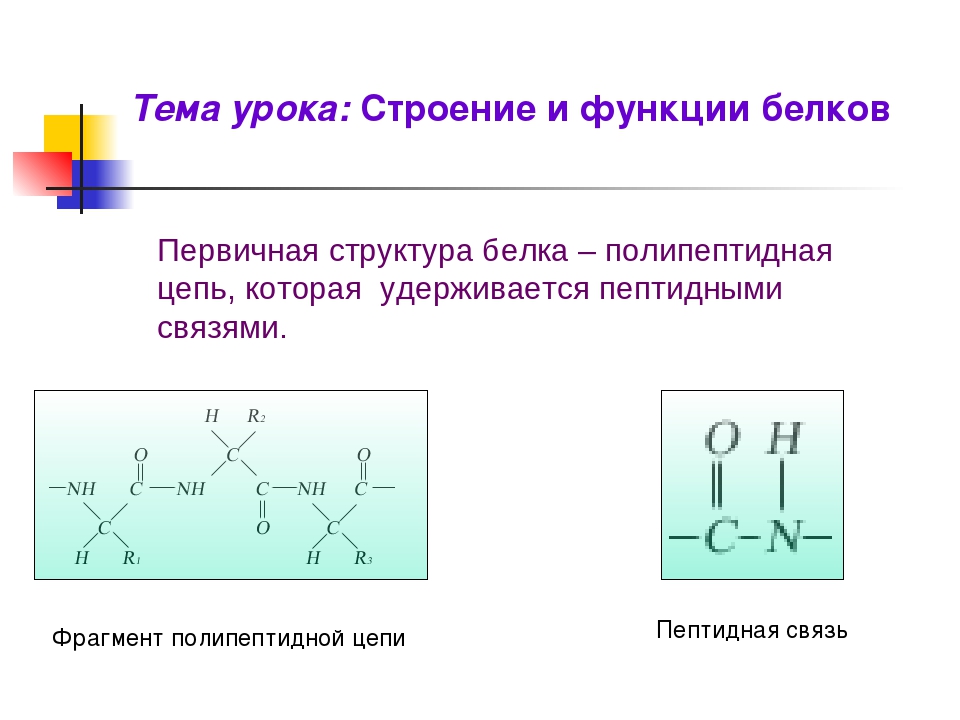 Невероятно, правда?
Невероятно, правда?
Давайте
познакомимся поближе с теми кирпичиками, из которых состоят белки.
Если вы уже разобрались со строением карбоновых кислот,
никаких сложностей не возникнет и с аминокислотами. Это вещества, содержащие не
только карбоксильную группу COOH
(отсюда кислота), но и аминогруппу NH2. Эти две функциональные группы обязательны
для каждой аминокислоты.
А
вот в остальном они очень разнообразны. Уникальная часть каждой аминокислоты – радикал.
Может выглядеть по-разному и содержать не только атомы углерода, водорода,
кислорода и азота, но и серу. В результате радикал может быть полярным и
неполярным, гидрофобным или гидрофильным, что и придаёт разным аминокислотам
особые свойства.
Если
аминокислоты содержат одну карбоксильную группу и одну аминогруппу, которая
придаёт им основные свойства, то они являются нейтральными амфотерными
соединениями. Но количество функциональных групп может различаться у разных
аминокислот. Те из них, которые имеют более одной аминогруппы, будут основными,
Те из них, которые имеют более одной аминогруппы, будут основными,
а имеющие более одной карбоксильной группы – кислыми.
Важно
отметить, что не все аминокислоты могут синтезироваться во всех живых
организмах. Если автотрофы справляются с этим самостоятельно благодаря
продуктам фотосинтеза, то гетеротрофам необходимо обязательное поступление
некоторых аминокислот с белками пищи. Такие аминокислоты относят к незаменимым.
В
зависимости от аминокислотного состава различают полноценные белки,
содержащие все незаменимые аминокислоты,
и неполноценные, в составе которых отсутствуют те или иные
аминокислоты.
Именно
поэтому людям, которые переходят к вегетарианству, нужно быть внимательными к
своему рациону. Так как полноценными являются животные белки, от которых они
отказались. И далеко не все растительные, на
которые они перешли, являются полноценными.
Хотя
та же соя заменяет мясо на 100%. Так как содержит все восемь незаменимых
для человека аминокислот: треонин, фенилаланин, лизин, триптофан, валин,
метионин, лейцин и изолейцин. В детском возрасте к ним добавляются аргинин
В детском возрасте к ним добавляются аргинин
и гистидин.
А
вот вашему вниманию все белокобразующие аминокислоты
и их общепринятые сокращения.
Запоминать
это сейчас не нужно, но в дальнейшем с этими названиями и сокращениями вы
будете работать. Не пугайтесь и привыкайте.
Каким
образом происходит соединение аминокислот в белковые цепочки?
Благодаря
наличию всё тех же функциональных групп, обуславливающих высокую реакционную
способность аминокислот.
Аминогруппа
одной аминокислоты способна взаимодействовать с карбоксильной группой другой
аминокислоты. При этом образуется молекула воды и так называемая пептидная
связь. Запомните, пептидная связь – это ковалентная связь между
атомом азота аминогруппы одной аминокислоты и атомом углерода карбоксильной
группы другой аминокислоты. Образующаяся молекула представляет собой
дипептид.
Поскольку
на одном конце дипептида находится свободная аминогруппа, а на другом –
свободная карбоксильная группа, дипептид может присоединять к себе другие
аминокислоты.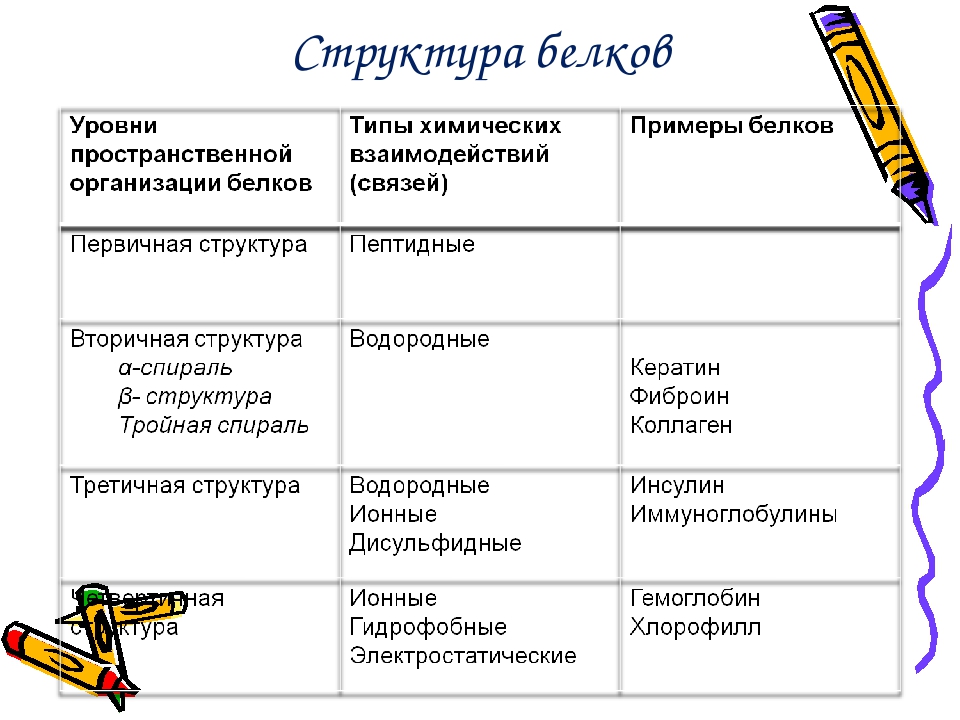 Если таким образом собираются пептиды, содержащие до 10 остатков
Если таким образом собираются пептиды, содержащие до 10 остатков
аминокислот, они называются олигопептидами.
Если больше 10-ти – полипептидами. В организме человека пептидами
являются многие гормоны, такие, как глюкагон, вазопрессин, окситоцин и
другие. Также пептидами по химической природе являются антибиотик грамицидин,
дифтерийный токсин и так далее.
Итак,
мы сказали, что белки состоят из аминокислот, аминокислоты соединяются в
цепочки, которые называются олигопептидами и
полипептидами. А где же тогда белки? Белками называются полипептиды,
содержащие от пятидесяти до нескольких тысяч аминокислот. То есть любой
белок есть полипептид, но не каждый полипептид есть белок.
В
состав белков могут входить не только аминокислоты. Если белок содержит
компоненты неаминокислотной природы, то такой белок
относят к сложным. Простые белки состоят только из аминокислот.
Структуры
белковых молекул.
Углеводы
и липиды, которые вы уже изучили, как и абсолютное большинство других веществ
на этом своё строение заканчивают. Что имеется ввиду? Свойства этих веществ
Что имеется ввиду? Свойства этих веществ
зависят только от цепочки соединённых между собой атомов. Других вариантов
строения практически не существует, а значит и свойства, и роль в организмах
живых существ всегда одна и та же.
С
белками всё гораздо сложнее, а поэтому намного интереснее.
Просто
цепочка (на первый взгляд
просто, конечно же) аминокислот, соединённых друг с другом в
полипептид, образует так называемую первичную структуру белковой
молекулы.
Она является самой важной, так как именно она определяет
конечные форму, структуру и, наконец, функции белка.
Если мы внимательно рассмотрим первичную структуру белка,
то обнаружим там атомы с разной электроотрицательностью. Поэтому при попадании
этого белка в воду между атомами кислорода остатков карбоксильной группы и
атомами водорода остатков аминогруппы возникнут водородные связи. Из-за
особенностей пространственного расположения атомов, это будет происходить через
определённый промежуток – с первой аминокислоты
на пятую, со второй – на шестую и так далее.
В результате наша “просто цепочка” свернётся в спираль.
Или, точнее, в альфа-спираль.
Но возможен и вот такой вариант соединения белковых
цепочек между собой водородными связями. Это так называемый складчатый слой
или β-слой.
Спиральная структура характерна, например, для белка кератина,
составляющего наши с вами волосы и ногти.
А вот натуральный шёлк состоит из белка фиброина,
который имеет уже складчатую структуру.
Итак, мы с вами рассмотрели вторичную структуру
белка. Она поддерживается водородными связями и может быть представлена либо
альфа-спиралью, либо складчтым бета-слоем.
Третичная
структура.
На
цепочках, спиралях и слоях ещё всё не заканчивается, а можно сказать, только
начинается.
Об
этом не знали вплоть до 1959 года. Кстати, как и о вторичной структуре. Так
вот, только в 1959 году (а это относительно совсем недавно) в результате
исследований, растянувшихся на несколько лет, Джон Кендрью
и Макс Перуц
методом
рентгеноструктурного анализа определили структуры миоглобина (белка мышечной
ткани) и гемоглобина (белка эритроцитов крови), а также предложили модели их
молекул.
В
1962 году за свои работы они были удостоены Нобелевской премии.
Что
же представляет из себя третичная структура белка?
Изображение всё того же миоглобина говорит нам о том, что это нечто округлое и
шарообразное.
Подтверждение
этому находим и в названии белка. Мио от греч. mys,
родительный падеж myos – мышца и
латинского globus – шар.
Сворачивание
спиральной структуры белка происходит под воздействием водородных связей между
разными группами атомов, гидрофобно-гидрофильных взаимодействий (когда
гидрофобные части молекулы как бы прячутся от воды внутрь её), а также так
называемых серных мостиков между атомами серы в остатках аминокислоты цистеина.
И
четвертичная структура.
Этой
структурой обладают не все белки. Образование четвертичной структуры происходит
тогда, когда несколько полипептидов с третичной структурой соединяются в
комплекс.
Рассмотрим это на примере известного всем гемоглобина. Четыре полипептидные
Четыре полипептидные
глобулы здесь связываются в комплекс с небелковой частью – гемом.
Перед нами пример сложного белка, о которых мы говорили выше.
Сложность
структуры белковых молекул обуславливает разнообразие функций, свойственных
этим биополимерам. Но в тоже время и их неустойчивость. Под влиянием самых
различных факторов белковые молекулы способны изменять свою структуру.
Процесс
нарушения природной структуры белка без разрушения первичной структуры
называется денатурацией. С утратой своей структуры белковая молекула
теряет способность выполнять свои функции.
Зачастую
денатурация необратима. Но в некоторых случаях при устранении повреждающего
фактора белок может восстанавливать своё природное строение. Это пример ренатурации.
3.4 Белки — Биология для курсов AP®
Цели обучения
В этом разделе вы исследуете следующие вопросы:
- Каковы функции белков в клетках и тканях?
- Какая связь между аминокислотами и белками?
- Каковы четыре уровня белковой организации?
- Какая связь между формой и функцией белка?
Соединение для AP
® Курсы
Белки представляют собой длинные цепи различных последовательностей из 20 аминокислот, каждая из которых содержит аминогруппу (-NH 2 ), карбоксильную группу (-COOH) и вариабельную группу.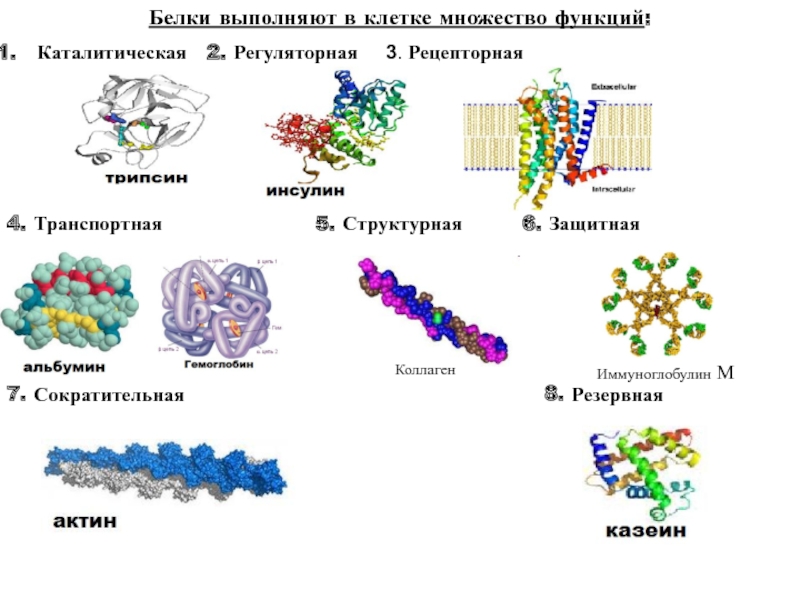 (Подумайте, сколько белковых «слов» можно составить из 20 «букв» аминокислот). Каждая аминокислота связана со своим соседом пептидной связью, образованной в результате реакции дегидратации. Длинная цепь аминокислот известна как полипептид. Белки выполняют в клетках множество функций. Они действуют как ферменты, которые катализируют химические реакции, обеспечивают структурную поддержку, регулируют прохождение веществ через клеточную мембрану, защищают от болезней и координируют сигнальные пути клетки. Структура белка организована на четырех уровнях: первичном, вторичном, третичном и четвертичном.Первичная структура — это уникальная последовательность аминокислот. Изменение только одной аминокислоты может изменить структуру и функцию белка. Например, серповидно-клеточная анемия возникает в результате замены одной аминокислоты в молекуле гемоглобина, состоящей из 574 аминокислот. Вторичная структура состоит из локального сворачивания полипептида за счет образования водородной связи; приводящие к конформациям α-спирали и β-складчатого листа.
(Подумайте, сколько белковых «слов» можно составить из 20 «букв» аминокислот). Каждая аминокислота связана со своим соседом пептидной связью, образованной в результате реакции дегидратации. Длинная цепь аминокислот известна как полипептид. Белки выполняют в клетках множество функций. Они действуют как ферменты, которые катализируют химические реакции, обеспечивают структурную поддержку, регулируют прохождение веществ через клеточную мембрану, защищают от болезней и координируют сигнальные пути клетки. Структура белка организована на четырех уровнях: первичном, вторичном, третичном и четвертичном.Первичная структура — это уникальная последовательность аминокислот. Изменение только одной аминокислоты может изменить структуру и функцию белка. Например, серповидно-клеточная анемия возникает в результате замены одной аминокислоты в молекуле гемоглобина, состоящей из 574 аминокислот. Вторичная структура состоит из локального сворачивания полипептида за счет образования водородной связи; приводящие к конформациям α-спирали и β-складчатого листа. В третичной структуре различные взаимодействия, например водородные связи, ионные связи, дисульфидные связи и гидрофобные взаимодействия между группами R, способствуют укладке полипептида в различные трехмерные конфигурации.Большинство ферментов имеют третичную конфигурацию. Если белок денатурируется, теряет свою трехмерную форму, он может больше не функционировать. Условия окружающей среды, такие как температура и pH, могут денатурировать белки. Некоторые белки, такие как гемоглобин, образованы из нескольких полипептидов, и взаимодействия этих субъединиц образуют четвертичную структуру белков.
В третичной структуре различные взаимодействия, например водородные связи, ионные связи, дисульфидные связи и гидрофобные взаимодействия между группами R, способствуют укладке полипептида в различные трехмерные конфигурации.Большинство ферментов имеют третичную конфигурацию. Если белок денатурируется, теряет свою трехмерную форму, он может больше не функционировать. Условия окружающей среды, такие как температура и pH, могут денатурировать белки. Некоторые белки, такие как гемоглобин, образованы из нескольких полипептидов, и взаимодействия этих субъединиц образуют четвертичную структуру белков.
Представленная информация и примеры, выделенные в разделе, вспомогательные концепции и цели обучения, изложенные в Большой идее 4 Структуры учебной программы по биологии AP ® .Цели обучения, перечисленные в структуре учебной программы, обеспечивают прозрачную основу для курса биологии AP ® , лабораторного опыта на основе запросов, учебных мероприятий и вопросов экзамена AP ® .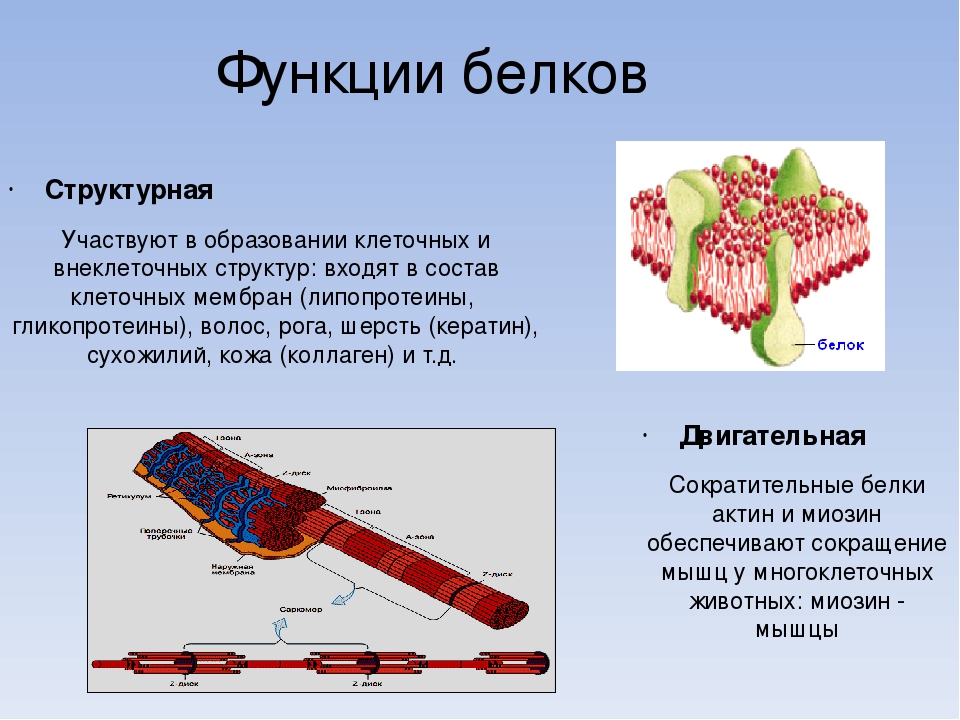 Цель обучения объединяет требуемый контент с одной или несколькими из семи научных практик.
Цель обучения объединяет требуемый контент с одной или несколькими из семи научных практик.
| Большая идея 4 | Биологические системы взаимодействуют, и эти системы и их взаимодействия обладают сложными свойствами. |
| Постоянное понимание 4.A | Взаимодействия внутри биологических систем приводят к появлению сложных свойств. |
| Основные знания |
4.A.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 7,1 Учащийся может связывать явления и модели в пространственных и временных масштабах. |
| Цель обучения | 4,1 Учащийся может объяснить связь между последовательностью и подкомпонентами биологического полимера и его свойствами. 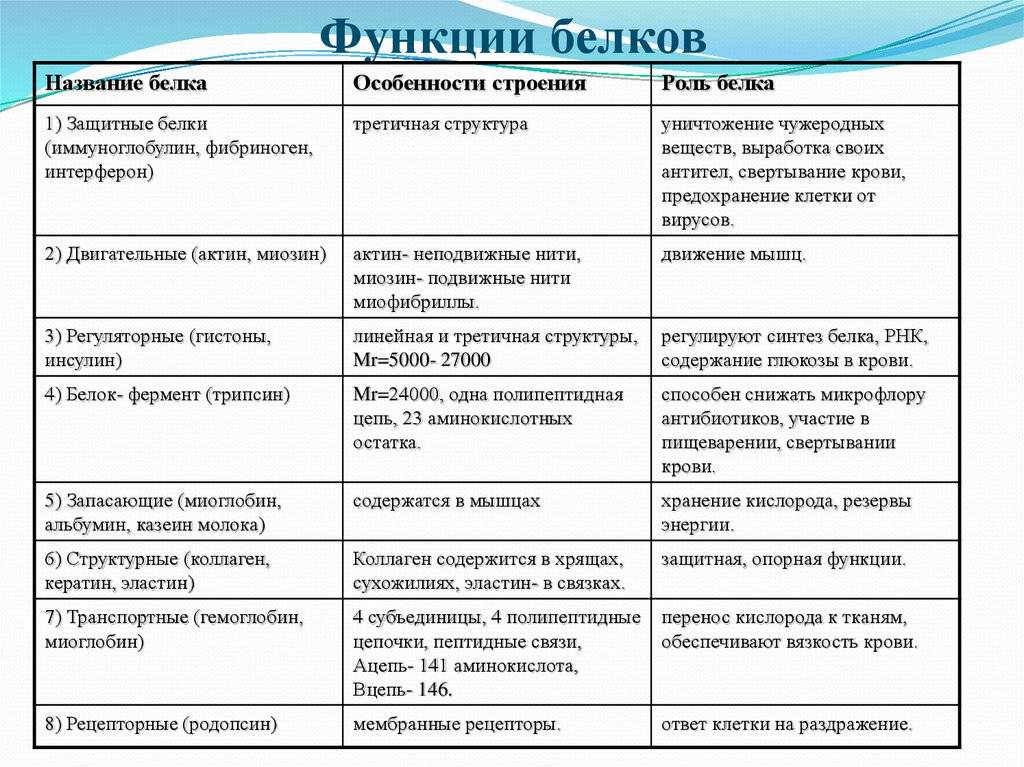
|
| Основные знания |
4.A.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 1.3 Студент может уточнить представления и модели природных или антропогенных явлений и систем в предметной области. |
| Цель обучения | 4,2 Учащийся может уточнить представления и модели, чтобы объяснить, как подкомпоненты биологического полимера и их последовательность определяют свойства этого полимера. |
| Основные знания |
4.A.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 6,1 Студент может обосновать свои претензии доказательствами. |
| Научная практика | 6,4 Студент может делать утверждения и предсказания о природных явлениях на основе научных теорий и моделей. 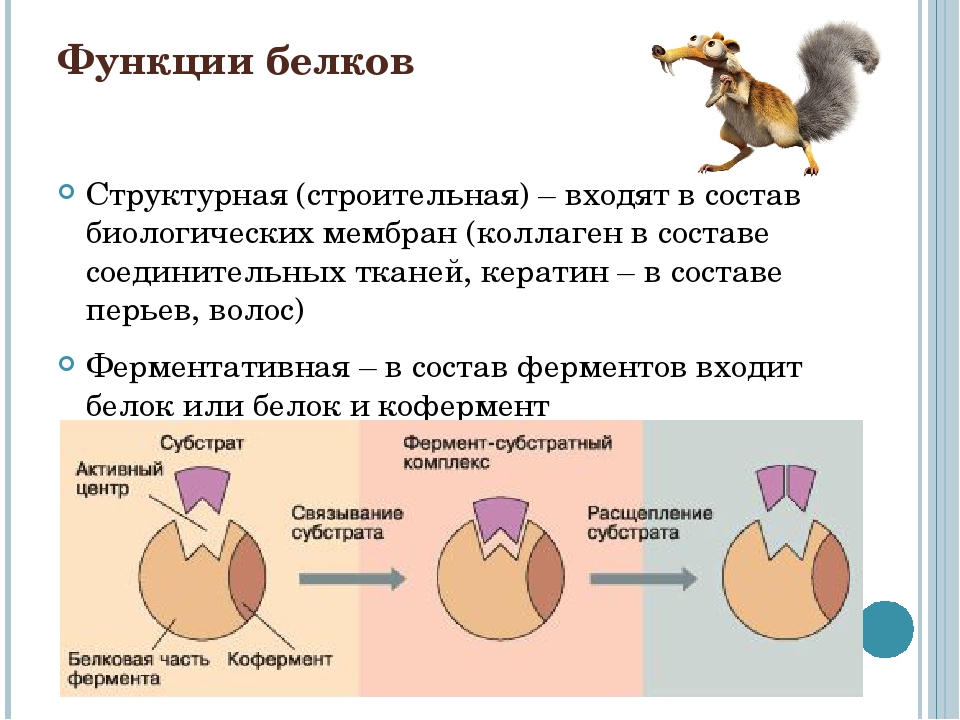
|
| Цель обучения | 4,3 Учащийся может использовать модели для прогнозирования и обоснования того, что изменения в подкомпонентах биологического полимера влияют на функциональность молекул. |
Поддержка учителей
Двадцать аминокислот могут быть преобразованы в практически неограниченное количество различных белков. Последовательность аминокислот в конечном итоге определяет окончательную конфигурацию белковой цепи, придавая молекуле ее специфическую функцию.
Поддержка учителей
Подчеркните, что белки выполняют в организме множество функций. Таблица 3.1 содержит несколько примеров этих функций. Обратите внимание, что не все ферменты работают в одинаковых условиях.Амилаза работает только в щелочной среде, такой как слюна, в то время как пепсин действует в кислой среде желудка. Обсудите другие материалы, которые могут переноситься белками в жидкостях организма в дополнение к веществам, перечисленным в тексте для транспортировки. Белки также переносят нерастворимые липиды в организме и заряженные ионы, такие как кальций, магний и цинк. Обсудите еще один важный структурный белок, коллаген, который содержится во всем теле, в том числе в большинстве соединительных тканей. Подчеркните, что не все гормоны являются белками и что гормоны на основе стероидов обсуждались в предыдущем разделе.
Обсудите другие материалы, которые могут переноситься белками в жидкостях организма в дополнение к веществам, перечисленным в тексте для транспортировки. Белки также переносят нерастворимые липиды в организме и заряженные ионы, такие как кальций, магний и цинк. Обсудите еще один важный структурный белок, коллаген, который содержится во всем теле, в том числе в большинстве соединительных тканей. Подчеркните, что не все гормоны являются белками и что гормоны на основе стероидов обсуждались в предыдущем разделе.
Аминогруппа аминокислоты теряет электрон и становится положительно заряженной. Карбоксильная группа легко получает электрон, становясь отрицательно заряженным. Это приводит к амфипатическим характеристикам аминокислот и придает соединениям растворимость в воде. Присутствие обеих функциональных групп также позволяет дегидратационному синтезу объединять отдельные аминокислоты в пептидную цепь.
Структура белка объясняется так, как будто она состоит из трех-четырех дискретных этапов.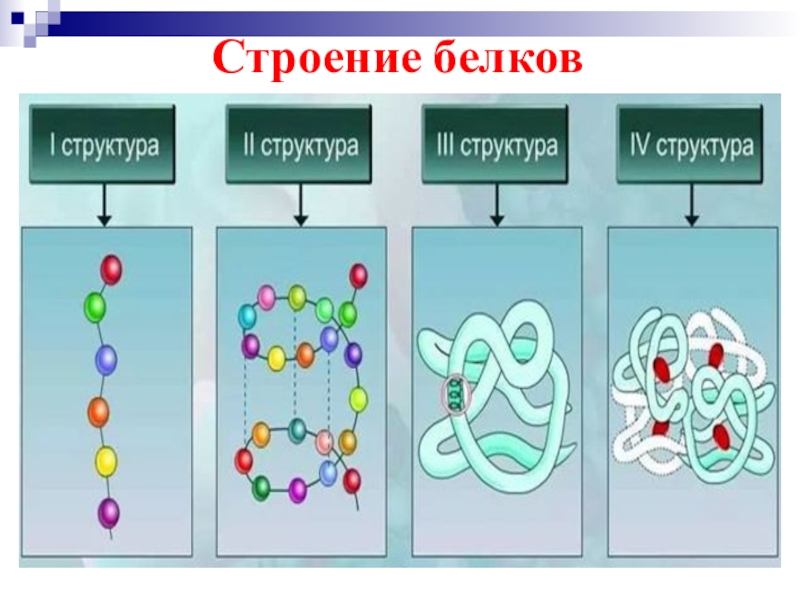 В действительности структурные изменения, в результате которых образуется функциональный белок, происходят непрерывно. Поскольку первичная структура формируется из рибосом, полипептидная цепь претерпевает изменения, пока не будет достигнута окончательная конфигурация. Предложите учащимся представить себе нитку спагетти, готовящуюся в прозрачной посуде. Изначально прядь прямая (в этом примере не обращайте внимания на жесткость). Во время приготовления нить будет изгибаться, скручиваться и (опять же, в этом примере) складываться в неплотный шар, состоящий из нити макаронных изделий.Полученная прядь имеет особую форму. Спросите студентов, какие типы химических связей или сил могут влиять на структуру белка. Эти формы продиктованы положением аминокислот вдоль нити. Другие силы завершат складывание и поддержат конструкцию.
В действительности структурные изменения, в результате которых образуется функциональный белок, происходят непрерывно. Поскольку первичная структура формируется из рибосом, полипептидная цепь претерпевает изменения, пока не будет достигнута окончательная конфигурация. Предложите учащимся представить себе нитку спагетти, готовящуюся в прозрачной посуде. Изначально прядь прямая (в этом примере не обращайте внимания на жесткость). Во время приготовления нить будет изгибаться, скручиваться и (опять же, в этом примере) складываться в неплотный шар, состоящий из нити макаронных изделий.Полученная прядь имеет особую форму. Спросите студентов, какие типы химических связей или сил могут влиять на структуру белка. Эти формы продиктованы положением аминокислот вдоль нити. Другие силы завершат складывание и поддержат конструкцию.
Проблемные вопросы по научной практике содержат дополнительные тестовые вопросы для этого раздела, которые помогут вам подготовиться к экзамену AP. Эти вопросы касаются следующих стандартов:
[APLO 1.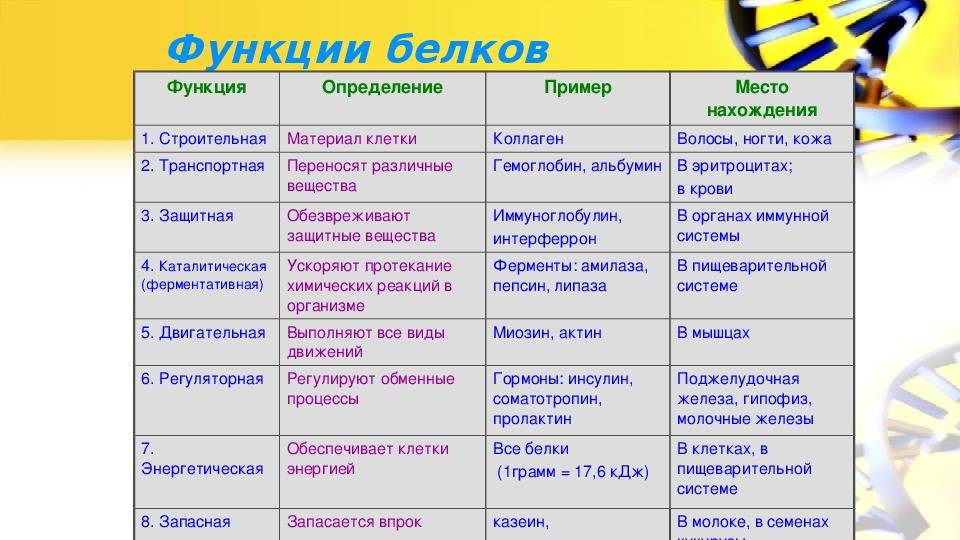 14] [APLO 2.12] [APLO 4.1] [APLO 4.3] [APLO 4.15] [APLO 4.22]
14] [APLO 2.12] [APLO 4.1] [APLO 4.3] [APLO 4.15] [APLO 4.22]
Типы и функции белков
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются.Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Ферменты, которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или конъюгированные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях разложения, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами.Следует отметить, что все ферменты увеличивают скорость реакции и, следовательно, считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.
Фермент может помочь в реакциях разложения, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами.Следует отметить, что все ферменты увеличивают скорость реакции и, следовательно, считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.
Гормоны — это химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.Основные типы и функции белков перечислены в таблице 3.1.
Типы и функции белков
| Примеры | Функции | |
|---|---|---|
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи путем катаболизма питательных веществ до мономерных единиц |
| Транспорт | Гемоглобин, альбумин | Переносит вещества в крови или лимфе на протяжении всего организма. тело |
| Структурный | Актин, тубулин, кератин | Создание различных структур, таких как цитоскелет |
| Гормоны | Инсулин, тироксин | Координация активности различных систем организма |
| Защита | Иммуноглобулины | Защитить организм от чужеродных патогенов |
| Сократимость | Актин, миозин | Эффект сокращения мышц |
| Хранение | Запасные белки бобовых, яичный белок (альбумин) | Обеспечить питание в раннем развитии эмбриона и саженец 9 0042 |
Таблица 3. 1
1
Белки имеют разную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин — это глобулярный белок, а коллаген, обнаруженный в нашей коже, — это волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается многими различными типами химических связей. Изменения температуры, pH и воздействие химикатов могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация.Все белки состоят из 20 наиболее распространенных типов аминокислот.
Аминокислоты
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и атом водорода. У каждой аминокислоты также есть другой атом или группа атомов, связанных с центральным атомом, известная как группа R (Рисунок 3.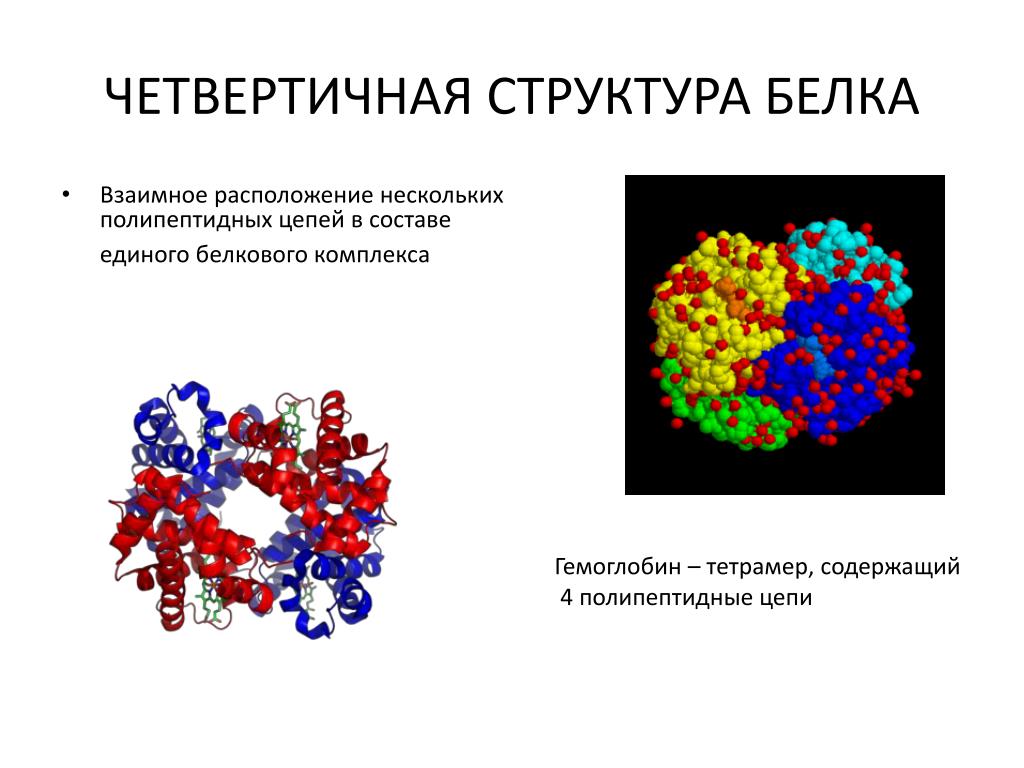 24).
24).
Рис. 3.24. Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (R-группа).
Название «аминокислоты» происходит от того факта, что они содержат как аминогруппу, так и карбоксильно-кислотную группу в своей основной структуре. Как уже упоминалось, в белках присутствует 20 распространенных аминокислот. Девять из них считаются незаменимыми аминокислотами у человека, потому что человеческий организм не может их производить, и они получают с пищей.Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. 3.25).
Визуальное соединение
Рис. 3.25. Обычно в белках содержится 20 общих аминокислот, каждая из которых имеет свою группу R (группа вариантов), которая определяет его химическую природу.
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри?
- Полярные и заряженные аминокислоты будут находиться на поверхности.
 Неполярные аминокислоты можно найти в интерьере.
Неполярные аминокислоты можно найти в интерьере. - Полярные и заряженные аминокислоты будут найдены в интерьере. Неполярные аминокислоты будут обнаружены на поверхности.
- Неполярные и незаряженные белки можно найти как на поверхности, так и внутри.
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R.Аминокислоты, такие как валин, метионин и аланин, неполярны или гидрофобны по природе, тогда как аминокислоты, такие как серин, треонин и цистеин, полярны и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры анимокислоты, поскольку его аминогруппа не отделена от боковой цепи (Рисунок 3.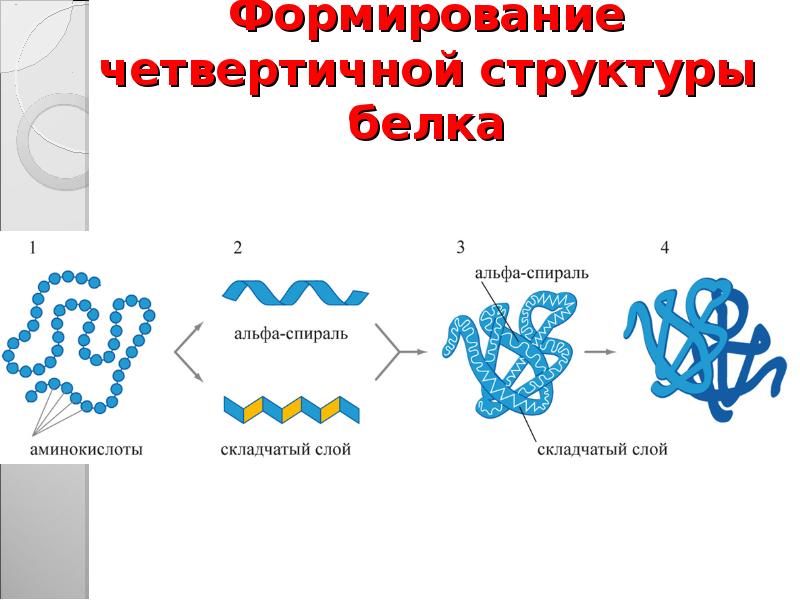 25).
25).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением. Например, валин обозначается буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, а у людей они включают изолейцин, лейцин и цистеин. Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не производятся организмом; Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Полученная связь является пептидной связью (рис. 3.26).
3.26).
Рис. 3.26. Образование пептидной связи — это реакция синтеза дегидратации.Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом выделяется молекула воды.
Продукты, образованные такими связями, называются пептидами. По мере того, как к этой растущей цепи присоединяется больше аминокислот, полученная цепь называется полипептидом. Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец.Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются.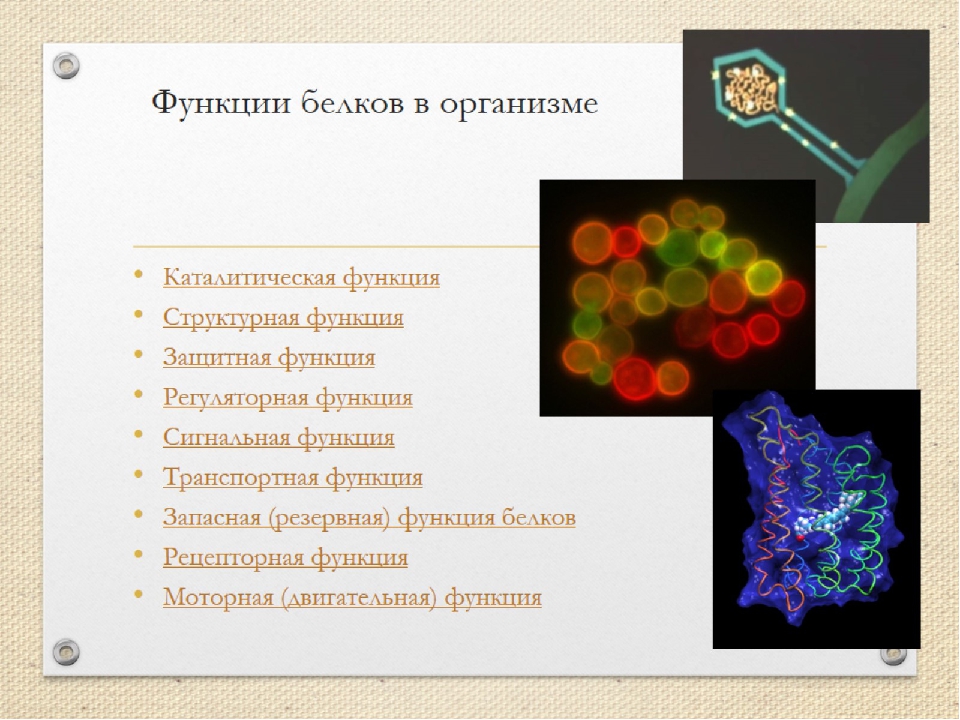 Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению или фосфорилированию или могут потребовать добавления других химических групп.Только после этих модификаций белок становится полностью функциональным.
Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению или фосфорилированию или могут потребовать добавления других химических групп.Только после этих модификаций белок становится полностью функциональным.
Ссылка на обучение
Просмотрите этапы синтеза белка в этом интерактивном руководстве.
Почему процесс синтеза белка так важен для жизни?
- Белок — предпочтительный источник энергии для организма для быстрого производства энергии.
- Белок хранится в печени и мышцах, обеспечивая энергию для использования в будущем.
- Белок необходим для образования тканей и состоит из гормонов и ферментов.
- Белки необходимы для усвоения всех жирорастворимых витаминов.
Evolution Connection
Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточной органелле, митохондрии. Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона. Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился.Секвенирование белков показало, что существует значительная степень гомологии аминокислотной последовательности цитохрома с среди различных видов; другими словами, эволюционное родство можно оценить путем измерения сходства или различий между последовательностями ДНК или белков различных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с от разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с.Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Белковая последовательность цитохрома с шимпанзе и человека идентична. Последовательность белка цитохрома с макак-резусов отличается от последовательности человека на одну аминокислоту.Что предлагают эти сравнения?
- Обезьяны-резусы более близки к людям, чем шимпанзе.
- Шимпанзе более тесно связаны с макаками-резусами, чем с людьми.
- Люди родственны шимпанзе, но не связаны с макаками-резусами.
- Шимпанзе более тесно связаны с людьми, чем макаки-резусы.
Структура белка
Как обсуждалось ранее, форма белка имеет решающее значение для его функции.Например, фермент может связываться со специфическим субстратом в сайте, известном как активный сайт. Если этот активный сайт изменяется из-за локальных изменений или изменений в общей структуре белка, фермент может быть неспособен связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Уникальная последовательность аминокислот в полипептидной цепи — это ее первичная структура.Например, гормон поджелудочной железы инсулин имеет две полипептидные цепи, А и В, и они связаны между собой дисульфидными связями. N-концевой аминокислотой A-цепи является глицин, а C-концевой аминокислотой — аспарагин (рис. 3.27). Последовательности аминокислот в цепях A и B уникальны для инсулина.
Рис. 3.27. Инсулин бычьей сыворотки — это белковый гормон, состоящий из двух пептидных цепей: A (длиной 21 аминокислота) и B (длиной 30 аминокислот). В каждой цепи первичная структура обозначена трехбуквенными сокращениями, которые представляют названия аминокислот в порядке их присутствия.Аминокислота цистеин (cys) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи A и B вместе, а третья помогает цепи A складываться в правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности показаны разные размеры.
Уникальная последовательность каждого белка в конечном итоге определяется геном, кодирующим этот белок. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка.При серповидно-клеточной анемии цепь гемоглобина β (небольшая часть которой показана на рис. 3.28) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка. В частности, аминокислота глутаминовая кислота заменена валином в цепи β . Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Таким образом, молекула содержит около 600 аминокислот.Структурное различие между нормальной молекулой гемоглобина и молекулой серповидноклеточных клеток — что резко снижает продолжительность жизни — состоит в одной из 600 аминокислот. Что еще более примечательно, так это то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, и мутация вызвано одним изменением основания (точечной мутацией), 1 из 1800 оснований.
Рис. 3.28. Бета-цепь гемоглобина имеет длину 147 остатков, однако единственная аминокислотная замена приводит к серповидно-клеточной анемии.В нормальном гемоглобине аминокислота в седьмом положении — глутамат. В серповидно-клеточном гемоглобине этот глутамат заменен валином.
Из-за этого изменения одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые искажают двояковогнутые или дискообразные красные кровяные тельца и заставляют их принимать серповидную или серповидную форму, что закупоривает кровеносные сосуды ( Рисунок 3.29). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у людей, страдающих этим заболеванием.
Рис. 3.29. В этом мазке крови, визуализированном при 535-кратном увеличении с помощью светлопольной микроскопии, серповидные клетки имеют форму полумесяца, тогда как нормальные клетки имеют форму диска. (кредит: модификация работы Эда Усмана; данные шкалы от Мэтта Рассела)
Вторичная структура
Локальное сворачивание полипептида в некоторых областях приводит к вторичной структуре белка. Наиболее распространенными являются α -спиральная и β -гофрированная листовые структуры (Рисунок 3.30). Обе структуры удерживаются вместе водородными связями. В структуре α -спирали водородные связи образуются между атомом кислорода в карбонильной группе в одной аминокислоте и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Рис. 3.30. Спираль α и складчатый лист β являются вторичными структурами белков, которые образуются из-за водородных связей между карбонильными и аминогруппами в основе пептида. Некоторые аминокислоты имеют склонность образовывать α -спираль, в то время как другие имеют склонность образовывать складчатый лист β .
Каждый виток в альфа-спирали содержит 3,6 аминокислотных остатка. Группы R (вариантные группы) полипептида выступают из -спиральной цепи . В листе с складками β «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи. Группы R прикреплены к атомам углерода и проходят выше и ниже складок складки. Гофрированные сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом водорода в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе основной цепи пептида.Спиральные структуры α и складчатые листы β обнаружены в большинстве глобулярных и волокнистых белков, и они играют важную структурную роль.
Третичная структура
Уникальная трехмерная структура полипептида — это его третичная структура (рис. 3.31). Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка.Природа групп R, присутствующих в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные группы R неполярных аминокислот лежат внутри белка, тогда как гидрофильные группы R лежат снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственную ковалентную связь, образующуюся во время сворачивания белка.
Рис. 3.31. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Все эти взаимодействия, сильные и слабые, определяют окончательную трехмерную форму белка. Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки образованы из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар. Инсулин начинается как отдельный полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи.Шелк (волокнистый белок), однако, имеет складчатую листовую структуру β , которая является результатом водородных связей между различными цепями.
Четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный) показаны на рис. 3.32.
Рис. 3.32 На этих иллюстрациях можно увидеть четыре уровня белковой структуры. (кредит: модификация работы Национального исследовательского института генома человека)
Денатурация и сворачивание белка
Каждый белок имеет свою уникальную последовательность и форму, которые удерживаются вместе за счет химических взаимодействий.Если белок подвержен изменениям температуры, pH или воздействию химических веществ, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в так называемой денатурации. Денатурация часто обратима, поскольку первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, позволяя белку возобновить свою функцию. Иногда денатурация необратима, что приводит к потере функции. Одним из примеров необратимой денатурации белка является жарение яйца.Белок альбумина в жидком яичном белке денатурируется при помещении на горячую сковороду. Не все белки денатурируются при высоких температурах; например, бактерии, которые выживают в горячих источниках, содержат белки, функционирующие при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки как часть процесса пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции.Первоначально считалось, что сами белки несут ответственность за процесс сворачивания. Только недавно было обнаружено, что часто они получают помощь в процессе сворачивания от белков-помощников, известных как шапероны (или шаперонины), которые связываются с целевым белком во время процесса сворачивания. Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и отделяются от белка, как только целевой белок сворачивается.
Ссылка на обучение
Чтобы получить дополнительную информацию о белках, просмотрите этот анимационный ролик под названием «Биомолекулы: белки.”
Веганы — это люди, которые не употребляют в пищу продукты животного происхождения. Почему веганам нужно уделять особое внимание белку, который они едят?
- Растительные белки содержат все незаменимые и заменимые аминокислоты.
- Сложнее получить все незаменимые аминокислоты из отдельных растительных источников.
- Растительные белки содержат только заменимые аминокислоты.
- Белки растений не содержат всех незаменимых аминокислот, но содержат незаменимые аминокислоты.
Подключение к научной практике для курсов AP®
Подумай об этом
- Предскажите, что произойдет, если даже одна аминокислота будет заменена другой в полипептиде, и представьте конкретный пример.
- Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой мембраны плазматической клетки?
Деятельность
Сворачивание — важное свойство белков, особенно ферментов.Белки имеют узкий диапазон условий, в которых они правильно сворачиваются; вне этого диапазона белки могут разворачиваться (денатурироваться) и часто не могут складываться заново и снова становиться функциональными. Изучите одно заболевание, которое возникает из-за неправильного сворачивания белка. Опишите причины разворачивания и последствия для молекулярной структуры полипептида, которые приводят к заболеванию.
Поддержка учителей
Первый вопрос «Подумай об этом» — это применение цели обучения 4.3 и научных практик 6.1 и 6.4, потому что студенты предсказывают, как изменение подкомпонентов молекулы может повлиять на свойства молекулы.
Второй вопрос «Подумай об этом» — это применение Задачи обучения 4.2 и Практики 1.3, потому что учащиеся используют представления молекул вместе с моделью клеточной мембраны, чтобы описать, как молекулярная структура аминокислот определяет их расположение с белком или другим. структура, такая как бислой фосфолипидов.
Это упражнение является применением Задачи обучения 4.1 и научная практика 7.1, цель обучения 4.2 и научная практика 1.3, а также цель обучения 4.3 и научная практика 6.1 и 6.4, потому что студентов просят объяснить, как факторы окружающей среды могут изменить молекулярную структуру белка и как это изменение может привести к изменению в функции, то есть болезни.
Структура белка | BioNinja
Понимание:
• Последовательность и количество аминокислот в полипептиде являются первичной структурой
Первичная (1º) структура
- Первый уровень структурной организации в белке — это порядок / последовательность аминокислот , которые составляют полипептидную цепь
- Первичная структура образована ковалентными пептидными связями между амино и карбоксильные группы соседних аминокислот
- Первичная структура контролирует все последующие уровни организации белка, поскольку она определяет характер взаимодействий между группами R различных аминокислот
Понимание:
• Вторичная структура представляет собой образование α-спиралей и β-складчатых листов, стабилизированных водородными связями
Вторичная (2º) структура
- Вторичная структура — это способ сворачивания полипептида в повторяющуюся структуру с образованием α- спиралей и β-складчатых листов
- Это складывание является результатом водородных связей между аминогруппами и карбоксильными группами несмежных аминокислот
- Последовательности, которые не образуют ни альфа-спирали, ни бета-складчатого листа, будут существовать в виде случайной спирали
- Вторичная структура обеспечивает полипептидную цепь с уровень механической устойчивости (из-за наличия водородных связей)
- На рисунках альфа-спирали представлены в виде спиралей (фиолетовый; слева) и бета-гофрированные листы в виде стрелок (синий; справа)
Понимание:
• Третичная структура — это дальнейшее сворачивание полипептида, стабилизируемое взаимодействиями между группами R
Третичная (3º) структура
- Третичная структура — это то, как полипептидная цепь скручивается и поворачивается, образуя сложную молекулярную форму (т.е.е. 3D-форма )
- Это вызвано взаимодействиями между группами R ; включая Н-связи, дисульфидные мостики, ионные связи и гидрофобные взаимодействия
- Важны относительные положения аминокислот (например, неполярные аминокислоты обычно избегают воздействия водных растворов)
- Третичная структура может быть важной для функции белка (например, специфичность активного центра ферментов)
Понимание:
• Четвертичная структура существует в белках с более чем одной полипептидной цепью
Четвертичная (4º) структура
- Множественные полипептиды или простетических групп могут взаимодействовать с образованием одного, более крупного, биологически активного белка (четвертичная структура)
- Простетическая группа — это неорганическое соединение, участвующее в структуре белка или функция (например,грамм. группа гема в гемоглобине)
- Белок, содержащий простетическую группу, называется конъюгированным белком
- Четвертичные структуры могут удерживаться вместе различными связями (аналогично третичной структуре)
Краткое описание четырех уровней структуры белка
Код минимальной последовательности для переключения структуры и функции белка
Реферат
Мы представляем здесь структурное и механистическое описание того, как белок меняет структуру и функцию, мутация за мутацией.Наш подход заключался в создании 2 белков, которые ( i ) стабильно уложены в 2 разных складки, ( ii ) имеют 2 разные функции и ( iii ) очень похожи по последовательности. В этом упрощенном пространстве последовательностей мы исследуем мутационный путь от одной складки к другой. Мы показываем, что связывание IgG в 4β + α-кратности может быть преобразовано в 3-α-кратное связывание с альбумином посредством мутационного пути, при котором ни функция, ни нативная структура не теряются полностью. Стабильность всех мутантов на пути оценивается, ключевые структуры с высоким разрешением определяются с помощью ЯМР, и предоставляется объяснение механизма переключения.Мы показываем, что конформационный переход от структуры 4β + α к структуре 3-α может происходить посредством единственной аминокислотной замены. С одной стороны от точки переключения 4β + α-кратность заселена> 90% (pH 7,2, 20 ° C). Одиночная мутация переключает конформацию в 3-α раз, что составляет> 90% населения (pH 7,2, 20 ° C). Мы также показываем, что в точке переключения существует бифункциональный белок со сродством как к IgG, так и к альбумину.
Белковые молекулы способны самоорганизовываться в трехмерные топологии, которые создают биологические функции.Однако фундаментальные принципы того, как последовательность аминокислот в белке определяет его структуру, остаются малоизученными, несмотря на его центральное значение для биологии. Первичный подход к «проблеме сворачивания» состоял в том, чтобы определить подробное структурное и энергетическое описание равновесия между нативным состоянием и случайной популяцией неупорядоченных, развернутых состояний. Хорошо известно, что равновесие между свернутым и развернутым может быть радикально изменено в любом направлении с помощью нескольких мутаций.Однако накапливаются доказательства того, что несколько мутаций иногда могут резко сдвинуть равновесие в сторону новых третичных (и / или четвертичных) структур (1, 2). Понимание способности белка приобретать совершенно иную структуру в результате незначительного мутагенного возмущения является центральным для понимания как сворачивания белка в целом, так и, в частности, эволюции новых структур и функций белка. Большинство природных белков в значительной степени заселяют только нативное состояние, при этом ΔG разворачивается ≥5 ккал / моль.Также обычно предполагается, что для сдвига равновесия требуется много мутаций, так что ΔG , разворачивающаяся для некоторого альтернативного состояния, составляет ≥5 ккал / моль. Фактически, это предположение лежит в основе большинства методов биоинформатики. Большинство мутаций в белке, которые увеличивают его склонность к альтернативной складке, дестабилизируют исходную складку. Таким образом, кажется интуитивно понятным, что путь одиночных аминокислотных замен должен приводить к длинной серии мутантов, которые будут разворачиваться до того, как накопится достаточно информации о сворачивании, чтобы значительно заселить альтернативную складку.Тем не менее, как природные, так и сконструированные примеры демонстрируют, что пространство последовательностей, разделяющих 2 белка с разными структурами, может быть довольно небольшим (3–5). Чтобы понять эту, казалось бы, парадоксальную ситуацию, необходимо методически исследовать пространство последовательностей, разделяющее 2 устойчивые складки. По идее это просто. Первый начинается с двух стабильных белков одинакового размера, но с разными складками и мутирует один, чтобы он стал больше похож на другой, пока не произойдет переключение в структуре. Однако на практике этот подход нетривиален.Любая мутация в белке изменит контекст других аминокислот. В этом суть проблемы складывания. Таким образом, наш подход заключался в создании упрощенного пространства последовательностей, в котором можно исследовать мутационный путь от одной складки к другой, а сдвиги в равновесии между двумя свернутыми состояниями (и развернутыми состояниями) могут быть измерены как функция мутации.
Ранее мы и другие исследовали структуру, укладку и стабильность 2 связывающих доменов белка G Streptococcus (6).Белок G содержит 2 типа доменов, которые связываются с белками сыворотки крови: домен G A из 45 структурированных аминокислот, которые связываются с человеческим сывороточным альбумином (HSA) (7, 8), и домен G B из 56 структурированные аминокислоты, которые связываются с константной (Fc) областью IgG (9, 10). Природные версии доменов G A и G B не обладают значительной гомологией последовательностей и имеют разные складки, 3-α и 4β + α, соответственно. На основе этих исследований мы смогли создать версии с высокой идентичностью G A и G B , которые обладают стабильностью дикого типа и функцией связывания, но идентичны на 77%.Эти белки обозначены G A 77 и G B 77. G A 77 связывается с HSA с K d = 100 нМ и имеет ΔG разворачивания 5 ккал / моль (20 ° C, 0,1 М KPO 4 , pH 7,2) (11). Аминокислоты 1–8 и 54–56 неупорядочены в G A 77. Остальные 45 аминокислотных остатков хорошо упорядочены в пучке 3-α спиралей (12). G B 77 связывается с константной (Fc) областью IgG с K d = 100 нМ и имеет ΔG разворачивания 5 ккал / моль (20 ° C, 0.1 М КПО 4 , pH 7,2) (13, 14). Все 56 аминокислотных остатков G B 77 хорошо упорядочены в 4-х нитном β-листе с α-спиралью, соединяющей нити 2 и 3 (12). Белки были сконструированы таким образом, что связывающие эпитопы IgG и HSA кодируются в обоих белках. IgG-связывающий эпитоп является функциональным в 4 + α-кратном и латентным в 3-α кратном, тогда как альбумин-связывающий эпитоп является функциональным в 3-α-кратном и латентным в 4-кратном + α-кратном. Это приводит к экспериментальной системе, в которой разоблачение скрытой функции связано с переключением конформации (рис.1). Эта работа описана в исх. 3, 4, 11, 12 и 15. Тот факт, что G A 77 и G B 77 настолько близки в пространстве мутаций, значительно упрощает последующий поиск в пространстве последовательностей, которое их разделяет. Проблема контекста не устранена, но сведена к практически достижимому уровню. Это позволило систематически исследовать пространство последовательностей, разделяющее эти 2 функциональные складки.
Результаты
Неидентичные положения между белками G A 77 и G B 77 показаны на рис.1. Наш подход заключался в исследовании пространства бинарных последовательностей (выбор аминокислоты G A или G B в неидентичных положениях). Очевидно, что выполнение 13 последовательных замен в любом порядке соответствующей аминокислотой в неидентичном положении приведет к конформационному переключению. Однако поиск пути с наименьшим количеством неструктурированных промежуточных продуктов требует систематического подхода. Сначала мы проанализировали все 13 односайтовых мутантов в G A 77 и G B 77.Мы смогли произвести и очистить свернутые белки примерно для половины этих мутантов. Белки очищали с использованием системы тегов аффинного расщепления, которую мы разработали (16), по существу, как описано в ссылке. 3. Система позволяет проводить быструю стандартизованную очистку мутантных белков даже с низкой стабильностью. Мутанты характеризовались круговым дихроизмом (ЦД) для оценки вторичной структуры (рис. S1), термической денатурацией с помощью ЦД для оценки стабильности (рис. S2), способностью связывать HSA и IgG для оценки функции и двумерной гетероядерной однокантовой корреляцией. (HSQC) спектры с использованием ЯМР для оценки третичной структуры.Мономерное состояние было установлено с помощью эксклюзионной хроматографии и многоуглового рассеяния лазерного света. Структуры высокого разрешения были определены стандартными методами 3D ЯМР для ключевых белков. Средние точки термической денатурации (T M ) (0,1 M KPO4, pH 7,2, 20 ° C) указаны для всех свернутых мутантов в таблице 1. Мы обнаружили, что каждое положение в той или иной складке может быть мутировано без кодирования нативного состав. Ключевые мутанты на пути к конформационному переключению показаны на рис.2. Была обнаружена гетероморфная пара с 88% идентичностью (G A 88 и G B 88b), в которой стабильность и функции остаются аналогичными некоторым природным связывающим доменам IgG и HSA. Сборка гетероморфных пар с идентичностью более 88% также была возможна, хотя дополнительная мутация приводит к падению стабильности ниже порогового значения, наблюдаемого для большинства природных белков. Пара G A 91 и G B 91 имеет ΔG при разворачивании > 3 ккал / моль при 20 ° C. Оба белка демонстрируют не сниженную аффинность связывания с соответствующими лигандами и являются мономерными.
Рисунок 1.
G A 77 в комплексе с HSA (из 1TFO.pdb) (36) и G B 77 в комплексе в IgG (из 1fcc.pdb) (37). Боковые цепи аминокислот в 13 неидентичных положениях изображены в виде желтых палочек.
Таблица 1.
Очищенные мутанты
Рис. 2.
Выравнивание последовательностей белков 3-α G A ( Top ) и белков 4β + α G B ( Bottom ) описано в тексте. Области вторичной структуры для G A 95 и G B 95 показаны вверху и внизу совмещения, соответственно.13 неидентичностей между G A 77 и G B 77 показаны голубым цветом, 7 неидентичностей между G A 88 и G B 88 зеленым цветом, 4 неидентичности между G A 91 и G B 91 синим цветом, 3 неидентичности между G A 95 и G B 95 — желтым, а разность одной аминокислоты между G A 98 и G B 98 в остатке 45 — красным.
Бинарное пространство мутаций, разделяющее G A 91 и G B 91, состоит только из 32 последовательностей.Мы сконструировали, экспрессировали и очистили 17 из этих вариантов, чтобы эффективно выбрать пространство последовательностей (таблицы 1 и S1). Основные наблюдения сводятся к следующему. Мутация Y33I мало влияет на стабильность в 4β + α-кратности (-0,1 ккал / моль), а мутация L50K оказывает наименьшее влияние на стабильность в 3-α-кратности (−1,0 ккал / моль). Мутация в положении 20, 33 или 45 недопустима в 3-α кратности ни в одном из 32 контекстов (Таблица S1). Мутация в положении 30, 45 или 50 недопустима в 4β + α-фолде ни в одном из контекстов.Единственным положением, которое не может быть изменено ни в одной из складок (без его разворачивания), было положение 45. Восемь из 17 белков были преимущественно свернуты в одну из нативных структур: четыре были 3-α и 4 были 4β + α. Из 9 «развернутых» белков все были очищены, и CD можно было увидеть, что они имеют значительное содержание вторичной структуры. Точный характер этой остаточной структуры, вероятно, можно будет определить в будущем с помощью методов 3D ЯМР.
Варианты, обозначенные G A 95 и G B 95, различаются только в положениях 20, 30 и 45, но при этом полностью сложены, при этом ΔG разворачивает ≈3 ккал / моль при 20 ° C (рис.S2). Оба белка проявляют аффинность связывания с соответствующими лигандами (K D <1 мкМ) и являются мономерными. Структуры этих белков с высоким разрешением были определены, чтобы лучше понять, как такое небольшое количество аминокислот контролирует конформационный переключатель. Это подробно обсуждается ниже. Статистика для ансамблей G B 95 и G A 95 из 20 структур показана в таблице S2. Коды доступа к банку данных белков для G A 95 и G B 95 — 2KDL и 2KDM, соответственно.
Мутация I30F в G A 95 (G A 98) и A20L в G B 95 (G B 98) приводит к гетероморфной паре, отличающейся всего в 1 аминокислоте. G A 98 свернут в конформацию 3-α (заселенность> 90%, pH 7,2, 20 ° C), а G B 98 свернута в конформацию 4β + α (заселенность> 90%, pH 7,2, 20 ° С). Спектры КД белков G A 98 и G B 98 практически идентичны спектрам их родительских белков G A и G B (рис.S1). Приписанные спектры HSQC G A 98 и G B 98 сравниваются на рис. 3. G A 98 демонстрирует пониженное сродство к HSA (K D > 1 мкМ), но приобретает сродство к IgG (K D <1 мкМ). G B 98 прочно связывается с IgG, но не с HSA. Способность G A 98 связывать IgG, а также HSA может выявить скрытую склонность к переключению в конформацию 4β + α и демаскировать IgG-связывающий эпитоп. Популяция конформации 4β + α слишком мала для обнаружения в не связанном состоянии G A 98, но связывание IgG может сместить равновесие от 3-α к 4β + α.Также возможно, что G A 98 связывает IgG по новому механизму. Это будет решено с помощью ЯМР для картирования связывающего эпитопа (17). В любом случае исследование пространства бинарных последовательностей показывает, что один функциональный белок может переключаться в совершенно другую конформацию с другой функцией посредством мутационного пути, при котором ни функция, ни нативная структура полностью не теряются. Белки G A 98 и G B 98 стабильны лишь незначительно, но восстановление стабильности и функции, близкой к дикому типу, в любом направлении может быть достигнуто только с помощью 3 дополнительных мутаций (например,g., согласно G A 88 и G B 88b).
Рис. 3.
1 H, 15 N Спектры HSQC. Назначение амидов основной цепи показано для G A 98 (черный) и G B 98 (красный). Из 56 аминокислот в этих 2 белках 55 идентичны, но имеют разное химическое окружение, отражающее 2 разные складки. Сигналы амидных протонов для боковых цепей соединены горизонтальными линиями.
Общее изменение топологии.
Структуры с высоким разрешением были определены для G A 95 и G B 95 и дают представление о структурных детерминантах конформационного переключения.Аминокислотные замены при 20, 30 и 45 сдвигают равновесие с> 99% 4β + α до> 99% 3-α. Аминокислоты 1–8 неупорядочены в G A 95 и образуют центральную цепь β1 в G B 95 (рис. 4). Аминокислоты 9–23 образуют спираль 1 в G A 95 и в G B 95 образуют поворот между β1 и β2, цепь β2 и поворот между β2 и центральной спиралью. Аминокислоты 27–33 имеют спиральную форму в G A 95. В G B 95 спираль немного длиннее: 24–37. Аминокислоты 39–51 образуют спираль 3 в G A 95 и в G B 95 образуют поворот между центральной спиралью и β3, цепью β3, поворот между β3 и β4 и первую часть цепи β4. .Аминокислоты 52–56 неупорядочены в G A 95 и образуют конец цепи β4 в G B 95. За исключением общих спиральных остатков 27–33, каждая аминокислота претерпела изменение вторичной структуры в переключателе. от 3-α до 4β + α.
Рис. 4.
Мультяшное изображение топологии магистрали G A 95 и G B 95. Остатки 1–8 — синие, 9–23 — зеленые, 24–37 — красные, 38–52 — желтые и 53–56 — голубые. .
Гидрофобные взаимодействия.
Гидрофобное ядро G A 95 включает A12, A16 и L20 из α1; I30, I33 и A36 от α2; и V42, K46 и I49 из α3 (рис.5). Алифатическая боковая цепь K46 способствует упаковке гидрофобного ядра с выступающей в растворитель группой аммония. A16, L20, I30, I33 и I49 образуют плотную сеть взаимозависимых гидрофобных контактов. L45 скрыт на 35% и фактически не очень консервативен среди природных доменов G A . Его основные контакты находятся с граничными остатками Y29, L32 и остатком ядра I33. Гидрофобное ядро G B 95 включает Y3, L5 и L7 из β1; A16 и A20 от β2; A26, F30 и A34 от α-спирали; W43 и Y45 из β3; и F52 и V54 из β4.Кластер Y3, L5, F30 и F52 составляет ≈50% гидрофобного ядра. F30 взаимодействует в первую очередь с Y3 и L5 в β1 и F52 в β4. Y45 упакован против F52, а также образует очень прочную водородную связь с D47, что повышает pK и Y45 до> 12,0 (18). Взаимодействия Y45, D47 и F52 внутри шпильки β3-β4 помогают придать ей независимую стабильность, наблюдаемую в предыдущих исследованиях мутантов белка G (19). Семь критических гидрофобных остатков в ядре 3-α (A12, A16, I33, A36, V42, K46 и I49) сохраняются в 4β + α-кратности G B 95.Девять критических остатков в 4β + α-кратности (Y3, L5, L7, A16, A26, A34, W43, F52 и V54) сохраняются в 3-α-кратном G A 95. Скрытые остатки в одном направлении — это часто большее количество растворителя экспонируется в другой складке (рис. S3).
Рис. 5.
Ансамбль из 20 структур ЯМР для ( A ) G A 95 (остатки 7–52) и ( B ) G B 95 (остатки 1–56). Среднеквадратичные значения RMSD магистрали для обеих структур составляют ≈0,5 Å. Полная статистика структуры представлена в Таблице S2. Упорядоченные остатки ядра показаны голубым, тогда как различия в трех аминокислотах между G A 95 и G B 95 выделены красным.Обратите внимание, что L20 упорядочен в гидрофобном ядре G A 95, тогда как I30 и L45 более неупорядочены и доступны для растворителя. И наоборот, F30 и Y45 вносят значительный вклад в стабилизацию сердечника в G B 95.
Критическая роль N- и C-концов в коммутации.
Можно рассматривать белок как 2 части: аминокислоты 9–51, которые полностью структурированы в обеих складках, и 2 конца (1–8 и 52–56), которые не структурированы в 3-α, но образуют β-цепи в G B 95 (рис.6). При переключении с 3-α на 4β + α гидрофобные взаимодействия в ядре спирального пучка высвобождаются и заменяются взаимоисключающими гидрофобными взаимодействиями между центральной спиралью (A26, F30 и A34) и центральными β-цепями: β1 (Y3, L5 и L7) и β4 (F52 и V54). Таким образом, существует конкуренция между формированием спирального пучка и привлечением N- и C-концевых остатков с образованием β-листа с альтернативным гидрофобным ядром. Когда 20 = L, 30 = I и 45 = L, их предпочтительные партнеры по связыванию находятся в гидрофобном ядре 3-α-кратной области (например.g., A16, I33 и I49). Когда 20 = A, 30 = F и 45 = Y, их предпочтительными партнерами по связыванию являются 3, 5 и 7 в цепи β1 и 52 и 54 в цепи β4. Пространство двоичной последовательности между G A 95 и G B 95 составляет всего 8 комбинаций. В этом пространстве последовательности L vs. Y на 45 имеет решающее значение для того, в какую сторону нарушится баланс. Когда 45 = L, варианты разворачиваются, если 20 = A. Если 45 = L и 20 = L, белок останется преимущественно 3-α, даже когда I30 станет F. Аналогично, когда 45 = Y, варианты развернуты, если 30 = I. .Если 45 = Y и 30 = F, белок останется преимущественно 4β + α, даже когда A20 станет L. Таким образом, переключение может быть уменьшено до 1 аминокислоты.
Рис. 6.
Механизм переключения. Альтернативные конформации N-концевых (оранжевый) и C-концевых (синий) аминокислот в 3-α и 4β + α-складках. Аминокислота критического переключения находится в положении 45 (красный). Также изображена гидрофобная упаковка N- и C-концевых аминокислот в ядре складки 4 + α.
Термодинамическая связь.
Чтобы полностью понять энергетику переключателя, важно понимать, что ( i ) две альтернативные складки термодинамически связаны, и ( ii ) эта связь развивается только по мере развития контекста альтернативной складки. Это лучше всего иллюстрируется вариациями при 45 и 52. Остатки L45 / Y45 имеют доступность растворителя ≈35% в обеих складках. В G A 95 L45 расположен в α3-спирали и не взаимодействует напрямую с F52. Как отмечалось выше, Y45 расположен в β3-цепи G B 95 и упакован против F52.Ни L45Y, ни A52F мутации не являются катастрофическими в 3-α раза (Таблица 1). В G A 77 мутация L45Y стоит 1,5 ккал / моль, а мутация A52F стоит всего 0,3 ккал / моль в ΔG , разворачивающемся . Однако мутация Y45L или F52A сильно дестабилизирует 4β + α-кратность. На конечную третичную структуру сильно влияет стабильность структуры шпильки β3-β4. Когда Y45 и F52 встречаются вместе, предпочтение отдается шпильке β3-β4. С точки зрения логических операторов это вентиль И.Другие комбинации 45 и 52 благоприятствуют 3-α. Переключение может быть результатом аддитивных эффектов дестабилизации 3-α-кратности Y45 (-1,5 ккал / моль) и стабилизации 4β + α-кратности при взаимодействии Y45 и F52 (+2 ккал / моль).
По умолчанию склонность изолированной последовательности 9–51 в G B 98 составляет 3-α. Эффекты коротких N- и C-концевых последовательностей могут преодолевать независимую предрасположенность. Ранее с короткими пептидами было продемонстрировано, что локальные склонности могут быть преодолены с помощью более крупного белкового контекста (20, 21), но здесь склонность независимо стабильного 45-аминокислотного домена преодолевается двумя короткими последовательностями на его концах.Однако важность концов не проявляется до тех пор, пока не разовьется контекст 4β + α складки. Например, N- (1–8) и C- (52–56) концы G B были заменены на ранних этапах разработки G A . Изменения нейтральны для стабильности 3-α до тех пор, пока не будет достигнута точка переключения в пространстве мутаций. Однако не следует вообще предполагать, что неструктурированные N- и C-концы нейтральны для стабильности. В более ранней работе мы обнаружили, что замена 8 неструктурированных аминокислот на N-конце другого 3-α белка (стафилококкового белка A) на 8 аминокислот из G B приводила к потере стабильности на 3 ккал / моль (4).
Важность контекста также проявляется в выборе Y против L в положении 45. В G A 98 мутация L45Y переключит конформацию на 4β + α. В G A 91 и G A 95, где недостаточно контекста для поддержки полного переключения на 4β + α, L45Y вызывает разворачивание. Дестабилизация 3-α может быть результатом стабилизации «неродной» (β3-β4 шпильки) структуры. Это согласуется с общим феноменом сворачивания белков. Изменения стабильности при мутации являются результатом взаимодействий как в нативном, так и в развернутом состоянии (например,г., исх. 22). В этом случае «развернутое» состояние 3-α, вероятно, включает шпильку β3-β4. В общем, эффекты мутации в развернутом состоянии трудно предсказать, поскольку конкретные структурные элементы в развернутом состоянии неизвестны.
В обход развернутого состояния.
Тот факт, что последовательные мутации могут переключать конформационные предпочтения белка, не заселяя развернутое состояние, на первый взгляд кажется парадоксальным. Однако, как только развиваются двойные склонности, наступает критическая точка, и мутации имеют тенденцию заселять альтернативное состояние, а не развернутое состояние.Это крайний случай еще одного хорошо известного явления складчатости. Денатурация с помощью тепла или хаотропного агента, такого как мочевина или Gu-HCl, обычно дает сильно неупорядоченное развернутое состояние, характеризующееся открытыми гидрофобными группами и высокой конформационной энтропией (23). Когда мутация является денатурирующим агентом (вместо тепла или хаотропного растворителя), «развернутое» состояние часто представляет собой ограниченный набор конформаций, характеризующийся высоким содержанием вторичной структуры, хотя обычно не является четко определенной третичной структурой.Сохранение порядка у мутантов с низкой стабильностью согласуется с основными принципами: ( i ) белки коллапсируют в воде в компактные структуры; ( ii ) компактность способствует приобретению вторичной структуры; и ( iii ) окончательные структурные склонности представляют собой тонкое сочетание многих компенсирующих слабых сил. Важным общим моментом является то, что многие дестабилизирующие мутации создают склонность к новым складкам, потому что одни неродные состояния предпочтительнее других.Новая склонность к определенной третичной структуре обычно может быть незаметна в расплавленной популяции, но даже слабая склонность может привести к коротким мутационным путям к стабильным альтернативным топологиям. Развернутые мутанты, такие как L45Y в G A 91 и G A 95, не обнаруживают ни 3-α, ни 4β + α складок, но могут содержать определенные структурные элементы каждой. Например, может формироваться структура шпильки β3-β4, но не β1-β2. Этот тип склонности к гибридам может привести к коротким мутационным путям еще до третьего типа складок, если бы мы расширили выбор аминокислот и положений.
Обсуждение
Мы демонстрируем, что сворачивание и функция могут переключаться посредством мутационного пути, при котором функция никогда не теряется и в котором развернутое состояние никогда не заселяется в значительной степени. Переход от связывания IgG, преимущественно 4β + α-кратности, к бифункциональной, преимущественно 3-α-кратной, может происходить посредством одной замены аминокислоты. Переключение было достигнуто, несмотря на ограничения, общие для усилий по инженерии белков: ( i ) определены конечные точки для складки и функции; и ( ii ) экспертиза ограниченного (i.е., двоичное) пространство последовательностей. Природа не имеет заранее определенных пунктов назначения в пространстве складок / функций и не действует в ограниченном пространстве мутаций. Даже в этом случае многочисленные инженерные усилия продемонстрировали способность белков переключать складки. Эта тема была рассмотрена в 2006 г. (2). Есть и естественные примеры свёртывания. Классические примеры основных конформационных изменений включают гемагглютинин вируса гриппа при взаимодействии с клеткой-хозяином (24), серпины при протеолизе петли (25) и прионные белки, которые изменяются с преимущественно α-спиральной доброкачественной формы (PrP C ) на инфекционное состояние (PrP Sc ) с повышенным содержанием β-листов (26).Другим недавним примером является хемокиновый лимфотактин, который имеет 2 заселенных конформационных состояния в физиологических условиях: каноническая хемокиновая складка (3-цепочечный β-лист и C-концевая α-спираль) в равновесии с димером, полностью состоящим из β-слоев (27). У каждой конформации своя связывающая функция. Кроме того, существуют природные факторы транскрипции Cro с 40% идентичностью, но разные структуры для 25 аминокислот на их С-концах (28).
Большинство примеров естественного и искусственного переключения складок связано с контекстным изменением белкового мономера.Наиболее распространенное изменение контекста — это изменение четвертичной структуры. Например, мутация нескольких остатков ядра в протеине G может привести к переключению со стабильного мономера на стабильный тетрамер со многими нативными вторичными структурными элементами (29). В примере с прионным белком движущей силой для конформационного переключения с мономера на агрегат является обширное взаимодействие краев внешних β-цепей в агрегированном состоянии. Связывание металлов также, как было показано, опосредует основные изменения вторичной, третичной и четвертичной структуры белков, сконструированных с помощью вычислений (30–32).Хотя наши результаты показывают переключение из одной мономерной складки в другую, энергетическая ситуация в некоторых отношениях похожа на переключение конформации, вызванное связыванием лиганда. В нашем случае «связывание» N- и C-концов с образованием центральных нитей β-листа в складке 4β + α является основной энергетической движущей силой для переключателя.
Наша работа также показывает, что скрытая функция связывания может быть связана с альтернативной склонностью к складыванию. Фактически, наш выбор альтернативных складок с высокой идентичностью основывался на миграции от связывания IgG к функции связывания с альбумином (3).Скрытая функциональность, вероятно, существует в природе, но ее трудно различить, потому что альтернативная функция раскрывается только в неизвестной альтернативной складке. Мы предполагаем, что когда скрытая функция существует в доступной альтернативной складке, функциональная миграция вероятна. Мы продемонстрировали в нашей искусственной системе, что нет автоматического наказания, связанного с развивающейся альтернативной склонностью или скрытой функцией. Мы предполагаем, что природа будет исследовать пространство последовательностей, когда за это нет никаких штрафов, то есть природа пойдет по любому функциональному пути.Небольшие изменения в аминокислотной последовательности могут вызвать склонность белка к другой складке, а иногда и переключать складки, что приводит к функциональной миграции. Тот факт, что складка и функция могут переключаться посредством коротких мутационных путей, предполагает, что функциональную аннотацию, основанную на сходстве последовательностей, следует рассматривать осторожно. Даже в этом случае подобная последовательность обычно подразумевает аналогичную структуру. Если в природе происходит переключение складок, после этого последовательности быстро расходятся. Лимфотактин и факторы транскрипции Cro, по-видимому, являются двумя естественными белками, которые, однако, были «пойманы с поличным» (27, 28).
Переключение складок между одними складками более вероятно, чем другим (33). Некоторые конструктивные особенности G A и G B делают их пригодными для переключения. Многие остатки ядра в каждой складке в значительной степени подвергаются воздействию растворителя в другой складке, что дает возможность существенной информации об укладке для обеих складок сосуществовать в одном белке. Степень, в которой положения гидрофобного ядра перекрываются в любых 2 произвольных складках одинакового размера, будет широко варьироваться. Это означает, что может быть некоторая предсказуемость относительно того, какие складки могут сблизиться в пространстве последовательности.Учитывая ограниченное количество семейств складок, это наблюдение может дать общее представление о том, как белки мигрируют через пространство складок в процессе эволюции.
Материалы и методы
Мутагенез.
Сайт-специфические мутанты получали с использованием наборов для мутагенеза QuikChange (Stratagene) в соответствии с инструкциями производителя.
Экспрессия и очистка белков.
Варианты
G A и G B были клонированы в вектор pG58 (16), который кодирует сконструированную прососледовательность субтилизина как N-концевой домен слияния, и полученные слитые белки очищали с использованием системы тегов аффинного расщепления, которая мы разработали (16), по существу, как описано в ссылке.3. Коммерческая версия системы очистки доступна в Bio-Rad Laboratories (система очистки Profinity eXact). Минимальная среда (14) использовалась для маркировки 15 N и 13 C. Растворимый клеточный экстракт слитого белка продомена (eXact tag) вводили в колонку S189 объемом 5 мл со скоростью 5 мл / мин для связывания, а затем промывали 10 объемами колонки 100 мМ KPO 4 , pH 7,2 для удаления примесей (16 ). Для расщепления и элюирования очищенного целевого белка 6 мл 10 мМ азида натрия, 100 мМ KPO 4 , pH 7.2 вводили со скоростью 0,5 мл / мин. Очищенный белок затем концентрировали до 0,2-0,3 мМ, как требуется для анализа ЯМР. В этих условиях все белки являются мономерными. Это было продемонстрировано с помощью гель-фильтрации с встроенным детектором многоуглового лазерного светорассеяния (miniDAWN TREOS; Wyatt Technology).
Связывание с IgG и HSA.
IgG и HSA были иммобилизованы на колонках GE HT1, содержащих NHS-активированную агарозную смолу, в соответствии с инструкциями производителя.Связывание мутантов проводили в 0,1 М KPO 4 , pH 7,2, вводя 1 мл раствора 1 мг / мл со скоростью 0,5 мл / мин. Промывка осуществлялась 15 мл 0,1 М KPO 4 , pH 7,2 при 1 мл / мин. Элюирование проводили 6 мл 0,1 М фосфорной кислоты.
ЯМР-спектроскопия.
15 N- и 13 C / 15 N-меченные образцы были приготовлены при концентрациях 0,2–0,3 мМ в 100 мМ буфере KPO 4 (pH 7,2), содержащем 10 мМ азида натрия и 5–10% Д 2 О.Спектры ЯМР получали на спектрометре Bruker AVANCE 600 МГц, оснащенном криозондом тройного резонанса z 1 H / 13 C / 15 N. Спектры записывали при 15 ° C для G A 95 и 20 ° C для G B 95. Для обработки данных использовали NmrPipe (34), а анализ выполняли с помощью Sparky (35). Стандартные эксперименты с тройным резонансом были использованы для получения значений ЯМР. Отнесение основных цепей было сделано из спектров HNCACB, CBCA (CO) NH, HBHA (CO) NH и HNCO, тогда как боковые цепи были отнесены к 3D (H) C (CO) NH-TOCSY, 3D H (CCO) NH-TOCSY. , 2D CBHD и 2D CBHE эксперименты.Информация о межпротонном расстоянии была получена из спектров 3D 15 N NOESY и алифатических и ароматических 3D 13 C NOESY с временами смешивания 100 и 150 мс. Для получения дополнительной информации см. SI Text .
Благодарности
Мы благодарим Дэвида Шортла и Джорджа Роуза за полезное обсуждение; Ян Шен, Дэвид Бейкер и Ад Бакс за предоставление результатов вычислительного анализа перед публикацией; и Джейн Ладнер за анализ рассеяния лазерного света.Работа поддержана грантом GM62154 Национальных институтов здравоохранения.
Сноски
- 1 Кому следует направлять корреспонденцию. Эл. Почта: bryan {at} umbi.umd.edu
-
Вклад авторов: P.A.A., Y.H., J.O., and P.N.B. спланированное исследование; P.A.A., Y.H., Y.C., J.O. и P.N.B. проведенное исследование; P.A.A., Y.H., J.O. и P.N.B. проанализированные данные; и П.Н.Б. написал газету.
-
Авторы заявляют об отсутствии конфликта интересов.
-
Эта статья представляет собой прямое представление PNAS.
-
См. Комментарий на странице 21011.
-
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/cgi/content/full/08106/DCSupplemental.
-
Свободно доступен онлайн через опцию открытого доступа PNAS.
Белки: структура, функция и типы
Структура белка
Белки состоят из аминокислот или органических соединений, которые связаны друг с другом пептидными связями.В организме человека содержится 21 аминокислота. Различные комбинации этих аминокислот составляют все белки, о которых вы только можете подумать, от фибрина , , который образует струпья на порезанном пальце, до белка, который позволяет гремучим змеям определять температуру тела.
Хотя аминокислоты отличаются друг от друга, они имеют некоторые общие характеристики, такие как:
- Аминогруппа
- Карбоксильная группа
- Уникальная боковая цепь, которая часто обозначается как R
Карбоксильная группа представляет собой углерод, который связан двойной связью с кислородом, а также с атомом кислорода и водорода.Аминогруппа представляет собой атом азота, связанный с двумя атомами водорода. Прежде чем мы продолжим, посмотрите на структуру аминокислоты.
Каждая аминокислота определяется своей уникальной R-группой. На диаграмме ниже вместо буквы «R» прописаны молекулы. Посмотрите, сможете ли вы найти группы, которые делают аминокислоту аминокислотой.
Уникальная R-группа придает аминокислотам их уникальные характеристики.Например, некоторые из них растворимы в воде, а другие — нет. Некоторые из них нейтральны, а другие имеют положительный или отрицательный заряд.
Помните, как мы говорили, что белок образуется, когда аминокислоты соединяются вместе в связь пептид ? Пептидные связи образуются, когда карбоксильная группа одной молекулы объединяется с аминогруппой другой молекулы с высвобождением молекулы воды. Группы связанных вместе аминокислот известны как полипептиды , и все белки являются полипептидами, как и Пит.Когда аминокислоты соединяются посредством пептидных связей с образованием полипептидов, происходит полимеризация .
Первичная, вторичная, третичная и четвертичная структура
Теперь, когда мы знаем, как Пит выглядит и как он работает, давайте посмотрим на его структуру. Подумайте о первичных, вторичных, третичных и четвертичных структурах как о разных способах взглянуть на белки. Например, подумайте о первичной структуре как о одномерном проекте, а о четвертичной как о фактической структуре.
Первичная структура относится к порядку аминокислот, составляющих белок. Аминокислоты сокращены, поэтому первичной структурой будет список сокращенных аминокислот.
Далее идет вторичная структура , которая показывает, как аминокислоты изгибаются и сворачиваются. Это происходит в результате связи, которая образуется между аминокислотными группами, в частности, связей между N-H и C = O.
Третичная структура относится к трехмерной структуре белка или к тому, как складывается вторичная структура. Четвертичные структуры образуются из нескольких полипептидных цепей и описывает, как эти цепи связаны.
Резюме урока
Белки можно найти во многих важных частях вашего тела, например, в мышцах; они также отвечают за выработку антител и гормонов.Они состоят из аминокислот , которые связаны между собой посредством пептидных связей с образованием полипептидов . Помните, что все белки — это полипептиды. Аминокислоты включают аминогруппу и карбоксильную группу; их уникальные свойства берут начало в их R-группах.
При изучении структуры белка важно отметить различия, обнаруженные между первичными, вторичными, третичными и четвертичными структурами, которые представляют собой все способы взглянуть на белок. Первичная структура определяет порядок аминокислот, в то время как вторичная структура смотрит на то, как аминокислоты изгибаются и сворачиваются.Третичная структура описывает, как вторичная структура складывается вместе. Наконец, четвертичная структура смотрит на то, как несколько полипептидных цепей соединяются вместе.
Устройство и функции
Структура макромолекул определяет функцию и регуляцию
Студенты должны уметь объяснять и применять основные концепции макромолекулярной структуры и функции, включая природу биологических макромолекул, их взаимодействие с водой, взаимосвязь между структурой и функцией, а также часто встречающиеся механизмы регулирования их функции.
Цели обучения, приведенные ниже, подразделяются на вводные A, промежуточные B и верхние C.
1. Биологические макромолекулы большие и сложные
Макромолекулы состоят из основных молекулярных единиц. Они включают белки (полимеры аминокислот), нуклеиновые кислоты (полимеры нуклеотидов), углеводы (полимеры сахаров) и липиды (с различными модульными составляющими). Биосинтез и разложение биологических макромолекул включает линейную полимеризацию, стадии разрушения (белки, нуклеиновые кислоты и липиды), а также могут включать разветвление / разветвление (углеводы).Эти процессы могут включать мультибелковые комплексы (например, рибосомы, протеасомы) со сложной регуляцией.
Ассоциированные цели обучения
- Учащиеся должны уметь обсуждать разнообразие и сложность различных биологически значимых макромолекул и макромолекулярных ансамблей с точки зрения эволюционной пригодности. A
- Учащиеся должны уметь описывать основные единицы макромолекул и типы связей между ними. A
- Студенты должны уметь сравнивать и противопоставлять процессы, участвующие в биосинтезе основных типов макромолекул (белков, нуклеиновых кислот и углеводов).B
- Учащиеся должны уметь сравнивать и противопоставлять процессы, участвующие в деградации основных типов макромолекул (белков, нуклеиновых кислот и углеводов).
- Студенты должны понимать, что белки состоят из доменов, и уметь обсуждать, как семейства белков возникают в результате дублирования первичного гена. C
2. Структура определяется несколькими факторами
Ковалентные и нековалентные связи определяют трехмерные структуры белков и нуклеиновых кислот, влияющие на их функцию.Аминокислотные последовательности, наблюдаемые в природе, тщательно отбираются по биологической функции, но не обязательно имеют уникальную складчатую структуру. Структура (и, следовательно, функция) макромолекул регулируется основополагающими принципами химии, такими как ковалентные связи и полярность, вращения и колебания связей, нековалентные взаимодействия, гидрофобный эффект и динамические аспекты молекулярной структуры. Последовательность (и, следовательно, структура и функция) белков и нуклеиновых кислот могут быть изменены путем альтернативного сплайсинга, мутации или химической модификации.Последовательности (и, следовательно, структура и функция) макромолекул могут развиваться, создавая измененные или новые биологические активности.
Ассоциированные цели обучения
- Учащиеся должны уметь распознавать повторяющиеся единицы в биологических макромолекулах и уметь обсуждать структурные воздействия вовлеченных ковалентных и нековалентных взаимодействий. A
- Учащиеся должны уметь обсуждать состав, эволюционные изменения и, следовательно, структурное разнообразие различных типов биологических макромолекул, обнаруженных в организмах.A
- Студенты должны уметь обсуждать химические и физические отношения между составом и структурой макромолекул. A
- Студенты должны уметь сравнивать и противопоставлять первичные, вторичные, третичные и четвертичные структуры белков и нуклеиновых кислот. B
- Студенты должны уметь использовать различные подходы биоинформатики для анализа первичной последовательности и структуры макромолекул. B
- Учащиеся должны уметь сравнивать и противопоставлять эффекты химической модификации конкретных аминокислот на трехмерной структуре белка.B
- Учащиеся должны уметь сравнивать и противопоставлять способы, которыми конкретная макромолекула может принимать новые функции в результате эволюционных изменений. B
- Студенты должны уметь использовать различные биоинформатические и вычислительные подходы для сравнения первичных последовательностей и определения влияния сохранения и / или эволюционных изменений на структуру и функцию макромолекул. C
- Учащиеся должны уметь предсказывать влияние мутаций на активность, структуру или стабильность белка и разрабатывать соответствующие эксперименты для оценки эффектов мутаций.C
- Студенты должны уметь предлагать подходящие химические или химические биологические подходы для изучения локализации и взаимодействия биологических макромолекул. C
- Учащиеся должны уметь обсуждать, как мутации дублированного гена создают функциональное разнообразие. C
- Студенты должны уметь оценивать химический и энергетический вклад в соответствующие уровни структуры макромолекулы и предсказывать влияние конкретных изменений структуры на динамические свойства молекулы.C
3. Структура и функции взаимосвязаны
Макромолекулы взаимодействуют с другими молекулами, используя множество нековалентных взаимодействий. Специфичность и сродство этих взаимодействий имеют решающее значение для биологической функции. Некоторые макромолекулы катализируют химические реакции или способствуют физическим процессам (например, молекулярному переносу), позволяя им протекать в условиях окружающей среды. Эти процессы могут быть количественно описаны с помощью законов скорости и термодинамических принципов (например,грамм. теория столкновений, теория переходного состояния, законы скорости и равновесия, эффекты температуры и структуры и химической реакционной способности, закон Кулона, законы движения Ньютона, энергия и стабильность, трение, диффузия, термодинамика и концепция случайности и вероятности).
Ассоциированные цели обучения
- Учащиеся должны уметь использовать механистические рассуждения, чтобы объяснить, как фермент или рибозим катализирует определенную реакцию. A
- Студенты должны уметь обсуждать основы различных типов ферментативных механизмов.A
- Студенты должны уметь рассчитывать ферментативные уровни и сравнивать их, а также соотносить эти показатели с гомеостазом клеток или организма. B
- Студенты должны уметь обсуждать различные методы, которые могут использоваться для определения сродства и стехиометрии комплекса лиганд-макромолекула, и соотносить результаты как с термодинамическими, так и с кинетическими данными. B
- Студенты должны уметь критически оценивать вклад в специфичность в комплексе лиганд-макромолекула и планировать эксперименты, чтобы как оценивать вклад в специфичность, так и проверять гипотезы о специфичности лиганда в комплексе.C
- Учащиеся должны уметь предсказывать биологические и химические эффекты мутации или структурных изменений лиганда на аффинность связывания и планировать соответствующие эксперименты для проверки своих прогнозов. C
4. Макромолекулярные взаимодействия
Взаимодействия между макромолекулами и другими молекулами основаны на тех же слабых нековалентных взаимодействиях, которые играют главную роль в стабилизации трехмерных структур самих макромолекул.Важны гидрофобный эффект, ионные взаимодействия и взаимодействия водородных связей. Структурная организация взаимодействующих химических групп в сайте связывания или активном сайте придает этим взаимодействиям высокую степень специфичности. Специфичность и сродство этих взаимодействий имеют решающее значение для биологической функции.
Ассоциированные цели обучения
- Учащиеся должны уметь обсуждать влияние изменений специфичности или аффинности на биологическую функцию и любое возможное влияние на эволюцию.A
- Студенты должны уметь обсуждать различные методы, которые можно использовать для определения сродства и стехиометрии для комплекса лиганд-макромолекула, и соотносить результаты как с термодинамическими, так и с кинетическими данными. B
- Учащиеся должны уметь обсуждать взаимодействия между различными биологическими молекулами (включая белки, нуклеиновые кислоты, липиды, углеводы, мелкие органические вещества и т. Д.) И описывать, как эти взаимодействия влияют на специфичность или сродство, приводя к изменениям биологической функции.B
- Учащиеся должны уметь предсказывать эффекты мутации или структурных изменений лиганда на аффинность связывания и планировать соответствующие эксперименты для проверки своих прогнозов. C
- Студенты должны уметь обсуждать взаимосвязь между температурой, необходимой для денатурации (Tm), и структурой макромолекул. C
5. Структура макромолекул динамическая
Макромолекулярная структура динамична в широком диапазоне временных масштабов, и динамические структурные изменения, большие и малые, часто имеют решающее значение для биологической функции.Небольшие изменения могут проявляться в виде локализованных молекулярных колебаний, которые могут облегчить доступ малых молекул к внутренним частям макромолекулы. Большие конформационные изменения могут происходить в виде движений различных макромолекулярных доменов относительно друг друга, чтобы облегчить катализ или другие формы работы. Белки могут содержать внутренне неструктурированные домены. Отсутствие структуры в растворе может способствовать функции, при которой взаимодействия должны происходить беспорядочно с несколькими другими молекулами.Динамическая структура макромолекул делает возможными быстрые изменения, влияющие на гомеостаз биохимических и молекулярно-биологических процессов.
Ассоциированные цели обучения
- Учащиеся должны уметь обсуждать временные масштабы различных конформационных эффектов в биологических макромолекулах А и планировать соответствующие эксперименты для исследования изменений конформации и динамики, вызванных лигандом. C
- Учащиеся должны уметь обсуждать структурную основу динамических свойств макромолекул и предсказывать эффекты изменений динамических свойств A, которые могут возникнуть в результате изменения первичной последовательности.C
- Учащиеся должны уметь предсказать, упорядочена или неупорядочена последовательность C, и обсудить потенциальные роли неупорядоченных областей белков. B
- Студенты должны уметь критически обсуждать доказательства за и против роли динамики в функции макромолекул. C
6. Биологическая активность макромолекул часто регулируется
Биологическая активность макромолекул часто регулируется одним или несколькими иерархическими способами (например,грамм. ингибиторы, активаторы, модификаторы, синтез, разложение и компартментализация).
Ассоциированные цели обучения
- Учащиеся должны уметь сравнивать и противопоставлять различные механизмы регуляции функции макромолекулы или ферментативной реакции или пути. A
- Студенты должны уметь аллостерически обсуждать преимущества и недостатки регулирования реакции. B
- Студенты должны уметь обсуждать примеры аллостерической регуляции, ковалентной регуляции и изменений на уровне генов макромолекулярной структуры-функции.B
- Студенты должны использовать экспериментальные данные для оценки типа регуляции в ответ на гомотропные или гетеротропные лиганды на макромолекуле. C
- Учащиеся должны уметь создавать модели, объясняющие регуляцию структуры-функции макромолекул. C
- Учащиеся должны уметь описывать, как эволюция повлияла на регуляцию макромолекул и процессов. C
- Студенты должны уметь описывать, как изменения клеточного гомеостаза влияют на сигнальные и регуляторные молекулы и промежуточные продукты метаболизма.C
7. Структура (и, следовательно, функция) макромолекул регулируется основополагающими принципами химии и физики
Структура (и, следовательно, функция) макромолекул регулируется основополагающими принципами химии (включая ковалентные связи и полярность; вращения и колебания связей; водородные связи и нековалентные взаимодействия; гидрофобный эффект; динамические аспекты молекулярной структуры; теория столкновений ; теория переходного состояния; законы скорости и равновесия; эффекты температуры и структуры и химической реактивности) и физика (включая закон Кулона; законы движения Ньютона; энергия и стабильность; трение; диффузия; термодинамика; а также концепция случайности и вероятности). .
Ассоциированные цели обучения
- Учащиеся должны уметь связывать основные принципы законов скорости и равновесия с реакциями и взаимодействиями и вычислять соответствующие термодинамические параметры для реакций и взаимодействий. A
- Студенты должны быть в состоянии объяснить, как лиганд, введенный в раствор, содержащий макромолекулу, с которой он может связываться, взаимодействует с макромолекулой. A
- Учащиеся должны уметь объяснять, используя основные принципы, влияние температуры на реакцию, катализируемую ферментами.B
- Учащиеся должны уметь обсуждать динамические свойства макромолекул, используя фундаментальные принципы физики. B
8. Для наблюдения и количественного измерения структуры, динамики и функций биологических макромолекул могут использоваться различные экспериментальные и вычислительные подходы
Для наблюдения и количественного измерения структуры, динамики и функции биологических макромолекул можно использовать различные экспериментальные и вычислительные подходы.Уравнения можно выводить из моделей и использовать для прогнозирования результатов или анализа данных. Данные можно анализировать статистически, чтобы оценить правильность модели и надежность данных.
Ассоциированные цели обучения
- Учащиеся должны уметь предложить схему очистки для конкретной молекулы в смеси с учетом биофизических свойств различных молекул в смеси. B
- Студенты должны уметь либо предлагать эксперименты, которые определяют четвертичную структуру молекулы, либо уметь интерпретировать данные, относящиеся к третичной и четвертичной структуре молекул.B
- Студенты должны быть в состоянии объяснить, как вычислительные подходы могут использоваться для изучения взаимодействий белок-лиганд, и обсудить, как результаты таких вычислений могут быть исследованы экспериментально. C
- Студенты должны иметь возможность сравнивать и противопоставлять доступные вычислительные подходы, чтобы предложить трехмерную структуру макромолекулы, и обсудить, как предложенная структура может быть подтверждена экспериментально. C
- Учащиеся должны уметь анализировать кинетические или связывающие данные для получения соответствующих параметров и оценки достоверности модели, используемой для описания явления.C
Функции, структура, свойства и классификация
Давайте углубимся в изучение белков. Прочитав эту статью, вы узнаете о: 1. Функции белков 2. Структуры белков 3. Свойства белков и 4. Классификация белков.
Белки — это азотистые органические соединения с высокой молекулярной массой, которые играют жизненно важную или первостепенную роль в живых организмах.Они состоят из 20 стандартных α-аминокислот.
Функции белков:
Основными функциями белков в организме человека являются:
1. Они служат единицами построения тела, например, мышечными белками.
2. Они обеспечивают поддержку и защиту различных тканей, например, коллагена и кератина.
3. Все химические реакции в организме катализируются белковыми ферментами, например трипсином.
4. Они переносят различные молекулы и ионы от одного органа к другому, например.г., гемоглобин, сывороточный альбумин.
5. Они хранят и обеспечивают питательные вещества, например, молочный казеин, яичный альбумин.
6. Они защищают организм от вредных чужеродных организмов, например, иммуноглобулина, фибриногена.
7. Они помогают регулировать клеточную или физиологическую активность, например, гормоны, а именно инсулин, GH.
Структуры белков:
Первичная структура белков :
Первичная структура белков относится к общему количеству аминокислот и их последовательности в данном конкретном белке.
Фиксированное количество аминокислот расположено в определенной последовательности. Последовательность аминокислот в белке определяет его биологическую роль. У разных белков разные последовательности. Следовательно, изучение общего числа и последовательности аминокислот в белке — это изучение его первичной структуры.
Первичная структура отличает нормальный белок от ненормального. Нормальный гемоглобин взрослого человека (HbA) состоит из 2 α-цепей и 2 β-цепей. Каждая α-цепь содержит 141 аминокислоту, а каждая β-цепь содержит 146 аминокислот, расположенных в определенной последовательности.Любое изменение последовательности приводит к аномальному гемоглобину. Как и в серповидно-клеточном гемоглобине (HbS), аминокислота валин присутствует в 6-м положении Р-цепи вместо глутаминовой кислоты в нормальном гемоглобине.
Вторичная структура белков :
Это относится к скручиванию полипептидной цепи в спиральную форму.
Найдено три типа винтовых структур:
(а) Альфа спираль
(б) Бета плиссе и
(c) Реверс.
1. Альфа-спираль:
α означает, что первая, а описанная ниже структура была первой среди обнаруженных спиральных структур, поэтому известна как альфа (α) спираль.
Основные особенности этой структуры:
и. Здесь полипептид скручен или свернут, образуя правую спиральную структуру.
ii. Расстояние между каждым витком катушки 5,4 Å.
iii. Их 3.6 аминокислот на ход.
iv. Видно, что группы «R» выступают из спирали.
v. Имеются внутрицепочечные водородные связи, при которых водород группы -NH соединяется с кислородом группы -CO 4-й аминокислоты, стоящей за ним. Таким образом, каждая пептидная группа участвует в образовании водородных связей.
vi. Этот тип структуры встречается во многих белках в сочетании с другими структурами. Чистая а-спиральная структура наблюдается в белке волос, то есть в кератине.
2.Бета плиссе:
β означает второе, а описанная ниже структура была вторым открытием после α спирали.
Основные особенности этой структуры:
и. Цепочка здесь не спиральная, а зигзагообразная.
ii. Расстояние между каждым витком — 7 Å.
iii. Полипептидные цепи расположены рядом в виде складок.
iv. Между цепями существует межцепочечная водородная связь, и каждая пептидная группа участвует в водородной связи.
Цепи антипараллельны друг другу.
3. Реверс:
Складывается в обратном направлении цепи.
Третичная структура белков :
Спиральная форма полипептида складывается в сферическую, глобулярную, эллипсоидальную или другую конформацию, которая называется третичной структурой белков. Это сворачивание необходимо для биологической активности белков. например, ферменты, иммуноглобулины.
Третичная конформация поддерживается четырьмя типами связей:
1. Водородные связи:
Образуется между водородом и электроотрицательным атомом, таким как кислород или азот, в группе «R» аминокислот.
2. Ионные взаимодействия:
Образуется между кислотными (глутаминовая и аспарагиновая) и основными (аргинин, лизин или гистидин) аминокислотами.
3. Дисульфидные связи:
Это прочная связь, образованная между сульфагидрильными группами двух аминокислот цистеина.Образовавшаяся димерная структура известна как цистин (аминокислота, содержащаяся только в белках, а не в свободной форме).
4. Гидрофобные взаимодействия:
Группы «R» гидрофобных аминокислот объединяются вместе в центре вдали от воды, тем самым развивая силу притяжения между каждой группой «R» и силу отталкивания от воды, и эти взаимодействия известны как гидрофобные взаимодействия.
Четвертичная структура белков:
Четвертичная структура представлена олигомерными белками.
Олигомерные белки:
— это те, которые имеют две или более полипептидных цепей.
Четвертичная структура относится к типу расположения полипептидов в олигомерном белке. Эти полипептиды удерживаются вместе водородными связями, ионными связями или силами Вандер-Ваальса, например, гемоглобин имеет четыре полипептидные цепи, которые расположены определенным образом, что относится к четвертичной структуре гемоглобина.
Четвертичная структура гемоглобина описывает, что он состоит из четырех полипептидных цепей; два из которых — α (α 1 и α 2 ), а два других — β (β 1 и β 2 ).Две альфа-цепи противоположны друг другу и примыкают к каждой -цепи. Цепи α и β связаны между собой солевыми мостиками.
Взаимосвязь структурных функций в белках:
Гемоглобин играет жизненно важную роль в транспортировке кислорода от легких к периферическим тканям и транспортировке углекислого газа из тканей в легкие.
Существует три типа нормального гемоглобина со следующими полипептидами:
(1) Гемоглобин взрослых (Hb A) имеет 2α2β цепи.
(2) Гемоглобин плода (Hb F) имеет 2α2γ цепи.
(3) Незначительный взрослый гемоглобин (Hb A 1 ) имеет 2α2δ цепи.
Число аминокислот в α-цепях составляет 141 аминокислоту, а в других цепях, то есть β, γ и δ цепи содержат 146 аминокислот. Эти цепи различаются на основании разницы в последовательности расположения аминокислот в цепях. Четвертичная структура гемоглобина создает полость между тетрамером, в которой присутствует 2, 3, дифосфоглицерат (DPG или BPG), образующий солевой мостик с аминоконцом β-цепи, который стабилизирует гемоглобин, тем самым снижая сродство к кислороду.
В легких парциальное давление кислорода высокое, что приводит к связыванию O 2 с одной из цепей Hb, тем самым разрывая солевые мостики между четырьмя субъединицами. Последующее связывание кислорода (сигмовидная кривая ассоциации Hb-O 9 ) облегчается за счет разрыва солевых мостиков, изменяющих вторичные, третичные и четвертичные структуры, что позволяет вращать одну субъединицу α / β относительно другой цепи α / β, тем самым сжимая тетрамер и выпуск ДПГ.Это приводит к увеличению его сродства к кислороду (R-состояние Hb).
В периферических тканях CO 2 связывается с a-аминогруппой аминоконца с его преобразованием из положительного в отрицательный заряд, что способствует образованию солевого мостика между полипептидными цепями с возвратом в дезокси-состояние (Т-состояние), т.е. высвобождение кислорода из Hb. Высвобождению O 2 из Hb также способствует связывание DPG с тетрамером.
Когда человек взлетает в полет, самолет медленно поднимается по высоте, что приводит к снижению напряжения O 2 , из-за чего оксигенация Hb невозможна.Таким образом, человек чувствует гипоксию, но физиологический механизм организма начинает снижать выработку DPG, благодаря чему Hb может связывать кислород даже при более низком давлении кислорода.
Следовательно, когда самолет достигает максимальной высоты и остается устойчивым, человек чувствует себя комфортно. Когда Hb достигает тканей, уровень DPG увеличивается, увеличивая выделение кислорода. Точно так же описанный выше процесс меняется на противоположный, когда человек ныряет глубоко в море. Высокое давление O 2 приводит к увеличению выработки DPG, способствуя оксигенации Hb в легких и дезоксигенированию периферических тканей.
Свойства белков:
1. Денатурация:
Частичное или полное разворачивание нативной (природной) конформации полипептидной цепи известно как денатурация. Это вызывается теплом, кислотами, щелочами, спиртом, ацетоном, мочевиной, бета-меркаптоэтанолом.
2. Коагуляция:
Когда белки денатурируются под действием тепла, они образуют нерастворимые агрегаты, известные как коагулят. Все белки не коагулируются при нагревании, только некоторые из них, такие как альбумины, глобулины способны коагулироваться при нагревании.
3. Изоэлектрический pH (pH 1 ):
pH, при котором белок имеет равное количество положительных и отрицательных зарядов, известен как изоэлектрический pH. Под воздействием электрического поля белки не перемещаются ни к аноду, ни к катоду, поэтому это свойство используется для выделения белков. Белки становятся наименее растворимыми при pH – и осаждаются. Показатель pH I казеина составляет 4,5, и при этом pH казеина в кислом молоке, образующем творог.
4. Молекулярная масса белков:
Средняя молекулярная масса аминокислоты принята равной 110. Общее количество аминокислот в белке, умноженное на 110, дает приблизительную молекулярную массу этого белка. Различные белки имеют разный аминокислотный состав и, следовательно, их молекулярные массы различаются. Молекулярные массы белков колеблются от 5000 до 10 9 Дальтон. Экспериментально молекулярную массу можно определить такими методами, как гель-фильтрация, PAGE, ультрацентрифугирование или измерения вязкости.
Классификация белков :
Белки классифицируются на основании:
(1) Их растворимость и
(2) Их структурная сложность.
A. Классификация на основе растворимости:
По растворимости в воде белки подразделяются на:
1. Волокнистые белки:
Нерастворимы в воде. В их состав входят структурные белки.У них есть поддерживающая функция (например, коллаген) и / или защитная функция (например, кератин и фибрин волос).
2. Глобулярные белки:
Они растворимы в воде. Они включают функциональные белки, например, ферменты, гемоглобин и т. Д.
B. Классификация на основе структурной сложности:
В зависимости от сложности конструкции они делятся на:
(1) Простой
(2) Конъюгированные и
(3) Производные белки.
1. Простые белки:
Белки, состоящие только из аминокислот, известны как простые белки.
Далее они подразделяются на:
(а) Альбумины:
Они растворимы в воде, коагулируются при нагревании и осаждаются при полном насыщении сульфатом аммония, например, сывороточным альбумином, лактальбумином и яичным альбумином.
(б) Глобулины:
Они нерастворимы в воде, но растворимы в разбавленных солевых растворах.Они коагулируются при нагревании и выпадают в осадок при полунасыщении сульфатом аммония, например глобулином сыворотки и овоглобулином.
(c) Глютелины:
Они не растворимы в воде и нейтральных растворителях. Растворим в разбавленных кислотах и щелочах. Они коагулируют под действием тепла, например глютелин пшеницы.
(d) Проламины:
Нерастворим в воде, но растворим в 70% спирте, например, в глиадине пшеницы, белках кукурузы, ячменя и т. Д.
(e) Истории:
Водорастворимый, основной по своей природе из-за присутствия в ядре аргинина и лизина. Они помогают в упаковке ДНК в клетке. Они образуют белковый фрагмент нуклеопротеина.
(f) Протамины:
Водорастворимый, основной по своей природе, не подвергается тепловой коагуляции. Находится в сперматозоидах, следовательно, является компонентом нуклеопротеина сперматозоидов.
(г) Глобина:
Они растворимы в воде, не подвергаются тепловой коагуляции.например, глобин гемоглобина.
(h) Альбуминоиды или склеропротеины:
Нерастворимо во всех нейтральных растворителях, разбавленных кислотах или щелочах, например, в кератине волос и протеинах костей и хрящей.
2. Конъюгированные белки:
Белки, состоящие из аминокислот и не аминокислотного / белкового вещества, называемого простетической группой, известны как конъюгированные белки.
Различные типы конъюгированных белков:
(а) Хромобелки:
Здесь небелковая часть представляет собой окрашенное соединение в дополнение к белковой части.Бывший. Гемоглобин имеет гем в качестве простетической группы, а цитохромы также содержат гем.
(б) Нуклеопротеины:
Эти белки связаны с нуклеиновыми кислотами, например с хроматином (гистоны + нуклеиновые кислоты).
(c) Гликопротеины:
Когда небольшое количество углеводов присоединяется к белку, он известен как гликопротеины, например, муцин слюны. (Примечание: гликопротеины содержат большое количество белка и некоторое количество углеводов, а протеогликаны содержат большое количество углеводов и небольшое количество белков).
(d) Pbosphoprotein:
Фосфорная кислота присутствует в белке. Бывший. Молочный казеин и яичный желток (желтеллин).
(e) Липопротеины:
Белки в сочетании с липидами, например, ЛПНП, ЛПВП.
(е) Металлопротеины:
В дополнение к аминокислотам они содержат ионы металлов, например, гемоглобин (железо), церулоплазмин (медь).
3. Производные белки:
Это белки с низким молекулярным весом, полученные из белков с большим молекулярным весом под действием тепла, ферментов или химических агентов.
Белки → Белки → Протеозы → Пептоны → Пептиды → Аминокислоты
Влияние генетической изменчивости на трехмерную структуру и функцию белков
Abstract
Банк данных по белкам (PDB; http://wwpdb.org) был основан в 1971 году как первый ресурс цифровых данных открытого доступа по биологии с семью белковыми структурами в качестве начальных запасов.Глобальный архив PDB в настоящее время содержит более 126 000 экспериментально определенных трехмерных (3D) структур атомарного уровня биологических макромолекул (белков, ДНК, РНК), все из которых находятся в свободном доступе через Интернет. Знание трехмерной структуры продукта гена может помочь понять его функцию и роль в заболевании. Особый интерес в архиве PDB представляют белки, для которых определены трехмерные структуры генетических вариантов белков, что позволяет выявить структурные различия на атомном уровне, вызванные вариациями на уровне ДНК.Здесь мы представляем систематический и качественный анализ таких случаев. Мы наблюдаем широкий спектр структурных и функциональных изменений, вызванных различиями отдельных аминокислот, включая изменения активности ферментов, склонности к агрегации, структурной стабильности, связывания и диссоциации, некоторые в контексте больших сборок. Структурное сравнение белков дикого типа и мутировавших белков, когда доступны оба, дает представление о структурных различиях на атомном уровне, вызванных генетической изменчивостью.
Образец цитирования: Bhattacharya R, Rose PW, Burley SK, Prlić A (2017) Влияние генетической изменчивости на трехмерную структуру и функцию белков.PLoS ONE 12 (3):
e0171355.
https://doi.org/10.1371/journal.pone.0171355
Редактор: Ян Чжан, Мичиганский университет, США
Поступила: 23 августа 2016 г .; Одобрена: 19 января 2017 г .; Опубликован: 15 марта 2017 г.
Авторские права: © 2017 Bhattacharya et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Дополнительные данные, описанные в этой рукописи, находятся в свободном доступе на GitHub https://github.com/rcsb/SnpsInPdb.
Финансирование: Эта работа была поддержана грантом Национального научного фонда для RCSB PDB (DBI-1338415; PI: Стивен К. Берли). Архив Protein Data Bank управляется организацией Worldwide Protein Data Bank, которая состоит из RCSB Protein Data Bank, Protein Data Bank в Европе, Protein Data Bank Japan и BioMagResBank.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
1. Введение
Учитывая постоянно растущее значение геномики для здоровья человека, значительные усилия были направлены на установление связи фенотипов человека с генотипическими вариациями на уровне нуклеотидов и изменениями в трехмерной структуре белка [1,2].Генетическая изменчивость может вызывать изменения фенотипа, если уровни экспрессии изменяются или нарушается сплайсинг пре-мРНК. Изменения последовательности на уровне аминокислот влияют на форму, функцию или связывающие свойства данного белка. Особый интерес при анализе данных секвенирования генома представляют однонуклеотидные вариации (SNV). Большинство SNV нейтральны или не влияют на здоровье человека или эмбриональное развитие [3,4]. Однако некоторые SNV могут быть полезны для прогнозирования индивидуальной реакции на определенные лекарства, восприимчивости к другим экзогенным факторам, таким как токсины окружающей среды, или риска развития заболевания [4,5,6].Идентификация SNV, приводящего к фенотипу, является сложной задачей из-за сложности биологии человека. Ассоциативные исследования часто используются для определения SNV (или SNV), приводящего к сложным фенотипам [7], на основе генетических вариаций среди затронутых людей для выявления ассоциации вариации с признаком (или фенотипом). Такие исследования обычно концентрируются на ассоциациях между точечными мутациями и фенотипическими признаками или заболеваниями [8]. Однако исследования геномной ассоциации (GWAS) требуют скрининга большого количества маркеров [9,10,11], и корреляция данного SNV с конкретным фенотипом не доказывает per se причинно-следственной связи.Хотя полногеномные исследования дают представление о генетической основе болезней человека, они относительно мало объясняют наследуемость многих сложных признаков. Этот недостаток поднял вопрос о том, где может быть обнаружена «недостающая наследственность» сложных заболеваний [12].
Одним из способов анализа больших наборов данных о генетической изменчивости является использование инструментов биоинформатики для фильтрации данных [9]. Вычислительные методы, такие как SIFT [13,14], Polyphen-2 [15] или MAPP [16], классифицируют SNV по отрицательному, нейтральному или положительному влиянию на структуру или функцию белка.Некоторые алгоритмы даже пытаются оценить изменение свободной энергии стабилизации структуры белка из-за изменений отдельной последовательности, например, DUET [17], Mupro [18] и I-Mutant2.0 [19]. Метод Site Directed Mutator (SDM), разработанный Topham и его коллегами, использует подход, аналогичный термодинамическому циклу [20,21]. Альтернативные аналитические инструменты используют сохранение последовательности конкретной аминокислоты в семействе белков или поиск отличительной особенности структуры белка, чтобы предсказать, влияет ли замена на функцию, например, SIFT или замены нетолерантных из толерантных [13,14,21].Другие инструменты биоинформатики, основанные на эволюционных принципах, которые предсказывают влияние вариантов кодирования на функцию белка, включая PANTHER [22,23], HMMER / LogR.E-value [24], Condel [25] и ряд других [26,27, 28,69]. Пользовательские базы данных, включая SAAP [27], PolyDoms [28], topoSNP [29], SNPeffect [30], SNPs3D [31], MutDB [32], FATHMM [33] и LS-SNP [34]), обеспечивают связь между SNV. и данные о последовательности / структуре белка и / или клеточных процессах, таких как локализация, фосфорилирование и гликозилирование.Национальная медицинская библиотека NCBI поддерживает инструмент tranSNP, который позволяет отображать расположение SNV в геноме [35]. ENSEMBL предлагает средство прогнозирования эффекта варианта [36]. Ресурсы, описанные выше, используют один из шести популярных наборов обучающих данных, перечисленных в таблице 1. Несмотря на сложность этих и других подходов, всегда возникает вопрос, можно ли полагаться на прогнозы на их основе, поскольку существует множество примеров несоответствия между отдельными методы прогнозирования мутаций.
Возможно, наиболее информативным источником данных, который может объяснить, что вызывает конкретный фенотип, является наличие трехмерной экспериментально определенной структуры, которая содержит понимание последствий конкретного геномного варианта на атомарном уровне. Банк данных белка RCSB (RCSB PDB) [35] обеспечивает открытый доступ к архиву банка данных белка экспериментальных структур биологических макромолекул без ограничений на использование. PDB — один из наиболее широко используемых ресурсов цифровых данных в биологии и биомедицине во всем мире.RCSB PDB предоставляет инструменты для размещения, аннотации, запросов, анализа и визуализации, а также образовательные ресурсы для использования с архивом PDB [43]. Все данные о трехмерной структуре макромолекул в PDB были получены одним из трех экспериментальных методов: дифракция рентгеновских лучей (~ 89%), ядерный магнитный резонанс в растворе (ЯМР) (~ 10%) или электронная микроскопия (<1%). . Структуры PDB обеспечивают детализацию на атомарном уровне, с помощью которой можно анализировать структурные эффекты несинонимичных кодирующих SNV.
Знание трехмерной структуры генного продукта полезно для прогнозирования и понимания как функции, так и роли в заболевании.Однако большинство опубликованных на сегодняшний день исследований, в которых анализируется взаимосвязь между точечными мутациями и экспериментально наблюдаемой трехмерной структурой белка, ограничиваются отдельными белками или отдельными заболеваниями. Количественный анализ последствий SNV для трехмерной структуры белка, выходящий за рамки предсказаний, ограничен [44].
Цель этого исследования — улучшить наше понимание взаимосвязи между точечными мутациями и экспериментально наблюдаемыми последствиями в 3D.Мы определили набор контрольных данных белковых структур, которые содержат хорошо охарактеризованные точечные мутации, для которых трехмерные координаты атомов доступны из PDB. Мы вручную проанализировали 374 структуры белков человека и SNV. Здесь мы представляем подробный обзор наблюдаемых эффектов SNV на структуру, функцию, стабильность и связывающие свойства белков.
2. Методология
2.1. Построение набора данных
Набор данных, используемый в этой статье, представляет собой полуавтоматически полученную и вручную подобранную коллекцию белков, каждый из которых имеет аминокислоту, которая была изменена с помощью SNV, а трехмерные атомные координаты доступны в PDB.
Чтобы собрать этот набор данных,
- Мы идентифицировали 2596 структур, существующих в PDB, для которых несинонимичные SNV могли быть отображены через LS-SNP / PDB [34]. Для каждой записи PDB аминокислотная последовательность кристаллизованного белка, экспериментально наблюдаемая в 3D, отличается от соответствующей последовательности UniProt в положении изменения.
- Из этих 2596 структур мы выбрали только те структуры, для которых информация о мутации dbSNP совпадала с информацией, поступающей из UniProt и трехмерной структуры.Например, rs28933981, изменение в dbSNP — T → M, а в PDB: 1BZE, разница последовательностей в структуре — также T → M, и этот случай был включен в наш набор данных. Напротив, запись в базе данных dbSNP для SNV rs128620185 сообщает R → H, но в архиве PDB (1BTK) экспериментально наблюдаемая разница последовательностей R → C. Этот случай был исключен из нашего набора данных, потому что он не соответствует заявленному R → H SNV.
- После фильтрации несогласованности базы данных мы удалили сопоставления одного и того же SNV с несколькими записями PDB, гарантируя, что каждый SNV представлен только один раз.Когда доступно несколько записей PDB с одной и той же мутацией, предпочтение было отдано структурам, определенным с помощью рентгеновской кристаллографии. В некоторых случаях это было невозможно, и набор данных содержит 49 структур, определенных методом ЯМР. (см. дополнительные файлы S1 и S2, рис.).
В результате этой строгой процедуры был получен окончательный набор контрольных данных из 374 уникальных SNV человека, каждая из которых соответствует отдельной записи PDB, для которой доступны трехмерные координаты атомного уровня. При фильтрации по идентичности белковой последовательности набор данных содержит 334 уникальных структуры PDB, что свидетельствует о том, что мы приняли некоторую ограниченную избыточность при построении набора данных.Каждая из 374 SNV описана в независимых экспериментах, и все такие случаи были сохранены в наборе данных. Полный набор данных см. В дополнительном файле S1 File.
2.2. Ручная аннотация SNV
Чтобы перечислить последствия данного SNV для генного продукта, мы систематически изучили доступную литературу для выявления экспериментально подтвержденных функциональных эффектов. Мы также провели поиск в нескольких базах данных (см. Ниже). Для каждого SNV мы извлекли из литературы и баз данных следующую информацию:
- Позиция SNV на трехмерной структуре белка в PDB (присутствует на поверхности по сравнению спохоронен внутри), оценено с помощью расчетов доступности поверхности BioJava [70].
- Попадает ли аминокислотная замена во вторичную структуру Loop vs. Alpha_helix vs. Beta_strand , определяется из аннотаций вторичных структур, полученных из PDB [35,43].
- Какой эффект или последствия SNV оказывает на белок?
Мы классифицировали мутации, влияют ли они на активность белка vs.его Стабильность против Связывание против Сборка против Перегруппировка (локальные конформационные изменения). 374 структуры PDB, которые отражают последствия конкретного SNV в этом наборе данных, могут содержать другие точечные мутации. Такие различия могут быть нейтральными или быть результатом преднамеренных мутаций, способствующих кристаллизации, и т. Д. Набор данных, используемый здесь, содержит только описанные в литературе и фенотипические причинные SNV, которые были связаны со структурным изменением (ями) на уровне белка.Во многих случаях эти белки были намеренно кристаллизованы с целью понимания структурных последствий изменения последовательности. Чтобы определить частоту, с которой SNV встречается в популяции, мы проконсультировались с сервером вариантов экзома NHLBI Exome Sequencing Project (ESP) [43,44] и dbSNP [34]. SNV с частотой минорного аллеля (MAF, относящаяся к частоте, с которой наименее распространенный аллель встречается в данной популяции) менее 1% считаются редкими , а остальные классифицируются как общих SNV.
Базы данных и серверы, использованные в данной работе:
- RCSB PDB — RCSB Protein Data Bank [35,43] — это региональный центр данных США для Всемирного банка данных белка (wwpdb.org), который управляет единым глобальным архивным хранилищем PDB экспериментальных трехмерных структурных данных биологические макромолекулы.
- LS-SNP / PDB –это веб-инструмент для аннотации человеческих SNP. Он содержит автоматизированный конвейер, который систематически отображает человеческие несинонимичные SNP на структуры PDB [34].
- dbSNP — База данных одиночного нуклеотидного полиморфизма (dbSNP) [36] — это архив генетических вариаций внутри и между разными видами, разработанный и размещенный Национальным центром биотехнологической информации (NCBI) в сотрудничестве с Национальным институтом исследования генома человека (NHGRI) . База данных содержит информацию о SNP, коротких делеционных и инсерционных полиморфизмах (indels / DIP), микросателлитных маркерах и коротких тандемных повторах (STR), многонуклеотидных полиморфизмах (MNP), гетерозиготных последовательностях и названных вариантах [36].
- NHLBI Exome Sequencing Project (ESP) Сервер вариантов экзома — Содержит большую коллекцию хорошо фенотипированных популяций США [45,46].
- PubMed —PubMed содержит более 23 миллионов рефератов по биомедицинской литературе из MEDLINE, журналов по естественным наукам и онлайн-книг [47].
2.2.1. Программные инструменты для сопоставления генетической изменчивости с последовательностью белка и трехмерной структурой.
Чтобы сделать возможным более глубокий анализ генетической изменчивости в контексте белковой последовательности и трехмерных структур, мы разработали инструменты, облегчающие картирование любого генетического местоположения на соответствующие белковые последовательности и трехмерные белковые структуры [43].Эти инструменты доступны на веб-сайте RCSB PDB [71] и использовались для проверки целостности эталонных данных, собранных для этого исследования.
- Инструмент картирования от положения генома человека до последовательности белка и трехмерной структуры — Этот инструмент позволяет сопоставить координаты из эталонных сборок человека версий 37 или 38 (как предоставлено Консорциумом ссылок на геном) с правильными изоформами UniProt и трехмерными структурами. . http://www.rcsb.org/pdb/chromosome.do
- Human Gene View — Этот браузер генома поддерживает навигацию по геному человека и исследование взаимосвязи между записями в архиве PDB и генами.
- Protein Feature View — Обеспечивает богатую графическую сводку характеристик белковых последовательностей, включая идентификацию геномных позиций, сопоставленных с белковыми последовательностями.
- 3D Viewer — PV (Protein Viewer) позволяет выделять позиции генома, сопоставленные со структурами белков, в 3D.
2.3. Категории для присвоения эффектов SNV
Следующие категории были использованы для классификации эффектов SNV на уровне белка:
- Активность — SNV вызывает увеличение, уменьшение или полную потерю активности белка.
- Агрегация — SNV делает белок склонным к агрегации.
- Стабильность — SNV вызывает изменение стабильности белка. Это может сделать белок восприимчивым к протеолитическому расщеплению, или вызвать изменение температуры термической инактивации, или вызвать изменение энергии стабилизации белка. Это также может привести к дестабилизации белкового олигомера, потере упаковки или гидрофобных взаимодействий или к изменению режима (ов) белок-белкового взаимодействия.
- Связывание / диссоциация — SNV приводит к изменениям сродства к известному партнеру по связыванию или изменениям кинетики ассоциации или диссоциации.Он также может вызывать структурные изменения в сайте связывания или влиять на специфичность партнера (ов) связывания.
- — SNV влияет на свойства сборки олигомеров белка.
- Перестройка — SNV вызывает локальные структурные перестройки (конформационные изменения) по соседству с заменой аминокислоты, возникающей из SNV.
Сборка
3. Результаты и обсуждение
3.1. Расположение SNV в трехмерных конструкциях
Сначала мы исследовали, возможно ли выявить закономерности, касающиеся сайтов, в которых происходят мутации.В частности, мы определили изменение положения аминокислоты, вызванное SNV в трехмерной структуре, доступной из PDB. Структурные местоположения SNV были затем вручную разделены на 2 основные группы: Поверхность и Погребенный , путем анализа биологической сборки (трехмерной олигомерной структуры) белка. Мы наблюдали, что 79% SNV (297 из 374) лежат на поверхности белка, а оставшиеся 21% (77 из 374) находятся внутри белка (рис. 1A). Для справки, поверхностные и захороненные остатки составляют 71% и 29%, соответственно, для всех остатков во всех структурах в наборе данных.
Рис. 1. Распределение SNV по структурному положению.
A. Распределение SNV в нашем наборе контрольных данных на основе структурного положения (диаграмма). Есть две широкие категории: Поверхность (остаток) или Погребенный (остаток). B. Распределение SNV в наборе данных на основе вторичного структурного местоположения (гистограмма). Две широкие категории, Поверхность (остаток) или Погребенный (остаток), далее подразделяются на Loop , Alpha_helix и Beta_strand на основе вторичного структурного элемента, на который отображается SNV.
https://doi.org/10.1371/journal.pone.0171355.g001
Поверхность и Скрытые категории были дополнительно подразделены на подкатегории Loop , Alpha_helix и Beta_strand в соответствии с вторичным структурным контекстом каждой Изменение, связанное с SNV, в соответствующей структуре PDB. Учитывая вторичные структуры, ожидаемое распределение в нашем наборе данных составляет 46% Alpha_helix, 24% Beta_strand и 30% Loop.
В категории Surface было замечено, что 52% (155 из 297) SNV соответствуют регионам Loop по сравнению с ~ 34% для Alpha_helix и ~ 14% для Beta_strand . Это открытие не было неожиданным, поскольку аминокислотные изменения в участках петли часто можно компенсировать, не влияя на структуру и функцию белка, благодаря гибкости этих сегментов полипептидной цепи. Напротив, для категории Buried ~ 42% SNV соответствуют Alpha_helix vs.~ 31% в Beta_strand против ~ 27% в регионах Loop (рис. 1B). Таким образом, SNV в категории Surface имеют более высокую вероятность того, что они будут обнаружены в областях Loop по сравнению с категорией Buried , где изменения, связанные с SNV, с большей вероятностью будут обнаружены в Alpha_helix и Beta_strand . Сходные распределения, основанные на структурном положении и вторичных структурных элементах, наблюдались при сравнении SNV с неизвестными структурными и функциональными последствиями и SNV с информацией о структурных и функциональных последствиях (см. S3 Рис.).Типичные примеры показаны на рис. 2.
Рис. 2. Последствия SNV отображаются в различных местах в белковых структурах.
A) PDB: 1AZV, SNV: rs121
1 (G37R) присутствует на поверхности белка в выделенном сегменте петли, где он вызывает неврологическое заболевание Лу Герига. B) PDB: 1J04, SNV: rs1219 (G170R) присутствует на поверхности белка в выделенной Alpha_helix, где он вызывает наследственную почечнокаменную болезнь, первичную гипероксалурию типа 1.C) PDB: 3S5E, SNV: rs138471431 (W155R) присутствует на поверхности белка в выделенном Beta_sheet, где он вызывает атаксию Фридрейха нейродегенеративного заболевания. D) PDB: 2V7A, SNV rs1219 (T315I) присутствует в АТФ-связывающем домене и вызывает устойчивость к лекарственному средству иматиниб у пациентов с хроническим миелолейкозом.
https://doi.org/10.1371/journal.pone.0171355.g002
3.2. Последствия изменений, связанных с SNV
Систематически просматривая соответствующую рецензируемую литературу, мы определили, что широкий спектр возможных эффектов может быть отнесен к единственному изменению остатка.Чтобы классифицировать эти результаты, мы классифицировали ответы или последствия, связанные с SNV, следующим образом: Активность , Агрегация , Стабильность , Связывание , Сборка и Перегруппировка (раздел 3.3, таблица 2). Однако уровень детализации, с которой каждое из изменений, связанных с SNV, было экспериментально охарактеризовано, варьируется. Например, функциональные анализы были выполнены только для относительно небольшого числа случаев. Данные, относящиеся к функциональным последствиям мутации, НЕ доступны в литературе для 249 из 374 SNV (~ 66%), а данные, касающиеся структурных последствий изменений, связанных с SNV, НЕ доступны для 284 из 374 SNV (~ 75%). ).Тем не менее, эффекты, описанные в литературе, часто бывают весьма драматичными. В таблице 3 приведены примеры того, что мы действительно знаем о 374 случаях SNV, составляющих наш набор данных.
Таблица 2. Влияние SNV на структуру и функцию белка для набора данных из 374 SNV, для которых экспериментально полученные данные на атомном уровне для вариации доступны в банке данных по белкам.
Каждый SNV может быть оценен по нескольким категориям.
https: // doi.org / 10.1371 / journal.pone.0171355.t002
Примеры для каждой категории ответов приведены ниже в Таблице 3.
Мутация с одним остатком может иметь множество эффектов на структуру и функцию белка. Таким образом, последствия одного SNV могут повлиять на более чем одну из шести категорий, представленных в Таблице 3. Ниже обсуждаются два информативных тематических исследования:
Арилсульфатаза А (ген: ARSA) расщепляет сульфатиды. Картирование мутации Pro → Leu (P428L) (rs28940893) на аминокислоту 426 в структуре PDB приводит к дефекту олигомеризации (предпочтительной сборкой мутанта является димер вместо октамера, как для дикого типа (PDB дикого типа: 1AUK)), что увеличивает восприимчивость белок разрушается лизосомальными цистеиновыми протеиназами, что приводит к серьезному сокращению периода полувыведения [48] и метахроматической лейкодистрофии [48].Следовательно, это связанное с SNV изменение влияет как на стабильность, так и на сборку белка (рис. 3A).
Рис. 3. SNV, которые влияют как на структуру, так и на функцию белка.
A) Мутантная форма арилсульфатазы A P428L принимает атипичную димерную конфигурацию (вместо нормального октамера), что снижает период полужизни белка. B) Мутантная форма дегидратазы дельта-аминолевулиновой кислоты F12L собирается в виде гексамера (вместо нормального октамера), который сдвигает оптимум pH фермента с pH 7 → pH 9.
https://doi.org/10.1371/journal.pone.0171355.g003
Дегидратаза дельта-аминолевулиновой кислоты (ген: ALAD) катализирует раннюю стадию биосинтеза тетрапиррола [49]. Мутация Phe → Leu (F12L) (rs121
В следующем разделе мы приводим сводку результатов для каждой категории ответов SNV и более подробно обсуждаем несколько примеров.
3.2.1. Деятельность.
52 из 374 изменений, связанных с SNV, в нашем наборе данных (~ 14%) либо увеличивают, либо уменьшают активность белка.В некоторых случаях SNV приводят к полной потере функции. Например, глицил-тРНК синтетаза человека (мутант PDB: 2PMF) теряет детектируемую ферментативную активность из-за мутации G526R (rs137852646), которая является причиной болезни Шарко-Мари-Тута [50]. G526 представляет собой эволюционно консервативный остаток, расположенный в середине мотива 3, который соединяет Beta_strand β19 с Alpha_helix α13. За исключением сайта мутации, общая структура мутантного белка G526R почти идентична структуре фермента дикого типа (PDB дикого типа: 2ZT5) (среднеквадратичное отклонение положения атома альфа-углерода = 0.8Å). Хотя изменение G526R не нарушает положения остатков, составляющих активный сайт, боковая цепь мутантного остатка (R526) препятствует доступу к активному сайту, тем самым инактивируя фермент [50] (рис. 4).
Рис. 4. Изменение, связанное с SNV, которое влияет на ферментативную активность.
Полупрозрачная, доступная для растворителя поверхностная репрезентация сайта связывания AMP. Для структуры дикого типа (PDB: 2ZT5) АМФ связывается в активном сайте (фигурка с цветовой кодировкой атомного типа), в то время как в мутантной структуре (PDB: 2PMF) связывание АМФ блокируется выступом боковой цепи аргинина (красный) в активный сайт, тем самым блокируя связывание субстрата с АТФ и инактивируя фермент.
https://doi.org/10.1371/journal.pone.0171355.g004
3.2.2. Агрегация.
28 из 374 изменений, связанных с SNV, в нашем наборе данных (~ 6%) вызывают агрегацию белков, которая является признаком некоторых нейродегенеративных заболеваний, например, болезни Альцгеймера (AD), болезни Паркинсона (PD), болезни Хантингтона (HD). , боковой амиотрофический склероз (БАС) и прионные заболевания. Чтобы проиллюстрировать, как единичная точечная мутация может вызывать агрегацию, мы рассмотрим случай болезни Лу Герига или бокового амиотрофического склероза (БАС), который вызван нестабильностью мутанта Ala → Val (A4V) (rs121
2) супероксида Cu, Zn человека. дисмутаза (HSOD) (мутант PDB: 1N19) [51].Ala4 расположен внутри Beta_strand , рядом с остатками интерфейса димера и рядом с остатками Leu106 и Ile113, которые помогают стабилизировать интерфейс димера. Leu106 является частью греческого ключевого супервторичного структурного мотива, участвующего в покрытии одного конца β-цилиндра. Алифатическая боковая цепь Leu106 стабилизирует интерфейс димера, действуя как пробка, которая стабилизируется ван-дер-ваальсовыми взаимодействиями с Ala4 и Ile113 [51]. Расположение боковых цепей остатков Phe20, Ile113, Leu106 и Ile15 смещено из-за мутации A4V.Эта мутация также вызывает смещение Leu106 на одном конце β-ствола. Ферментативная активность мутантного белка составляет ~ 50% от активности дикого типа (PDB дикого типа: 4FF9). Другим следствием дестабилизированной мутации A4V является то, что она способствует образованию HSOD-содержащих агрегатов, которые, как полагают, являются токсичными для мотонейронов и вызывают заболевание [51].
3.2.3. Стабильность.
58 из 374 изменений, связанных с SNV, в нашем наборе данных (~ 16%) приводят к снижению стабильности белка.SNV может влиять на стабильность белка, делая его чувствительным к протеолизу или изменяя температуру термической инактивации. Чтобы проиллюстрировать, как мутация может повлиять на стабильность белка, мы проанализируем следующий случай:
DJ-1 (мутант PDB: 2RK4) — небольшой консервативный белок (189 аминокислот), отсутствие или инактивация которого приводит к редким формам семейного паркинсонизма у людей [52]. Он также является Ras-зависимым онкогеном и был связан с несколькими типами рака [53].Мутация Met → Ile (M26I) (rs74315351) снижает термостабильность и усиливает образование агрегатов DJ-1 [54]. M26 (PDB дикого типа: 1P5F) представляет собой консервативный остаток, расположенный в гидрофобной сердцевине белка. Хотя M26 находится рядом с интерфейсом димера, он не участвует напрямую в межмолекулярных взаимодействиях белок-белок через интерфейс димера. Мутация M26I вводит β-разветвленную аминокислоту (изолейцин) в плотно упакованное гидрофобное ядро мономера DJ-1. Стерическое столкновение между I26 и боковой цепью I31 слегка смещает остатки и вызывает потерю оптимальных контактов упаковки внутри белка, что приводит к снижению стабильности [54] (Рис. 5).
Рис. 5. SNV, влияющий на стабильность структуры белка.
Болезнь, вызывающая сайт мутации в протеине DJ-1. Структура дикого типа (PDB: 1P5F) изображена зеленым, а вариант (PDB: 2RK4) — красным. M26 — это консервативный остаток в Alpha_helix A, расположенный внутри гидрофобного ядра белка. Стерическое столкновение между I26 и боковой цепью I31 приводит к смещению I31 на ~ 0,7 Å от I26, что приводит к потере благоприятных контактов упаковки с участием M26.
https: // doi.org / 10.1371 / journal.pone.0171355.g005
3.2.4. Переплет.
44 из 374 изменений, связанных с SNV, в нашем наборе данных (~ 12%) влияют на свойства связывания лиганда или макромолекулы белка. SNV может изменять аффинность связывания с партнерами, такими как активаторы, репрессоры или субстраты. Такие изменения также могут влиять на кинетику взаимодействий с партнерами или изменять специфичность связывания. Структурно SNV может изменять сайт связывания белка, что, в свою очередь, может влиять на взаимодействия с белками-партнерами, лигандами и т. Д.Замена Lys → Arg (K117R) (rs104894227) в HRAS (мутантный PDB: 2QUZ) не изменяет ни внутренней активности Ras GTPase, ни чувствительности к активирующим GTPase белкам, но вместо этого вызывает конститутивную активацию HRAS (и нижестоящих мишеней), заметно увеличивая скорость диссоциации ВВП [55]. Этот мутантный белок HRAS активирует сигнальный каскад RAF / MEK / ERK, что приводит к независимой от фактора роста клеточной пролиферации. Хотя лизин и аргинин являются положительно заряженными аминокислотами, даже эта консервативная замена приводит к конститутивной активации HRAS [55].Клинически изменение K117R в HRAS приводит к постоянному и неконтролируемому клеточному делению, вызывающему синдром Костелло [55], который является редким генетическим заболеванием, поражающим многие части тела.
Замена Lys → Arg в положении 117 соответствует консенсусной последовательности связывания нуклеотидов NKXD. В HRAS дикого типа (PDB дикого типа: 2CE2), K117 стабилизирует связывание нуклеотидов, когда его алифатическая часть взаимодействует с основанием, в то время как его концевая аминогруппа взаимодействует с кислородом рибозы O4 N85 и с сегментом основной цепи (Gly13, CO) из фосфат-связывающая петля (P-петля) [55].Дестабилизация связывания нуклеотидов является следствием тонких перестроек из-за введения большей боковой цепи, способной производить дополнительные полярные взаимодействия [55]. (Рис 6)
Рис. 6. Увеличенный вид нуклеотид-связывающей области Lys117Arg.
Мутированный остаток R117 стабилизируется за счет взаимодействий с P-петлей (Gly13, CO основной цепи) и дополнительного взаимодействия с Asn85. Таким образом, мутированный остаток вызывает дестабилизацию связывания нуклеотида из-за потери прямого контакта с лигандом.Мутированный PDB: 2QUZ (синий) и PDB дикого типа: 2CE2 (розовый).
https://doi.org/10.1371/journal.pone.0171355.g006
3.2.5. Сборка.
19 из 374 SNV в нашем наборе данных (~ 5%) изменяют четвертичную структуру (олигомерную сборку) белка. Мутация скрытого Ile → Thr (I58T) (rs1141718) в ядре четырехспирального пучка, который также образует межсубъединичный интерфейс в супероксиддисмутазе марганца человека или MnSOD (мутантный PDB: 1VAR), снижает стабильность сборки обоих белков. и активность.Нативный человеческий MnSOD представляет собой гомотетрамер, или, точнее, димер димеров. [56]. Мутантная форма I58T MnSOD является димером, что подтверждается аналитической гель-фильтрацией [56]. Нативная боковая цепь Ile 58 находится на границе димер-димер, где она помогает стабилизировать нормальное тетрамерное состояние фермента (PDB дикого типа: 1MSD). Мутация привнесла бы меньшую боковую цепь, Thr58, в интерфейс димер-димер, где, как было бы предсказано, возникнет полость с дефектом упаковки. Следовательно, нарушение границы раздела димер-димер изменяет равновесие димер-тетрамер в пользу димера.что может быть связано с боковым амилотрофическим склерозом [56] (рис. 7). Как было предсказано по снижению термостабильности, мутантный MnSOD подвергается опасности при нормальной температуре тела. Быстрая инактивация Ile58Thr MnSOD при повышенных температурах (например, во время лихорадки и воспаления) увеличила бы окислительное повреждение, опосредованное супероксидом, и, возможно, способствовала бы возникновению заболеваний.
Рис. 7. В супероксиддисмутазе марганца SNV может влиять на сборку белка.
Состояние сборки дикого типа является тетрамерным (слева, но из-за картирования мутации на границе димер-димер (красный), тетрамерная структура не наблюдается в растворе (справа).
https://doi.org/10.1371/journal.pone.0171355.g007
3.2.6. Перестановка.
25 из 374 изменений, связанных с SNV, в нашем наборе данных (~ 7%) вызывают значительные конформационные изменения в непосредственной близости от мутировавшего остатка. Мутация Ile → Val (I546V) (rs61749389) в факторе фон Виллебранда (vWF, мутантный PDB: 1IJK) вызывает нарушение свертывания крови при болезни Виллебранда. Мутация имеет эффект «усиления функции», создавая конститутивно активную форму vWF, которая связывает тромбоциты в отсутствие сдвигающих сил [57].Ile546 находится в гидрофобной сердцевине белка, рядом с доменом A1. (Примечание: vWF связывается с гликопротеином lb или рецептором Gplb на тромбоцитах посредством взаимодействий с доменом A1.) В экспериментально определенной структуре мутантного белка молекула воды проникла в полость внутри гидрофобного ядра белок, созданный заменой Ile на меньшую боковую цепь Val [57]. Присутствие молекулы воды влияет на структуру домена A1, что, в свою очередь, усиливает связывание GpIb [57].Механизм, вызывающий болезнь, — распространение конформационных изменений от гидрофобного ядра белка к его поверхности, где усилено связывание Gplb [57] (рис. 8) (PDB дикого типа: 1OAK).
Рис. 8. Фактор фон Виллебранда (дикий тип: зеленый PDBID 1OAK; мутантный PDB I546V: 1IJK) с выделенным местоположением мутации I546V.
Замена Ile на Val в положении 546 создает полость в гидрофобном ядре мутантной структуры I546V, которая занята молекулой воды (обозначенной +).Возникающее в результате структурное возмущение передается через внутреннюю часть белка, влияя на расположение боковых цепей Y565, His563 и D560. В совокупности эти изменения влияют на связывание Gplb, вызывая болезнь фон Виллебранда.
https://doi.org/10.1371/journal.pone.0171355.g008
Такие процессы можно сравнить с машинами «Руба Голдберга», которые изображал карикатурист, лауреат Пулитцеровской премии Руби Голдберг. Карикатурист «изобрел» вымышленные машины, в которых он воображал, что небольшое возмущение одной части машины приведет к большим изменениям в конце сложной последовательности согласованных взаимодействий (www.rubegoldberg.com/about/).
3.2.7. SNV не вовлечены в заболевание.
В предыдущих примерах мы выделили трехмерные структурные изменения белка, возникающие из-за SNV, которые считаются причиной заболевания. Однако многие варианты одной аминокислоты оказывают влияние на структуру и функцию макромолекул, которые НЕ связаны с заболеванием. Например, вариант T105I в гистамин-N-метилтрансферазе (HNMT) (Mutant PDB: 1JQE) вызывает изменение зависящей от температуры специфической активности белка, но, как известно, не вызывает заболевания [58,59].В этом случае вариант Ile 105 оказывает существенное влияние на катализ только при сверхфизиологических температурах (т.е. вызывает тепловую нестабильность при ~ 50 ° C), что несовместимо с жизнью человека [58]. Идентичность аминокислоты в положении 105 оказывает значительное влияние на структуру и динамику активного сайта. При визуализации в 3D видно, что Ile 105 устанавливает больше контактов с другими остатками в гидрофобном ядре, чем Thr 105 (PDB дикого типа: 2AOT). Измененная упаковка вызывает структурную перестройку полипептидной цепи, но, по-видимому, не способствует заболеванию [59].
Большинство программных средств биоинформатики предсказывают, что вариант T105I — это заболевание, вызывающее , или , не вызывающее заболевание, , ни один из которых не описывает адекватно происходящие изменения. Доступные программные инструменты предсказывают, что вариант T105I будет иметь либо 1) умеренное воздействие, 2) ~ 40% шансов оказаться вредной мутацией, либо 3) пониженную термостабильность. Фактически, мутация T105I проявляет эффекты только при надфизиологических температурах.Следовательно, существует острая потребность в более точных инструментах программного прогнозирования.
3.3. Недостаточность структурных и функциональных данных для SNV
Для большинства SNV, представленных в нашем наборе данных, мы не нашли информации о структурных или функциональных изменениях, вызванных SNV, опубликованной в рецензируемой литературе. Мы сгруппировали все эти SNV в Unknown_Structural_Consequence и Unknown_Functional_Consequence соответственно. SNV, в которых не было информации о структурных последствиях (например,g., конформационные изменения из-за мутации) были сгруппированы в категорию Unknown_Structural_Consequence . Если в литературе нет информации о функциональном воздействии (например, влиянии на активность или связывание), мы сгруппировали SNV под Unknown_Functional_Consequence . Для этих SNV нет экспериментальных данных об эффекте. Таким образом, SNV, влияние которых на структуру и функцию белка неизвестно, попадают в эту категорию. Одной из возможных причин высоких значений в этих двух категориях (249 SNV в Unknown_Functional_Consequence и 284 SNV в Unknown_Structural_Consequence ) может быть ~ 70% миссенс-мутаций, которые считаются нейтральными [4].Для справки, 9 из 374 SNV, хорошо охарактеризованных на уровне белка, имеют экспериментальные данные, подтверждающие нейтральный SNV. Мы считаем вероятным, что большинство из 249 или 284 SNV также могут иметь нейтральный эффект, но для таких выводов необходимы экспериментальные доказательства.
Для небольшого подмножества из 374 записей PDB в нашем наборе данных также можно было идентифицировать соответствующие структуры дикого типа в архиве PDB. По состоянию на конец ноября 2016 года 143 записи PDB с мутациями, связанными с SNV, могли быть сопоставлены с аналогом дикого типа в PDB.Дополнительный файл CSV (файл S4), описанный в разделе «Доступность данных», содержит сопоставление идентификаторов PDB как для записей дикого типа, так и для мутантных записей, если они доступны.
3.4. Особые случаи
Перечисленные выше различные категории последствий SNV достаточны для описания наиболее наблюдаемых SNV. Тем не менее, есть несколько дополнительных эффектов, заслуживающих обсуждения.
- Изменение функции (PDB: 1OPH, SNV ID: rs121
3, Мутация: M358R, PDB дикого типа: 2QUG) — это изменение, связанное с SNV, связано с Alpha1-Antitrypsin Pittsburg, фатальным нарушением свертываемости крови [60].Мутация Met → Arg в положении 358 превращает альфа1-антитрипсин, ингибитор эластазы, в ингибитор тромбина. Поверхности активного сайта эластазы и тромбина достаточно похожи, так что альфа1-антитрипсин Met358 дикого типа связывается с активным сайтом эластазы (который специфичен для метионина в сайте расщепления), а мутантный альфа1-антитрипсин Arg358 связывается с активным сайтом эластазы. тромбин (который специфичен для аргинина или лизина в сайте расщепления) [60] (рис. 9A).
Рис 9. Примеры частных случаев.
A) PDB: 1OPH. Выделенный красным остаток представляет сайт мутации (M358R). Из-за этой мутации альфа-1-антитрипсин теряет свою функцию ингибитора эластазы, сохраняет свою функцию ингибитора трипсина и приобретает функцию ингибитора тромбина. Б) PDB: 1J04. Две выделенные области представляют два полиморфизма, которые действуют синергетически. Выделенная область зеленым цветом представляет полиморфизм P11L в AGT, тогда как выделенная область красным цветом представляет специфическую для заболевания мутацию G170R.В) PDB: 1J47. Выделенный красным остаток представляет собой M64I в полноразмерной последовательности hSRY, которая соответствует M9I в данной конструкции и влияет на степень изгиба ДНК.
https://doi.org/10.1371/journal.pone.0171355.g009
3,5. Частота среди населения
Один из важных вопросов генетических исследований человека заключается в том, как частота, с которой генетическая вариация может быть обнаружена в популяции, соотносится с риском заболевания. Генетический вклад в заболевание был приписан A) большому количеству распространенных вариантов с малым эффектом по всему частотному спектру аллелей, B) большому количеству редких вариантов с большим эффектом, или C) некоторой комбинации генотипических, экологических и эпигенетических взаимодействия [65,66,67].
С ростом внедрения технологии секвенирования следующего поколения, частота, с которой можно обнаружить конкретную вариацию в популяции, определяется для все большего числа SNV. В этом контексте мы изучили известные популяционные частоты 374 SNV в нашем наборе данных и коррелировали наблюдаемые частоты с данными о серьезности последствий.
В целом вариации идентифицируются как полиморфизмы, если они наблюдаются у> 1% населения. Если SNV имеет частоту второстепенных аллелей (MAF) <= 1%, мы называем его Rare SNV, в противном случае — общим SNP .Данные о частоте популяции были получены из сервера вариантов экзома NHLBI Exome Sequencing Project (ESP), который предоставляет данные о более чем 200 000 человек в США, и dbSNP. Среди 374 проанализированных SNV 51% (191) были Common , 16% (61) были Rare , а для 33% (122) информация о частоте отсутствовала, обозначенная No_Freq (рис. 10). В одном случае данные о 1000 геномах и ESP противоречили друг другу. В данном случае данные были взяты из ESP. Мы дополнительно разделяем эти данные в зависимости от серьезности SNV.Если SNV связаны с заболеванием, мы классифицировали их как , вызывающее заболевание, вызывающее . SNV, связанные с риском развития заболевания, сгруппированы в группе Риск . Наконец, в разделе Другое / Нет эффекта мы определили SNV, которые имеют нейтральный эффект или по которым не было доступной информации, связанной с заболеванием.
Рис. 10. Частотное распределение SNV.
Гистограмма показывает распределение SNV как Другое / Нет эффекта (либо нейтральное, либо не вызывает заболевания), Болезнь , вызывающая и ассоциированная с Риском развития заболевания в каждой частотной категории.
https://doi.org/10.1371/journal.pone.0171355.g010
SNV, связанные с заболеванием , по-видимому, чаще встречаются в категории Rare . Кроме того, болезни, которые имеют SNV Common , обычно намного легче и вряд ли будут опасными для жизни до деторождения (например, астма или диабет). Вариации в категории No_Freq имеют большое количество SNV, связанных с заболеванием, а частотное распределение аналогично категории Rare .Мы предполагаем, что некоторые из этих SNV являются очень редкими SNP или что заболевания, вызванные этими вариациями, серьезны, поэтому для надежного определения частот может потребоваться гораздо больший размер популяции.
Скомпилированный здесь набор данных содержит сочетание вариантов с большим и малым эффектом. Некоторые из наиболее ярких примеров, описанных в этой рукописи, — это редкие вариации, оказывающие большое влияние на белки. Однако существует также большое количество SNV, для которых не известно четких последствий для трехмерной структуры белка.Другой возможной моделью для объяснения этих мутаций является также упомянутая выше гипотеза малого эффекта / общего варианта.
4. Заключение
В центре внимания данного исследования находятся белковые структуры в архиве PDB, для которых были определены трехмерные структуры генетических вариантов белков. В этом контексте важно отметить, что содержимое банка данных по белкам не является репрезентативным подмножеством всех белков. В PDB существует систематическая ошибка отбора в том смысле, что доступность трехмерной структуры данного белка в решающей степени зависит от научного вкуса исследователя, тенденций финансирования, технической осуществимости и немалой доли удачи на скамейке запасных.Собранные здесь данные дают важную информацию о возможных структурных и функциональных изменениях белков. Но необходимо подчеркнуть, что наша работа дает качественное описание возможных изменений, а не количественную оценку . Несмотря на огромный рост PDB с 7 до более чем 124 000 архивных записей, просто невозможно дать точный отчет о последствиях генетической изменчивости человека в протеоме человека.
Вариации единичных нуклеотидов (SNV)
представляют собой наиболее распространенные генетические вариации, наблюдаемые у людей, на которые приходится около 90% различий в последовательностях [68].В этом исследовании мы проанализировали структурные и функциональные эффекты изменений отдельных аминокислот в белках из-за SNV. Наш анализ относительно небольшого набора данных, состоящего всего из 374 SNV, подчеркивает проблемы, связанные с попытками понять последствия конкретной генетической вариации на уровне кодируемого белка.
В частности, наши результаты подтверждают, что диапазон возможных эффектов SNV на уровне белка значительно больше, чем в настоящее время предполагают существующие методы прогнозирования программного обеспечения, и что правильное прогнозирование последствий остается серьезной проблемой.В целом, большинство программных методов, которые пытаются предсказать последствия SNV, классифицируют SNV как , вызывающие заболевание, или , не вызывающие заболевания, . Точечная мутация может не вызывать заболевания, но все же может влиять на структуру и функцию белка. Последствия таких точечных мутаций часто остаются незамеченными, поскольку они не приводят к фенотипу заболевания, хотя они влияют на белок и могут нарушить нормальную физиологию человека.
В дополнение к примерам, описанным здесь, легко представить, что другие последствия, связанные с изменениями SNV, будут обнаружены по мере того, как станут доступны более экспериментально определенные 3D-структуры и наше понимание взаимосвязей структура-функция белка будет продолжать расти.Например, влияние генетической изменчивости на белок-белковые взаимодействия недостаточно хорошо представлено в текущем наборе данных.
Требуется всестороннее понимание трехмерной структуры, динамики и биофизики белков дикого типа и мутантных белков для разработки более совершенных инструментов, которые могут делать точные прогнозы относительно последствий генетических изменений, проявляющихся на атомарном уровне в белковых генных продуктах.
Дополнительная информация
S1 Рис. Процедуры эксперимента.
Экспериментальные процедуры для определения структур PDB в наборе данных из 374 SNV. 325 SNV имеют координаты PDB, определенные с помощью рентгеновской кристаллографии. 49 имеют структуры ЯМР раствора, доступные в PDB.
https://doi.org/10.1371/journal.pone.0171355.s001
(PNG)
S3 Рис. Распределение SNV.
Распределение SNV в наборе данных, для которого не было обнаружено структурных и функциональных последствий в существующей литературе, на основе структурного положения и вторичных структурных элементов (слева).Распределение на основе структурного положения и вторичных структурных элементов для SNV с информацией о структурных и функциональных последствиях (справа).
https://doi.org/10.1371/journal.pone.0171355.s003
(PNG)
Благодарности
Мы благодарим Хагена Тилгнера, Лилию Якучеву и Розера Короминаса за полезные обсуждения, Саджани Свами за отзывы о рукописи.
Вклад авторов
- Концептуализация: AP.
- Обработка данных: РБ.
- Формальный анализ: РБ.
- Приобретение финансирования: СКБ.
- Расследование: РБ.
- Методика: РБ PWR СКБ АП.
- Программное обеспечение: AP RB.
- Контроль: AP.
- Проверка: RB PWR SKB AP.
- Написание — черновик: РБ АП.
- Написание — просмотр и редактирование: PWR SKB.
Список литературы
- 1.
Альтшулер Д., Дейли М.Дж., Лендер Э.С. Генетическое картирование болезней человека. Наука. 2008: 881–8. - 2.
Ботштейн Д., Риш Н. Обнаружение генотипов, лежащих в основе фенотипов человека: прошлые успехи в лечении менделевской болезни, будущие подходы к комплексной болезни. Генетика природы. 2003; 33 Дополнение: 228–37. - 3.
Кимура М., Такахата Н. Селективное ограничение в полиморфизме белков: изучение модели эффективно нейтральной мутации с использованием улучшенного метода псевдодискретизации.Труды Национальной академии наук США. 1983; 80 (4): 1048–52. pmid: 6573657 - 4.
Wang Z, Moult J. SNP, структура белка и болезнь. Человеческая мутация. 2001; 17 (4): 263–70. pmid: 11295823 - 5.
Пирмохамед М, Парк БК. Генетическая предрасположенность к побочным реакциям на лекарства. Направления фармакологических наук. 2001; 22 (6): 298–305. - 6.
Gamazon ER, Huang RS, Cox NJ, Dolan ME. SNP, ассоциированные с чувствительностью к химиотерапевтическим препаратам, обогащены локусами количественных признаков экспрессии.Труды Национальной академии наук США. 2010; 107 (20): 9287–92. pmid: 20442332 - 7.
Риш Н., Мерикангас К. Будущее генетических исследований сложных заболеваний человека. Наука. 1996; 273 (5281): 1516–7. pmid: 8801636 - 8.
Хиршхорн Дж. Н., Ломюллер К., Бирн Э., Хиршхорн К. Всесторонний обзор исследований генетических ассоциаций. Генетика в медицине. 2002: 45–61. pmid: 11882781 - 9.
Раменский В., Борк П., Сюняев С. Человеческие несинонимичные SNP: сервер и обзор.Исследования нуклеиновых кислот. 2002; 30 (17): 3894–900. pmid: 12202775 - 10.
Риш, штат Нью-Джерси. В поисках генетических детерминант в новом тысячелетии. Природа. 2000; 405 (6788): 847–56. pmid: 10866211 - 11.
Lai E, Riley J, Purvis I, Roses A. 4-мегабайтная карта на основе однонуклеотидного полиморфизма высокой плотности вокруг человеческого APOE. Геномика. 1998. 54 (1): 31–8. pmid: 9806827 - 12.
Эйхлер Э., Флинт Дж., Гибсон Дж., Конг А., Леал С.М., Мур Дж. Х., Надо Дж. Х. Отсутствие наследственности и стратегий поиска основных причин сложного заболевания.Природа Обзоры Генетики. 2010 июн; 11 (6): 446–50. pmid: 20479774 - 13.
Ng PC, Хеникофф С. Прогнозирование вредных аминокислотных замен. Геномные исследования. 2001; 11 (5): 863–74. pmid: 11337480 - 14.
Нг ПК, Хеникофф С. SIFT: Прогнозирование аминокислотных изменений, влияющих на функцию белка. Исследования нуклеиновых кислот. 2003. 31 (13): 3812–4. pmid: 12824425 - 15.
Аджубей I, Иордания Д.М., Сюняев С.Р. Прогнозирование функционального эффекта миссенс-мутаций человека с помощью PolyPhen-2.Текущие протоколы в генетике человека. 2013; (ПРИЛОЖЕНИЕ 76). - 16.
Stone EA, Sidow A. Нарушение физико-химических ограничений миссенс-заменами опосредует нарушение функции белка и тяжесть заболевания. Геномные исследования. 2005. 15 (7): 978–86. pmid: 15965030 - 17.
Pires DE, Ascher DB, Blundell TL DUET: сервер для прогнозирования эффектов мутаций на стабильность белков с использованием интегрированного вычислительного подхода. Исследования нуклеиновых кислот. 2014 июль; 42 (выпуск веб-сервера): W314–9.pmid: 24829462 - 18.
Ченг Дж., Рэндалл А., Балди П. Прогнозирование изменений стабильности белка для односайтовых мутаций с использованием машин опорных векторов. Белки. 2006. 62 (4): 1125–32. pmid: 16372356 - 19.
Capriotti E, Fariselli P, Calabrese R, Casadio R. Прогнозирование изменений стабильности белка на основе последовательностей с использованием машин поддерживающих векторов. Биоинформатика. 2005; 21 Приложение 2: 54–8. - 20.
Topham CM, Srinivasan N, Blundell TL. Прогнозирование стабильности белковых мутантов на основе структурных зависимостей аминокислотных замен и таблиц предрасположенности.Белковая инженерия. 1997. 10 (1): 7–21. pmid:29
- 21.
Burke DF, Worth CL, Priego E-M, Cheng T, Smink LJ, Todd JA и др. Биоинформатический анализ генома несинонимичных SNP. BMC Bioinformatics. 2007; 8: 301. pmid: 17708757 - 22.
Ми Х, Муругануджан А, Томас П.Д. PANTHER в 2013 г .: Моделирование эволюции функции генов и других атрибутов генов в контексте филогенетических деревьев. Исследования нуклеиновых кислот. 2013; 41 (D1). - 23.
Томас П.Д., Кеджаривал А.Кодирование однонуклеотидных полиморфизмов, связанных с комплексной болезнью по сравнению с менделевской болезнью: эволюционное свидетельство различий в молекулярных эффектах. Труды Национальной академии наук США. 2004. 101 (43): 15398–403. pmid: 154 - 24.
Клиффорд Р.Дж., Эдмонсон М.Н., Нгуен С., Буетоу К.Х. Масштабный анализ однонуклеотидных полиморфизмов несинонимичных кодирующих областей. Биоинформатика. 2004. 20 (7): 1006–14. pmid: 14751981 - 25.
Гонсалес-Перес А., Лопес-Бигас Н.Улучшение оценки результатов несинонимичных SNV с помощью консенсусной оценки вредоносности, Condel. Американский журнал генетики человека. 2011. 88 (4): 440–9. pmid: 21457909 - 26.
Чой Ю., Симс Г.Е., Мерфи С., Миллер-младший, Чан А.П. Прогнозирование функционального эффекта аминокислотных замен и инделей. PLoS One. 2012; 7 (10). - 27.
Аль-Нумайр Н.С., Мартин А.С. Конвейер и база данных SAAP: инструменты для анализа воздействия и прогнозирования патогенности мутаций.BMC Genomics [Интернет]. БиоМед Централ Лтд; 2013; 14 Приложение 3: S4. - 28.
Джегга А.Г., Говрисанкар С., Чен Дж., Ароноу Б.Дж. PolyDoms: база данных полного генома для идентификации несинонимичных кодирующих SNP, которые могут влиять на болезнь. Исследования нуклеиновых кислот. 2007; 35 (ПРИЛОЖЕНИЕ 1). - 29.
Stitziel NO, Binkowski TA, Tseng YY, Kasif S, Liang J. topoSNP: топографическая база данных несинонимичных однонуклеотидных полиморфизмов с известной ассоциацией болезни и без нее.Исследования нуклеиновых кислот. 2004; 32 (выпуск базы данных): D520–2. pmid: 14681472 - 30.
Де Баэтс Дж., Ван Дурм Дж., Реумерс Дж., Маурер-Стро С., Ванхи П., Допазо Дж. И др. SNPeffect 4.0: онлайн-прогнозирование молекулярных и структурных эффектов вариантов, кодирующих белок. Исследования нуклеиновых кислот. 2012; 40 (D1). - 31.
Юэ П., Меламуд Э., Молт Дж. SNPs3D: ген-кандидат и выбор SNP для ассоциативных исследований. BMC Bioinformatics. 2006; 7: 166. pmid: 16551372 - 32.Данцер Дж., Моад С., Хейланд Р., Муни С. Услуги MutDB: интерактивный структурный анализ данных о мутациях. Исследования нуклеиновых кислот. 2005; 33 (ПРИЛОЖЕНИЕ 2).
- 33.
Шихаб Х.А., Гоф Дж., Купер Д.Н., Стенсон П.Д., Баркер Г.Л. а, Эдвардс К.Дж. и др. Прогнозирование функциональных, молекулярных и фенотипических последствий аминокислотных замен с использованием скрытых марковских моделей. Человеческая мутация. 2013. 34 (1): 57–65. pmid: 23033316 - 34.
Райан М., Диханс М., Лиен С., Лю Ю., Карчин Р.LS-SNP / PDB: аннотированные несинонимичные SNP, сопоставленные со структурами банка данных белка. Биоинформатика. 2009. 25 (11): 1431–2. pmid: 19369493 - 35.
Berman HM, Westbrook J, Feng Z, Gilliland G, Bhat TN, Weissig H, et al. Банк данных о белках. Исследования нуклеиновых кислот. 2000. 28 (1): 235–42. pmid: 105 - 36.
Шерри С.Т., Уорд М.Х., Холодов М., Бейкер Дж., Фан Л., Смигельски Е.М. и др. dbSNP: база данных генетической изменчивости NCBI. Исследования нуклеиновых кислот. 2001. 29 (1): 308–11.pmid: 11125122 - 37.
Ли Б., Кришнан В.Г., Морт М.Э., Синь Ф., Камати К.К., Купер Д.Н. и др. Автоматический вывод о молекулярных механизмах заболевания по аминокислотным заменам. Биоинформатика. 2009. 25 (21): 2744–50. pmid: 19734154 - 38.
Калабрезе Р., Каприотти Е., Фаризелли П., Мартелли П.Л., Касадио Р. Функциональные аннотации улучшают прогнозируемую оценку мутаций белков в белках, связанных с заболеванием человека. Человеческая мутация. 2009. 30 (8): 1237–44. pmid: 19514061 - 39.Олатубосун А., Валиахо Дж., Хэрконен Дж., Тусберг Дж., Вихинен М. PON-P: интегрированный предиктор патогенности миссенс-вариантов. Человеческая мутация. 2012; 33 (8): 1166–74. pmid: 22505138
- 40.
Каприотти Э., Калабрезе Р., Касадио Р. Прогнозирование роста генетических заболеваний человека, связанных с точечными мутациями белков, с помощью опорных векторных машин и эволюционной информации. Биоинформатика. 2006. 22 (22): 2729–34. pmid: 16895930 - 41.
Wu CH, Apweiler R, Bairoch A, Natale D. a, Barker WC, Boeckmann B, et al.Универсальный белковый ресурс (UniProt): расширяющаяся вселенная информации о белках. Исследования нуклеиновых кислот. 2006; 34 (выпуск базы данных): D187–91. pmid: 16381842 - 42.
Бендл Дж., Стоурак Дж., Саланда О, Павелка А., Вибен Э.Д., Зендулка Дж. И др. PredictSNP: надежный и точный консенсусный классификатор для прогнозирования мутаций, связанных с заболеванием. PLoS Компьютерная биология. 2014; 10 (1). - 43.
Rose PW, Prlic´ A, Bi C, Bluhm WF, Bourne PE, Burley SK et al. Банк данных белка RCSB: взгляды на структурную биологию для фундаментальных и прикладных исследований и образования.Исследования нуклеиновых кислот. 2015 28 января; 43 (выпуск базы данных): D345 – D356. pmid: 25428375 - 44.
Arod T, Płonka PM. Влияние точечных мутаций на структуру белка неэкспоненциально распределено. Белки, структура, функции и биоинформатика. 2012. 80 (7): 1780–90. - 45.
Ауэр П.Л., Джонсен Дж. М., Джонсон А. Д. и др.: Внесение вариантов последовательности экзома в популяционные образцы и локусы, связанные с признаками клеток крови, у афроамериканцев: проект по секвенированию экзома NHLBI GO. Американский журнал генетики человека . 2012; 91: 794–808. pmid: 23103231 - 46.
Сервер вариантов экзома, NHLBI GO Exome Sequencing Project (ESP), Сиэтл, Вашингтон (URL: http://evs.gs.washington.edu/EVS/) [Май, 2016] - 47.
Sayers EW, Barrett T, Benson DA и др. Ресурсы базы данных Национального центра биотехнологической информации. Исследования нуклеиновых кислот. 2010; 38: D5 – D16. pmid: 194
- 48.
фон Бюлов Р., Шмидт Б., Диркс Т., Швабауэр Н., Шиллинг К., Вебер Е., Усон И., фон Фигура К.Дефектная олигомеризация арилсульфатазы а как причина ее нестабильности в лизосомах и метахроматической лейкодистрофии. Журнал биологической химии. 2002 15 марта; 277 (11): 9455–61 pmid: 11777924 - 49.
Брейниг С., Кервинен Дж., Стит Л., Уоссон А.С., Фэрман Р., Влодавер А., Зданов А., Яффе Э. Контроль биосинтеза тетрапирролов с помощью альтернативных четвертичных форм порфобилиногенсинтазы. Структурная биология природы. 2003 сентябрь; 10 (9): 757–63. pmid: 12897770 - 50.
Xie W, Nangle LA, Zhang W., Schimmel P, Yang X-L.Долгосрочные структурные эффекты мутации Шарко-Мари-Тута, вызывающей заболевание, в глицил-тРНК синтетазе человека. Труды Национальной академии наук США. 2007. 104 (24): 9976–81. pmid: 17545306 - 51.
Cardoso RMF, Thayer MM, DiDonato M, Lo TP, Bruns CK, Getzoff ED, et al. Понимание болезни Лу Герига на основе структуры и нестабильности мутанта A4V человеческой супероксиддисмутазы Cu, Zn. Журнал молекулярной биологии. 2002. 324 (2): 247–56. pmid: 12441104 - 52.Бонифати В., Риццу П., ван Барен М.Дж., Шаап О., Бридвелд Г.Дж., Кригер Э. и др. Мутации в гене DJ-1, связанные с аутосомно-рецессивным паркинсонизмом с ранним началом. Наука. 2003. 299 (5604): 256–9. pmid: 12446870
- 53.
Нагакубо Д., Тайра Т., Китаура Х., Икеда М., Тамай К., Игучи-Арига С.М. и др. DJ-1, новый онкоген, который трансформирует мышиные клетки NIh4T3 в сотрудничестве с ras. Сообщения о биохимических и биофизических исследованиях. 1997. 231 (2): 509–13. pmid:10
- 54.Лакшминарасимхан М., Мальдонадо М.Т., Чжоу В., Финк А.Л., Уилсон М.А. Структурное влияние трех миссенс-мутаций, связанных с паркинсонизмом, на DJ-1 человека. Биохимия. 2008. 47 (5): 1381–92. pmid: 18181649
- 55.
Denayer E, Parret A, Chmara M, Schubbert S, Vogels A, Devriendt K и др. Анализ мутаций при синдроме Костелло: функциональная и структурная характеристика мутации HRAS p.Lys117Arg. Человеческие мутации. 2008. 29 (2): 232–9. - 56.
Borgstahl GEO, Parge HE, Hickey MJ, Johnson MJ, Boissinot M, Hallewell RA и др.Полиморфный вариант митохондриальной супероксиддисмутазы марганца человека Ile58Thr снижает активность, дестабилизируя тетрамерный интерфейс. Биохимия. 1996; 35 (14): 4287–97 pmid: 8605177 - 57.
Фукуда К., Доггетт Т.А., Банкстон Л.А., Круз М.А., Дьяково Т.Г., Лиддингтон Р.К. Структурные основы активации фактора фон Виллебранда змеиным токсином ботроцетином. Состав. 2002. 10 (7): 943–50. pmid: 12121649 - 58.
Horton JR, Sawada K, Nishibori M, Zhang X, Cheng X. Две полиморфные формы гистамин-метилтрансферазы человека: структурные, термические и кинетические сравнения.Состав. 2001. 9 (9): 837–49. pmid: 11566133 - 59.
Резерфорд К., Парсон В.В., Даггетт В. Полиморфизм гистамин-N-метилтрансферазы T105I влияет на структуру и динамику активного сайта. Биохимия. 2008. 47 (3): 893–901. pmid: 18154359 - 60.
Оуэн М.С., Бреннан С.О., Льюис Дж. Х., Каррелл Р. В.. Мутация антитрипсина в антитромбин. альфа-1-антитрипсин Питтсбург (358 Met приводит к Arg), смертельное нарушение свертываемости крови. Медицинский журнал Новой Англии. 1983. с. 694–8.pmid: 6604220 - 61.
Purdue PE, Takada Y, Danpure CJ. Идентификация мутаций, связанных с ошибочным нацеливанием пероксисомы на митохондрии аланин / глиоксилат аминотрансферазы при первичной гипероксалурии 1. Журнал клеточной биологии. 1990; 111 (6 ЧАСТЬ 1): 2341–51. - 62.
Lumb MJ, Danpure CJ. Функциональный синергизм между наиболее распространенным полиморфизмом аланина человека: глиоксилатаминотрансферазой и четырьмя наиболее распространенными мутациями, вызывающими заболевание. Журнал биологической химии.2000. 275 (46): 36415–22. pmid: 10960483 - 63.
Purdue PE, Allsop J, Isaya G, Rosenberg LE, Danpure CJ. Неверное нацеливание пероксисомальной L-аланин: глиоксилатаминотрансферазы на митохондрии у пациентов с первичной гипероксалурией зависит от активации скрытой митохондриальной целевой последовательности точечной мутацией. Труды Национальной академии наук США. 1991. 88 (23): 10900–4. pmid: 1961759 - 64.
Мерфи Е.К., Журкин В.Б., Луис Дж. М., Корнилеску Г., Клор Г. М..Структурная основа SRY-зависимой смены пола 46-X, Y: модуляция изгиба ДНК естественной точечной мутацией. Журнал молекулярной биологии. 2001; 312 (3): 481–99. pmid: 11563911 - 65.
Цирулли Э.Т., Гольдштейн ДБ. Выявление роли редких вариантов в распространенных заболеваниях посредством секвенирования всего генома. Природа Обзоры Генетики. 2010 июн; 11 (6): 415–25. pmid: 20479773 - 66.
Гибсон Г. Редкие и распространенные варианты: двадцать аргументов. Природа Обзоры Генетики.2012 18 января; 13 (2): 135–45. pmid: 22251874 - 67.
Эйхлер Э., Флинт Дж., Гибсон Дж., Конг А., Леал С.М., Мур Дж. Х., Надо Дж. Х. Отсутствие наследственности и стратегий поиска основных причин сложного заболевания. Природа Обзоры Генетики. 2010 июн; 11 (6): 446–50. pmid: 20479774 - 68.
Коллинз Ф.С., Брукс Л.Д., Чакраварти А. Ресурс по открытию полиморфизма ДНК для исследования генетической изменчивости человека. Геномные исследования. 1998. 8 (12): 1229–31. pmid: 9872978 - 69.Hecht M, Bromberg Y, Rost B. Лучшее предсказание функциональных эффектов для вариантов последовательности. BMC Genomics. 2015; 16 Дополнение 8: S1. Epub 2015 18 июня.
- 70.
Prlic A et al. Biojava: платформа с открытым исходным кодом для биоинформатики в 2012 году. Биоинформатика. 2012; 28 (20): 2693–2695. pmid: 22877863 - 71.
Prlic A et. Al. Интеграция геномной информации с белковыми последовательностями и трехмерной структурой уровня атомов в банке данных белков RCSB. Биоинформатика. 2016 г.
.